水提铵沉法提取蜂王浆水溶性蛋白工艺优化
2018-01-22,
,
(锦州医科大学食品科学与工程学院,辽宁锦州 121000)
蜂王浆(royaljelly,RJ),是蜂王整个生命当中唯一的食物,是决定蜜蜂幼虫成为工蜂还是蜂王的关键因素。现代营养学和医学表明它具有延缓衰老、增加机体免疫力、增强记忆力、防癌抗癌等保健功能和疗效,这些功能和疗效大多跟蜂王浆中所含的丰富的蛋白质密切相关[1-2]。蜂王浆蛋白质约占其干物质的50%,可分为水溶性蛋白质和水不溶性蛋白质,其中水溶性蛋白质约占蜂王浆总蛋白的46%~89%,是蜂王浆中最主要的活性成分,是代表蜂王浆新鲜度和质量的重要标志[3-4]。但是由于国内外市场上销售的仅有鲜蜂王浆或其冻干粉产品,研发蜂王浆水溶性蛋白相关的新产品十分必要[5]。因此,对于蜂王浆水溶性蛋白的研究具有非常重要的意义。
目前对蜂王浆水溶性蛋白的提取多采用碱溶酸沉、盐提酸沉法等,与这些方法相比,水提铵沉法具有成本低、操作简单、可保存被分离物生物活性等优点[6-8]。因此,本实验以水溶性蛋白提取率为评价指标,通过单因素实验、PB实验和响应面优化分析,对蜂王浆水溶性蛋白的提取工艺进行优化,以获得最佳提取条件。
1 材料与方法
1.1 材料与仪器
蜂王浆 黑龙江密山蜂场,-20 ℃冻藏;牛血清蛋白 北京索莱宝科技有限公司;硫酸铵、硫酸钾、95%乙醇、盐酸、考马斯亮蓝G-250、85%磷酸等 均为分析纯,天津市科密欧化学试剂有限公司。
UV-6300型紫外可见分光光度计 上海美普达仪器有限公司;KND-04微量凯氏定氮装置 上海新嘉电子有限公司;KQ3200B型超声清洗器 昆山市超声仪器有限公司;立式高速冷冻离心机 湖南赫西仪器装备有限公司。
1.2 实验方法
1.2.1 蜂王浆水溶性蛋白提取工艺 将10.0 g蜂王浆与蒸馏水按一定比例混合,搅拌使其充分混匀,超声波(150 W)提取一段时间后于4 ℃离心,去沉淀,收集上清液,加入硫酸铵,调节pH,沉淀一段时间,4 ℃、12000 r/min离心20 min,去上清液,收集沉淀得到含盐蛋白质,透析除盐,得蛋白提取液。
1.2.2 蜂王浆水溶性蛋白提取工艺优化
1.2.2.1 单因素实验 采用1.2.1的工艺提取蜂王浆水溶性蛋白,固定超声波提取30 min,硫酸铵饱和度70%,调pH到6,沉淀40 min,考察不同料水质量比(1∶5、1∶10、1∶15、1∶20、1∶25 g/mL)对水溶性蛋白提取率的影响;固定料水质量比1∶20,硫酸铵饱和度70%,调pH到6,沉淀40 min,考察不同超声波提取时间(10、20、30、40、50 min)对水溶性蛋白提取率的影响;固定料水质量比1∶20,超声波提取40 min,调pH到6,沉淀40 min,考察不同硫酸铵饱和度(60%、70%、80%、90%、100%)对水溶性蛋白提取率的影响;固定料水质量比1∶20,超声波提取40 min,硫酸铵饱和度90%,沉淀40 min,考察不同pH(5、6、7、8、9)对水溶性蛋白提取率的影响;固定料水质量比1∶20,超声波提取40 min,硫酸铵饱和度90%,pH5,考察不同沉淀时间(20、30、40、50、60 min)对水溶性蛋白提取率的影响。
1.2.2.2 PB实验 以单因素实验结果为依据进行N=12的PB实验,对上述5个因素加以考察,每个因素选择-1和1两个水平,将蜂王浆水溶性蛋白提取率作为响应值[9]。PB实验设计因素水平和编码如表1所示。

表1 PB实验设计因素水平和编码Table 1 Independent variables and their levels used in Plackett-Burman design
1.2.2.3 响应面优化设计 固定超声波提取时间40 min,沉淀时间50 min,以PB实验选定因素进行响应面实验,实验设计因素水平如表2所示。
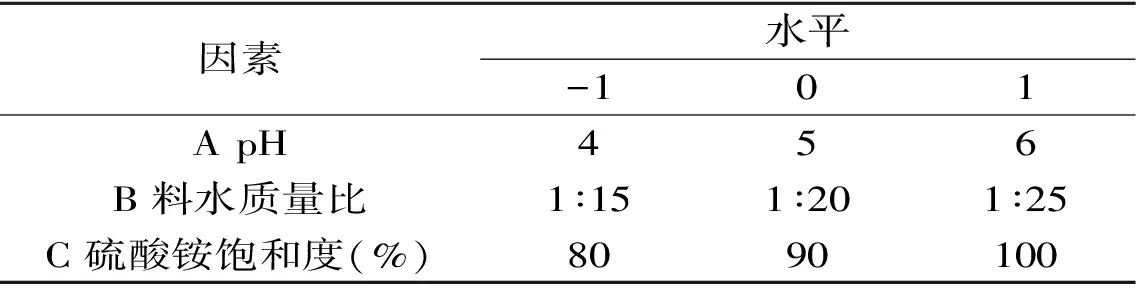
表2 响应面实验因素水平设计Table 2 Factors and level design of response surface methodology
1.2.3 水溶性蛋白提取率测定 参考GB5009.5-2016中方法测定蜂王浆总蛋白含量。参考《进出口危险化学品安全实验方法》中第20部分Bradford法测定提取所得蜂王浆水溶性蛋白含量,得到线性回归方程:y=0.0062x+0.0621,R2=0.9999,表明牛血清蛋白含量(x)与吸光度(y)之间有非常明显的线性关系,将样品吸光度代入该方程,即可得样品蜂王浆中所含水溶性蛋白含量,再根据公式(1)计算出蜂王浆水溶性蛋白的提取率。
蜂王浆水溶性蛋白提取率(%)=提取液中水溶性蛋白质量/蜂王浆总蛋白含量×100
式(1)
1.2.4 数据处理 PB实验与响应面的设计、数据分析利用Design-expert8.0软件。
2 结果与分析
2.1 单因素实验
2.1.1 料水质量比对水溶性蛋白提取率的影响 如图1所示,水溶性蛋白提取率随着料水质量比的增大出现先增高后略微降低的趋势,并且料水质量比在1∶20时最高。这可能是因为料水质量比太低的情况下水溶性蛋白不能完全溶于水中,随着料水质量比的增大,水溶性蛋白逐渐最大限度的溶于水中,而过高的料水质量比会使得体系中的蛋白质太过分散,有效组分含量减少,难以全部回收,导致水溶性蛋白提取率降低[10],因此,料水质量比选取1∶20。
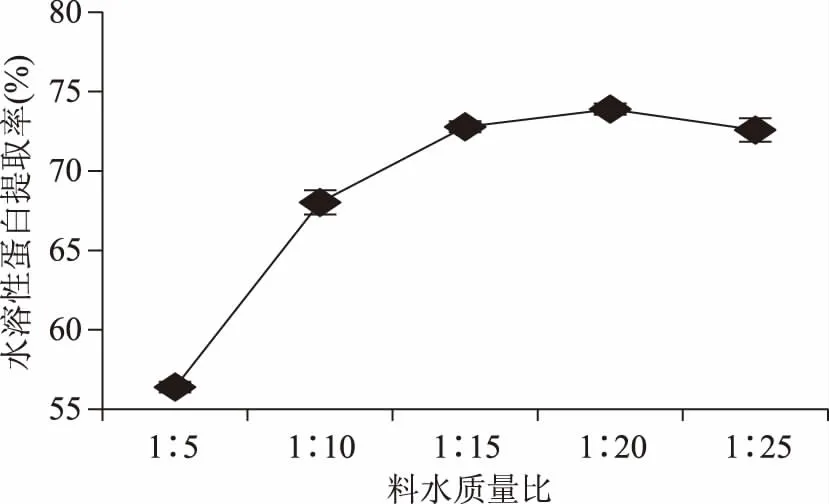
图1 料水质量比对水溶性蛋白提取率的影响Fig.1 Effect of the mass ratio of material and water on extraction rate of water-soluble protein
2.1.2 超声波提取时间对水溶性蛋白提取率的影响 如图2所示,蜂王浆水溶性蛋白提取率随着超声波提取时间的增加,出现先升高后略微降低的趋势,并且在超声波提取时间40 min时最高。超声波通过波源的振荡作用,使提取物的外表受到机械损伤和破碎,使溶胀的时间大大地减少。超声空化作用使得蛋白质在较短时间内最大限度的溶出,而超声空化作用时间过长会使得蛋白质变性,从而导致水溶性蛋白提取率降低[11-12]。因此,超声波提取时间选择40 min。
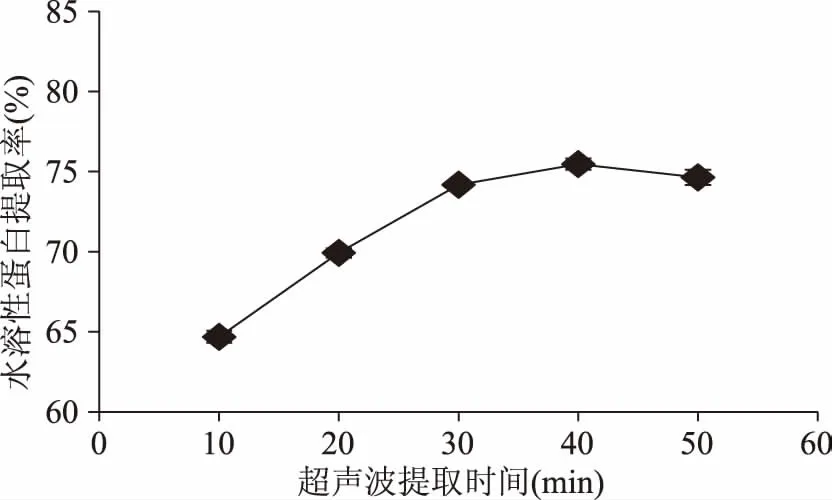
图2 超声波提取时间对水溶性蛋白提取率的影响Fig.2 Effect of ultrasonic extraction time on the extraction rate of water-soluble protein
2.1.3 硫酸铵饱和度对水溶性蛋白提取率的影响 如图3所示,蜂王浆水溶性蛋白提取率随着硫酸铵饱和度的增加,出现逐渐升高并趋于恒定的趋势,并且在硫酸铵饱和度100%时最高。硫酸铵饱和度越大,水溶性蛋白沉降越多,90%以后趋于最大限度沉降。所以考虑到节约资源,硫酸铵饱和度选择90%。

图3 硫酸铵饱和度对水溶性蛋白提取率的影响Fig.3 Effect of ammonium sulfate saturation on extraction rate of water-soluble protein
2.1.4 pH对水溶性蛋白提取率的影响 如图4所示,蜂王浆水溶性蛋白提取率随着pH的增大,出现先降低后增高的趋势,pH9时最高。但是碱性过强会使得蛋白质发生脱氨、脱羧等情况[13-16],有较大氨味。因此,pH选择5。

图4 pH对水溶性蛋白提取率的影响Fig.4 Effect of pH on the extraction rate of water-soluble protein
2.1.5 沉淀时间对水溶性蛋白提取率的影响 如图5所示,蜂王浆水溶性蛋白提取率随着沉淀时间的增加,出现先增高后趋于恒定的趋势,并且在沉淀时间60 min时最高。沉淀时间越长沉降越多,50~60 min逐渐趋于最大沉降限度。所以考虑节约资源问题,沉淀时间选择50 min。
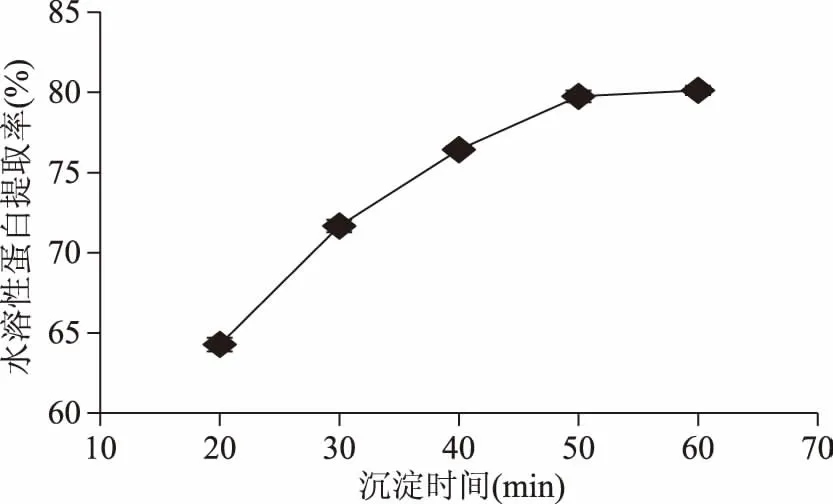
图5 沉淀时间对水溶性蛋白提取率的影响Fig.5 Effect of precipitation time on extraction rate of water-soluble protein
2.2 PB实验结果与分析
2.2.1 PB实验结果 以单因素实验结果为依据进行N=12的PB实验,对上述5个因素加以考察,结果如表3所示。
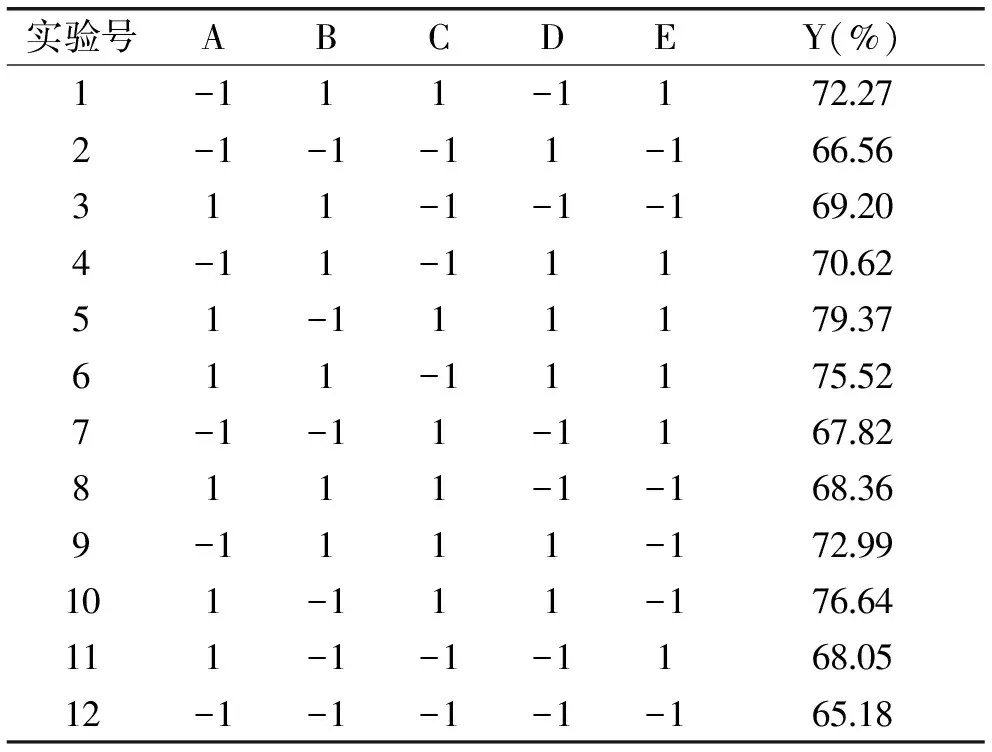
表3 PB实验设计与结果Table 3 Design and results of PB experiment
2.2.2 PB实验方差分析 利用Design-expert 8.0软件进行回归拟合,得到回归方程为:蜂王浆水溶性蛋白提取率Y=71.05-1.81A+0.45B+1.86C+2.57D+1.23E,且回归模型(p<0.05)显著,具有统计学意义。方差分析如表4所示,5个因素影响大小顺序为D>C>A>E>B,其中料水质量比、硫酸铵饱和度、pH对蜂王浆水溶性蛋白提取率影响显著,因此选定该三个因素进行接下来的响应面优化分析。

表4 PB实验方差分析Table 4 The variance analysis of PB experiment

表6 回归模型的方差分析结果Table 6 Analysis of variance(ANOVA)of the regression model
注:***为极显著(p<0.001),**为非常显著(p<0.01),*为显著(p<0.05)。
2.3 响应面优化实验
2.3.1 实验设计与结果 以单因素及PB实验结果为基础,选择料水质量比、硫酸铵饱和度、pH三个因素,利用响应面软件设计水提铵沉法提取蜂王浆水溶性蛋白实验方案。结果如表5所示。
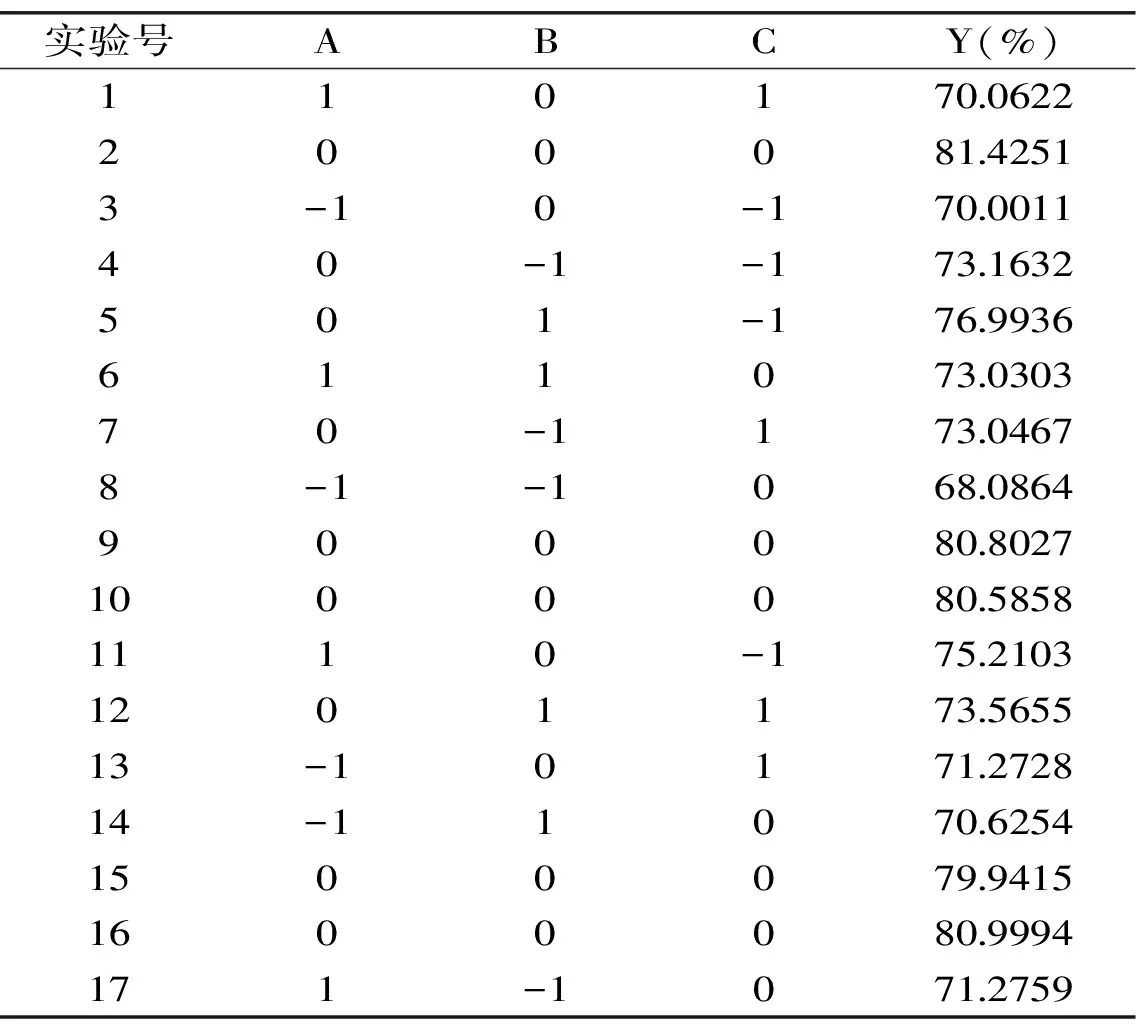
表5 响应面实验设计与结果Table 5 Design and results of the response surface methodology
2.3.2 回归模型的方差分析 运用响应面软件将实验数据回归拟合,得到蜂王浆水溶性蛋白提取率与料水质量比、硫酸铵饱和度及pH三因素间的回归方程:水溶性蛋白提取率Y=80.75+1.20A+1.08B-0.93C-0.20AB-1.60AC-0.83BC-6.28A2-3.73B2-2.84C2。该方程的二次项系数均为负值,初步推断响应面开口向下,在各因素所选水平范围内具有极大值点,能够进行蜂王浆水溶性蛋白提取率工艺的优化分析[17-18]。
回归模型的方差分析结果如表6所示,回归模型R2=0.9953,即拟合优度为99.53%,表示该回归模型与实验数据拟合程度较高,自变量和响应值间有明显的线性关系,所以该模型可对蜂王浆水溶性蛋白提取工艺进行理论预测。该模型p<0.001(极显著),失拟项=0.7805>0.05(不显著),表明该回归模型与实验数据很吻合,实验误差较小,模型选择正确。料水质量比、硫酸铵饱和度和pH的p值均小于0.001,说明三因素对蜂王浆水溶性蛋白提取率影响均极显著。F值大小能够反映出各因素对响应值的影响程度[10-13],可得出三者对蜂王浆水溶性蛋白提取率的影响程度依次是:pH>料水质量比>硫酸铵饱和度。交互项AB影响不显著(p>0.05),交互项AC影响极显著(p<0.001),交互项BC影响非常显著。
2.3.3 响应面分析图 从图6能够清楚的观察到各因素及其交互作用对蜂王浆水溶性蛋白提取率的影响。从图6a中可以看出,随着料水质量比和pH的增加,蜂王浆水溶性蛋白提取率均呈现先增加后减少的趋势,响应面图形曲面均不陡峭,表明二者对蜂王浆水溶性蛋白提取率影响不显著。从图6b中可以看出,随着pH和硫酸铵饱和度的增加,蜂王浆水溶性蛋白提取率均呈现先增加后减少的趋势,响应面图形曲面弧度较大且pH面较陡峭,表明pH对蜂王浆水溶性蛋白提取率的影响较硫酸铵饱和度更大,这与方差分析结果一致。从图6c中可以看出,随着料水质量比和硫酸铵饱和度的增加,蜂王浆水溶性蛋白提取率均呈现先增加后减少的趋势,响应面图形曲面弧度较大且料水质量比面较陡峭,表明料水质量比对蜂王浆水溶性蛋白提取率的影响较硫酸铵饱和度更大。

图6 交互作用对蜂王浆水溶性蛋白提取率影响的响应面图Fig.6 The response surface plots for effects of interaction on the extraction rate of water-soluble protein
2.4 验证实验
根据上述回归模型,通过响应面优化实验所得水提铵沉法提取蜂王浆水溶性蛋白的最佳条件是:料水质量比1∶20 g/mL、硫酸铵饱和度88.94%、pH5.08,并得到蜂王浆水溶性蛋白提取率的预测值是80.63%。为检验该结果的可靠性,拟采用上述响应面优化实验所得水提铵沉法提取的条件,并结合实际情况,在料水质量比1∶20、硫酸铵饱和度89%、pH5的条件下,经过3次重复实验,得到蜂王浆水溶性蛋白提取率的平均值为80.22%,与响应面优化实验所得预测值接近,响应面优化分析回归模型可信度较高,所得最佳条件具有可行性[19]。
3 结论
采用水提铵沉法提取蜂王浆水溶性蛋白,并在单因素实验和PB实验的基础上,利用响应面优化分析并结合实际情况,确定水提铵沉法提取蜂王浆水溶性蛋白的最佳条件:料水质量比为1∶20、超声波提取时间为40 min、硫酸铵饱和度为89%、pH为5、沉淀时间为50 min。通过该最佳提取条件得到蜂王浆水溶性蛋白提取率的平均值为80.22%,与理论预测值的误差小于0.5%,表明所建蜂王浆水溶性蛋白提取回归模型成功。
[1]李俊霖. 10-HDA对G+抑菌活性及机制的研究[D].济南:齐鲁工业大学,2014.
[2]唐雨薇,宁方勇. 蜂产品的保健医疗作用[J]. 信息化建设,2015(5):115-116.
[3]Kamakura M. Royalactin induces queen differentiation inhoneybees[J].Nature,2011,473(7348):478-483.
[4]沈立荣,张璨文,丁美会,等.蜂王浆的营养保健功能及分子机理研究进展[J].中国农业科技导报,2009,11(4):41-47.
[5]Salazar-Olivo L A,Paz-Gonzales V.Screening of biologicalactivities present in honeybee(Apismellifera)royal jelly[J].Toxicologyinvitro,2005,19(5):645-651.
[6]胡熠凡,陈忠周,田文礼,等. 蜂王浆中主蛋白成分(MRJP2)的分离纯化及圆二色谱分析[J]. 食品科学,2013(23):57-61.
[7]魏文挺. 基于蜂王浆与盐酸显色反应和脂肪酸组成的蜂王浆质量控制研究[D].杭州:浙江大学,2014.
[8]季文静,胡福良. 2008~2009年国内外蜂王浆研究概况[J].蜜蜂杂志,2010(4):6-12.
[9]刘细霞,卢思帆,侯建军,等. Plackett-Burman实验结合响应面分析法优化“黑金刚”马铃薯紫红色素的提取工艺条件[J]. 食品工业科技,2016(22):285-289,295.
[10]高飞,韩春然,石彦国,等. 南极磷虾蛋白质提取条件优化[J]. 天然产物研究与开发,2016(2):307-312,194.
[11]张乐,宋洪波,周林燕,等. 超声波提取金针菇根中的蛋白质[J]. 食品与发酵工业,2013(12):204-208.
[12]黄国平. 玉米醇溶蛋白的超声波提取、改性与释药性能的研究[D].广州:华南理工大学,2004.
[13]李琳,王正全,张晶晶,等. 暗纹东方鲀肌肉组织蛋白酶B提取工艺优化[J]. 食品科学,2016(3):91-96.
[14]孙文怡,刘金阳,刘瑜,等. 响应面法优化小刺猴头菌寡糖的纯化工艺研究[J]. 长春师范学院学报,2011(10):59-62.
[15]宋晓敏. 蚕豆蛋白的提取、功能特性及酶水解研究[D].天津:天津商业大学,2013.
[16]于张颖,肖发,柳丹丹,等. 蜂王浆主蛋白提取工艺优化及质量分析[J]. 食品工业科技,2014(19):185-188.
[17]孙文怡,刘金阳,刘瑜,等. 响应面法优化小刺猴头菌寡糖的纯化工艺研究[J]. 长春师范学院学报,2011(10):59-62.
[18]许彦腾,张建新,宋真真,等. 响应面法优化黑水虻幼虫蛋白质提取工艺[J]. 昆虫学报,2014(4):401-410.
[19]黄艳,谢三都,许艳萍. 响应面法优化复合酶酶解草鱼蛋白工艺[J]. 武夷学院学报,2015(12):21-27.
