国槐种子蛋白质提取工艺优化及其抗氧化活性
2018-01-22,,,,*,
, ,, ,*,
(1.河西学院农业与生物技术学院,甘肃张掖 734000; 2.甘肃省高校河西走廊特色资源利用省级重点实验室,甘肃张掖 734000)
国槐(SophorajaponicaL.)为豆科落叶乔木,别名槐树、中国槐、槐米树等。国槐资源丰富,其果实、花、叶、树皮、根及槐胶可入药[1]。槐角为其果实,别名槐实、槐子,富含蛋白质、类黄酮、皂苷、维生素类和氨基酸、植物凝集素[2-3]等多种活性成分,槐角具有抗炎、抗溃疡、抗氧化、抗肿瘤、清热泻火、凉血止血、止痛消肿之功效[4-5]。近年来,对于国槐研究主要集中在槐角黄酮、总异黄酮及脂溶性成分的提取及分析[6-9],而对于槐角中蛋白质的研究鲜见报道。大量文献表明,植物蛋白具有降低胆固醇、抗肿瘤、降血压和预防心血管疾病等生理功能[10],因此寻求植物蛋白资源具有重要的现实意义。
蛋白质提取的方法有碱溶酸沉法、盐提法、有机溶剂提取法等[11],其中盐提法所需设备简单,无需加入有机溶剂,污染少,成本低,条件温和,适用于蛋白质提取的工业化生成[12]。超声波提取法具有空化效应、粉碎作用,对植物细胞有破坏现象,能使所提取目标物质很好的溶于溶剂中,具有提取时间短、无需加热、产率高等优点[13],广泛应用于天然活性成分的提取等领域。
响应面法是一种统计学实验设计方法,目前已被广泛应用于植物提取过程的优化,有效快速地确定最佳因素范围[14-18],但是采用响应面优化超声辅助提取国槐种子蛋白质的工艺研究尚未见报道,更未见抗氧化方面的研究。本研究以国槐种子为材料,通过单因素实验和BB设计及响应面分析对超声辅助盐法提取国槐种子蛋白质的工艺条件进行优化,并研究其对DPPH和ABTS自由基的清除效果,以期为国槐种子蛋白质的进一步开发利用提供实验依据。
1 材料与方法
1.1 材料与仪器
国槐 2015年11月采自河西学院,经张勇教授鉴定为豆科植物国槐SophorajaponicaL.的果实(槐角),分离出中各部位,种子清洗干净后,阴干,粉碎过60目备用;氯化钠、磷酸氢二钠、磷酸二氢钠、考马斯亮蓝G-250、磷酸、硫酸铵、95%乙醇等试剂 均为国产分析纯;牛血清白蛋白(BSA) 苏州工业园区亚科化学试剂有限公司;2,2-朕氮-双(3-乙基苯并噻吡咯林-6-磺酸(ABTS)、二苯代苦味肼基(DPPH) 均购自Sigma公司。
KQ-250B型超声波清洗器 昆山市超声仪器有限公司;Sarstorius BT125D电子天平 德国;DR6000型紫外可见分光光度计 美国哈希;CR21GII高速冷冻离心机 日本日立公司;pH510酸度计 安莱立思仪器科技(上海)有限公司;自动移液枪100~5000 μL 百得实验室(苏州)仪器有限公司;MiLL ROCK冷冻干燥机 美国。
1.2 实验方法
1.2.1 提取方法 准确称取国槐种子粉末0.5000 g,按料液比1∶20加入0.2 mol/L磷酸缓冲液,在30 ℃,超声提取(频率为40 kHz,超声功率为250 W)30 min,然后在4 ℃,5000 r/min离心10 min,上清液用缓冲液定容50 mL,用于蛋白质含量测定。
1.2.2 国槐种子蛋白质的测定 国槐种子蛋白质含量采用考马斯亮蓝染色法[19]。标准曲线的制作:分别吸取100 μg/mL牛血清白蛋白0、0.20、0.40、0.60、0.80、1.00 mL于试管中,用蒸馏水补足至1 mL,再加入5 mL考马斯亮蓝溶液,混合均匀,5 min后测其吸光度值,建立回归方程为Y=0.0082X+0.04,Y为吸光度值,X为蛋白质质量(μg),牛血清白蛋白在20~100 μg之间具有良好的线性关系(R2=0.9992)。
蛋白质含量测定:准确吸取0.5 mL稀释10倍的蛋白质提取液,按照标准曲线的操作,在595 nm处测定吸光度值,根据回归方程计算蛋白质的质量,以单位质量材料中蛋白质的含量高低评价提取效果。国槐种子蛋白质提取量按以下公式计算:
式中:Y为提取液中蛋白质质量(μg),V为提取液总体积(mL),M为国槐种子质量(g)。
1.2.3 国槐种子蛋白质提取的单因素实验 采用1.2.1方法提取国槐种子蛋白质,提取条件为:准确称取国槐种子粉末0.5000 g 5份,选择提取温度30 ℃,超声时间30 min,料液比1∶20 (g/mL),考察不同pH(5.0、6.0、7.0、8.0、9.0)对蛋白质提取效果的影响;准确称取国槐种子粉末0.5000 g 5份,选择pH8.0,料液比1∶20 (g/mL),提取温度30 ℃,考察超声提取时间(20、30、40、50、60 min)对蛋白质提取效果的影响;准确称取国槐种子粉末0.5000 g 5份,选择pH8.0,提取温度30 ℃,超声提取时间30 min,考察料液比(1∶10、1∶20、1∶30、1∶40、1∶50)对蛋白质提取效果的影响;准确称取国槐种子粉末0.5000 g 5份,选择提取温度30 ℃,超声提取时间30 min,料液比1∶30 (g/mL),在pH8.0的缓冲液中加入NaCl使终浓度为0.6、0.7、0.8、0.9、1.0 mol/L,考察NaCl浓度对蛋白质提取效果的影响。
1.2.4 响应面法提取国槐种子蛋白质工艺研究 在上述单因素实验的基础上,对缓冲液pH、超声时间、料液比、NaCl浓度4个因素进行Box-Behnken实验设计,进行响应面分析,优化工艺条件。实验因素与水平见表1。
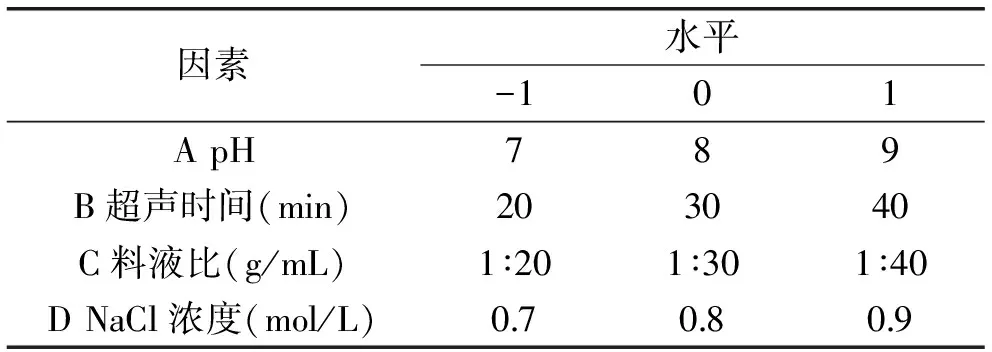
表1 Box-Behnken实验设计因素水平表Table 1 Factors and levels table of Box-Behnken experiment design
1.2.5 工艺的验证 对优化工艺进行5次重复验证,考察工艺的可靠性,并比较超声与未超声时,国槐种子蛋白提取的效果。
1.2.6 蛋白质的初步纯化 根据优化的条件提取国槐种子蛋白,取100 mL的蛋白质提取液,加入硫酸铵使饱和度为70%(边加边磁力搅拌至硫酸铵溶解),置于冰箱过夜,在4 ℃,5000 r/min离心20 min,弃上清。沉淀溶于0.2 mol/L磷酸缓冲液中进行透析,每6 h换一次透析液,透析至用0.1 moL/L的BaCl2溶液检测至无白色沉淀为止,用聚乙二醇进行吸水浓缩,浓缩液在温度-40~-47 ℃下冷冻干燥,得到国槐种子纯化蛋白。称取一定的蛋白用磷酸缓冲液溶解,采用1.2.2的方法测定蛋白质质量浓度为1902 μg/mL,并稀释200、150、100、50倍使蛋白质质量浓度为9.51、12.68、19.02、38.04 μg/mL,用做抗氧化实验。
1.2.7 国槐种子蛋白质抗氧化性的研究
1.2.7.1 国槐种子蛋白质对DPPH自由基的清除作用 对DPPH自由基的清除作用参照文献[20],并稍作修改,在试管中分别加入不同质量浓度的蛋白质溶液2 mL、然后加入2 mL的DPPH乙醇溶液,混合,避光静置30 min,在517 nm波长下测吸光度Ai;以相应体积的缓冲液代替样液作空白对照在517 nm波长下测吸光度A0,同时测定2 mL待测液与2 mL 95%乙醇在517 nm波长下的吸光度值(Aj)作为样品空白,DPPH自由基清除率按以下公式计算。
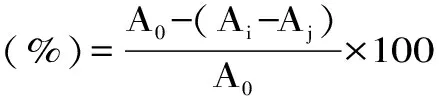
式中:A0-不加样品的吸光值,Ai-样品的吸光值,Aj-样品的本底吸光值。
1.2.7.2 国槐种子蛋白质对ABTS自由基的清除作用 对ABTS自由基的清除作用参照文献[21],并稍作修改,分别加入不同浓度国槐种子蛋白质提取液2 mL于试管中,然后加入2 mL的ABTS,混合,避光静置6 min,在734 nm波长下测吸光度Ai;以相应体积的缓冲液代替样液作空白对照在734 nm波长下测吸光度A0,同时测定2 mL待测液与2 mL蒸馏水在734 nm波长下的吸光度值(Aj),ABTS自由基清除率按以下公式计算。
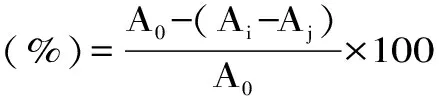
式中:A0-不加样品的吸光值,Ai-样品的吸光值,Aj-样品的本底吸光值。
1.2.8 数据处理 采用Excel 2003软件对数据进行统计,通过Origin 8.0与Design-Expert 8.0软件进行实验数据统计分析。
2 结果与分析
2.1 单因素实验

图1 pH对国槐种子蛋白质提取量的影响Fig.1 Effect of pH on extraction yield of Sophora japonica protein
2.1.1 pH对国槐种子蛋白质提取量的影响 由图1可以看出,pH对国槐种子蛋白质提取量的影响比较明显,随着pH的增大,国槐种子蛋白质提取量也随着增大,尤其在pH5.0~8.0之间,蛋白质提取量从41.75 mg/g增加到96.75 mg/g,但继续增大pH,提取量增大不明显,反而呈现下降的趋势。这是因为碱性条件会打破蛋白质分子间的部分氢键[17],从而促使淀粉与蛋白质的分离,大大提高了蛋白质的提取量。但是,过于碱性的环境下可能会使蛋白质发生变性或者水解,进一步影响到蛋白质的提取量,因此,提取国槐种子蛋白质的缓冲液pH应该控制在pH8.0左右。
2.1.2 超声时间对国槐种子蛋白质提取量的影响 由图2可以看出,超声时间在达到30 min时,国槐种子蛋白质提取量达到最高水平,其后随着时间的延长,蛋白质的提取量下降,但下降幅度不大,在30~60 min的范围内,提取量从96.89 mg/g下降到89.63 mg/g,下降了7.26%。分析原因,在超声波作用下,导致分子振动加快,摩擦增加蛋白质的溶解作用,从而有利于提取。但是提取时间过长可能导致蛋白质变性与水解[17],同时提取时间过长会加大生产成本,故选择超声提取时间为30 min比较适宜。

图2 超声时间对国槐种子蛋白质提取量的影响Fig.2 Effect of extraction time on extraction yield of Sophora japonica protein
2.1.3 料液比对国槐种子蛋白质提取量的影响 图3反映了料液比对国槐种子蛋白质提取量的影响,随着料液比的增大,国槐种子蛋白质的提取量不断增大,当料液比为1∶30时,蛋白质的提取量达到最大值,而后蛋白质提取量缓慢下降。如果料液比过小,提取体系的黏度过大,物料扩散速度慢,不利于蛋白质的溶出,使提取不完全。且过大的料液比不利于蛋白质后续的分离纯化,料液比以1∶30 (g/mL)为宜。

图3 料液比对国槐种子蛋白质提取量的影响Fig.3 Effect of the solid-liquid rate on extraction yield of Sophora japonica protein
2.1.4 NaCl浓度对国槐种子蛋白质提取量的影响 由图4可以看出NaCl的添加大大提高了蛋白质的提取量。随着NaCl浓度的增加,蛋白质的提取量呈上升趋势,但浓度达到0.8 mol/L时,蛋白质提取量最大,而后随浓度增大缓慢下降。这是因为低浓度的盐溶液能够增加蛋白质分子表面的电荷,增加其水中溶解度,而随着NaCl浓度继续增加,蛋白质提取量呈下降趋势,可能是由于高浓度的盐溶液反而会破坏蛋白质表面的水化膜和电荷[22],且NaCl浓度过大会产生盐析作用,从而导致提取量下降。因此,选择NaCl浓度为0.8 mol/L较为适宜。
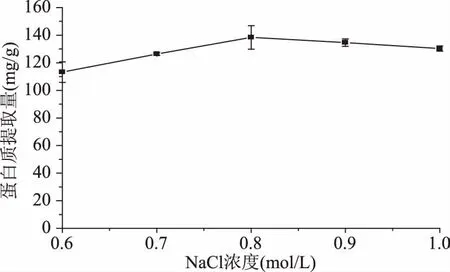
图4 NaCl浓度对国槐种子蛋白质提取量的影响Fig.4 Effect of NaCl concentration on extraction yield of Sophora japonica protein
2.2 响应面法优化国槐种子蛋白质提取工艺参数
2.2.1 模型方程的建立与显著性检验 在单因素实验的基础上,按照Box-Behnken实验设计方案进行4因素3水平实验,实验结果见表2。

表2 响应面实验分析方案及结果Table 2 Program and experimental results of RSA
将表2数据利用Design-Expert软件进行方差分析,通过对pH(A)、提取时间(B)、料液比(C)、NaCl浓度(D)进行多元回归拟合,获得国槐种子蛋白质对编码自变量pH、提取时间、料液比、NaCl浓度的回归方程:
Y=138.0615+4.745A-1.19533B+4.469583C+1.524417D-0.6975AB+2.54175AC+1.05625AD-1.043BC+0.5575BD+4.3065CD-10.6567A2-6.86224B2-8.84512C2-5.19037D2。
方差分析显著性检验见表3,从表3可以看出,该模型F=16.20,p<0.01,表明此回归模型是极显著的。pH与料液比的一次项、料液比与NaCl浓度的交互项、pH、超声时间、料液比以及NaCl浓度的二次项对国槐种子蛋白质提取影响极显著(p<0.01),其它项影响不显著(p>0.05)。失拟项F=5.51,p=0.0572>0.05,复相关系数为0.9418,说明94.18%的蛋白质的变化可由此模型解释,表明方程的拟合度较好,因此可用该回归方程代替实验真实点对实验结果进行预测和分析。变异系数的值为2.27,变异系数值越小,实验的可信度和精密度越高。由回归方程的各项方差分析结果表明,一次项和二次项均有显著性因素,表明选取的四因素对国槐种子蛋白质提取的影响不是简单的线性关系,平方项对响应值也有很大影响。由槐角种子蛋白质提取量的回归方程可知,各因素系数的绝对值大小反应了其对响应值的影响程度,绝对值大影响程度就越大[23],因为本方程的二次项系数是均为负值,说明回归方程所对应的响应面图形抛物面开口向下,有极大值,可以进行优化分析[17]。
各因素的F值大小可以反映因素对实验指标的重要性,F值越大表明对实验指标的影响越大。由表3可知,F(A)=33.44,F(B)=2.12,F(C)=29.67,F(D)=3.45,且F(A)>F(C)>F(D)>F(B),即各因素对国槐种子蛋白质提取量的影响顺序为:pH>料液比>NaCl浓度>超声时间。
2.2.2 国槐种子蛋白质提取的响应面分析 利用Design-Expert软件对表2数据进行多元回归拟合,所得回归方程的响应面和等高线图,该图组可直观地反映各因素及其交互作用对蛋白质提取量的影响。响应曲面坡度的陡峭程度越大,说明随着影响因素的变化,对响应值的影响程度越大。而等高线的形状及疏密程度也可以反映两因素间交互作用的强弱及因素影响的大小,椭圆形表示两因素间交互作用较强,圆形则相反[24]。具体结果及分析见图5(a~f)。

表3 回归模型方差分析Table 3 Variance analysis of the regression model
注:**为差异极显著(p<0.01);*为差异显著(p<0.05)。
由图5(a)可知,当料液比与NaCl浓度一定时,随着超声时间的增大,蛋白质提取量先增大后降低,但变化趋势比较平缓,而pH的变化坡度陡峭,且提取液pH轴向等高线密集,等高线呈圆形,说明两交互作用不显著,从曲面图的陡峭及等高线的疏密程度表明pH比超声时间对响应值的峰值影响较大。pH在8附近,超声时间在30 ℃左右,响应值最大。
图5(b)表明,当超声时间与NaCl浓度一定时,随着pH的增大,蛋白质提取量先升高后降低,变化趋势陡峭;随着料液比的增大,蛋白质提取量先增高后降低,变化趋势相对于pH平缓,等高线呈圆形,两交互作用不显著。说明pH比料液比对于国槐种子蛋白质的提取影响较大。
图5(c)表明,当超声时间与料液比固定时,随着pH与NaCl浓度的增大,蛋白质提取量呈现出先增高后降低的趋势,但pH较NaCl浓度变化的曲面曲度较大,且等高线呈圆形,表面两交互作用不显著,pH的变化对蛋白质提取量的影响较大。
图5(d~e)反映超声时间与料液比、NaCl浓度对蛋白质提取量交互影响的响应面图,从图可以看出,随着超声时间和NaCl浓度的增大,蛋白质提取量先增大后降低,但变化趋势比较平缓,随着料液比的增大,蛋白质提取量急剧增加,而后缓慢降低,说明料液比的变化对响应值影响较大。超声时间与NaCl浓度、料液比对蛋白质提取量的等高线呈圆形,说明两者交互作用不显著。
图5(f)表明,当超声时间与pH固定在零水平时,反映料液比与NaCl浓度对蛋白质提取量交互影响的响应面图,可以看出,蛋白质提取量随料液比和NaCl浓度增大而增大而后降低,并发现料液比轴向等高线变化密集,NaCl浓度轴向等高线的变化相对稀疏,等高线呈椭圆形,说明料液比与NaCl浓度交互作用显著。分析可知料液比对响应值的峰值较NaCl浓度影响较大。
因此,综合表3及图5(a~f)可以得出,pH、超声时间、料液比、NaCl浓度对蛋白质提取量影响的大小为pH>料液比>NaCl浓度>超声时间。

图5 各因素交互作用对蛋白质提取量影响的响应面和等高线图Fig.5 Response surface and contour plots showing the interactive effects of extraction conditions on protein extraction yield
2.3 验证实验
经Design-Expert 8.0软件对回归方程进行分析,得到该模型优化最佳参数为:pH8.15缓冲液包含0.82 mol/L NaCl、超声时间29 min、料液比1∶31.5、预测值为139.36 mg/g。考虑到实际的操作性,将实验条件修正为:pH8.2缓冲液包含0.82 mol/L NaCl,超声时间29 min,料液比1∶31,对此工艺进行5次重复验证,测得蛋白质含量的平均值为139.25 mg/g,相对标准偏差为0.37%,模型预测值139.36 mg/g,实测值与预测值非常接近,说明该方程与实际情况拟合很好,充分验证了所建模型的正确性,证实了该模型的有效性。同时也说明了响应面分析法适用于超声辅助提取国槐种子蛋白质参数的优化。在上述参数条件下比较了超声与未超声时国槐种子蛋白提取的效果,在超声与未超声条件下蛋白质的提取量分别为139.38和88.75 mg/g,说明超声辅助提取大大提高了国槐种子蛋白质的提取量。
2.4 国槐种子蛋白的抗氧化效果研究
DPPH自由基是一种人工合成的、稳定的以氮为中心的质子有机自由基,ABTS是一种水溶性的自由基引发剂,由于DPPH法和ABTS法操作简单,重复性好,不需要特殊的检测设备,通过反应体系颜色的改变来评价试样的抗氧化性,因此许多研究者将DPPH法和ABTS法用作抗氧化剂的抗氧化能力评价方法[25]。如图6、图7所示,随着蛋白质质量浓度的增大,对DPPH自由基和ABTS自由基清除率均呈现上升趋势,当蛋白质质量浓度为38.04 μg/mL,对DPPH自由基和ABTS自由基的清除率分别为29.44%和90.82%,而且国槐种子蛋白质对ABTS自由基的清除作用大于对DPPH自由基的清除作用。

图6 国槐种子蛋白对DPPH自由基的清除作用Fig.6 The scavenging effect of Sophora japonica seeds protein on DPPH radical

图7 槐种子蛋白对ABTS自由基的清除作用Fig.7 The scavenging effect of Sophora japonica seeds protein protein on ABTS radical
3 结论与讨论
本研究在单因素实验的基础上,采用BB设计及响应面分析优化了超声辅助盐溶法提取国槐种子蛋白质的工艺,得到国槐种子蛋白质提取的最优条件,即pH8.2缓冲液包含0.82 mol/L NaCl、超声时间29 min、料液比1∶31,在这种条件下,蛋白质最大提取量为139.25 mg/g,高于单因素实验结果。国槐种子蛋白的研究相对较少,但是产地、采样时间的不同,其结果差异较大,李婷等[26]研究了国槐不同采样时间种子萌发及代谢生理的影响,发现国槐种子11月采收后可溶性蛋白为144.40 mg/g,赵垦田等[3]对国槐种子化学成分进行了分析,种子中蛋白质占主要成分,粗蛋白在50%左右,由此说明国槐种子含有大量的蛋白质,有开发利用前景。
研究表明,蛋白质的抗氧化活性与巯基含量和蛋白酶及组成蛋白质的氨基酸种类、氨基酸的序列及蛋白质的疏水性有关[27],本研究结果显示,国槐种子蛋白质在一定的质量浓度范围内对DPPH自由基和ABTS自由基有清除作用,但对ABTS自由基清除效果较好,浓度为38.04 μg/mL时其清除率为90.82%,表现出良好的抗氧化活性,该抗氧化活性是否与蛋白质的巯基及氨基酸组成等因素有关,需要更一步研究。
[1]毛秀红,荀守华,孙居文,等.我国槐属植物育种及种质资源开发利用进展[J]. 植物生理学报,2015,51(4):399-406.
[2]Davis BD,Brodbelt JS. Determination of the glycosylation site of flavonoid monoglucosides by metal complexation and tandem mass spectrometry[J]. Journal of the American Society for Mass,2004,15(9):1287-1299.
[3]赵垦田,韩淑芹,崔玉兰.等.国槐(Sophorajaponica)种子成分分析[J].植物研究,1999,19(3):281-285.
[4]国家药典委员会.中华人民共和国药典(第一部)[M].北京:中国医药科技出版社,2015:355.
[5]陈明珠,申艳艳,赵越,等.槐角黄酮的体外抗氧化活性研究[J].食品工业科技,2013,34(4):94-96.
[6]丛艳波,刘宁,张永忠. 微波辅助提取槐角总异黄酮的研究[J].精细化工,2010,27(11):1083-1085.
[7]冉晓燕,胡德禹,薛伟.槐角中总黄酮的提取工艺研究[J].贵州教育学院学报,2009,20(6):22-24.
[8]周金娥,陈聪颖,谢一凡,等.槐角中脂溶性化学成分的研究[J].上海交通大学学报,2006,26(11):1245-1248.
[9]王景华,王亚琳,楼凤昌.槐树种子的化学成分研究[J].中国药科大学学报,2001,32(6):471-473.
[10]陈贵堂,赵霖.植物蛋白的营养生理功能及开发利用[J].食品工业科技,2004,25(9):137-140.
[11]Albert Sickmann,Wilma Dormeyer,Stefanie Wortelkamp,et al.Identification of proteins from human cerebrospinal fluid. separated by two-dimensional polyacrylamide gelelectrophoresis[J]. Electrophoresis,2000,21(13):2721-2728.
[12]初众,邢春影,严善春.洋虫成虫蛋白质化学提取方法的比较[J].东北林业大学学报,2007,35(4):50-52.
[13]罗琥捷,杨宜婷,黄寿根,等. 超声提取法与索氏提取法提取陈皮黄酮类有效成分的分析比较[J].中药材,2016,39(2):371-374.
[14]余小翠,刘高峰.响应面分析法在中药提取和制备工艺中的应用[J].中药材,2010,33(10):1651-1655.
[15]张艳,李永哲. 响应面法及其在药学领域中的应用[J].吉林化工学院学报,2012,29(7):20-25.
[16]李莉,张赛,何强,等. 响应面法在实验设计与优化中的应用[J]. 实验室研究与探索,2015,34(8):41-45.
[17]张秀云,李丹丹,马艳芳.响应面法优化白果蛋白质提取工艺[J].食品工业科技,2016,37(4):299-302.
[18 Tang De-Song,Tian Ying-Juan,He Yuan-Zhe,et al. Optimisation of ultrasonic-assisted protein extraction from brewer’s spent grain[J]. Czech J Food Sci,2010,28(1):9-17.
[19]王林嵩.生物化学实验技术[M].北京:科学出版社,2010.
[20]liu Xiao Li,Cui Chun,Zhao Mou Ming,et al.Identification of phenolics in the fruit of emblica(PhyllanthusemblicaL.)and their antioxidant activities[J].Food Chemistry,2008,109(4):905-915.
[21]Zhang Sheng,Li Xiang Zhou,Wu Zhi Ping,et al. Antioxidant activity of polysaccharide from camellia cake against ABTS and DPPH free radicals[J]. Advanced Materials Research,2012,550-553(7):1545-1549.
[22]饶胜其,臧祥玉,濮瑜雯,等.响应面实验优化广昌白莲蛋白提取工艺及其酶解多肽抗氧化活性[J].食品科学,2015,36(24):63-69.
[23]宋海燕,何文辉,彭自然,等.响应面法优化鹿角菜中岩藻多糖的提取工艺[J].海洋科学,2016,40(4):73-80.
[24]单丽芳,曹蕾,杨红梅,等. Box-Behnken 响应面法优选参芪复方颗粒的水提工艺[J]. 天然产物研究与开发,2016,28(4):568-574.
[25]Vít Marecek,Alexandr Mikyska,David Hampel,et al. ABTS and DPPH methods as a tool for studying antioxidant capacity of spring barley and malt[J]. Journal of Cereal Science,2017,73:40-45.
[26]李婷,彭祚登. 不同采种期对国槐种子萌发及生理代谢的影响[J].东北林业大学学报,2016,44(3):33-36.
[27]FANG Yunzhong,YANG Sheng,WU Guoyao. Free radicals antioxidants and nutrition[J]. Nutrition,2002,18(10):872-879.
