Thermus thermophilus分支酶的重组表达及其在抗性糊精制备中的应用
2018-01-22,,,,,,,*
, ,, ,, ,,*
(1.江南大学食品科学与技术国家重点实验室,江苏无锡 214122; 2.江南大学生物工程学院,江苏无锡 214122)
分支酶(Branching Enzyme,简称BE,EC 2.4.1.18),属于糖苷水解酶家族GH13[1]。它的主要作用一方面催化供体线性α-1,4葡聚糖链的降解(直链淀粉和支链淀粉),另一方面又可以通过α-1,6糖苷键将降解分子片段连接到受体上,形成更多的支链,从而改变淀粉的支化程度,该酶可以广泛应用于修饰淀粉,催化α-1,6糖苷键的生成,因此目前工业中主要用于制备高支化淀粉,在食品和医药行业用途广泛[2-4]。
抗性糊精又称难消化糊精,它是以淀粉为原料加工制成,拥有抗人体消化酶作用成分,具有持水性高,饱腹感强,在消化道内不易被吸收等重要作用,还可促进肠道蠕动和益生菌增殖[5]。此外,抗性糊精产品具有水溶性好、溶速快、无色无味等特性,在改善食品口感、优化食品加工性能等方面独具优势,因此在饮料、烘焙、乳制品等行业具有广泛的应用[6]。抗性糊精的研究最早起源于日本,我国在20世纪九十年代才开始对抗性糊精进行研究,1995年林勤保等以淀粉为原料制备焦糊精,并将焦糊精用α-淀粉酶处理后再用葡萄糖淀粉酶处理制备抗性糊精[7]。2006年,广东省食品研究所申请了一种抗性麦芽糊精的制备工艺的专利,它先对焦糊精用α-淀粉酶水解,然后用普鲁兰酶处理,后进行脱色离子交换和喷雾干燥得到抗性麦芽糊精[8]。
分支酶能够进一步利用焦糊精里的α-1,4糖苷键,合成人体抗消化成分的α-1,6糖苷键,提高焦糊精中抗性成分的含量。目前国内外尚无利用分支酶来制备抗性糊精的相关报道。由于天然菌株的产酶能力较低,为了克服天然菌株的低生产能力,将其基因进行过量表达以提高产量是降低生产成本的有效途径之一[2]。本文通过构建基因工程菌,将来源于Thermusthermophilus的淀粉分支酶(TtSBE)在大肠杆菌中过量表达,并研究此酶的酶学性质及其在抗性糊精制备过程中的应用。
1 材料与方法
1.1 材料与仪器
大肠杆菌E.coliBL21(DE3)、E.coliJM109、表达载体pET-24a(+) 本实验室保藏;pMD18-T-simple载体、T4 DNA连接酶、碱性磷酸酶CIAP、DNA聚合酶PrimeSTAR®HS、限制性内切酶(NdeI、HindⅢ) 大连宝生物公司;琼脂糖凝胶DNA回收试剂盒、PCR纯化试剂盒、质粒小提试剂盒 北京天根生化科技有限公司;PCR引物 上海生工生物工程有限公司;异丙基-β-D-硫代半乳糖苷(Isopropylβ-D-1-Thiogalactopyranoside,IPTG)、氨苄青霉素(Ampicillin,Amp)、卡那霉素(Kanamycin,Kan) 上海捷瑞有限公司;蛋白质凝胶电泳试剂盒 碧云天生物技术(南通)有限公司;焦糊精 山东百龙创园生物科技有限公司;直链淀粉 美国Sigma公司;分子级酵母粉和蛋白胨 Oxoid公司;其它常规试剂 国药集团化学试剂有限公司。
细胞超声波破碎仪 宁波新芝生物科技股份有限公司;Unic 7200可见分光光度计 尤尼科(上海)有限公司;蛋白电泳仪、UVP凝胶成像系统 美国Bio-Rad公司;pH计 瑞士Mettler-Toledo公司;恒温调速回转式摇床 上海精密仪器仪表有限公司;恒温水浴摇床 太仓市华利达实验设备有公司;PTC-200型基因扩增仪 美国MJ Research公司;Eppendorf高速离心机 德国Eppendorf公司;DYY-6C型核酸电泳仪 北京六一电泳仪厂。
1.2 实验方法
1.2.1 聚合酶链(PCR)反应体外扩增目的基因 以Thermusthermophilus的基因组为模板,分别设计正、反向引物,PCR扩增TtSBE基因。
正向引物含有NdeI酶切位:5′-CATATGATG GCGCGCTTCGCCCTG-3′,
反向引物含有HindIII酶切位:5′-AAGCTT TCACGCCTCCCGGAAAAGG-3′
PCR反应的体系:5×PS Buffer 10 μL,dd H2O 34 μL,dNTP Mix 4 μL,模板1 μL,正、反向引物各0.5 μL,PrimeSTAR® HS DNA Polymerase 0.5 μL。
PCR反应条件:DNA模板经过94 ℃预变性4 min之后,然后开始进入35个循环:先98 ℃变性10 s形成单链,然后在55 ℃下退火10 s使得引物分别与其同源序列相结合,之后72 ℃在PrimeSTAR® HS DNA聚合酶的作用下延伸2 min形成双链,72 ℃再延伸10 min,最后4 ℃保存。
1.2.2 基因工程菌的构建 将PCR产物与pMD18-T simple载体相连接,将连接产物转化大肠杆菌JM109,37 ℃培养3 h左右后涂布含有100 mg/L氨苄青霉素的LB平板。经37 ℃培养过夜,挑选菌落,接入LB液体培养基,8~10 h后提取质粒[9],命名为TtSBE/pMD18-T simple,采用质粒小提试剂盒来提取质粒DNA,具体参照操作按照试剂盒说明书,并稍作修改。
将该质粒与表达载体pET-24a(+)经双酶切后用T4连接酶连接,得到重组表达质粒,连接产物转化E.coliJM109感受态细胞,经37 ℃培养8 h,挑转化子在含有100 mg/L卡那青霉素的LB中振荡培养8~10 h[10],挑取基因工程菌到含有卡那青霉素的TB培养基中培养3 h后加入IPTG终浓度为0.2 mmol/L,诱导48 h后收集菌体[11]。
1.2.3 酶活测定 配制50 mmol/L,pH6.5的磷酸缓冲液(Na2HPO4.12H2O和NaH2PO4·2H2O)。
鲁戈碘液(母液):0.26 g碘与2.6 g碘化钾溶于10 mL的容量瓶中(提前3 d配制,确保碘完全溶解),避光室温保存(6个月)[12]。
终止反应液:0.1 mL的鲁戈碘液+50 μL的2 mol/L盐酸溶液,定容到26 mL(现配现用)[12]。
底物:0.01 g直链淀粉(0.1 g支链淀粉)+0.2 mL 96%乙醇。3~4 min后加入0.5 mL,2 mol/L的NaOH溶液,加入10 mL的水,搅拌10 min溶解淀粉,再加入0.5 mL,2 mol/L的HCl溶液,加入pH6.5的缓冲液定容到10 mL调节pH。(现配现用)
50 μL的酶液+50 μL的底物,在60 ℃下水浴30 min,在加入2 mL的终止反应液,室温放置20 min后660 nm处测吸光值。
酶活定义:常温下在660 nm处,吸光值每分钟降低1%为一个酶活单位。
1.2.4 TtSBE的分离纯化 采用AKTA avant蛋白纯化系统,具体步骤为:将发酵液装入离心杯中配平,于4 ℃、12000 r/min条件下离心20 min收集菌体,用20 mmol/L pH6.5 Na2HPO4·12H2O-NaH2PO4·2H2O缓冲液悬浮菌体,在输出功率为325 W,总工作时间为20 min,工作/间歇时间为2 s/3 s,超声破碎后12000 r/min离心15 min,破壁上清即为TtSBE粗酶液。然后在60 ℃下热处理0.5 h左右,采用60%的(NH4)2SO4盐析,盐析过夜,12000 r/min离心收集沉淀。然后将沉淀用pH6.5的缓冲液悬浮均匀,在pH7.5,20 mmol/L Na2HPO4·12H2O-NaH2PO4·2H2O缓冲液中,用透析袋4 ℃透析过夜,经过无机膜过滤后制成上样样品[13]。最后,用monoQ阴离子交换色谱柱进行纯化(A液:20 mmol/L pH7.5 Na2HPO4·12H2O-NaH2PO4·2H2O缓冲液;B液:20 mmol/L pH7.5 Na2HPO4·12H2O-NaH2PO4·2H2O缓冲液+1 mol/L NaCl),280 nm紫外在线监测,分步收集含TtSBE的洗脱液。测定酶活并进行蛋白电泳检测。
1.2.5 TtSBE的酶学性质研究
1.2.5.1 TtSBE的最适温度和热稳定性分析 以直链淀粉为底物,分别在30、40、50、60、70、80 ℃下测定活力,按照1.2.3酶活测定方法计算TtSBE的酶活,定义最高酶活力为100%,并计算各个温度下的相对酶活,以此确定TtSBE的最适温度,为了研究TtSBE的热稳定性,将重组酶在60 ℃下保温,定期取样测定重组酶的残留酶活(定义初始酶活力为100%)。

表1 重组TtSBE的纯化过程参数Table 1 Purification process parameters of recombinant TtSBE
1.2.5.2 TtSBE的最适pH 用Na2HPO4·12H2O和NaH2PO4·2H2O配制不同pH的磷酸钠缓冲液,按照1.2.3酶活测定方法计算TtSBE分别在pH为5.5、6、6.5、7.0、7.5下的酶活,定义最高酶活力为100%,并计算各个pH下的相对酶活,来确定TtSBE的最适pH[1]。
1.2.6 TtSBE在抗性糊精制备中的应用
1.2.6.1 抗性糊精的检测方法 抗性糊精的纯度测定参照国标GB/T22224-2008《食品中膳食纤维的测定-酶重量法》。
抗性糊精的得率(%)=干燥后物质重量/反应前焦糊精重量×100[11,14]。
1.2.6.2 TtSBE在不同温度下对生成抗性糊精的影响 以2%的焦糊精为底物,溶于50 mmol,pH6.5的磷酸钠缓冲液,加入TtSBE酶液,加酶量为最适加酶量,依次在40、50、60、70、80 ℃下酶催化反应,然后沸水浴灭酶10 min,用1.2.6.1方法测定抗性糊精的得率。
1.2.6.3 TtSBE在不同pH下对生成抗性糊精的影响 以2%的焦糊精为底物,溶于50 mmol,pH依次为5、5.5、6、6.5、7.0、7.5的磷酸钠缓冲液中,加入TtSBE酶液,在最适酶转化温度下反应,然后沸水浴灭酶10 min,用1.2.6.1方法测定抗性糊精的得率。
1.2.6.4 TtSBE不同加酶量对生成抗性糊精的影响 以2%的焦糊精为底物,溶于50 mmol,pH6.5的磷酸钠缓冲液,混合均匀后加入TtSBE酶液,加酶量依次为1000、2000、3000、4000、5000 U/g(焦糊精),进行酶催化反应,然后沸水浴灭酶10 min,用1.2.6.1方法测定抗性糊精的得率。
1.2.6.5 TtSBE在不同反应时间对生成抗性糊精的影响 以2%的焦糊精为底物,溶于50 mmol,pH6.5的磷酸钠缓冲液,加入TtSBE酶液,加酶量为最适加酶量,在最适酶转化温度下催化时间依次为0、4、8、12、16 h,然后沸水浴灭酶10 min,用1.2.6.1方法测定抗性糊精的得率。
2 结果与讨论
2.1 TtSBE的克隆表达
将Thermusthermophilus来源的淀粉分支酶基因克隆表达于E.coli中,摇瓶发酵培养后收集菌体,破壁离心取上清后测得TtSBE酶活为700 U/mL。然后将破壁上清液进行SDS-PAGE分析,重组TtSBE的分子量大小为59.2 kDa,如图1所示,表明重组TtSBE在大肠杆菌中成功表达。
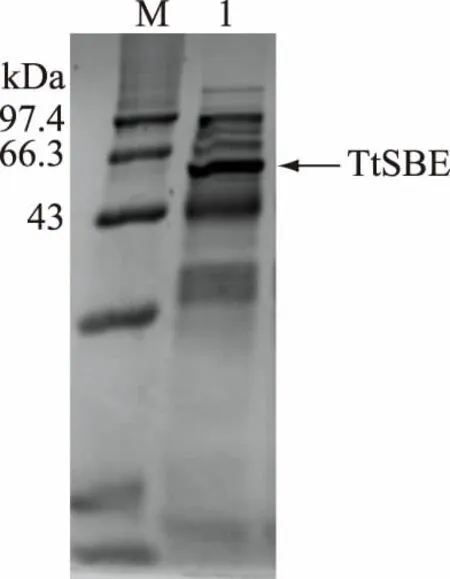
图1 重组TtSBE破壁上清SDS-PAGE图Fig.1 Intracellular soluble fraction SDS-PAGE of recombinant TtSBE注:M.标准蛋白样品;1.重组酶TtSBE。
2.2 重组TtSBE的分离纯化
经过60%(NH4)2SO4沉淀、monoQ阴离子交换色谱柱等步骤纯化后重组TtSBE的比活由88.50 U/mg提高到773.27 U/mg(表1),纯化后的重组TtSBE在SDS-PAGE电泳图(图2)中呈现单一条带,表明得到电泳纯的重组TtSBE。
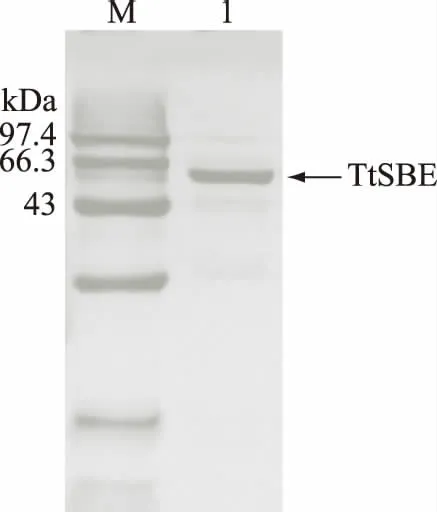
图2 重组TtSBE的SDS-PAGE蛋白电泳图Fig.2 SDS-PAGE of purified recombinant TtSBE注:M.标准蛋白样品;1.纯化重组酶TtSBE。
2.3 TtSBE酶学性质研究
2.3.1 重组TtSBE的最适温度及温度稳定性 酶受温度的影响较大,温度会对酶的结构产生影响,从而影响酶促反应的催化速率。为了研究重组TtSBE的最适温度和热稳定性,在不同温度下测定重组TtSBE的酶活力,结果如图3所示,发现温度在60 ℃时,酶活达到最大,高于或低于60 ℃,酶活都有所下降,说明TtSBE的最适温度为60 ℃;并在60 ℃进行热稳定分析,发现该酶在60 ℃条件下半衰期接近40 h(图4),60 ℃的热稳定性较好。
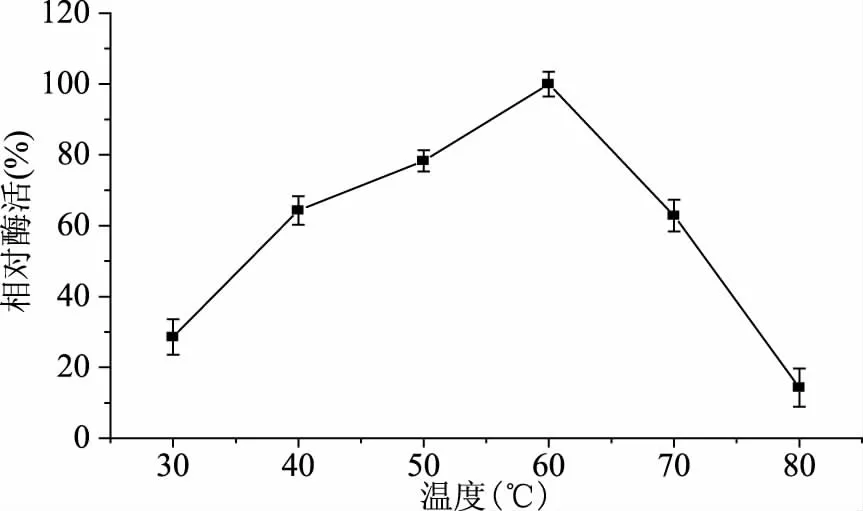
图3 重组TtSBE的最适温度Fig.3 The optimum temperature for recombinant TtSBE
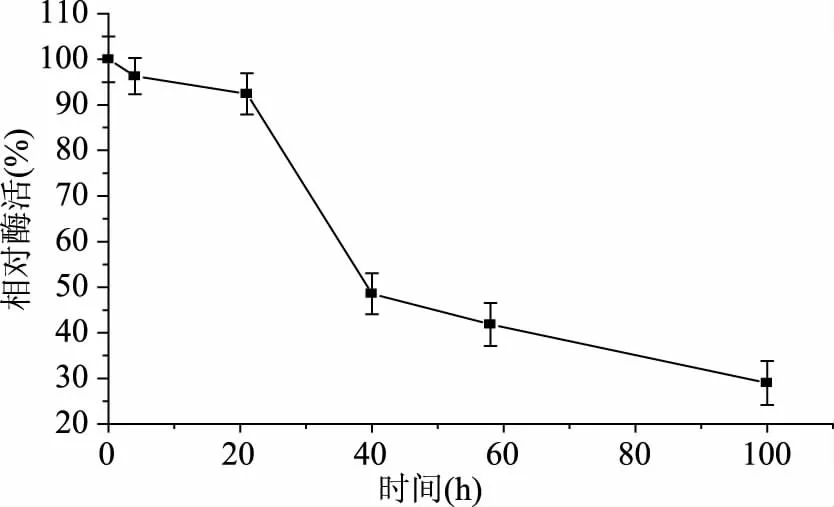
图4 TtSBE在60 ℃的热稳定性Fig.4 The temperature stability of recombinant TtSBE at 60 ℃
2.3.2 重组TtSBE的最适pH 酶的活性容易受到环境pH的影响,过酸或过碱都能使酶发生不可逆转的失活(极端耐酸耐碱酶除外)[15],因此研究重组TtSBE的最适pH至关重要。测定重组TtSBE在不同pH缓冲液下的最适pH的酶活力,结果如图5所示,重组TtSBE最适pH为6.5,且pH在6.0和7.0时,重组TtSBE的酶活均达到80%以上。
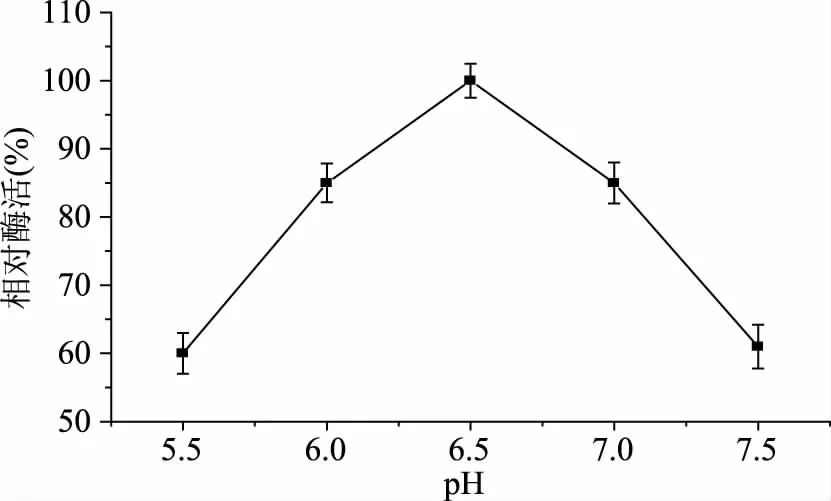
图5 重组TtSBE最适pHFig.5 The optimum pH for recombinant TtSBE
2.4 重组TtSBE在抗性糊精制备中的应用
2.4.1 不同温度对TtSBE生成抗性糊精的影响 酶催化反应速率存在最适反应温度,高于或低于最适酶催化反应温度,都会影响酶转化效率[8]。结果发现,当TtSBE催化温度为60 ℃时,生成抗性糊精的得率达到最大(图6),为50.5%,比焦糊精中抗性成分提高了7%,而低于或者高于60 ℃时,抗性糊精得率都有所减少,因此选择在60 ℃制备抗性糊精。
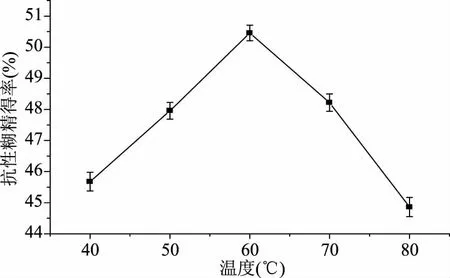
图6 不同温度对TtSBE生成抗性糊精的影响Fig.6 The influence of different temperature on TtSBE synthesis resistance dextrin
2.4.2 不同pH对TtSBE生成抗性糊精的影响 为了研究TtSBE酶转化制备抗性糊精的最适pH,分别在不同pH下进行酶转化,结果如图7所示,重组TtSBE制备抗性糊精的最适pH为6.5,低于或者高于6.5时,抗性糊精得率都有所降低,因此选择pH6.5为最佳酶转化的初始pH。
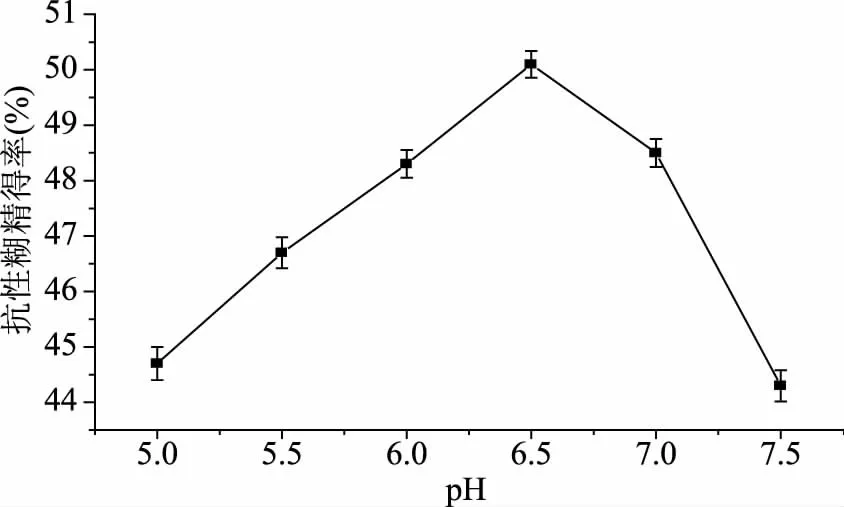
图7 不同pH对TtSBE生成抗性糊精的影响Fig.7 The influence of different pH for TtSBE synthesis resistance dextrin
2.4.3 不同TtSBE加酶量对生成抗性糊精的影响 底物浓度一定时,随着加酶量的增大,酶催化反应效率也会随之增加,当加酶量达到某一数值时,继续增大加酶量,催化效率不再增加,会保持在某一数值,此时催化效率达到最大值。探究加酶量对生成抗性糊精得率的影响,结果发现,当加入3000 U/g(焦糊精)的TtSBE时,抗性糊精得率达到最大值为49.5%(图8),较焦糊精中抗性成分提高了5.5%,之后继续增大加酶量,抗性糊精得率并没有增加。
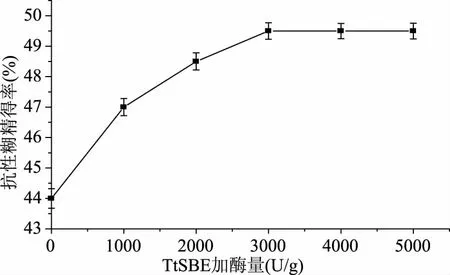
图8 不同TtSBE加酶量对生成抗性糊精的影响Fig.8 Effects of different amounts of enzyme for TtSBE synthesis resistant dextrins
2.4.4 不同反应时间对TtSBE生成抗性糊精的影响 反应时间会影响抗性糊精的产率,随着反应时间的延长,产率不断提高,当达到平衡时,产率趋于稳定。为了研究在不同反应时间内TtSBE利用焦糊精生成抗性糊精的变化,分别在不同时间内检测抗性糊精,结果发现,当反应时间为12 h时,抗性糊精得率达到最大(图9),当继续延长反应时间时,抗性糊精得率没有变化,因此,选择酶转化反应时间为12 h来制备抗性糊精。
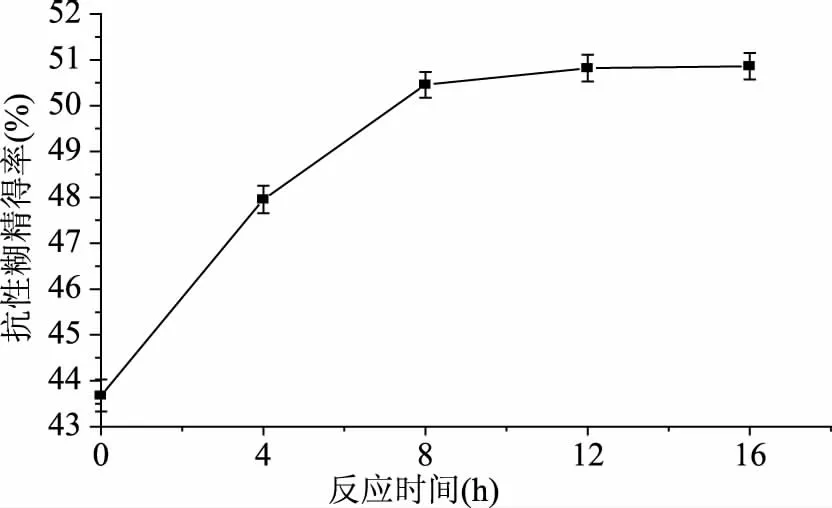
图9 不同反应时间TtSBE对生成抗性糊精的影响Fig.9 The influence of different reaction time on TtSBE synthesis resistant dextrin
3 结论
本文通过构建基因工程菌将分支酶异源表达于大肠杆菌,发酵得到重组TtSBE的酶活达700 U/mL;在此基础上对重组TtSBE进行了酶学性质研究,确定了TtSBE的最适pH为6.5,最适温度为60 ℃,在60 ℃时的半衰期为40 h左右;并研究了分支酶制备抗性糊精的催化反应条件,发现当温度为60 ℃,pH为6.5,反应时间为12 h,加酶量为3000 U/g(焦糊精)时,抗性糊精得率达到最大,为50%左右,比焦糊精原料提高约7%。该研究为利用分支酶制备抗性糊精提供了方法借鉴,具有潜在的工业化生产价值。
[1]Palomo M,Pijning T,Booiman T,et al. Thermus thermophilus glycoside hydrolase family 57 branching enzyme:crystal structure,mechanism of action,and products formed[J]. Journal of Biological Chemistry,2011,286(5):3520.
[2]Maarel,MjecvdLeemhuis H. Starch modification with microbial alpha-glucanotransferase enzymes[J]. Carbohydrate Polymers,2013,93(1):116.
[3]Dijkhuizen L. Properties of the glucan branching enzyme of the hyperthermophilic bacterium[J]. Biocatalysis and Biotransformation,2003,21(4-5):199-207.
[4]鲍春辉,顾正彪,李才明,等. 重组大肠杆菌产淀粉分支酶的发酵条件探索[J]. 食品工业科技,2014,35(15):155-162.
[5]Sonnenburg ED,Smitssa,Tikhonov M,et al. Diet-induced extinction in the gut microbiota compounds over generations[J]. Nature,2016,529(7585):212.
[6]Requena M,Gonzlezcna,Barragnlap,et al. Functional and physico-chemical properties of six desert-sources of dietary fiber[J]. Food Bioscience,2016,1(16):26-31.
[7]林勤保,杨连生. 以淀粉为原料制造难消化糊精[J]. 食品与发酵工业,1995,5(10):49-51.
[8]陈磊. 功能淀粉糊精的制备及其应用研究[D]. 广州:华南理工大学,2014.
[9]张悦,宿玲恰,吴敬. 重组大肠杆菌生产海藻糖合酶发酵工艺优化[J]. 食品与生物技术学报,2016,35(9):913-919.
[10]姜欢. 4-α-葡萄糖基转移酶、分支酶对淀粉的改性作用研究[D]. 无锡:江南大学,2014.
[11]Luebke W. branching glucosyltransferase from rhodothermus obamensis expressed in bacillus subtilis[J]. Perflavory,2009,93(1):115.
[12]段绪果. 淀粉脱支酶的重组表达及分子改造[D]. 无锡:江南大学,2013.
[13]汪红,祁玉峰,魏红. 酶重量法测定食品中膳食纤维含量方法的改进[J]. 食品工业科技,2007,28(9):203-205.
[14]杨玉路,王蕾,陈晟,等. 重组β-环糊精葡萄糖基转移酶生产β-环糊精的工艺条件优化[J]. 生物技术通报,2014,12(8):175-181.
