罗非鱼皮明胶酶解物及其模拟消化产物的抗氧化活性
2018-01-22,,,,
, ,,,
(大连工业大学食品学院,国家海洋食品工程技术研究中心,辽宁大连 116034)
罗非鱼(Oreochromisniloticus)是一种十分广泛的淡水养殖鱼类。2015年产量为171万吨[1]。目前,罗非鱼的生产加工主要以出口冷冻鱼肉片为主,加工过程产生的下脚料占全鱼重的60%~70%,包括鱼皮、鱼头、鱼鳍和鱼骨[2]。有效利用这些下脚料,避免浪费的同时还可减少环境污染[3]。且这些副产物中仍含丰富的蛋白质[4],鱼皮中含量最为丰富,而鱼皮作为胶原蛋白和明胶的丰富来源[5]更为安全[6]。
明胶经酶解制备成的明胶肽具有较高的生物活性,如血管紧张素转化酶抑制作用、抗氧化、免疫调节和抗菌活性等[7]。而且其富含多种氨基酸,不含脂肪,能够满足人们对“低脂高蛋白”这一类食品的需求。鱼皮中的明胶肽,可增强低钙水平下的骨胶原结构、加强皮肤中胶原代谢的速度、改善与老化相关的胶原合成低下问题、预防及治疗关节症等胶原病[8]。酶法水解明胶后所得的生物活性肽中不含有机溶剂或有毒有害残留物质[9],故其与陆地动物皮胶原或明胶资源相比,已然成为制备天然抗氧化活性肽的最佳原料,近年来更是受到人们广泛关注[10]。研究人员以多种鱼皮作为原料,通过不同种类酶酶解制备多种明胶肽并对其抗氧化活性进行的研究在逐渐增多。例如,Niranian等[11]研究发现,当鱼皮明胶肽的N端为疏水性氨基酸,特别是缬氨酸或亮氨酸时,抗氧化活性较高。Zhang[12]发现:组分中甘氨酸、蛋氨酸、苯丙氨酸、赖氨酸等含量较高的肽具有较好的抗氧化活性,预示明胶肽可以作为一种良好的抗氧化剂在食品中应用。

表1 不同蛋白酶的酶解条件Table 1 Hydrolytic conditions of different protease
本研究以罗非鱼皮为原料,提取明胶并以风味蛋白酶和胰蛋白酶作为工具酶制备具有抗氧化活性的罗非鱼皮明胶肽,考察其ABTS自由基、DPPH自由基、羟基自由基清除活性及其对亚油酸过氧化体系的抑制作用。同时,以商品化的谷胱甘肽(GSH)为对照,评价罗非鱼皮明胶肽的抗氧化活性。本研究为罗非鱼皮蛋白质资源高值化利用提供研究基础,同时也为制备新型食品抗氧化剂提供理论依据。
1 材料与方法
1.1 材料与仪器
罗非鱼皮(tilapia skin) 广西百洋水产集团股份有限公司提供;风味蛋白酶 酶活为34606 U/g,丹麦诺维信有限公司;胰蛋白酶 来源于猪胰脏,酶活为3000 U/g,南宁庞博生物制药有限公司;胃蛋白酶 来源于猪胰脏,酶活为345160 U/g,上海生工生物工程股份有限公司;谷胱甘肽(GSH) 上海生工生物工程技术服务有限公司;trolox、2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS)、1,1-二苯基-2-三硝基苯肼(DPPH)、亚油酸 美国Sigma-Aldrich公司;吐温20、2-硫代巴比妥酸(TBA) 上海BBI生命科学有限公司;细胞色素C、甘氨酸、抑肽酶 上海生工生物股份有限公司;VB12美国Sigma-Aldrich公司;MOG(Myelin oligodendrocyte glycoprotein)、β-Amyloid 上海强耀生物科技有限公司;其他试剂均为分析纯。
SHZ-D9循环水式真空泵、DF-101S恒温加热磁力搅拌器 巩义市予华仪器有限公司;Micro 17R微量台式离心机 赛默飞世儿科技(中国)有限公司;PHS-3精密pH计 上海雷磁仪器公司;HITACHI CF16RXII 离心机 日本株式会社日立制作所;XW-80A漩涡振荡器 上海精科实业有限公司;UV-5200型紫外可见分光光度计 上海元析仪器有限公司;干浴器 德国IKA公司;Infinite200 NANO酶标定量测定仪 TECAN(上海)贸易有限公司;A200电子自旋共振波谱仪 德国Bruker BioSpin公司;P230半制备高效液相色谱 大连依利特分析仪器有限公司;HH-6超声波清洗机 江苏金坛荣华仪器制造有限公司。
1.2 实验方法
1.2.1 明胶提取 罗非鱼皮经去鳞、切块、清洗后,用0.1 mol/L NaOH溶液(1∶10,w/v)在4 ℃条件下搅拌24 h,每8 h换一次NaOH溶液,过滤,得沉淀,并洗至中性后,所得沉淀使用0.2 mol/L HAc溶液(1∶10,w/v)于4 ℃条件下搅拌24 h,每8 h换一次HAc溶液,过滤,所得沉淀用去离子水洗至中性,过滤,所得沉淀用去离子水(1∶10,w/v)在45 ℃条件下溶胀8 h。采用两层滤布和Whatman NO.4滤纸过滤,滤液经冷冻干燥后得鱼皮明胶,于-30 ℃冷冻保存。
1.2.2 酶解物制备
1.2.2.1 酶解工艺 准确称取一定量的罗非鱼皮明胶并补水至底物蛋白浓度为2%,在每种酶的最适温度下保温并调至适宜pH后加酶,于适宜温度下恒温酶解不同时间(保持pH恒定在最适),所得酶解液于100 ℃条件下灭酶10 min,将离心(4000 r/min,20 min)后所得上清液冷冻干燥,制得罗非鱼皮明胶酶解物。
1.2.2.2 酶解条件 以风味蛋白酶(34606 U/g)和胰蛋白酶(30000 U/g)为工具酶,以罗非鱼皮明胶为底物,底物浓度以蛋白质计,依据各种酶的商品说明书,分别在两种酶的最适温度和最适pH条件下进行酶解,酶解具体条件如表1所示。
1.2.3 水解度的测定 水解度定义为水解过程中断裂肽键数与底物中肽键总数的百分比,测定方法采用pH-stat法[13],以滴定所消耗的标准NaOH溶液体积计算水解度。计算公式如下:
式中:DH-水解度,%;B-保持pH不变所消耗的碱(NaOH)的体积,mL;Nb-碱的当量浓度,mol/L;Mp-底物中蛋白总量,g;htot-底物蛋白质中肽键总数,mmol/g,本研究中htot以7.5计;α-水解过程中α-氨基的解离度,计算公式如下:
式中:pH为酶解过程中恒定的pH;本研究中pK以7.5计。
1.2.4 三氯乙酸(TCA)可溶性肽得率的测定 按照金文刚等[14]的方法进行测定,即三氯乙酸(TCA)沉淀结合Folin-酚的方法。取1 mL稀释一定浓度的罗非鱼皮明胶酶解液,加入1 mL的20%(w/v)的三氯乙酸(TCA)溶液,室温条件下静置20 min,13500 r/min离心10 min。吸取100 μL上清液,加入500 μL Folin-酚甲液,振荡混匀后静置10 min。再加入50 μL Folin-酚乙液,立即振荡后静置30 min。吸取200 μL该溶液加入96孔板中,3组平行,在500 nm波长下用酶标仪测定光密度值。根据绘制的牛血清白蛋白标准曲线(y=0.6492x+0.0597,R2=0.9940)获得水解液中TCA可溶性肽质量。在此基础上,根据水解液中总蛋白质量,计算TCA可溶性肽得率。
1.2.5 抗氧化能力的测定
1.2.5.1 ABTS自由基清除能力测定 参考Arts等[15]的方法进行测定。具体方法如下,将7 mmol/L ABTS溶液与2.45 mmol/L过硫酸钾溶液1∶1混合,摇匀后室温下避光孵育12~16 h制得ABTS+·溶液。测定前用0.2 mol/L PBS(pH7.4)缓冲溶液将ABTS+·溶液稀释至OD734=0.7±0.02后,立即分别吸取1 mL加入到不同浓度罗非鱼明胶水解物中于2 mL EP管中振荡混合均匀,30 ℃干浴器内避光反应6 min,吸取200 μL反应液加入到96孔板中,于734 nm波长下用酶标仪测定吸光值,按照下式计算清除率。
ABTS自由基清除率(%)=(A0-A1)/A0×100。
式中,A1为样品吸光值;A0为以超纯水代替样品时所测吸光值。以Trolox做标准曲线(y=0.0194x+0.0002,R2=0.9978),并将结果转换成Trolox当量。
1.2.5.2 DPPH自由基清除能力测定 参考金文刚等[16]的方法进行测定。取0.2 mL不同浓度样品溶液与0.4 mL磷酸盐缓冲溶液(PBS)(0.04 g/L,pH6)、0.4 mL DPPH乙醇溶液(200 μmol/L)于1.5 mL离心管中混合均匀。振荡后室温下避光静置30 min,4000 r/min离心10 min后,取200 μL该溶液加入96孔板中,于517 nm波长下用酶标仪测定吸光值,按照下式计算清除率。DPPH自由基清除率(%)=[1-(As-A0)/A]×100。式中,As为样品吸光值测定值;A0为以95%乙醇代替DPPH溶液时测定的吸光值;A为以去离子水代替样品时的空白吸光值。
1.2.5.3 羟基自由基清除能力测定 参考段秀红等[18]的方法即应用电子自旋共振的方法(ESR)进行测定,以Fenton反应体系产生·OH。取38 μL磷酸盐缓冲溶液(PB)(pH7.4,0.15 mol/L),39 μL样液,5 μL DMPO(1 mol/L),10 μL EDTANa2和FeSO4混合液(6 mmol/L),8 μL H2O2(6%),混合均匀,40 ℃避光孵育30 min后,立即吸入毛细管中,一端用凡士林封口后放入电子自旋共振波谱仪的谐振腔,进行羟基自由基信号谱图的测定。
利用磷酸盐缓冲溶液(PB)配制不同浓度的样品溶液,以GSH为对照,测定时以样品溶液代替磷酸盐缓冲溶液(PB)获取羟基自由基信号谱图。测试条件:中心磁场强度3368.99 G,微波功率0.721 mW,微波频率9.44 GHz,放大倍数1.0×105,调制幅度1.00 G,调制频率为100 kHz,时间常数81.92 ms,转换时间40 ms。按照下式计算清除率,·OH的清除率E(%)=[(ho-hx)/ho]×100,其中ho和hx分别为体系中加入试样前后ESR图谱中第二个峰的峰高。
1.2.5.4 亚油酸过氧化抑制活性测定 采用硫代巴比妥酸(TBA)法测定亚油酸过氧化抑制活性[17]。将200 μL亚油酸与400 μL吐温-20加入到19.4 mL磷酸缓冲溶液(PBS)(0.02 mol/L,pH7.4)中进行乳化,超声处理10 min后获得混合均匀的亚油酸乳液。取500 μL亚油酸乳液,加入600 μL PBS(0.02 mol/L,pH7.4)、200 μL FeSO4(0.01%,w/v)、200 μL抗坏血酸(0.01%,w/v)及分别稀释不同倍数的样品500 μL,漩涡振荡混匀后于37 ℃避光孵育24 h。向反应24 h后的混合液中立即加入200 μL TCA(4%,w/v)、2 mL TBA(0.8%,w/v)、200 μL BHT(0.4%,w/v),于100 ℃沸水浴30 min,冷却后的混合物于4000 r/min离心10 min,于534 nm处测定上清液吸光度,按照下式计算抑制率。亚油酸过氧化抑制率(%)=(A0-As)/A0×100。式中,As为样品吸光值测定值;A0为以去离子水代替样品时的空白测定值。
1.2.6 模拟胃肠道消化实验 参考Sunantha Ketnawa等[19]人的方法稍作修改。模拟胃液消化方法如下,40 mg胃蛋白酶溶解于1 mL 0.1 mol/mL HCl中,制备模拟胃消化液。0.5 g罗非鱼皮明胶酶解物冻干粉溶于35 mL超纯水中,37 ℃下140 r/min振荡孵育30 min。调节pH至2.0,加入125 μL模拟胃消化液(含5 mg胃蛋白酶,E∶S=1∶100 wt/wt),在37 ℃水浴条件下模拟胃液消化2 h;模拟肠液消化方法如下,20 mg胰蛋白酶和120 mg牛胆酸钠溶解于10 mL 0.1 mol/mL NaHCO3中,制备模拟肠消化液。将上述模拟胃消化后的溶液pH调节至7.5,加入5 mL模拟肠消化液,在37 ℃水浴条件下继续模拟肠液消化1 h,完成后于100 ℃水浴条件下加热10 min进行灭酶活,10000×g离心10 min取上清液,冻干成粉。
1.2.7 消化后罗非鱼皮明胶酶解物分子量分布测定 参考金文刚等[20]人方法进行测定。将经胃肠道消化后酶解物用去离子水稀释一定倍数后,0.45 μm微孔滤膜过滤后采用高效液相色谱,匹配Superdex Peptide 10/300GL(10 mm×300 mm)凝胶色谱柱进行分子量分布测定,进样量10 μL;检测波长:220 nm;流动相:体积比为超纯水/乙腈/三氟乙酸(TFA)=70/30/0.1;洗脱流量:0.4 mL/min。分子量标准品分别选用β-Amyloid、GSH、MOG、VB12、细胞色素C、抑肽酶及甘氨酸。对凝胶过滤色谱而言,分子质量的对数(y)与保留时间(x)呈线性关系,经计算所得分子量标准曲线回归方程为y=-0.0713+5.6943(R2=0.9906)。
1.2.8 数据分析 每个样品设三组平行,实验数据以平均值±标准差表示。采用http://www.physics.csbsju.edu/stats/t-test bulk form.html在线软件进行student’s t检验,p<0.05具有显著性差异。半抑制率(IC50)的计算方法为:以样品浓度(mg/mL)为横坐标,ABTS、DPPH、·OH自由基清除率或亚油酸过氧化抑制率(%)为纵坐标,获取回归方程及相关系数R2。通过回归方程,计算DPPH自由基清除率或亚油酸过氧化抑制率为50%时样品的浓度,即为IC50值。
2 结果与讨论
2.1 罗非鱼皮明胶的水解曲线
利用风味蛋白酶和胰蛋白酶对罗非鱼皮明胶进行酶解,在加酶量为3000 U/g底物蛋白的条件下,酶解过程中水解度随水解时间的变化曲线如图1所示。随着酶解时间的延长,风味和胰蛋白酶的水解度在起始20 min内上升较快,之后上升趋势趋于平缓。相比而言,胰蛋白酶对罗非鱼皮明胶的水解能力明显强于风味蛋白酶,且其水解度在中后期一直缓慢增加。在酶解60 min时,胰蛋白酶和风味蛋白酶酶解的水解度分别为23.76%和4.41%。在酶解3 h后,胰蛋白酶及风味蛋白酶酶解的水解度分别达到25.36%和5.8%,其原因可能是罗非鱼皮明胶经变性处理后,其蛋白质的二、三、四级结构被破坏,而胰蛋白酶与蛋白质分子内部的酶切位点更容易发生作用,从而促进了酶解。Wang等人[21]采用木瓜、中性、碱性和风味蛋白酶分别对黄鳍金枪鱼皮胶原进行酶解,结果显示不同的酶对蛋白质的水解能力不同,其中风味蛋白酶水解度最低,其水解黄鳍金枪鱼皮胶原能力较弱,与本文结果相一致。
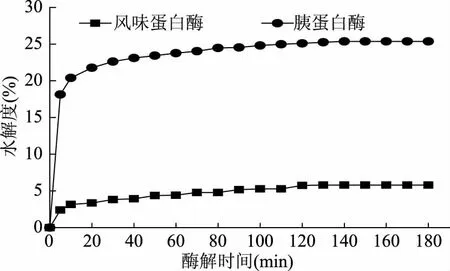
图1 罗非鱼皮明胶酶解过程中的水解度曲线Fig.1 DH curve of freeze-dried powder from tilapia skin gelatin in the process of hydrolysis
2.2 罗非鱼皮明胶酶解物TCA可溶性肽含量及肽得率
从图2中可以看出,两种酶的酶解物肽含量均呈现先增加后减小的趋势。酶解时间为0~30 min时,风味蛋白酶与胰蛋白酶的酶解物TCA可溶性肽含量基本相当,酶解到60 min时,胰蛋白酶酶解物TCA可溶性肽含量稍高于风味蛋白酶酶解物TCA可溶性肽含量,两种酶的酶解物中肽含量均达最高,分别为56.82%和54.44%。酶解120 min开始,风味蛋白酶酶解物肽含量反超胰蛋白酶酶解物肽含量,且两种酶的酶解物肽含量均逐渐下降。综合工业化生产成本、生产效率及样品水解度,选择风味蛋白酶和胰蛋白酶酶解60 min所得的2个样品进行后续实验。
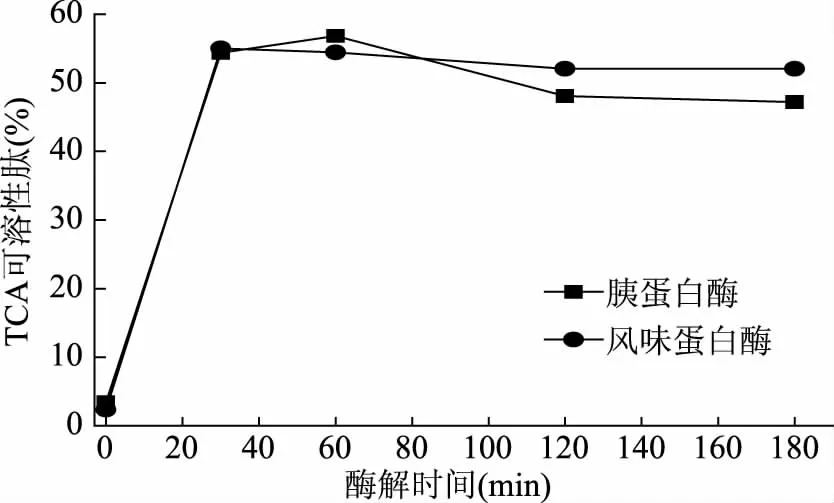
图2 罗非鱼皮明胶酶解物TCA可溶性肽得率Fig.2 TCA soluble oligopeptide content of tilapia skin gelatin hydrolyastes
2.3 罗非鱼皮明胶酶解物的抗氧化能力评价
以风味蛋白酶60 min酶解物(F-60)及胰蛋白酶60 min酶解物(T-60)为原料,以GSH为阳性对照,利用ABTS自由基、DPPH自由基、·OH清除活性及亚油酸过氧化反应体系,通过比较半抑制率(IC50),评价F-60及T-60的抗氧化能力。由图3~图6可见,罗非鱼皮明胶酶解物及GSH均具有一定的清除ABTS自由基、DPPH自由基、·OH和抑制亚油酸过氧化的能力,且样品的抗氧化能力均随着浓度的升高而逐渐增强,呈明显的剂量依赖性。
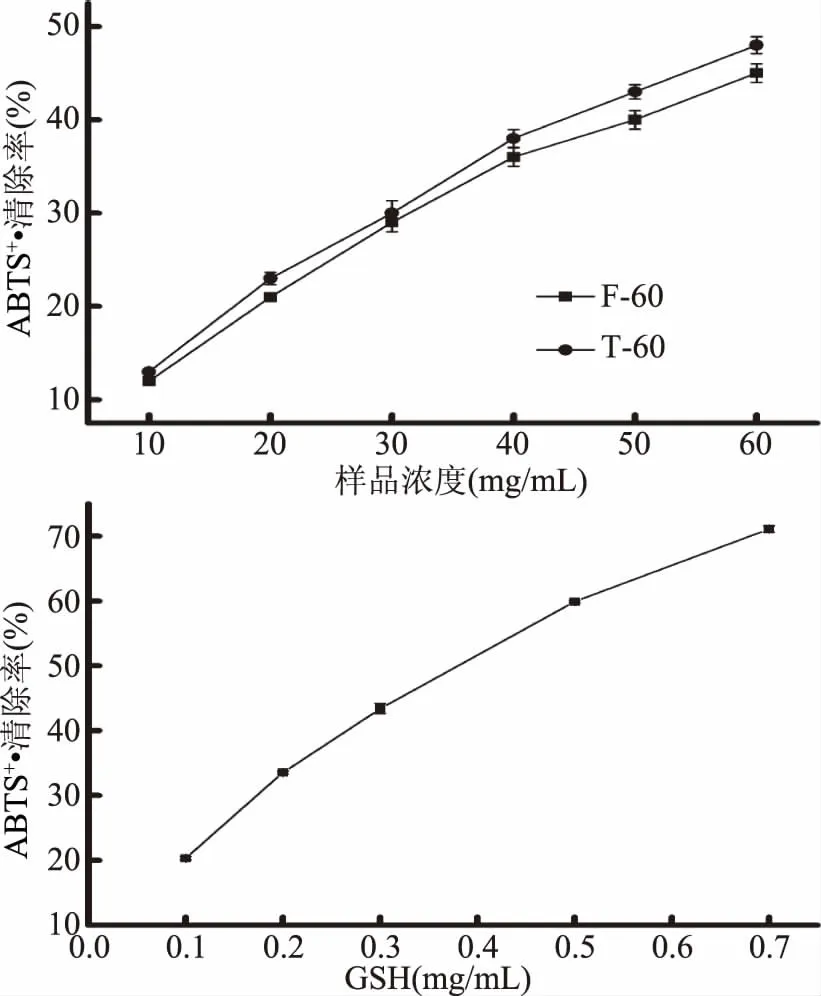
图3 不同样品对ABTS自由基的清除能力Fig.3 ABTS radical scavening capacities of different samples
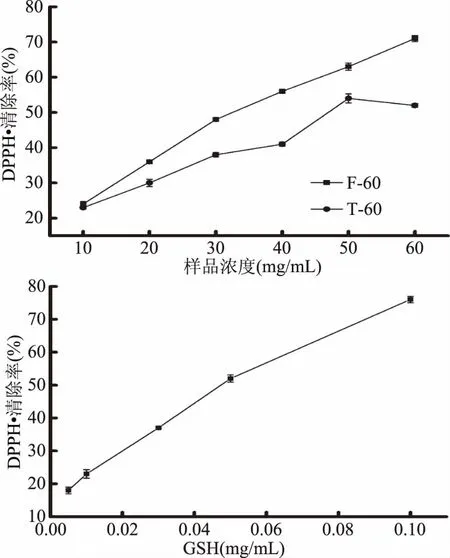
图4 不同样品对DPPH自由基的清除能力Fig.4 DPPH radical scavening capacities of different samples
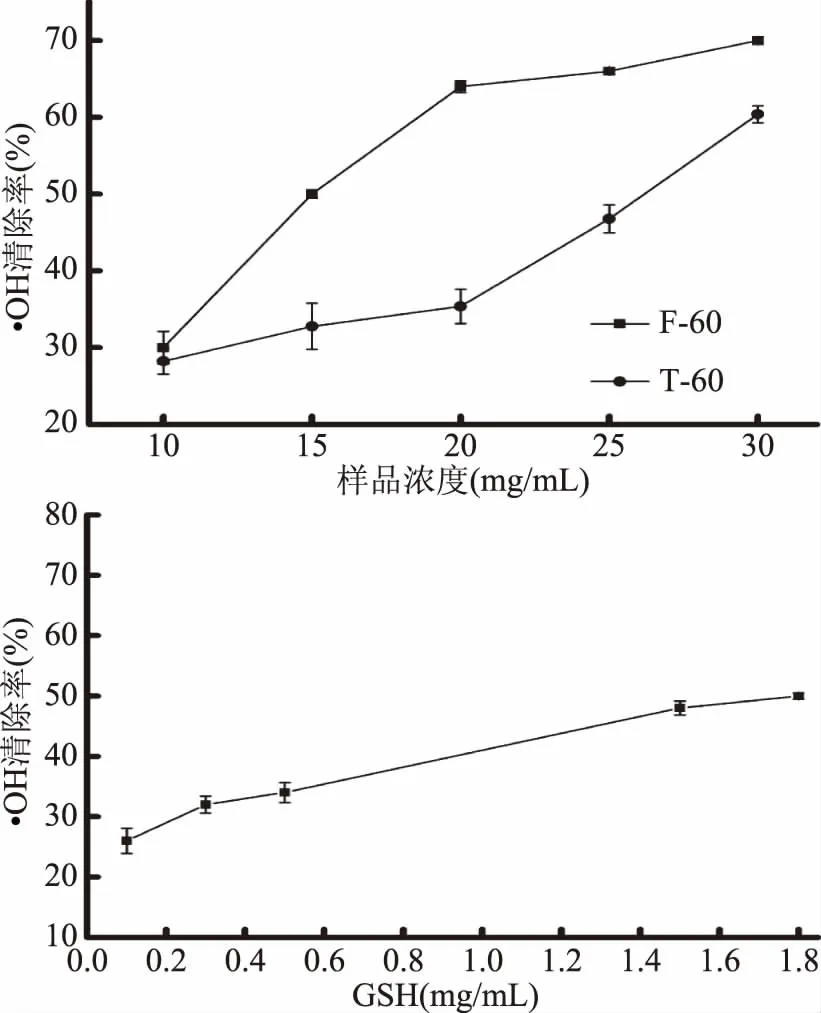
图5 不同样品对·OH的清除能力Fig.5 Hydroxyl radical scavening capacities of different samples

图6 不同样品对亚油酸过氧化能力Fig.6 Linoleic acid anti-peroxidation capacities of different samples
如表2所示,根据拟合的回归方程,计算各样品的半抑制率(IC50),结果显示,四种抗氧化指标中,风味蛋白酶-罗非鱼皮明胶酶解物的抗氧化能力大小依次为亚油酸过氧化抑制能力>·OH清除能力>DPPH自由基清除能力>ABTS自由基清除能力;而胰蛋白酶-罗非鱼皮明胶酶解物的抗氧化能力大小依次为·OH清除能力>DPPH自由基清除能力>亚油酸过氧化抑制能力>ABTS自由基清除能力。相较于胰蛋白酶-罗非鱼皮明胶酶解物,风味蛋白酶-罗非鱼皮明胶酶解物具有较高的DPPH自由基清除活性及亚油酸过氧化抑制能力,但两种酶解物的抗氧化活性均弱于GSH。
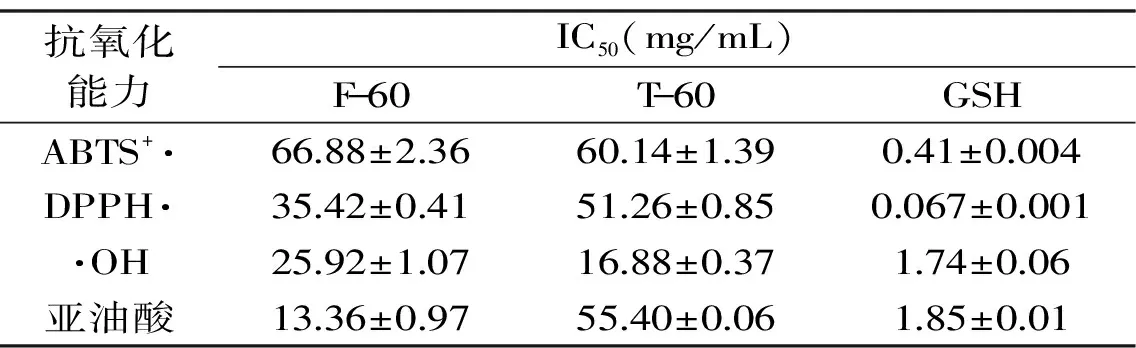
表2 罗非鱼皮明胶酶解物的抗氧化能力评价Table 2 Evaluation of antioxidant capacities of tilapia skin gelatin hydrolysates
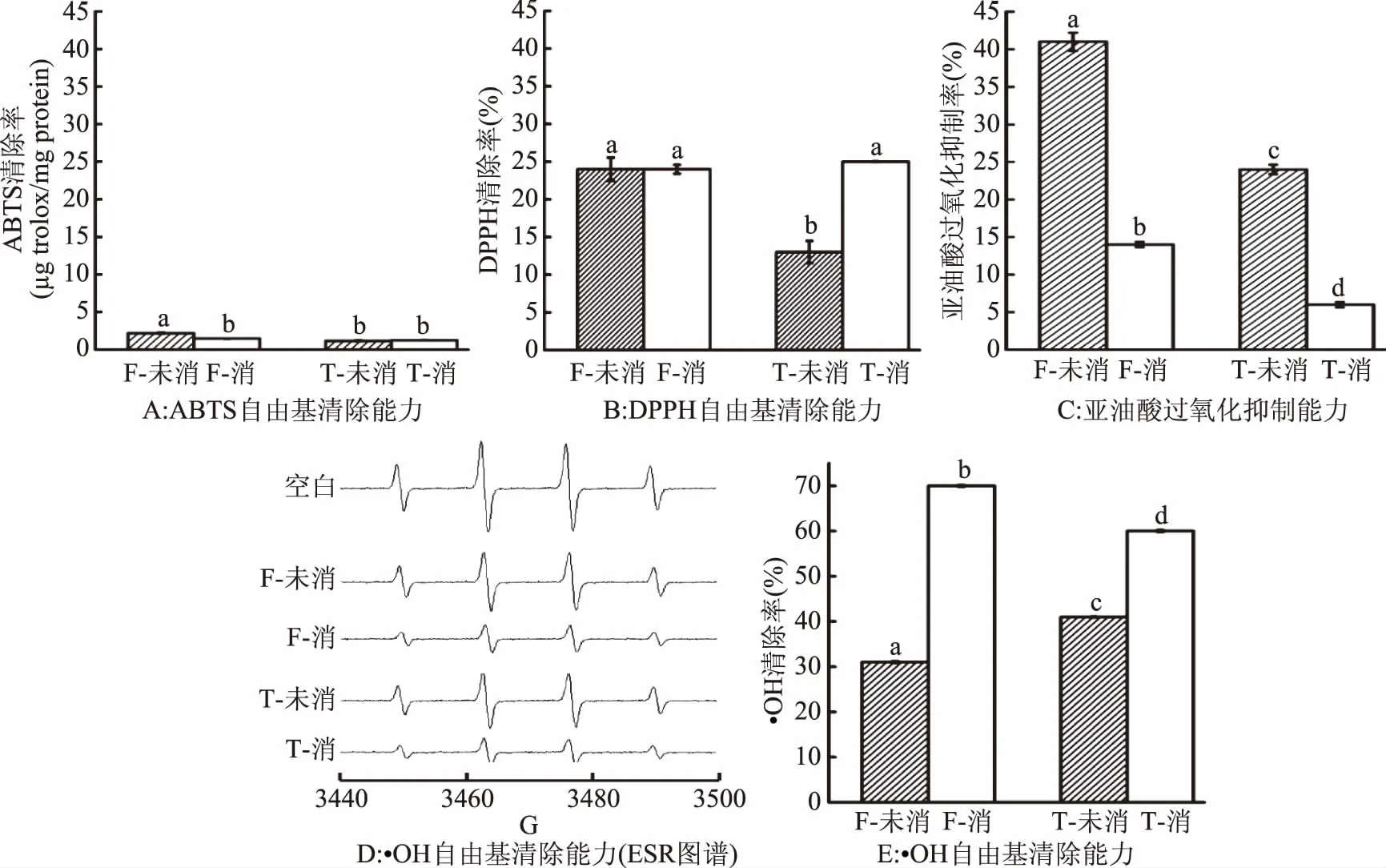
图7 经模拟胃肠道消化前后的不同样品对ABTS自由基、DPPH自由基、·OH的清除及亚油酸过氧化抑制能力Fig.7 ABTS,DPPH,·OH radical scavening and linoleic acid peroxidating capacities of different samples before and after gastrointestinal digestion in vitro注:不同小写字母代表消化与未消化样品间差异显著(p<0.05)。
相同酶解时间条件下,两种蛋白酶酶解物表现出了不同程度的抗氧化活性,说明蛋白酶的种类不同对多肽的品质有重要影响,而这与Hou等[22]研究结果一致。风味蛋白酶酶解物的DPPH自由基清除活性及亚油酸过氧化抑制活性均高于胰蛋白酶酶解物,这与图1罗非鱼皮明胶水解度结果并不一致,显示具有较高水解度的胰蛋白酶酶解物并不具有较强的抗氧化活性,说明酶解物的抗氧化活性与水解度并不一致。这一结果与Zhou等[23]以鲍鱼内脏蛋白酶酶解液体外抗氧化活性研究结果一致,其研究结果表明鲍鱼内脏蛋白酶酶解液的水解度、氨基酸组成和抗氧化活性均与采用的蛋白酶有关,而酶解物的抗氧化活性与水解度无正相关性。对于阳性对照GSH,其DPPH自由基清除能力最强,IC50值达0.067±0.004 mg/mL,这一结果与Wang等[24]对鱼皮低聚肽氨基酸组成及抗氧化活性研究中还原性谷胱甘肽的DPPH清除活性高于·OH自由基清除活性一致,且与其DPPH清除活性IC50值0.030 mg/mL结果相近。罗非鱼皮明胶酶解物的抗氧化活性均低于GSH,其原因可能是酶解物本身是包含多肽及其他化合物等不均一的混合物,故体系内仍会存在一定量的大分子量物质。
2.4 罗非鱼皮明胶酶解物模拟体外胃肠道消化前后的抗氧化能力评价
将F-60及T-60样品模拟体外胃肠道消化后的样品冻干,以ABTS自由基、DPPH自由基、·OH清除和亚油酸过氧化反应体系为评价指标,以同浓度下未经胃肠道消化样品作为阳性对照,评价经模拟的胃肠道消化后罗非鱼皮明胶酶解物的抗氧化能力。
由图7A、图7C可以看出,风味蛋白酶60 min酶解物经胃肠道消化后其ABTS自由基清除活性及亚油酸过氧化抑制能力显著降低(p<0.05),均下降约50%;消化前后其DPPH自由基清除活性几乎不变(图7B);而·OH清除活性显著增强(p<0.05),提高约1.3倍(图7D)。胰蛋白酶60 min酶解物经胃肠道消化后ABTS自由基清除活性基本不变(图7A);DPPH自由基及·OH清除活性显著增强(p<0.05),分别增加约1倍和0.47倍(图7B、图7E);而图7C显示,亚油酸过氧化抑制能力显著降低(p<0.05)约75%。
以上结果表明,风味蛋白酶及胰蛋白酶60 min酶解物经模拟胃肠道消化后,亚油酸过氧化抑制能力均显著降低,而·OH自由清除活性均显著提升。消化前后两种酶的酶解物自由基清除活性不一致,抗氧化活性显著降低阶段可能为模拟胃液消化阶段,相关研究[25]结果表明,由于胃蛋白酶对许多高活性肽段的酶切降解,故在经胃消化后使物质发生改变,从而阻碍其与自由基反应,促使抗氧化肽的原有活性显著降低;而模拟肠消化阶段,胃酶酶解物经胰蛋白酶消化后会进一步生成小肽和氨基酸,或者处于该阶段的酶解物暴露的活性基团较多,酶解物与自由基反应的机会增加,抗氧化活性也会相应增加,而由于酶解采用的酶不同,其抗氧化活性回升程度大小不同,故会导致不同种类酶酶解样品消化前后自由基清除活性变化大小有所差异。综上所述,罗非鱼皮明胶酶解物经过胃肠道消化后,具有一定的抗氧化活性。
2.5 罗非鱼皮明胶酶解物经模拟体外胃肠道消化前后的分子量分布范围
对罗非鱼皮明胶酶解物模拟胃肠道消化前后样品的分子量分布范围进行考察,结果如表3。根据保留时间并结合峰面积,对照标准品的分子质量和保留时间,发现未经模拟胃肠道消化的酶解物分子量主要分布在≥3000 Da范围内,是一种分子量较大的混合物;而其经过胃肠道消化后,两种酶解产物各段分子量范围内变化均较为显著(p<0.05)(胰蛋白酶酶解物1000~3000 Da范围除外),风味及胰蛋白酶酶解物经体外模拟胃肠道消化后分子量主要集中于3000~5000 Da左右,此组分的含量与消化前相比分别提高了45%及13%;风味蛋白酶酶解物对照消化前其1000~3000 Da组分含量提高了1.62倍;两种酶解物大于5000 Da的组分含量经消化后有一定程度的减少,分别减少约51%和6%,仍属于一种复杂的混合物体系。以上结果表明,风味及胰蛋白酶酶解物经体外模拟胃肠道消化后其抗氧化活性的变化可能分别与体系中3000~5000 Da组分含量上升有关。
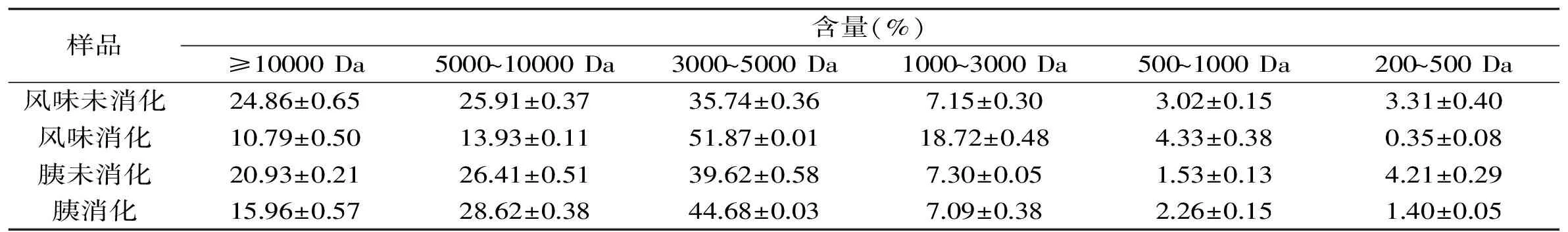
表3 罗非鱼皮明胶酶解物的分子量分布Table 3 The molecular mass distribution of hydrolysates of tilapia skin gelatin
Qin等[26]通过对菜籽饼粕蛋白模拟胃肠道消化过程抗氧化活性进行研究结果显示,消化后产物分子量范围在211~5000 Da的多肽含量占总多肽含量的85%,此时体系中多肽具较高的抗氧化活性。Sunantha Ketnawa等[19]对3种碱性蛋白酶酶解所得鲶鱼皮明胶酶解物模拟胃肠道消化后产物抗氧化活性进行了研究,研究结果显示,模拟胃肠道消化后的明胶水解产物抗氧化活性显著提高,其酶解物消化后主要分子量在366~1602 Da范围。而且已有相关研究[27]报道指出蛋白水解物的抗氧化活性不仅依赖于多肽分子量的大小,还与肽的序列及所用酶的特异性有关。
3 结论
罗非鱼皮明胶经风味蛋白酶及胰蛋白酶酶解60 min时,其水解度及TCA可溶性肽含量最高,分别达到4.41%、56.82%和23.76%、54.44%。以ABTS自由基、DPPH自由基、·OH清除能力及亚油酸过氧化抑制能力为评价指标,确定酶解60 min时风味蛋白酶酶解物的清除DPPH自由基及抑制亚油酸过氧化能力较胰蛋白酶酶解物强,但弱于商品化的GSH。风味蛋白酶和胰蛋白酶酶解60 min的罗非鱼皮明胶酶解物经体外模拟胃肠道消化后其分子量分布范围仍主要集中于3000~5000 Da,大于10000 Da组分含量显著降低,小于3000 Da组分含量有所提高,酶解物整体抗氧化活性有一定提高。以上研究结果说明,风味及胰蛋白酶酶解60 min后所得罗非鱼皮明胶酶解物具有一定的抗氧化能力,具有潜在的开发价值。
[1]农业部渔业局. 中国渔业年鉴[M]. 北京:中国农业出版社,2016.
[2]Dekkers E,Raghavan S,Kristinsson H G,et al. Oxidative stability of mahi mahi red muscle dipped in tilapia protein hydrolysates[J]. Food Chemistry,2011,124(2):640-645.
[3]Liu C M,Liang H Y,Liu W. Study on acavening efficacy of peptides fromOreochromisniloticusskin[J]. Food Research and Development,2007,11(11):148-151.
[4]Kuochiang H. Purification of antioxidative peptides prepared from enzymatic hydrolysates of tuna dark muscle by-product[J]. Food Chemistry,2010,122(1):42-48.
[5]Gòmez-Guillén M C,Giménez B,López-Caballero M E,et al. Functional and bioactive properties of collagen and gelatin from alternative sources:a review[J]. Food Hydrocolloids,2012,25(8):1813-1827.
[6]张帅,王昱琳,黄雅钦. 鱼来源和家禽来源明胶原料的研究进展[J]. 明胶科学与技术,2011,31(4):174-181.
[7]郭瑶,曾名勇,崔文萱. 水产胶原蛋白及胶原多肽的研究进展[J]. 水产科学,2006,25(2):101-104.
[8]蒋挺大. 胶原与胶原蛋白[M]. 北京:化学工业出版社,2006.
[9]Vercruysse L,Van C J,Smagghie G. ACE inhibitory peptides derived from enzymatic hydrolysates of animal muscle protein,a review[J]. Journal of Agricultural & Food Chemistry,2005,53(21):8106-8115.
[10]Han Y,Xie J,Gao H,et al. Hepatoprotective effect of collagen peptides from cod skin against liver oxidative damageinvitroandinvivo[J]. Cell Biochemistry and Biophysics,2015,71(2):1089-1095.
[11]Rajapakse N,Mendis E,Jung W K,et al. Purification of a radical scavenging peptide from fermented mussel sauce and its antioxidant properties[J]. Food Research International,2005,38(2):175-182.
[12]Zhang X Q,Chen X F. Study of Scavenging Effection on OH Radical,Separation and Purification of Gelatin Antioxidant Peptides[J]. Food Research and Development,2014,25(10):9-12.
[13]QIN L,ZHU B W,ZHOU D Y,et al. Preparation and antioxidant activity of enzymatic hydrolysates from purple sea urchin(Strongylocentrotusnudus)gonad[J]. Lebensmittel-Wissenschaft und-Technologie,2011,44(4):1113-1118.
[14]金文刚,吴海涛,朱蓓薇,等. 虾夷扇贝生殖腺多肽的制备及分离[J]. 大连工业大学学报,2011,30(6):391-395.
[15]Arts M J,Haenen G R,Voss H P,et al. Antioxidant capacity of reaction products limits the applicability of the Trolox Equivalent Antioxidant Capacity(TEAC)assay[J]. Food &Chemical Toxicology,2004,42(1):45-49.
[16]金文刚,段秀红,吴海涛,等. 虾夷扇贝生殖腺多肽美拉德反应过程的研究[C].中国食品科学技术学会东西方食品业高层论坛. 2011.
[17]Ahmed I A,Mikail M A,Ibrahim M B,et al. Antioxidant activity and phenolic profile of various morphological parts of underutilised Baccaurea angulata fruit[J]. Food Chemistry,2015,172:778-787.
[18]段秀红,齐申,赵雅娉,等. 基于ESR和细胞培养体系的海参肠自溶寡肽抗氧化活性研究[J]. 现代食品科技,2014,30(5):28-32.
[19]Ketnawa S,Martínez-Alvarez O,Benjakul S,et al. Gelatin hydrolysates from farmed Giant catfish skin using alkaline proteases and its antioxidative function of simulated gastro-intestinal digestion[J].Food Chemistry,2016,192:34-42.
[20]金文刚. 虾夷扇贝生殖腺水解物及其衍生物的功能特性研究[D]. 西安:西北农林科技大学,2013.
[21]Wang Y S,Leng Y,Chen H H,et al. Study on Enzymolysis Technology of Collagen Peptide and Antioxide Activities from Tuna Skin[J]. Journal of Chinese Institute of Food Science and
Technology,2015,15(2):72-77.
[22]Hou H,Li B,Zhao X,et al. Optimization of enzymatic hydrolysis of Alaska pollock frame for preparing protein hydrolysates with low-bitterness[J]. LWT-Food Science and Technology,2011,44(2):421-428.
[23]Zhou D Y,Zhu B W,Qiao L,et al.Invitroantioxidant activity of enzymatic hydrolysates perpared from abalone(Haliotisdiscushannai Ino)viscera[J]. Food and Bioproducts Processing,2012,90(C2):148-154.
[24]Wang N L,Xu Y M,Liu Y,et al. Study on Acid Composition and Antioxidative Activity of Fish Skin Oligopeptides[J]. Food Research and Development,2016,37(2):31-35.
[25]王兴,王敏,王莉,等. 苦荞蛋白模拟消化过程抗氧化活性相关模型分析[J]. 中国酿造,2009(4):27-32.
[26]Qin X P,Yu X J,Yang H,et al. Antioxidant Activity of Hydrolysate Peptides from Rapeseed Meal Digested with Simulated Gastrointestinal[J]. Journal of the Chinese Cereals and Oils Association,2016,31(1):21-26.
[27]Alemán A,Pérez-Santín E,Bordenave-Juchereau S,et al. Squiid gelatin hydrolysates with antihypertensive,anticancer and antioxidant activity[J]. Food Research International,2011,44(4):1044-1051.
