谷氨酰胺转氨酶对山杏仁蛋白凝胶特性的影响
2018-01-22,,,
, , ,
(北京林业大学生物科学与技术学院,林业食品加工与安全北京市重点实验室,北京 100083)
山杏(Armeniacasibirica(L.)Lam)属于蔷薇科(Rosaceae)杏属(Armeniaca)植物,又称西伯利亚杏,是我国重要的野生植物资源[1]。山杏仁油脂含量高(约50%)[2],而榨油后剩余的饼粕中蛋白质含量高达45.3%[3],且以易消化的低分子清蛋白为主,占总量的80%以上,而较难消化的大分子球蛋白不到10%[4]。研究发现山杏仁蛋白含有17种氨基酸,其中8种为人体所必需的氨基酸,约占总量的28%,且缬氨酸(6.65)和异亮氨酸(7.79)含量显著高于联合国粮农组织(FAO)的推荐值(5.0和6.0)[5],因此,山杏仁蛋白是一种食用价值极高的植物蛋白。
凝胶性是植物蛋白重要的功能特性之一,采用谷氨酰胺转氨酶(TG酶)作为交联剂促进蛋白质凝胶的形成已成为蛋白质酶法改性的重要手段。它以肽链中谷氨酰胺残基的γ-羧酰胺基作为酰基供体,通过催化其与酰基受体间的酰基转移反应促使交联现象的发生[6]。目前,针对山杏仁蛋白的研究主要集中在提取工艺及乳化性、起泡性、溶解性,而对凝胶特性研究还未有报道。顾欣[7]等用响应面法优化了山杏仁蛋白的提取工艺,蛋白的提取率达到92.35%;薛蕾[8]等研究了pH、NaCl浓度、温度对苦杏仁蛋白溶解性、乳化性及起泡性的影响,发现在等电点附近各项性质均最差,NaCl浓度在0~0.8 mol/L以及适宜的温度(35~55 ℃)均有利于提高各项性质。本文在前期研究的基础上,利用碱溶酸沉法提取山杏仁蛋白,采用TG酶作为交联剂,分析工艺参数对其凝胶特性的影响,通过响应面优化得到最佳交联条件,为山杏仁饼粕的深加工与利用提供理论依据及技术指导。
1 材料与方法
1.1材料与仪器
脱脂山杏仁粉 河北承德亚欧果仁有限公司,用石油醚脱脂,过80目筛;谷氨酰胺转氨酶(200 U/g,TG) 江苏省泰兴市一鸣生物制品有限公司;其余所用试剂 均为国产分析纯。
1.2实验方法
1.2.1 山杏仁蛋白的提取 脱脂山杏仁粉按1∶10加入去离子水,超声破碎10 min,1 mol/L NaOH调节溶液pH至9,45 ℃磁力搅拌提取1 h,4000 r/min离心15 min,上清液用1 mol/L HCl调节溶液pH至4.1,4000 r/min离心15 min,沉淀用去离子水复溶,pH调节至中性,冷冻干燥得到山杏仁分离蛋白(蛋白质含量可达84.52%),-18 ℃下保存备用。
1.2.2 山杏仁蛋白凝胶的制备 配制16%(w/v)的山杏仁蛋白溶液,调节溶液pH至7,按一定的量加入TG酶,分别在一定的温度下反应一定的时间,然后90 ℃灭酶15 min,将样品置于冰水浴中迅速冷却至室温,置于4 ℃冰箱中保存12 h,然后测定其凝胶硬度、弹性和内聚力。
1.2.3 凝胶特性的测定 参照何轩辉[9]的方法,略微修改。采用Perten TVT 6700质构仪,选择直径为20 mm的TVT 673020型圆柱探头、TVT 675088型平板基台。设置参数:测前速度为2.0 mm/s;测试速度为0.8 mm/s;测后速度为0.8 mm/s;压缩比50%;数据采集速率为200 pps。一次测定过程中探头下压两次,凝胶硬度为第一次压缩过程中的峰值,弹性为第二次开始压缩到压缩结束的总时间与第一次开始压缩到压缩结束的总时间的比值,内聚力为第二次压缩峰下面积与第一次压缩峰下面积的比值。每个样品重复测定5次。
1.2.4 单因素实验设计
1.2.4.1 加酶量对蛋白凝胶特性的影响 固定pH为7,交联温度40 ℃,交联时间1 h,考察不同的加酶量(0、4、8、12、16、20、24、28 U/g)对蛋白凝胶硬度、弹性和内聚力的影响。
兰州石化始终坚持“环保优先、安全第一、质量至上、以人为本”的理念,强化HSE体系建设,常年坚持开展公司、分厂和车间三级岗位责任制大检查,建立了四级风险“管控网”,形成了专业监督、专职检查、干部走动式巡检、值班检查“四位一体”的监督检查体系,做到了现场作业风险识别管控全过程、全覆盖。兰州石化严格执行环保新标准,推进清洁生产、绿色发展。5年来,公司重点环保项目建设投入达到20多亿元,减排成效显著。
1.2.4.2 pH对蛋白凝胶特性的影响 固定加酶量16 U/g,交联温度40 ℃,交联时间1 h,考察pH(5、6、7、8、9)对蛋白凝胶硬度、弹性和内聚力的影响。
1.2.4.3 温度对蛋白凝胶特性的影响 固定加酶量16 U/g,pH为7,交联时间1 h,考察交联温度(20、30、40、50、60、70 ℃)对蛋白凝胶硬度、弹性和内聚力的影响。
1.2.4.4 时间对蛋白凝胶特性的影响 固定加酶量16 U/g,pH为7,交联温度40 ℃,考察交联时间(0.5、1、1.5、2、2.5、3、3.5 h)对蛋白凝胶硬度、弹性和内聚力的影响。
1.2.5 响应面实验 在单因素实验的基础上,以凝胶硬度为考察指标,选取TG酶添加量、交联温度、pH、交联时间为实验因素,确定凝胶形成的最佳条件,响应面实验因素水平表见表1。

表1 响应面实验因素与水平Table 1 Factors and levels table of response surface experiment
1.2.6 数据处理 采用Microsoft Excel(Office 2013)、Design Expert 7.0、SPSS Statistics 21软件进行分析。显著性分析采用Duncana新复极差法比较,p<0.05认为结果差异显著。
2 结果与分析
2.1TG酶添加量对山杏仁蛋白凝胶特性的影响

图1 加酶量对山杏仁蛋白凝胶特性的影响Fig.1 Effect of TG amount on the gel properties of apricot protein gel注:同一性质,字母不同者为差异显著(p<0.05),相同者为差异不显著(p>0.05);图2~图4同。
由图1可得,随着TG酶添加量的增加,凝胶硬度呈现出先增加后降低的趋势,当加酶量为16 U/g时,凝胶硬度达到最大值106 g;弹性在0~8 U/g内增加,之后变化不显著,在8 U/g时达到最大值0.77;内聚力在16~28 U/g时显著高于0~12 U/g,在16 U/g时出现最大值0.47。TG酶交联赖氨酸上的ε-氨基和谷氨酸上的γ-酰胺基形成共价键,促进蛋白质分子间的共价交联,生成了大分子聚集体,使得蛋白质分子量增大,凝胶硬度也随之增大[10]。但加酶量过高反而导致蛋白凝胶硬度有所下降,这是因为维系蛋白质凝胶网络稳定所需的共价键的数目已达到饱和,过量的酶可能会导致蛋白质分子表面的作用位点发生交联,减少了与周围蛋白质分子交联的机会[11]。汪亚强[12]等利用TG酶催化制备小麦和大豆蛋白的混合凝胶,发现随着加酶量的增加,凝胶强度持续增加,但并非一直呈正相关关系。所以选取加酶量在16 U/g。
2.2pH对山杏仁蛋白凝胶特性的影响
由图2可知,随着pH的升高,凝胶硬度和内聚力均呈现先增加后降低的趋势,在pH为7时达到最大值;弹性在pH为5~7时增加,之后无显著性变化。反应体系的pH主要影响酶的活性和稳定性,TG酶的最适pH为6.0~7.5,当pH过高或过低,TG酶空间构象发生改变导致活性降低[13];另一方面,当pH接近山杏仁蛋白的等电点(pH4.1)时,蛋白质发生沉淀,无法形成有序的凝胶网状结构,导致凝胶特性有所降低。袁建[14]等研究了pH对菜籽蛋白凝胶性的影响,发现当pH远离菜籽蛋白等电点时均具有良好的凝胶性,且碱性条件下的凝胶性高于酸性条件下的凝胶性,所以选取pH为7。
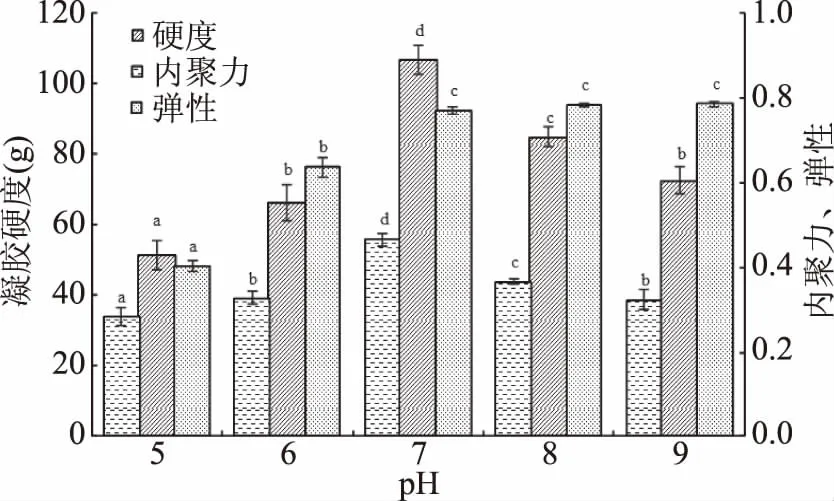
图2 pH对山杏仁蛋白凝胶特性的影响Fig.2 Effect of pH on the gel properties of apricot protein gel
2.3交联温度对山杏仁蛋白凝胶特性的影响
如图3所示,随着交联温度的升高,山杏仁蛋白的凝胶硬度呈现先增加后减小的趋势,在温度为40 ℃时达到最大值;弹性和内聚力均先增加达到最大值,之后逐渐减小,内聚力在60~70 ℃范围内却显著增加,这可能时因为高温导致酶失活,此时蛋白质发生热聚集而非酶促聚集形成凝胶,使得凝胶内聚力有所增加。研究表明TG酶的热稳定性较好,最适温度为37~50 ℃,但加热到70 ℃时活性便完全丧失,从而失去交联蛋白质的能力[15]。安静等[16]人研究发现,反应温度能显著提高大豆分离蛋白的凝胶强度,40~60 ℃范围内变化不显著,在70 ℃时却显著降低。所以选取交联温度为40 ℃。

图3 交联温度对山杏仁蛋白凝胶特性的影响Fig.3 Effect of temperature on the gel properties of apricot protein gel
2.4交联时间对山杏仁蛋白凝胶特性的影响
如图4所示,时间在0.5~2 h范围内凝胶硬度变化不显著,在时间达到2.5 h时硬度出现最大值,之后逐渐降低;弹性在0.5~3 h内呈现轻微的先增加后降低的趋势,其值均较高,在0.71以上,当时间超过3 h却显著降低;内聚力在1 h时达到最大值,之后逐渐减小。维系蛋白质凝胶网络稳定的共价键数目有限,当所需共价键数目达到饱和,过长时间的交联反而会导致凝胶网络结构的破裂,使得蛋白的凝胶特性有所降低[17]。封小龙[18]研究了TG酶交联时间对花生球蛋白和伴花生球蛋白凝胶硬度的影响,结果表明交联时间在1~2 h内,花生球蛋白凝胶硬度无显著变化,伴花生球蛋白凝胶硬度显著增加,当时间达到2.5 h时两者的凝胶硬度均显著降低。所以选取交联时间2.5 h。
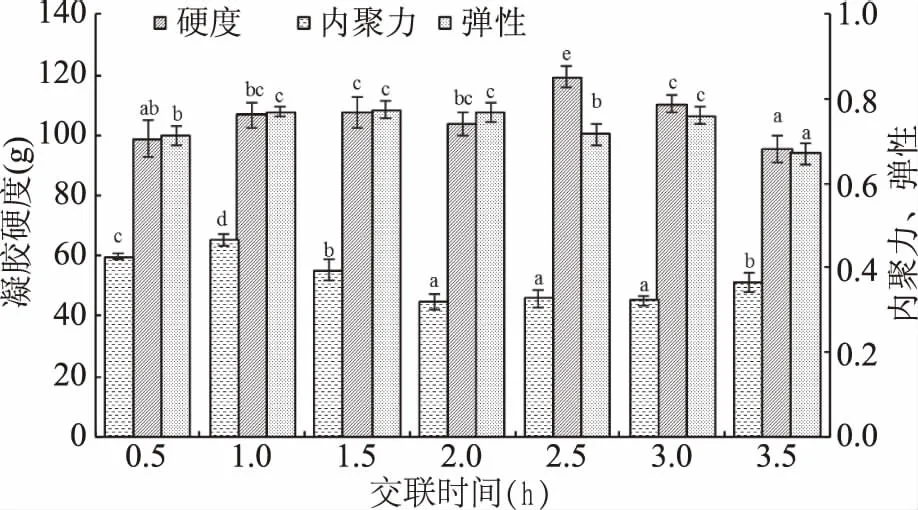
图4 交联时间对山杏仁蛋白凝胶特性的影响Fig.4 Effect of treatment time on the gel properties of apricot protein gel
2.5响应面优化实验
根据单因素实验结果,依据Box-Behnken中心组合实验设计原理,运用Design Expert 7.0软件设计响应面实验,响应面实验结果见表2。
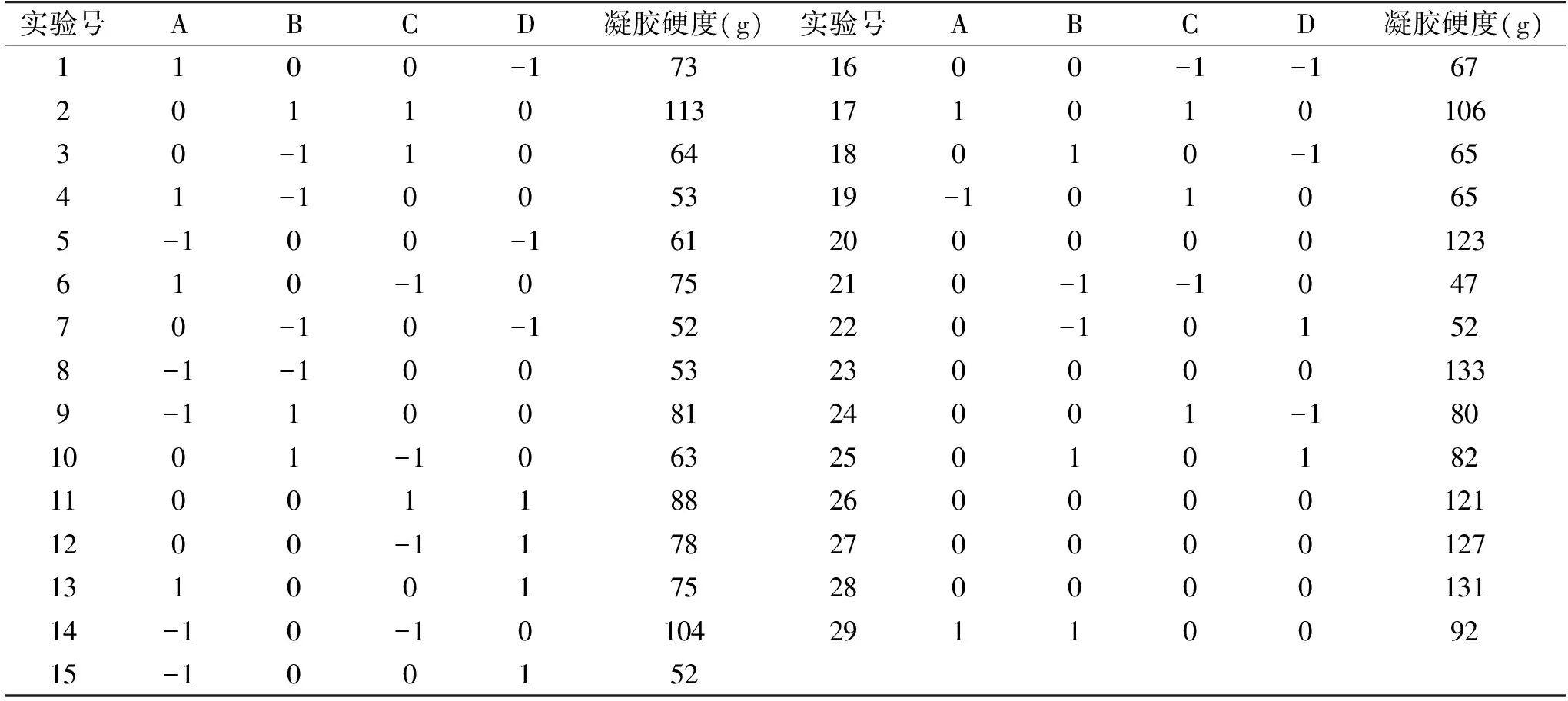
表2 响应面实验设计方案及结果Table 2 Design and results of response surface methodology experiment

表3 回归方程方差分析表Table 3 Variance analysis of mathematical regression model
注:*:p<0.05,显著;**:p<0.01,极显著。
采用Design Expert 7.0软件对响应面实验数据进行回归分析,得到山杏仁蛋白凝胶硬度的二次多项回归模型为:
Y=127.00+4.83A+14.58B+6.83C+2.42D+2.75AB+17.50AC+2.75AD+8.25BC+4.25BD-0.75CD-24.79A2-33.92B2-17.29C2-32.92D2
对上述方程进行方差分析,结果如表3所示。
由表3可知,回归方程显著性检验F值为14.47(p<0.0001),表明回归方程在实验点上的拟合度达到极显著水平;失拟项检验F值为4.60(p=0.0772>0.05),表明差异不显著,拟合的模型方程效果较好;回归模型相关系数R2=0.9352,表明模型成立有效。
模型中一次项C、交互项AC、二次项C2影响显著;B、A2、B2、D2的影响达到极显著水平。各因素对山杏仁分离蛋白凝胶硬度的影响程度由大到小依次为:交联温度(B)>pH(C)>TG酶添加量(A)>交联时间(D)。
对于双因素间的交互作用,模型中只有AC(TG酶添加量-pH)交互作用显著,根据分析结果分别绘制双因素交互作用的曲面图和等高线,如图5所示。由图5可知,响应面曲线为开口向下的抛物曲面,即在实验范围内存在响应值的最大值。当交联温度为40 ℃,交联时间为2.5 h时,TG酶添加量和pH的交互作用对响应值起着二次影响作用。随着TG酶添加量和pH的增加,山杏仁蛋白的凝胶硬度先增大后减小,在接近中心点时达到最大值。

图5 TG酶添加量和pH对山杏仁蛋白凝胶硬度的交互作用分析Fig.5 Effect of TG amount and pH on the gel strength of apricot protein gel
对回归方程进行分析,可得TG酶交联山杏仁蛋白凝胶的最佳理论工艺参数:TG酶添加量17 U/g,交联温度43 ℃,pH为7.2,交联时间2.5 h,此条件下山杏仁蛋白凝胶硬度的预测值为131 g。为检验响应面优化结果的可靠性,在上述条件下进行重复验证实验,得到山杏仁蛋白的凝胶硬度为(135±7.14) g,与理论预测值的相对误差在2.96%左右,说明模型优化所得参数有效,可用于TG酶交联山杏仁蛋白形成凝胶。
3 结论
利用TG酶交联山杏仁蛋白形成凝胶,通过单因素实验考察TG酶添加量、pH、交联温度、交联时间对凝胶硬度、内聚力、弹性的影响,结果表明TG酶对山杏仁蛋白的凝胶硬度、内聚力、弹性均具有明显的提高作用,其中交联温度对凝胶硬度的影响最大,pH、TG酶添加量次之,交联时间的影响最小。并以凝胶硬度为指标,运用Box-Behnken响应面对条件进行优化,得到凝胶形成的最佳条件为TG酶添加量17 U/g,交联温度43 ℃,pH为7.2,交联时间2.5 h,在此条件下凝胶硬度达到(135±7.14)g。本研究可为实现山杏仁饼粕的深加工与利用提供理论依据及技术指导。
[1]中科院中国植物志编辑委员会. 中国植物志[M]. 北京:科学出版社,1986:27-28.
[2]WANG L B,YU H Y. Biodiesel from Siberian apricot(Prunus sibirica L.)seed kernel oil[J]. Bioresource Technology,2012,112:355-358.
[3]ALPASLAN M,HAYTA M. Apricot kernel:physical and chemical properties[J]. Journal of the American Oil Chemists
Society,2006,83(5):469-471.
[4]EL-AAL M H A,HAMZA M A,RAHMA E H. In vitro digestibility,physico-chemical and functional properties of apricot kernel proteins[J]. Food Chemistry,1986,19(3):197-211.
[5]李科友,史清华,朱海兰. 苦杏仁氨基酸的营养评析[J]. 林业科技开发,2001,15(4):23-24.
[6]GASPAR A L C,GOES-FAVONI S P de. Action of microbial transglutaminase(MTGase)in the modification of food proteins:A review[J]. Food Chemistry,2015,171:315-322.
[7]顾欣,李莉,侯雅坤,等. 响应面法优化山杏仁蛋白提取工艺研究[J]. 河北林果研究,2010,25(2):162-168.
[8]薛蕾,李大文,尉芹,等. 苦杏仁蛋白的功能特性[J]. 食品科学,2013,34(7):70-75.
[9]何轩辉. 超高压对花生分离蛋白凝胶特性的影响及其机理研究[D]. 北京:中国农业科学院,2013.
[10]YANG M,LIU F,TANG C H. Properties and microstructure of transglutaminase-set soy protein-stabilized emulsion gels[J]. Food Research International,2013,52:409-418.
[11]徐幸莲,程巧芬,周光宏. 转谷氨酰胺酶对蛋白质凝胶性能的影响[J]. 食品科学,2003,24(10):38-43.
[12]汪亚强,罗水忠,钟昔阳,等. 谷氨酰胺转氨酶对大豆与小麦混合蛋白凝胶性质的影响[J]. 食品科学,2016,37(21):48-52.
[13]于国萍,安静,初云斌,等. 转谷氨酰胺酶催化对大豆分离蛋白凝胶性的影响[J]. 东北农业大学学报,2010,41(10):100-107.
[14]袁建,鞠兴荣,何荣,等. 谷氨酰胺转氨酶改性菜籽蛋白凝胶特性的研究[J]. 食品科学,2010,31(18):10-13.
[15]姜巍巍,于国萍. 转谷氨酰胺酶对大豆11S蛋白疏水性的影响[J]. 食品工业科技,2009,30(8):96-98.
[16]安静,于国萍,初云斌,等. 转谷氨酰胺酶催化对不同大豆蛋白凝胶性的影响[J]. 食品科学,2011,32(6):32-37.
[17]胡晓. 酶法交联与微射流均质改性花生蛋白及其结构与功能特性的研究[D]. 广州:华南理工大学,2011.
[18]封小龙. 花生蛋白组分制备、改性及应用研究[D]. 北京:中国农业科学院,2014.
