金属有机骨架材料修饰玻碳电极循环伏安法测定维生素C片中抗坏血酸
2018-01-22李庆伟李海莹郭征楠张淑芬
李庆伟,刘 峥* ,李海莹,郭征楠,魏 席,唐 群,张淑芬
(1.桂林理工大学 广西电磁化学功能物质重点实验室,桂林541004; 2.桂林理工大学 化学与生物工程学院,桂林541004)
抗坏血酸易变质,又名维生素C(Vc),其作为生物体内必须的营养物质,同时作为一种氧化剂和生物酶,可减缓自由基的伤害[1]。Vc借由新陈代谢产生,也可通过水果、蔬菜等摄入[2],但其使用量必须严格按照《中华人民共和国食品安全法》规定[3]。维生素C对维护身体机能具有重要性[4],如果长期缺乏维生素C的摄入,可能会引起坏血病,进而导致皮下黏膜出血、抵抗力低下。近些年,科学家提出了维生素C具有一定的抗癌作用[5-6]。因此,为了保证人们日常的饮食健康,建立灵敏的维生素C的检测方法,监控其在食品、药品中的添加量具有极其重要的意义。目前,常用的测定抗坏血酸的方法有色谱法[7-9]、直接碘 量法[10]、电化学法[11-12]、分光光度法[13]等。
化学修饰电极是人为对电极表面进行分子设计,将具有优良电子传递特性的物质通过电沉积、滴涂等方法固定在电极表面,使电极具有特定的电化学性质。金属有机骨架(MOFs)材料具有较高的比表面积、较大的孔隙率和较小的密度,且其孔道易于调节,这使得一些功能基团很容易嵌入到MOFs材料的骨架中,同时MOFs材料合成方法简单、来源广泛,以上特性为其作为电极修饰剂提供了坚实的基础。
通过电沉积法将MOFs材料修饰到电极表面,能够很好地增加电极表面的接触面积,进而达到增加修饰电极峰电流的作用。本工作采用溶剂热法合成了具有较大孔道 (1.062×1.068nm2)的 Zn-MOFs材料将Zn-MOFs材料修饰到玻碳电极表面,建立了一种能够灵敏测定维生素C片中抗坏血酸含量的方法。
1 试验部分
1.1 仪器与试剂
Perkin-Elmer 2400型碳氢氮元素分析仪;岛津Shimadzu FTIR-8400 型 红 外 光 谱 仪;Bruker SMART APEX CCD型单晶衍射仪;S-4800型场发射扫描电子显微镜;CHI 860D型电化学工作站,采用三电极体系:修饰电极为工作电极,Ag/AgCl电极为参比电极,铂盘电极为辅助电极。
Zn-MOFs溶液:称取 Zn-MOFs 15mg在玛瑙研钵中碾碎,于室温下溶解于25mL水中,超声至完全溶解,待用。
铁氰化钾溶液:5mmol·L-1,分别称取铁氰化钾0.082 3g和氯化钾0.372 7g置于10mL烧杯中,加入水超声溶解,用水定容至50mL,备用。使用时每次移取20mL至烧杯中。
抗坏血酸标准储备溶液:1,0.2,2×10-2mol·L-1,称取一定量的抗坏血酸溶于水中,充分溶解后,用水定容至25mL,置于阴凉处保存,用时稀释成所需浓度的标准溶液。
pH 3,4,5,6,7的磷酸盐缓冲溶液(PBS):按文献[14]进行配制。
所用试剂均为分析纯,试验用水为二次蒸馏水。
1.2 试验方法
1.2.1 Zn-MOFs合成方法
将10mL含有0.5mmol Zn(NO3)2·10H2O、0.5mmol噻吩-2,5-二甲酸 (2,5-tdc)、0.5mmol 4,4′-联吡啶(4,4′-pydc)和1mmol氢氧化钠的混合溶液,室温下在烧杯中磁力搅拌1h,然后将混合液转移至25mL带有聚四氟乙烯衬底的水热反应釜中,将反应釜放入烘箱加热到170℃晶化72h。72h后进行程序降温至100℃,保温10h,关掉烘箱让其在自然状态下冷却至室温,取出反应釜,釜中生成无色针状晶体,过滤,收集产物,自然晾干后,产率为75%。
ZnC16O4H10N2S元素分析(理论值):C%49.02(49.09%);H%2.55(2.52%);红外光谱分析(溴化钾压片):3 592cm-1(芳环C-H 伸缩振动),1 554 cm-1(C=O 伸缩振动),405cm-1(Zn-O伸缩振动);经X单晶衍射仪确认ZnC16O4H10N2S晶体结构见图1。

图1 ZnC16O4H10N2S的晶体结构(50%椭球概率,对称操作A:x+1,y,z;B:-x+1,-y+1,-z+2;C:-x+1,y-1/2,-z+3/2)Fig.1 Crystal structure of ZnC16O4H10N2S shown as 50%thermal ellipsoid probability(symmetry codes A:x+1,y,z;B:-x+1,-y+1,-z+2;C:-x+1,y-1/2,-z+3/2)
1.2.2 玻碳电极的预处理
用0.5μm的氧化铝抛光粉将直径为2mm的玻碳电极在抛光布上抛光呈镜面,然后在超声波辅助下依次在无水乙醇、丙酮、水中各清洗10min。将清洗好的玻碳电极置于0.5mol·L-1硫酸溶液中,以100mV·s-1扫描速率于电位-0.6~1.5V进行循环伏安扫描,以清洗电极,直到开路电位稳定,然后将玻碳电极取出用水在超声波辅助下清洗干净,最后置于阴凉处干燥待用。玻碳电极每次测定前都要经过预处理。
1.2.3 Zn-MOFs修饰玻碳电极的制备
将预处理好的玻碳电极浸泡在配制好的Zn-MOFs溶液中,以pH 5的PBS为支持电解液,在电位为-1.7~1.7V,扫描速率为100mV·s-1的条件下,用循环伏安法扫描40圈,通过电沉积法将Zn-MOFs修饰到玻碳电极(GCE)表面,然后放置于阴凉处晾干,最终制得Zn-MOFs修饰玻碳电极,记为Zn-MOFs/GCE。
2 结果与讨论
2.1 Zn-MOFs/GCE的电化学表征
以pH 5的PBS为支持电解液,在电位为-1.7~1.7V,扫描速率为100mV·s-1的条件下,将玻碳电极浸入配制好的Zn-MOFs溶液中,进行循环伏安扫描。连续循环扫描40圈得到稳定的循环伏安曲线,见图2。
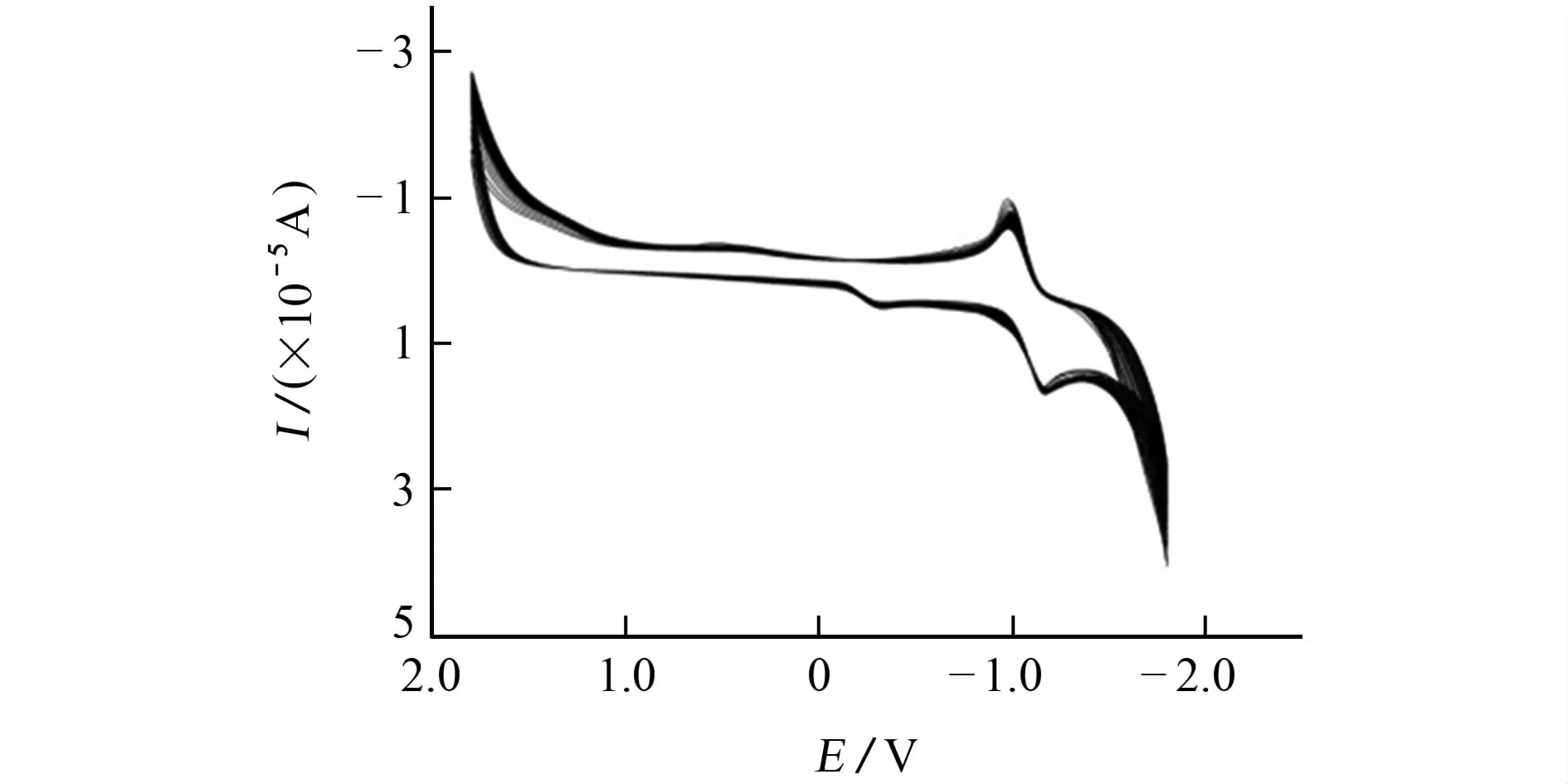
图2 Zn-MOFs/GCE连续扫描的循环伏安曲线Fig.2 CVs of Zn-MOFs/GCE with continuous scanning
由图2可知:Zn-MOFs薄膜在玻碳电极表面上生长,氧化峰电位和还原峰电位分别出现在-0.972,-1.16V处,氧化还原峰归属于 MOFs化合物中Zn2+/Zn电对发生的电极反应。
将GCE和Zn-MOFs/GCE浸泡在配制好的5mmol·L-1铁氰化钾溶液中,在电位为-0.2~0.7V,扫描速率为100mV·s-1的条件下,获得GCE与Zn-MOFs/GCE的循环伏安曲线,见图3。

图3 不同修饰电极的循环伏安曲线Fig.3 CVs of different modified electrodes
由图3可知:GCE出现了一对氧化还原峰,峰电流不大;Zn-MOFs/GCE出现了一对明显的氧化还原峰,还原峰电位(Epc)为0.452V,还原峰电流(Ipc)为 -2.824×10-5A,氧 化 峰 电位 (Epa)为0.218V,氧化峰电流(Ipa)为3.732×10-5A。这可能是由于Zn-MOFs修饰到玻碳电极后(MOFs材料本身具有孔道结构)增加了玻碳电极接触面的表面积,同时Zn-MOFs/GCE的表面修饰膜也可促进Fe(CN6)3-/Fe(CN6)4-电子对在电极上的转移。由图3还可看出:曲线1的氧化还原峰电流变化较明显,氧化还原峰电位间隔较小,电极反应可逆程度增大。
2.2 Zn-MOFs/GCE的扫描电镜表征
通过场发射扫描电子显微镜观测玻碳电极和Zn-MOFs/GCE的表面形貌,不同修饰电极的扫描电镜图见图4。

图4 不同修饰电极的扫描电镜图Fig.4 SEM images of different modified electrodes
由图4可知:玻碳电极表面很光滑,仅存在少量 缺陷;Zn-MOFs/GCE表面由于形成了MOFs化合物层,存在大量的点状颗粒,说明Zn-MOFs薄膜(粒子膜)已经在玻碳电极表面上生成。
2.3 抗坏血酸在Zn-MOFs/GCE上的电化学行为
以pH 5的PBS为支持电解液在电位为-0.2~0.7V,扫描速率为100mV·s-1的条件下,考察了抗坏血酸在GCE和Zn-MOFs/GCE上的电化学行为。GCE、Zn-MOFs/GCE在8×10-3mol·L-1抗坏血酸标准溶液中的循环伏安曲线见图5。
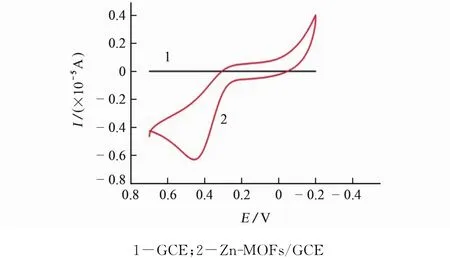
图5 GCE、Zn-MOFs/GCE在8×10-3 mol·L-1抗坏血酸标准溶液中的循环伏安曲线Fig.5 CVs of GCE and Zn-MOFs/GCE in the presence of 8×10-3 mol·L-1 Vc standard solution
由图5可知:曲线1没有出现氧化还原峰,表明抗坏血酸在GCE上不能被氧化;Zn-MOFs薄膜修饰到玻碳电极上后,曲线2出现了明显的氧化峰,表明抗坏血酸在Zn-MOFs/GCE上被氧化。
2.4 扫描速率的选择
以pH 5的PBS为支持电解液,考察了扫描速率为20~1 000mV·s-1时对抗坏血酸在 Zn-MOFs/GCE上的电催化氧化的影响,不同扫描速率下Zn-MOFs/GCE的循环伏安曲线见图6。

图6 不同扫描速率下Zn-MOFs/GCE的循环伏安曲线Fig.6 CVs of Zn-MOFs/GCE at different scanning rates
由图6可知:随着扫描速率的增大,氧化峰电位向正方向移动,氧化峰、还原峰电流随着扫描速率的增加而增加;当扫描速率在400mV·s-1以内时,峰电流和扫描速率呈线性关系,其线性回归方程为y=-0.001 640 x-0.778 3,相关系数为0.996。峰电流和扫描速率呈线性关系表示抗坏血酸氧化的电极反应受吸附控制。试验选择扫描速率为100mV·s-1。
2.5 支持电解液酸度的选择
以100mV·s-1扫描速率,分别在pH 3,4,5,6,7的PBS中加入适量的抗坏血酸,考察酸度对抗坏血酸在Zn-MOFs/GCE上的电催化氧化的影响,不同酸度下Zn-MOFs/GCE的循环伏安曲线见图7。
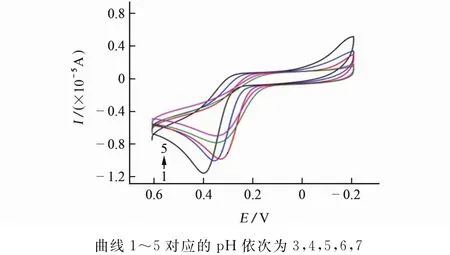
图7 不同酸度下Zn-MOFs/GCE的循环伏安曲线Fig.7 CVs of Zn-MOFs/GCE with different acidity
由图7可知:pH为3~6时,氧化峰电位向正方向移动。考虑到抗坏血酸在碱性溶液中易于氧化而失效,在水溶液中迅速变质,是强还原剂,而酸性溶液对参比电极和工作电极损害较大,试验选择pH 5的PBS为支持电解液。
2.6 干扰试验
试验采用食品中常见的6种添加剂作为干扰物,向1×10-3mol·L-1抗坏血酸标准溶液20mL中添加15~25μL高浓度的上述6种常见干扰物,考察饮料中常见干扰物对Zn-MOFs/GCE测定抗坏血酸的影响,以相对误差超过±5.0%作为产生干扰的标准。以下物质(以倍数计)不干扰测定:氯化钠、氯化钾(150),乙酸钠(100),柠檬黄、胭脂红、葡萄糖(50)。这说明这些共存物质不干扰抗坏血酸的测定,Zn-MOFs/GCE对抗坏血酸具有良好的选择性。
2.7 标准曲线和检出限
将1,0.2,2×10-2mol·L-1抗坏血酸标准储备溶液用pH 5的PBS稀释成4×10-5,6×10-5,8×10-5,1×10-4,2×10-4,4×10-4,6×10-4,8×10-4,1×10-3,2×10-3,4×10-3,6×10-3,8×10-3,1×10-2mol·L-1的抗坏血酸标准溶液,记录Zn-MOFs/GCE在上述抗坏血酸标准溶液系列中的循环伏安曲线,并绘制标准曲线。结果表明:抗坏血酸的浓度在4×10-5~1×10-2mol·L-1内与其对应的氧化峰电流呈线性关系,线性回归方程为I=-1 037c+0.017 65,相关系数为0.996 0,检出限(3s/k)为6.7×10-6mol·L-1。
2.8 Zn-MOFs/GCE的稳定性和可重复性
在pH 5的PBS中,在-0.2~0.7V 电位下进行循环伏安连续扫描,检测Zn-MOFs/GCE的稳定性。结果表明:在100mV·s-1扫描速率下循环100个连续周期后,循环伏安曲线的氧化峰高度没有明显变化。此外,Zn-MOFs/GCE在空气下暴露3周后峰电流无明显变化(<3%)。
试验制备了4个Zn-MOFs/GCE并检测它们对2×10-3mol·L-1抗坏血酸标准溶液的响应,测定值的相对标准偏差(RSD)为0.025%,这表明本方法具有明显的重现性。Zn-MOFs/GCE对2×10-3mol·L-1抗坏血酸标准溶液连续测定9次,测定值的相对标准偏差为2.7%,表明该修饰电极具有可重复性。
2.9 样品分析
选取3种不同品牌的Vc片进行分析。分别称取0.071g 1#片剂(标示Vc的质量分数为10%),0.423g 2#片剂(标示 Vc的质量分数为25%),0.564g 3#片剂(标示 Vc的质量分数为25%),用10mL水溶解,并用水定容至100mL。移取样品溶液10.00mL,采用循环伏安扫描,测定抗坏血酸含量,再进行加标回收试验,结果见表1。

表1 样品分析结果(n=5)Tab.1 Analytical results of samples(n=5)
由表1可知:加标回收率为91.0%~109%,RSD为0.80%~1.9%,表明本方法的精密度和准确度较好。
[1] SOLATIE D,CARBOL P,BETTI M,et al.Ion chromatography inductively coupled plasma mass spectrometry(IC-ICP-MS)and radiometric techniques for the determination of actinides in aqueous leachate solutions from uranium oxide[J].Fresenius Journal of Analytical Chemistry,2003,68(1):88-94.
[2] 曾翔云.维生素C的生理功能与膳食保障[J].中国食物与营养,2005(4):52-54.
[3] 高志杰,李静涛,饶小思,等.高效液相色谱-二极管阵列检测器法检测饮料中Vc的研究[J].中国卫生检验杂志,2006,16(4):446-447.
[4] 邵丽华.饮料中还原型维生素C与总维生素C测定方法的研究[J].营养学报,2007,29(2):192-194.
[5] 王爱月,张向兵,李发生,等.高效液相色谱法测定食品及保健品中维生素C含量的研究[J].中国卫生检验杂志,2006,16(10):1175-1176.
[6] 毕玉琦,田甜,凌云.GB 14881-2013《食品生产通用卫生规范》解读[J].标准科学,2014(4):65-68.
[7] WANG S F,DAN D.Differential pulse voltammetry determination of ascorbic acid with ferrocene-L-cysteine self-assembled supramolecular film modified electrode[J].Sensors and Actuators B Chemical,2004,97(2):373-378.
[8] 刘国如,刘永锁,陈振玲,等.高效液相色谱法测定维生素C注射液含量[J].中国医药导报,2011,27(8):50-51.
[9] TANG Y J,WU M J.A quick method for the simultaneous determination of ascorbic acid and sorbic acid in fruit juices by capillary zone electrophoresis[J].Talanta,2005,65(3):794-798.
[10] 解文秀,马玉翔.铁(Ⅱ)-邻菲罗啉-桑色素体系分光光度法测定果蔬中的维生素C[J].山东教育学院学报,2002,17(4):47-48.
[11] 谭学才,韦冬萍,邓光辉,等.维生素C在多壁碳纳米管/壳聚糖复合膜修饰玻碳电极上的电化学行为及测定[J].分析测试学报,2007,26(5):662-666.
[12] LI B H,YU T H,WENG C Y,et al.Thermal and plasma synthesis of metal oxide nanoparticles from MOFs with SERS characterization[J].Vibrational Spectroscopy,2016,84:146-152.
[13] CHIZALLET C,LAZARE S,BAZER-BACHI D,et al.Catalysis of transesterification by a nonfunctionalized metal organic framework:Acido-basicity at the external surface of ZIF-8probed by FTIR and ab initio calculations[J].Journal of the American Chemical Society,2010,132(35):12365-12377.
[14] 强琳,袁林江,丁擎,等.缓冲液对微生物燃料电池产电性能影响研究[J].环境科学,2011,32(5):1524-1528.
