槲皮素在多壁碳纳米管修饰碳糊电极上的电化学行为及其与脱氧核糖核酸的相互作用
2018-01-22尚永辉孙家娟
尚永辉,孙家娟,周 琴,毛 茹,商 娟
(咸阳师范学院 化学与化工学院,咸阳712000)
槲皮素又称槲皮黄素或枥精,属黄酮类有机化合物,广泛存在于蔬菜、水果以及谷类植物中,具有祛痰、止咳、平喘,降血脂、扩张冠状动脉和增加冠脉血流量等多种功效[1]。近年的研究发现:其在抗人类免疫缺陷病毒(HIV)以及抗癌等方面也具有一定的潜在药理作用,特别在前列腺癌的治疗方面效果显著[2]。
脱氧核糖核酸(DNA)是生物界遗传信息的数据库,生物的发育和生命的基体机能正常运转是通过DNA来指导的,同时DNA也是组成遗传命令的主体[3]。DNA是由很多组分组成的一条长链聚合物,药物分子和DNA作用之后会改变DNA长链的序列,从而在一定程度上改变了DNA的性质。DNA是抗癌药物分子在人体内作用的靶标物,近年来,药物分子与DNA作用的研究十分广泛。
本工作探究了槲皮素在多壁碳纳米管修饰碳糊电极上的电化学行为,并研究了槲皮素与DNA的相互作用。
1 试验部分
1.1 仪器与试剂
CHI 660C型电化学工作站;CH 2250型电子天平;DZX-3型真空干燥箱;KQ 520DE型数控超声波清洗器;三电极系统:多壁碳纳米管修饰碳糊电极为工作电极,Hg/Hg2Cl2为参比电极,铂电极为辅助电极。
槲皮素标准储备溶液:1.00×10-3mol·L-1,称取槲皮素0.015 1g,用热乙醇溶解后转移至50mL容量瓶中,用无水乙醇定容,摇匀,备用。
DNA 溶 液:604mg· L-1,称 取 DNA 0.030 2g,用水在50mL烧杯里搅拌至完全溶解,再转移至50mL容量瓶中,用水定容,摇匀,备用。
中性红溶液:1.00×10-3mol·L-1,称取中性红粉末0.014 4g,用水溶解,转移至50mL容量瓶中,用水定容,摇匀,备用。
试验用水为蒸馏水。
1.2 试验方法
1.2.1 电极的制备
取石墨粉适量于研钵中,逐滴加入液体石蜡适量并充分研磨至混合物呈有韧性的小片状,夯实填充入0.5mL注射器中。将打磨后的铜丝从尾端插入作为电极的导线,另一端打磨抛光至镜面,制得裸碳糊电极。
称取多壁碳纳米管粉末5mg于试管中,加入二甲基甲酰胺(DMF)适量,用数控超声波超声分散2h,使其均匀分散,制得多壁碳纳米管DMF悬浮液。移取上述悬浮液10μL,滴至制备好的裸碳糊电极表面,倒立放置,自然晾干,制得多壁碳纳米管修饰碳糊电极。
1.2.2 电化学测定
移取 pH 3.29 的 B-R 缓冲溶液 3.00mL 于10mL比色管中,加入槲皮素标准储备溶液适量,用水定容至10mL,摇匀,以多壁碳纳米管修饰碳糊电极为工作电极,用三电极系统测定循环伏安曲线和差分脉冲曲线。
2 结果与讨论
2.1 槲皮素的电化学特性
移取槲皮素标准溶液适量,分别用裸碳糊电极和多壁碳纳米管修饰碳糊电极作为工作电极,按试验方法进行循环伏安扫描,扫描速率为0.30V·s-1,结果见图1。

图1 不同电极的循环伏安图Fig.1 CVs of different electrodes
由图1可知:槲皮素在裸碳糊电极上产生一个较为明显的氧化峰,无明显还原峰出现;槲皮素在多壁碳纳米管修饰碳糊电极上产生一对明显的氧化还原峰,峰电位分别为0.488,0.348V,且氧化峰的电流信号明显强于裸碳糊电极上的氧化峰电流信号(约为裸碳糊电极上电流信号的5.3倍),这表明多壁碳纳米管对槲皮素有很好的催化作用。
2.2 试验条件的选择
2.2.1 酸 度
试验考察了酸度对槲皮素电化学信号的影响。槲皮素在不同pH的B-R缓冲溶液中的循环伏安图见图2,槲皮素标准溶液的浓度为2.00×10-4mol·L-1,扫描速率为0.30V·s-1。

图2 槲皮素在不同pH的B-R缓冲溶液中的循环伏安图Fig.2 CVs of quercetin in B-R buffer solution with different pH
由图2可知:随着pH增加,槲皮素的氧化峰线性负移,峰电位(Ep)与pH的线性回归方程为Ep=-0.066 42pH+0.747 4,相关系数为0.996 6,表明有质子参与槲皮素在多壁碳纳米管修饰碳糊电极上的反应过程,依据峰电位与pH之间的公式:

式中:m为质子转移数;E0为标准电极电位;n为电子转移数。计算得m/n=1.122≈1,即m=n,表明该电极反应为等质子等电子参与过程[4]。
pH为3.29时,槲皮素氧化峰电流最大,峰形最佳,试验选择反应体系的pH为3.29。
2.2.2 底液
试验考察了槲皮素分别在pH为3.29的柠檬酸-柠檬酸钠缓冲溶液、B-R缓冲溶液、邻苯二甲酸氢钾-盐酸、乙酸-乙酸钠、磷酸氢二钠-柠檬酸缓冲溶液等5种底液中的电化学信号,槲皮素标准溶液的浓度为2.00×10-4mol·L-1,扫描速率为0.30V·s-1,底液对电化学性质的影响见图3。
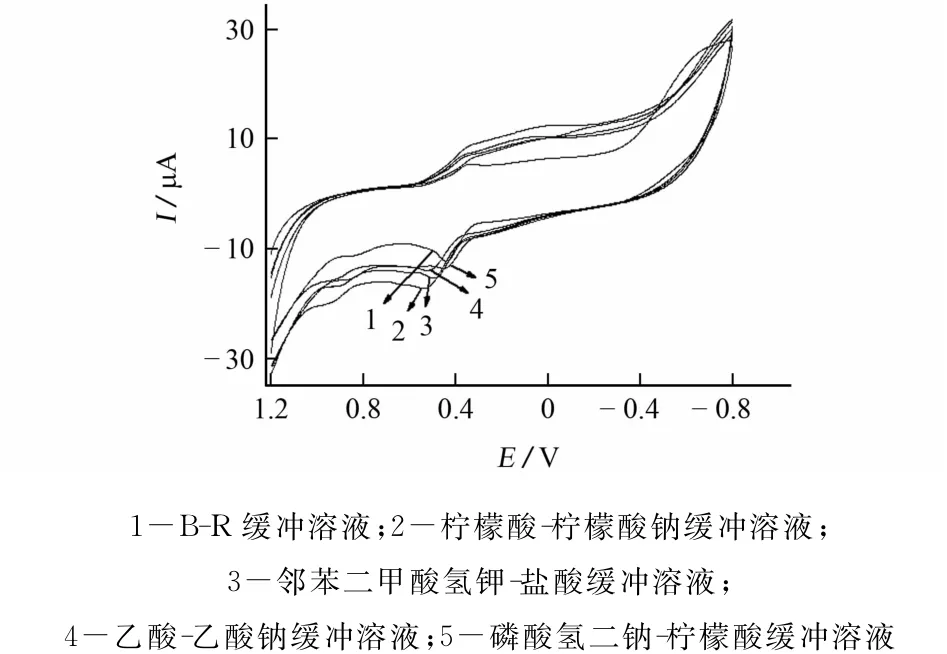
图3 底液对电化学性质的影响Fig.3 Effect of based liquid on electrochemical properties
由图3可知:槲皮素在pH 3.29的B-R缓冲溶液中氧化峰电流最大,峰形最好。试验选择pH为3.29的B-R缓冲溶液为底液。
2.2.3 扫描速率
移取1.00×10-3mol·L-1槲皮素标准储备溶液2.00mL于pH 3.29的B-R缓冲溶液中,用多壁碳纳米管修饰碳糊电极为工作电极,在最佳电位下改变扫描速率,记录循环伏安曲线,扫描速率对电化学性质的影响见图4。
由图4可知:随扫描速率增加,槲皮素的氧化峰电流逐渐增加,峰电位逐渐正移。试验选择扫描速率为0.30V·s-1。
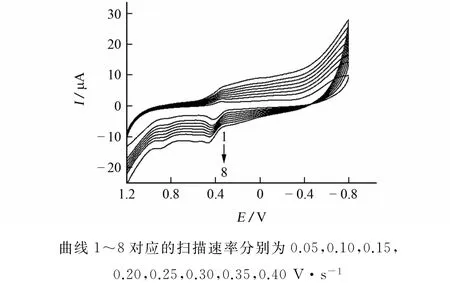
图4 扫描速率对电化学性质的影响Fig.4 Effect of scanning rates on electrochemical properties
试验还发现,0.488V左右的氧化峰电流与其对应的扫描速率呈线性关系,线性回归方程为I=-18.81 v-3.903,相关系数为0.997 0。这表明槲皮素在修饰电极表面的电极反应受吸附控制。
氧化峰电位对扫描速率的线性回归方程为Ep=0.022 3lnv+0.478 6,相关系数为0.996 5。根据公式(2):
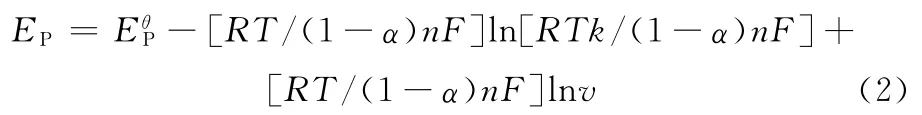
式中:α为电子转移系数;k为电极反应速率常数;F为法拉第常数;Eθp为标准峰电位;R为摩尔气体常数;T 为热力学温度。α取0.5[5],得到n=2.30≈2,结合2.2.1节电极反应为等质子等电子参与过程,可知槲皮素在多壁碳纳米管修饰碳糊电极上的电化学反应过程为2质子2电子参与转移的过程,槲皮素在多壁碳纳米管修饰碳糊电极上的电极反应过程见图5。

图5 电极反应过程Fig.5 Process of electrode reaction
根据文献[6]可知:在循环伏安曲线上观察到槲皮素在约0.88V和约0.20V处的较小的峰电流(Ip)可能是槲皮素结构式中C3位上的-OH反应引起的。
2.3 标准曲线及检出限
按试验方法测定了槲皮素标准溶液系列的差分脉冲曲线,结果表明:槲皮素的浓度在5.00×10-7~5.00×10-5mol·L-1内与其对应的差分脉冲伏安电流呈线性关系,线性回归方程为-i=8 472 c+8.720,相关系数为0.999 7,检出限为2.00×10-7mol·L-1。
2.4 槲皮素与DNA的相互作用
2.4.1 槲皮素与DNA相互作用的电化学方法
移取pH 3.29的 B-R 缓冲溶液2.00mL于比色管中,加入一定量的1.00×10-3mol·L-1槲皮素标准储备溶液和一定量的DNA溶液,用水定容至10mL,摇匀,静置60min,使其充分反应。以多壁碳纳米管修饰电极为工作电极的三电极系统进行测定,记录循环伏安曲线和差分脉冲曲线,DNA对槲皮素电化学行为的影响见图6。
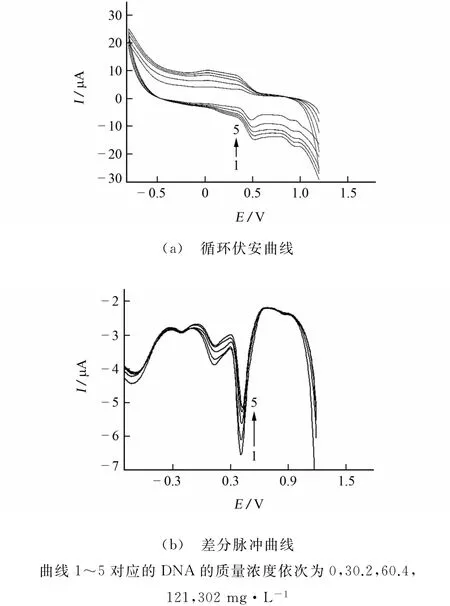
图6 DNA对槲皮素电化学行为的影响Fig.6 Effect of DNA on electrochemical behavior of quercetin
由图6(a)可知:随着DNA质量浓度的增加,槲皮素的氧化峰、还原峰电流均依次减小,其中氧化峰逐渐正移,还原峰逐渐负移,氧化峰正移程度大于还原峰负移程度,表明随着DNA的加入,槲皮素峰电位明显正移。根据文献[7]总结的相互作用规律,推测槲皮素主要通过嵌入方式与DNA产生相互作用。图6(b)也观察到一致的现象:随着DNA的加入,峰电流减小了21.1%(曲线1~5),峰电位正移了13mV(曲线1的0.410V到曲线5的0.423V)。从结构上看:槲皮素的主体结构有5个羟基,属亲水基团,易与DNA上的碱基对发生相互作用。
2.4.2 以中性红为探针研究槲皮素与DNA的相互作用
中性红能与DNA发生嵌插作用[8]。为了进一步探究槲皮素与DNA的相互作用过程,试验以中性红为探针进行研究。在pH 3.29的B-R缓冲溶液中,分别加入一定量的中性红溶液,中性红与DNA的混合溶液,中性红、DNA和槲皮素的混合溶液,分别静置反应30min后,按试验方法以多壁碳纳米管修饰碳糊电极为工作电极测定差分脉冲曲线和紫外-可见吸收光谱。中性红、DNA及槲皮素反应的差分脉冲曲线和紫外-可见吸收光谱见图7。
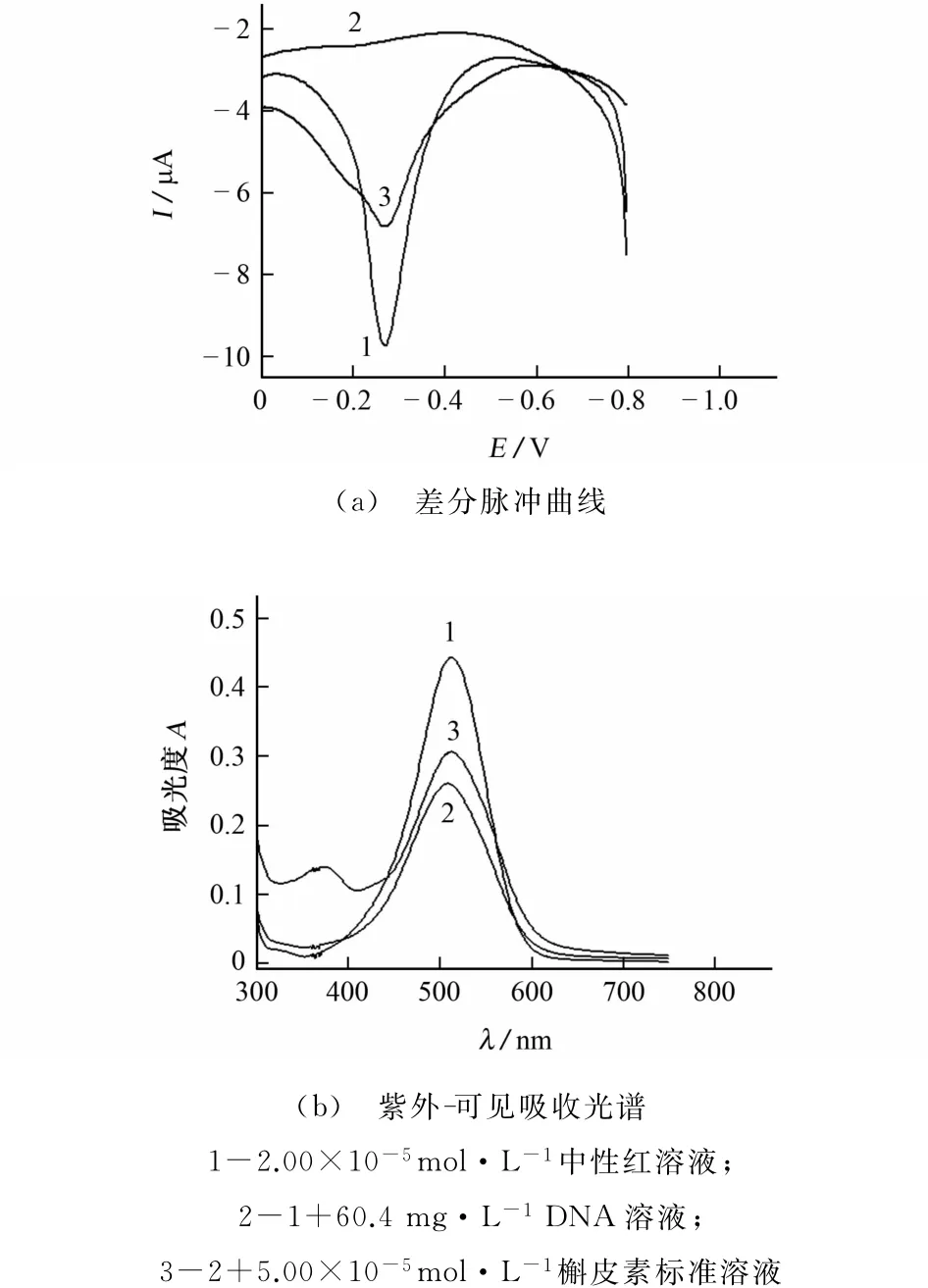
图7 中性红、DNA及槲皮素反应的差分脉冲曲线和紫外-可见吸收光谱Fig.7 DPVs and UV-Vis adsorption spectra of neutral red,DNA dn quercetin
由图7(a)可知:中性红在-0.268V处具有一灵敏的氧化峰(曲线1);加入DNA后,由于中性红与DNA的结合导致体系中中性红的浓度降低,从而使中性红氧化峰电流随之降低(曲线2);当体系中加入槲皮素后,中性红的峰电流又明显增强(曲线3)。图7(b)也得到了相同的试验结果。这应该是由于槲皮素、中性红两者与DNA的相互作用过程具有相同的作用方式和作用位点。混合溶液中槲皮素与中性红相互竞争与DNA相结合,加入的槲皮素通过竞争导致插进DNA双链的碱基对中的中性红分子被游离出来,因此体系中游离的中性红浓度增加,导致中性红的氧化峰电流和吸光度增加。据此可以判断槲皮素与中性红类似能有效插进DNA双链的碱基对中,与DNA发生嵌插作用的结合。
本方法灵敏度高、检出限低,可作为槲皮素测定的新方法。
[1] 孙涓,余世春.槲皮素的研究进展[J].现代中药研究与实践,2011,25(3):85-88.
[2] 翟广玉,马海英,郜蕾.槲皮素及其衍生物的抗肿瘤活性研究进展[J].化学试剂,2015,37(2):97-103.
[3] 黄振兴,李晨晨,金旭琴,等.除藻剂新洁尔灭与鲱鱼精子DNA的相互作用[J].环境化学,2016,35(8):1636-1641.
[4] ZHU Y H,ZHANG Z L,PANG D W.Electrochemical oxidation of theophylline at multi-wall carbon nanotube modified glassy carbon electrodes[J].Journal of Electroanalytical Chemistry,2005,581(2):303-309.
[5] 李玲,王娟,刘计敏,等.L-半胱氨酸/纳米金/DNA/壳聚糖修饰金电极测定布洛芬[J].分析科学学报,2016,32(5):644-648.
[6] 余从立.槲皮素的电分析与电氧化机理研究[D].合肥:合肥工业大学,2006.
[7] CARTER MICHAEL T,BARD ALLEN J.Voltammetric studies of the interaction of tris(1,10-phenanthroline)cobalt(III)with DNA[J].J Am Chem Soc,1987,109(24):7528-7530.
[8] 杨昌英,汪鋆植,代忠旭,等.以中性红为电化学探针考察根皮苷、根皮素与DNA的作用[J].天然产物研究与开发,2009(21):221-224.
