高效液相色谱-串联质谱法测定天然彩色棉中23种邻苯二甲酸酯
2018-01-22王晓娟桂家祥林振兴杨力生
王晓娟,桂家祥,林振兴,杨力生
(1.宁波出入境检验检疫局,宁波315012, 2.赣州出入境检验检疫局,赣州332000)
邻苯二甲酸酯(PAEs)是一类普遍使用的化学工业品,广泛存在于化妆品、儿童玩具、食品包装、服装和人造革等产品中。研究表明:PAEs可干扰动物和人体正常的内分泌功能,在体内长期积累会导致畸形、癌变和突变[1-4]。由于PAEs与基质之间未形成化学键,彼此保持着各自独立的化学性质,PAEs极易从基质中释放出来,进入人体或土壤、空气、水体等环境中,危害人体健康并对生态环境造成污染,因此PAEs被称为第二个全球性多氯联苯污染物,国内外已将其列为优先控制污染物[5-7]。
天然彩色棉制品具有色泽自然、柔和典雅、质地柔软等特点,用天然彩色棉纤维生产的纺织品无需染色,是名副其实的生态纺织品,是21世纪国际绿色纺织品市场上最具发展潜力的产品之一[8-9]。但天然彩色棉作为一种农作物,它在生长过程中会从土壤、空气、水中吸收PAEs,从而影响其生态。文献[10]采用超声萃取-气相色谱法检测棉花秸秆中邻苯二甲酸酯的含量,在棉花秸秆中检出PAEs,含量随检测部位不同以及PAEs性质略有不同。但有关天然彩色棉中PAEs检测研究还未见报道。因此,开展对天然彩色棉中PAEs的监测,对于评价彩色棉质量、保护人类健康具有重要的现实意义。
目前,PAEs的检测方法主要有气相色谱法和气相色谱-质谱法[11-17]。文献[18]采用液相色谱-串联质谱法对水体、食品中PAEs进行测定。目前PAEs的检测仍面临以下问题:① 现有报道的检测范围包含的PAEs种类较少,未涉及国际上关注度高、有限量要求的邻苯二甲酸二异壬酯(DINP)、邻苯二甲酸二异癸酯(DIDP)和邻苯二甲酸二烯丙酯(DAP),不能满足目前的检测需求。② 碳原子数较多的异构体混合物的分离检测仍然是PAEs检测的难点,目前对高相对分子质量的异构体混合物的检测还很少,如邻苯二甲酸二壬酯(DNP)、DINP、邻苯二甲酸二正辛酯(DNOP)、邻苯二甲酸二(2-乙基)己酯(DEHP),仍需进一步研究。
液相色谱-质谱法将具有分离能力的高效液相色谱和具有检测和表征能力的质谱结合起来,具有灵敏度高,适用范围较宽,针对复杂基质样品可进行定性、定量分析等优点[19-20],有望解决目前PAEs检测中存在的问题。本工作通过对色谱条件、质谱条件等的优化,建立了同时测定天然彩色棉中邻苯二甲酸二甲酯(DMP)、邻苯二甲酸二乙酯(DEP)、邻苯二甲酸二异丙酯(DIPrP)、DAP、邻苯二甲酸二丙酯(DPrP)、邻苯二甲酸二异丁酯(DIBP)、邻苯二甲酸二丁酯(DBP)、邻苯二甲酸二(2-甲氧基)乙酯(DMEP)、邻苯二甲酸二异戊酯(DIPP)、邻苯二甲酸二(4-甲基-2-戊基)酯(BMPP)、邻苯二甲酸二(2-乙氧基)乙酯(DEEP)、邻苯二甲酸二戊酯(DPP)、邻苯二甲酸二己酯(DHXP)、邻苯二甲酸丁基苄基酯(BBP)、邻苯二甲酸二(2-丁氧基)乙酯(DBEP)、邻苯二甲酸二环己酯(DCHP)、DEHP、邻苯二甲酸二庚酯(DHP)、邻苯二甲酸二苯酯(DPhP)、DNOP、DINP、DIDP、DNP等23种PAEs的高效液相色谱-串联质谱法。
1 试验部分
1.1 仪器与试剂
Agilent 1200 型高效液相色谱仪-API 4000Q型质谱仪;SCQ-2211A型超声波清洗仪;Milli-Q纯水系统。
23种PAEs标准储备溶液:1.00g·L-1,分别称取适量的23种PAEs,用甲醇分别配制而成。
23种PAEs标准品的纯度均大于99.0%,甲醇、乙腈、正己烷为色谱级,试验用水为二次水。
1.2 仪器工作条件
1)色谱条件 Kinetex-C18色谱柱(100mm×4.6mm,2.6μm),柱温30 ℃;进样量10μL;流量300μL·min-1。流动相:A为甲醇,B为0.1%(体积分数,下同)甲酸溶液。梯度洗脱程序:0~2.0min时,A由40%升至80%,保持4min;6.0~6.1min时,A 由80%升至95%,保持3.9min;10.0~10.1min 时,A 由 95% 升至 98%,保持7.9min;18.0~18.1min时,A由98%降至40%,保持6.9min。
2)质谱条件 电喷雾离子源(ESI),离子源喷雾电压5.5kV,离子源温度550℃,正离子扫描;雾化气压力0.345MPa,辅助气压力0.345MPa,气帘气压力0.207MPa;多反应监测模式。其余质谱参数见表1,其中“*”为定量离子。
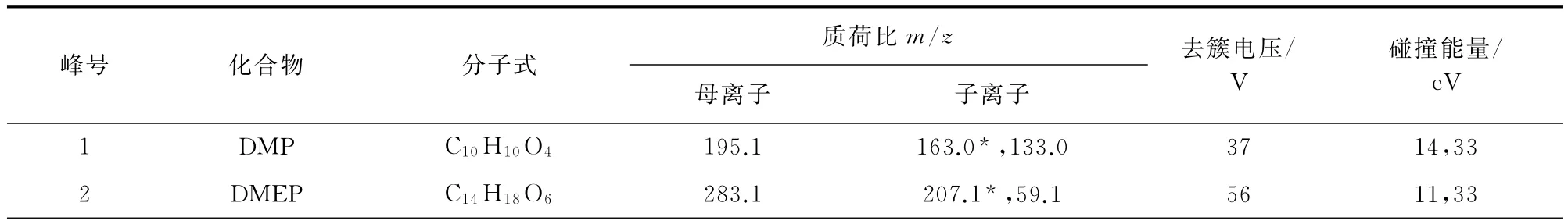
表1 质谱参数Tab.1 MS parameters

表1(续)
1.3 试验方法
分别将天然棕色棉纤维和绿色棉纤维粉碎,称取纤维粉末1.000 0g,加入甲醇30mL经超声提取30min后,将提取液移至蒸馏烧瓶中,残渣用甲醇洗涤3次,合并提取液。提取液用旋转蒸发仪减压蒸馏浓缩并用氮气吹至近干,用甲醇定容至1mL,经0.45μm有机滤膜过滤后,按仪器工作条件进行测定。如溶液中待测组分含量过高,则适当稀释后再按仪器工作条件进行测定。
2 结果与讨论
2.1 色谱行为
23种PAEs混合标准溶液的MRM图见图1。
2.2 提取溶剂和提取时间的选择
采用超声提取法提取天然彩色棉纤维中的23种PAEs。由于PAEs易溶于有机溶剂,试验分别考察了甲醇、正己烷、三氯甲烷等有机溶剂作为提取溶剂时对PAEs提取效率的影响。结果表明:甲醇、三氯甲烷作为提取溶剂时,提取效率相近,且提取效率优于正己烷。考虑到三氯甲烷毒性较大,试验选用甲醇作为提取溶剂。

图1 23种PAEs混合标准溶液的MRM图Fig.1 MRM chromatograms of 23PAEs
试验考察了提取(超声)时间依次为5,10,20,30,40,50,60min时对PAEs提取效率的影响。结果表明:随着提取时间的延长,提取效率逐渐增加,但当提取时间超过30min后,提取效率几乎不再增加。试验选择提取时间为30min。
2.3 色谱条件的选择
试验考察了甲醇-水溶液、乙腈-水溶液、甲醇-0.1%甲酸溶液、乙腈-0.1%甲酸溶液等4种流动相对测定结果的影响。结果表明:采用甲醇为有机相时的分离效果和响应均优于乙腈;PAEs为弱极性化合物,流动相的组成对PAEs的离子化效率影响显著,在流动相中添加0.1%甲酸有助于生成[M+H]+的准分子离子峰,从而提高检测灵敏度和稳定性。因此,试验选择甲醇-0.1%甲酸溶液为流动相。
为实现23种邻苯二甲酸酯的有效分离,采用流动相梯度洗脱,经过反复优化,确定的洗脱条件见1.2节。在此洗脱条件下,23种PAEs在20min内出峰并具有较好的分离效果。
2.4 质谱条件的选择
在进行质谱条件优化时,分别取23种PAEs标准溶液,用流动注射泵分别注入离子源。在正、负离子监测方式下分别对其进行一级质谱扫描,确定其分子离子。试验结果表明:负离子模式下分子离子信号很弱,干扰信号较多;正离子模式下获得了较强的分子离子[M+H]+信号。因此,试验对23种PAEs采用正离子扫描方式。
以23种PAEs的分子离子[M+H]+为母离子进行二级质谱扫描,选取二级质谱中丰度较高、干扰较少的两个碎片离子为定性、定量离子。最后以多反应监测(MRM)正离子模式优化各种质谱参数,试验选择的各种质谱参数见表1。
2.5 标准曲线和检出限
分别移取1.00g·L-123种PAEs标准储备溶液适量,用甲醇稀释成23种PAEs混合标准溶液系列。按仪器工作条件对其进行测定,并绘制标准曲线。结果表明:23种PAEs的质量浓度均在0.01~0.50mg·L-1内与其对应的峰面积呈线性关系,线性回归方程、相关系数见表2。
以3倍信噪比计算方法的检出限(3S/N),结果见表2。

表2 线性回归方程、相关系数及检出限Tab.2 Linear regression equations,correlation coefficients and detection limits
2.6 方法的精密度和回收试验
按试验方法对空白天然彩色棉样品进行加标回收试验,平行测定6次,结果见表3。
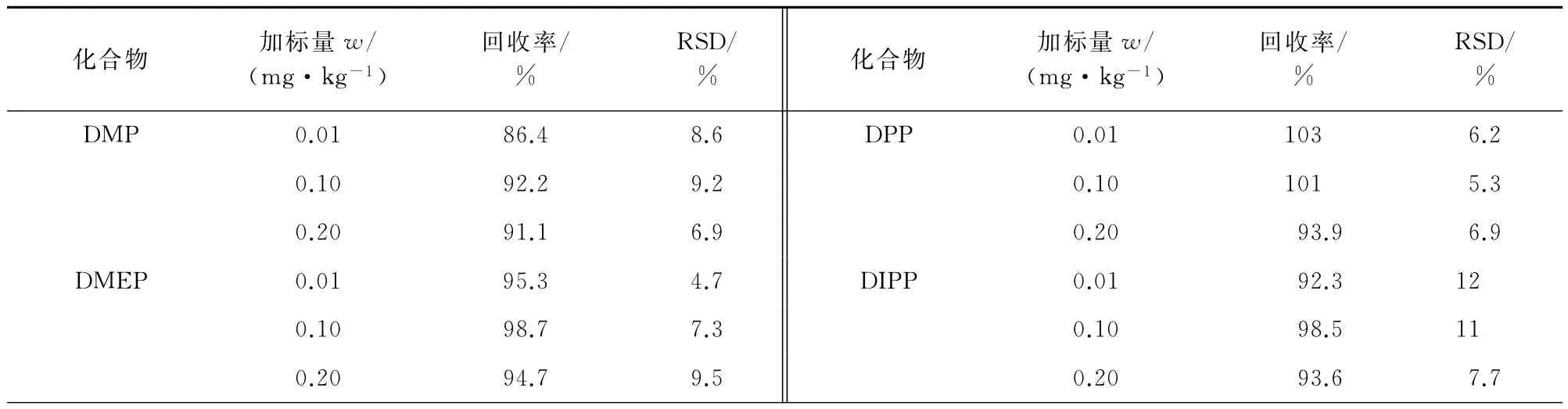
表3 精密度和回收试验结果(n=6)Tab.3 Results of tests for precision and recovery(n=6)

表3(续)
由表3可知:加标回收率为85.2%~105%,相对标准偏差为0.60%~12%,表明方法的准确度和精密度较高。
2.7 样品分析
按试验方法对6个天然彩色棉样品进行分析,结果表明:4个样品中检出3.20~21.90mg·kg-1DIBP,4个样品中检出7.50~25.30mg·kg-1DBP,3个样品中检出36.80~84.60mg·kg-1DEHP。
本工作采用高效液相色谱-串联质谱法测定天然彩色棉中23种邻苯二甲酸酯,方法灵敏、准确、重复性好,能满足天然彩色棉中23种PAEs定量分析的要求。
[1] KATO K,SILVA M J,NEEDHAM L L,et al.Determination of total phthalates in urine by isotope-dilution liquid chromatography-tandem mass spectrometry[J].J Chromatogr B,2005,814(2):355-360.
[2] NET S,DELMONT A,SEMPERE R,et al.Reliable quantification of phthalates in environmental matrices(air,water,sludge,sediment and soil):A review[J].Sci Total Environ,2015,515:162-180.
[3] GUO Y,KANNAN K.Challenges encountered in the analysis of phthalate esters in foodstuffs and other biological matrices[J].Anal Bioanal Chem,2012,404(9):2539-2554.
[4] 梁婧,庄婉娥,魏丹琦,等.气相色谱-质谱法同时测定化妆品中19种邻苯二甲酸酯[J].色谱,2012,30(3):273-279.
[5] 李娜,王兴宁,刘康书,等.固相萃取-气相色谱-质谱法同时测定植物油中7种邻苯二甲酸酯[J].理化检验-化学分册,2015,51(6):778-781.
[6] 朱彬,朱帆,徐振林,等.酱油与白酒中邻苯二甲酸二甲酯的化学发光酶免疫分析方法研究[J].分析化学,2015,43(7):1027-1032.
[7] 兰小波,赵文斌,王梦凡,等.分子印迹光子晶体传感芯片的制备及对邻苯二甲酸酯类化合物的检测[J].分析化学,2015,43(4):471-478.
[8] 谭燕玲,周献珠.天然彩棉研究现状及其发展趋势[J].纺织科技进展,2015(1):1-4.
[9] 张林水,姜艳丽,吴霞,等.我国彩色棉的发展战略选择[J].中国棉花,2005,33(2):9-11.
[10] 吴瑛,王春燕,张越锋.超声萃取-气相色谱法测定棉花秸秆中邻苯二甲酸酯[J].中国农学通报,2011,27(33):53-56.
[11] KHOSRAVI K,PRICE G W.Determination of phthalates in soils and biosolids using accelerated solvent extraction coupled with SPE cleanup and GC-MS quantification[J].Microchem J,2015,121:205-212.
[12] 李敏霞,吴京红,曾玮,等.液相微萃取-气相色谱法测定水样中邻苯二甲酸酯[J].分析化学,2006,34(8):1172-1174.
[13] KRYLOV V A,VOLKOVA V V.Sources of systematic errors in the gas chromatographic determination of dialkyl o-phthalates in water[J].J Anal Chem,2015,70(5):585-592.
[14] 赵云霞,蒋俊,王祖翔,等.GC-MS同时测定油脂性的食品及食品添加剂中16种邻苯二甲酸酯类迁移物[J].分析试验室,2012,31(2):95-100.
[15] REN R,JIN Q,HE H L,et al.Determination of 17 phthalate esters in infant milk powder and dairy products by GC-MS with 16internal standards[J].Chromatographia,2016,79(13/14):903-910.
[16] KIM J W,KIM Y M,MOON H M,et al.Comparative study of thermal desorption and solvent extraction-gas chromatography-mass spectrometric analysis for the quantification of phthalates in polymers[J].J Chromatogr A,2016,1451:33-40.
[17] 杨悠悠,谢云峰,田菲菲,等.常见食品中邻苯二甲酸酯类增塑剂含量及食品包装材料中邻苯二甲酸酯类增塑剂迁移量的测定[J].色谱,2013,31(7):674-678.
[18] 王祖翔,蒋俊,杨霁,等.高效液相色谱-串联质谱法检测食品中6种邻苯二甲酸酯[J].分析科学学报,2013,29(4):551-555.
[19] 马强,白桦,王超,等.超高效液相色谱-串联质谱法同时测定玩具中的16种致癌和致敏燃料[J].分析化学,2010,38(1):51-56.
[20] 孟兆玲,齐元英,柳仁民.高效液相色谱-质谱联用技术的应用进展[J].化学分析计量,2006,15(6):99-103.
