周期性饥饿再投喂对曼氏无针乌贼(Sepiella japonica)幼体生长、体组成及氨基酸和脂肪酸的影响*
2018-01-22平洪领史会来余方平
张 涛 平洪领 史会来 余方平 孟 浩 林 成
(浙江省海洋水产研究所 浙江省海水增养殖重点实验室 舟山 316021)
在自然界中, 动物经常由于饵料不足或者环境突变等原因, 受到不同程度的饥饿胁迫(乔秋实等,2011)。大部分动物往往可以依靠消耗自身储能物质或者降低代谢率来应对短期的饥饿胁迫; 而当食物供给恢复正常后, 生物个体通常会表现出一定程度的快速生长, 这种现象即为补偿生长(崔奕波, 1989;Mlglavs et al, 1989; Jobling et al, 1994; Wang et al,2000; Ali et al, 2003)。补偿生长是水生动物生理生态学和营养学研究的重要内容, 在鱼类(吴立新等, 2000;王岩, 2001; Cui et al, 2006; 楼宝等, 2008a, b)、甲壳类(Wu et al, 2001; 李君丰等, 2007; 李志华等,2008)、贝类(His et al, 1992; 杨凤等, 2008; 闫喜武等,2009; 章承军等, 2010)等重要经济水生动物中已有大量研究报道。
曼氏无针乌贼(Sepiella japonica)俗称墨鱼, 隶属于软体动物门(Mollusca)、头足纲(Cephalopoda)、十腕目(Decapoda)、乌贼科(Sepiidae)、无针乌贼属(Sepiella)。曼氏无针乌贼曾是我国“四大海产”之一,浙江省历史上最高年产量曾达6万多吨。20世纪70年代末以来, 由于过度捕捞及产卵场破坏, 自然资源已近衰竭。为了修复曼氏无针乌贼资源, 浙江省于2014年将曼氏无针乌贼列为最主要的增殖放流品种之一。曼氏无针乌贼在全人工繁育过程中, 常常会由于养殖密度过大、投饵不均匀或投饵不及时等因素的影响, 遭受饥饿胁迫。近年来, 国内外学者针对曼氏无针乌贼的资源分布(唐逸民等, 1986a, b)、繁殖生物学(李星颉等, 1985; 吴常文等, 2010; 史会来等,2016)、生理生态学(尹飞等, 2005; 蒋霞敏等, 2010)及增养殖(常抗美等, 2008, 2009)等方面开展了大量研究, 虽有学者报道了其初孵阶段的补偿生长研究(范帆等, 2011), 但对其幼体阶段多重周期性饥饿胁迫后的补偿生长缺乏深入研究。因此, 本文在不同天数的饥饿与再投喂组合下, 研究了周期性饥饿再投喂对曼氏无针乌贼幼体的生长、生化组成、氨基酸和脂肪酸的影响, 揭示其适应饥饿胁迫的生理生态学对策, 拟对制定适合曼氏无针乌贼高效投喂策略提供科学依据。
1 材料与方法
1.1 实验材料
实验在浙江省海洋水产研究所西闪试验场完成。实验用曼氏无针乌贼(Sepiella japonica)为本试验场自行繁育的幼体, 体质量为 10.16±0.25g, 胴体长为4.06±0.15cm。幼体乌贼暂养于 15m3水泥池中, 每天投喂两次(08:00, 17:00), 吸污、换水各一次; 暂养7d后, 随机选取240只幼体供作实验。
1.2 实验设计
实验设1个对照组和3个周期性饥饿再投喂组,每组设 3个重复, 每个重复 15只乌贼。实验周期为30d, 实验设计如下:
对照组(C), 饥饿0d, 喂食30d;
S1F5组: 饥饿1d, 喂食5d, 共5个周期;
S2F4组: 饥饿2d, 喂食4d, 共5个周期;
S3F3组: 饥饿3d, 喂食3d, 共5个周期。
实验在 0.8m3的圆形塑料桶中进行, 使用经暗沉淀和沙滤后的自然海水, 盐度为 26.5—27.0, 水温为26.0—27.0℃; 采用自然光照, 微流水充气养殖, 饵料为小个体的脊尾白虾。每天投喂两次(08:00, 17:00),投饵至乌贼不抢食饵料为止, 每天吸污一次。
由于乌贼离水后极易喷墨而造成活力下降, 因此, 该实验的称量过程是先在烧杯中加入少量自然海水去除重量后, 再将乌贼移入带水的烧杯中称量,记录的湿重量即为体质量。
1.3 样品测定
实验开始和结束后分别测定 4个处理组中乌贼体重、胴体长及存活数, 并随机取3只乌贼在冰盘上解剖, 将去掉内脏和海螵蛸后的乌贼躯干在–80℃下保存留作生化分析。
1.3.1 一般生化组成测定 将乌贼样品置于 70℃烘箱中烘干至恒重, 测定水分含量; 采用凯氏定氮法测定乌贼样品粗蛋白含量(粗蛋白含量=总氮含量×6.25); 采用索氏抽提法测定乌贼样品粗脂肪含量;采用马福炉焚烧法(550℃)测定乌贼样品灰分含量。
1.3.2 氨基酸与脂肪酸组成测定 16种氨基酸采用酶水解法测定(Biochrom 30氨基酸自动分析仪),按照GB/T 5009.124-2003执行。半胱氨酸采用氧化水解法测定(Biochrom 30氨基酸自动分析仪), 按照GB/T 18246-2000执行。色氨酸采用碱水解法测定(Agilent 1100高效液相色谱仪), 按照 GB/T 18246-2000执行。脂肪酸采用气相色谱分析法测定(Agilent 6890气相色谱仪), 按照GB/T 22223-2008执行。
1.4 数据计算与方差分析
实验过程中乌贼的相对增长率、相对增重率分别用以下公式计算:
相对增长率(%)=100×(L2– L1)/L1
相对增重率(%)=100×(W2– W1)/W1
式中, L1和L2分别为实验开始和实验结束时乌贼的胴体长(cm), W1和 W2分别为实验开始和实验结束时乌贼的湿重(g)。
所有实验数据均以平均值±标准差(Mean±SD)表示, 用Excel进行整理统计, 采用SPSS 17.0软件进行单因素方差分析, 以Ducan多重比较方法检验组间差异, 以P<0.05为差异显著。
2 结果与分析
2.1 饥饿再投喂对曼氏无针乌贼幼体生长及成活率
的影响
初始体重没有显著差异的 4个实验组(P>0.05),经过5个周期的饥饿再投喂处理后, 在生长性能及成活率方面表现出部分差异。由表1可知, 随着饥饿胁迫时间的增加各生长指标及成活率呈现下降趋势。饥饿时间最长的S3F3组在体重相对增重率、胴体长相对增长率及成活率方面均显著低于饥饿时间较短的S1F5、S2F4组及对照组 C (P<0.05)。但其它两个处理组与对照组C之间没有显著性差异(P>0.05)。说明不同饥饿时间对曼氏无针乌贼幼体的各生长指标及成活率影响显著, 并且饥饿时间越长对生长及成活率越不利。
2.2 曼氏无针乌贼幼体在不同饥饿时间下体组成变化
由表2可知, 实验结束后, 水分含量随着周期性饥饿时间的延长而逐渐升高, S2F4和S3F3处理组均显著高于对照组C (P<0.05); 粗蛋白与粗脂肪含量均随周期性饥饿时间的延长而逐渐降低, S3F3处理组均显著小于对照组C (P<0.05), 且粗蛋白含量下降相对明显; 三个处理组的灰分含量虽有上升趋势, 但均与对照组C差异不显著(P>0.05)。

表1 周期性饥饿再投喂对曼氏无针乌贼幼体生长性能的影响Tab.1 Effects of periodical starvation-refeeding on growth performance of juvenile S. japonica

表2 周期性饥饿再投喂对曼氏无针乌贼幼体生化组成的影响Tab.2 Effects of periodical starvation-refeeding on biochemical composition of juvenile S. japonica
2.3 周期性饥饿再投喂对曼氏无针乌贼幼体氨基酸的影响
由表3可知, 共检出18种氨基酸, 其中必需氨基酸10种, 非必需氨基酸8种。经分析, 三个处理组中仅半胱氨酸(Cys)、色氨酸(Trp)两种氨基酸含量显著高于对照组C (P<0.05), 其余氨基酸均与对照组C差异不显著(P>0.05); 三个处理组中氨基酸总量(T)、必需氨基酸总量(E)及 E/T均与对照组 C差异不显著(P>0.05), 但随周期性饥饿时间的延长, T、E及 E/T数值均有先升高后降低再升高的变化。
2.4 周期性饥饿再投喂对曼氏无针乌贼幼体脂肪酸的影响
由表4可知, 本试验共检测出了18种脂肪酸, 起始碳链长度在14—22之间。其中饱和脂肪酸(SFA) 7种, 单不饱和脂肪酸(MUFA) 3种, 多不饱和脂肪酸(PUFA) 8种。S1F5处理组的饱和脂肪酸(ΣSFA)总百分比显著低于对照组C(P<0.05); 而S2F4和S3F3均与对照组C差异不显著(P>0.05); 三个处理组中单不饱和脂肪酸(ΣMUFA)和多不饱和脂肪酸(ΣPUFA)总百分比均与对照组 C差异不显著(P>0.05)。同时, 三个处理组中Σn-3UFA、Σn-6UFA和Σn-9UFA总百分比也均与对照组C差异不显著(P>0.05)。三个处理组中EPA、DPA和DHA含量均与对照组C差异不显著(P>0.05)。
3 讨论
3.1 关于曼氏无针乌贼幼体补偿生长的实验设计
在自然界中, 曼氏无针乌贼的生长往往会受到饥饿-捕食-再饥饿-再捕食的多重周期性影响;而在其全人工生产过程中, 亦会由于饵料不足、投饵不均等多种因素而同样受到周期性饥饿再摄食的影响。本实验设计是在“饥饿+喂食”总持续时间相等的基础上(楼宝等, 2008a, b), 研究了不同饥饿天数组合对曼氏无针乌贼幼体补偿生长的影响。而饥饿时间长短的设定对补偿生长的研究存在着一定影响, 如虎斑乌贼饥饿3d后相互残杀, 饥饿6d后漂浮在水面上(乐可鑫等, 2016); 青蛤幼虫随着饥饿时间的延长存活率显著下降(杨凤等, 2008)。在实际生产中, 曼氏无针乌贼受到的饥饿时间越长, 相互残食越严重, 成活率则越低。因此, 本实验设计时, 结合前人研究成果及实际生产经验, 将最长饥饿时间设定为3d。
3.2 周期性饥饿再投喂对曼氏无针乌贼幼体生长的影响
根据试验动物在恢复投喂期间的生长率和体重
的变化程度, 可将补偿生长分为四种类型, 即超额补偿生长、完全补偿生长、部分补偿生长和不能补偿生长(谢小军等, 1998)。一般而言, 摄食率和饲料转化率、蛋白质合成率及能量储备的增加被认为是反映试验动物补偿生长的衡量指标(Ribeiro et al, 2010)。本实验中, 考虑到曼氏无针乌贼幼体在受到饥饿胁迫时, 存在相互残食的现象, 因此笔者认为把增重率和成活率作为曼氏无针乌贼幼体补偿生长的衡量指标更为确切。本研究结果表明, 在“饥饿+喂食”总持续时间相等的前提下, S1F5与S2F4组中体重相对增重率、胴体长相对增长率及成活率虽略低于对照组 C,但均与对照组 C差异不显著 (P>0.05), 表明两处理组曼氏无针乌贼幼体均发生了完全补偿生长。在对星斑川鲽(张升利等, 2010)、大菱鲆幼鱼(阿荣等, 2013)等的补偿生长研究中均得到相似结果。同时, 从表 1的研究结果可看出, 曼氏无针乌贼幼体的体重、胴体长、相对增重率及相对增长率均随饥饿时间的延长而降低, 在重复饥饿3d再投喂3d模式下, 曼氏无针乌贼幼体发生部分(有限)补偿生长, 这也暗示如果再增加饥饿时间可能会产生不能补偿生长, 这将对曼氏无针乌贼的工厂化养殖生产非常不利。因此, 在考虑到节约劳动力及降低饵料成本的前提下, 建议曼氏无针乌贼幼体的最佳投喂模式为周期性饥饿2d再投喂4d。
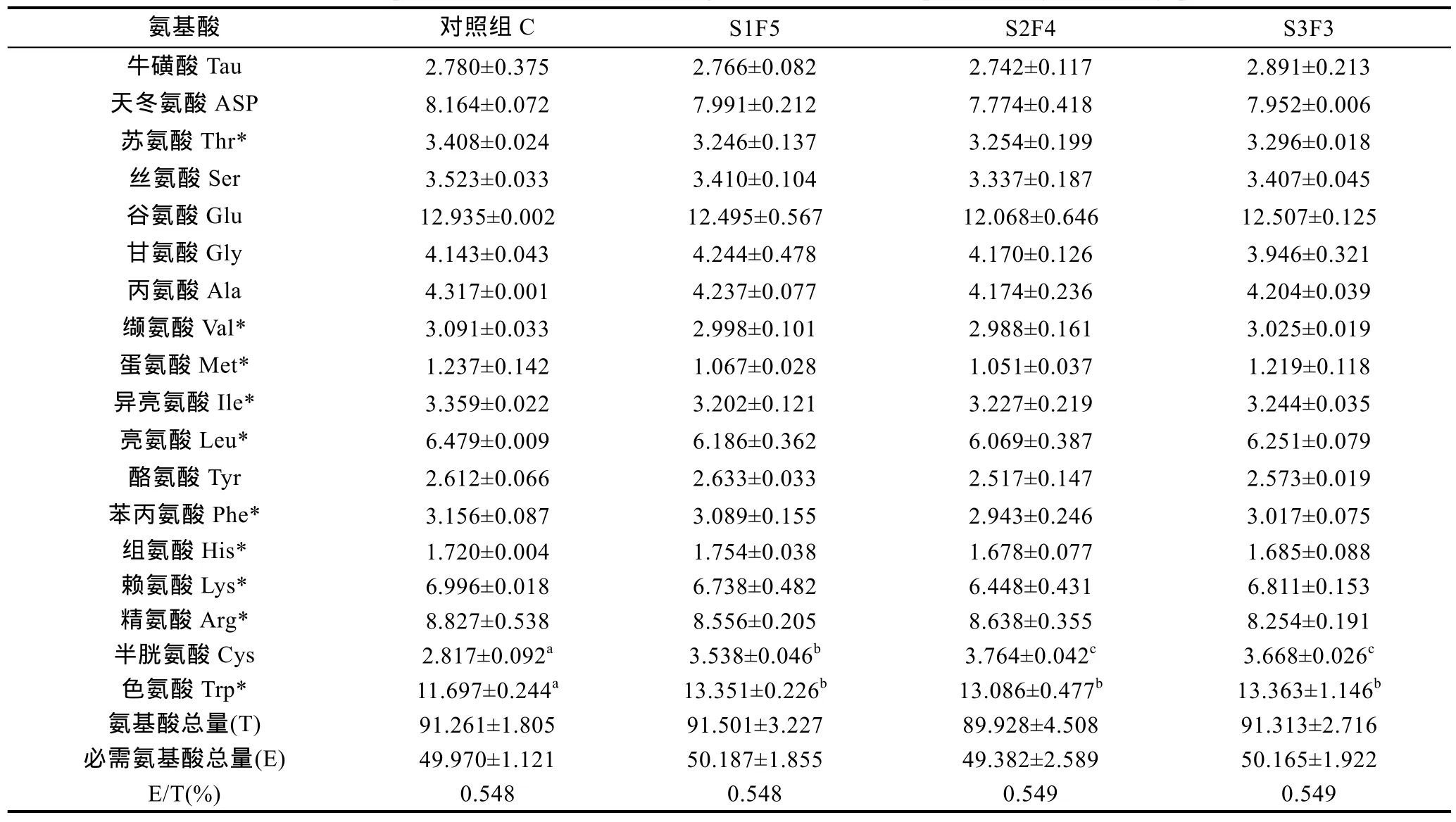
表3 周期性饥饿再投喂对曼氏无针乌贼幼体氨基酸的影响Tab.3 Effects of periodical starvation-refeeding on amino acid composition of juvenile S. japonica
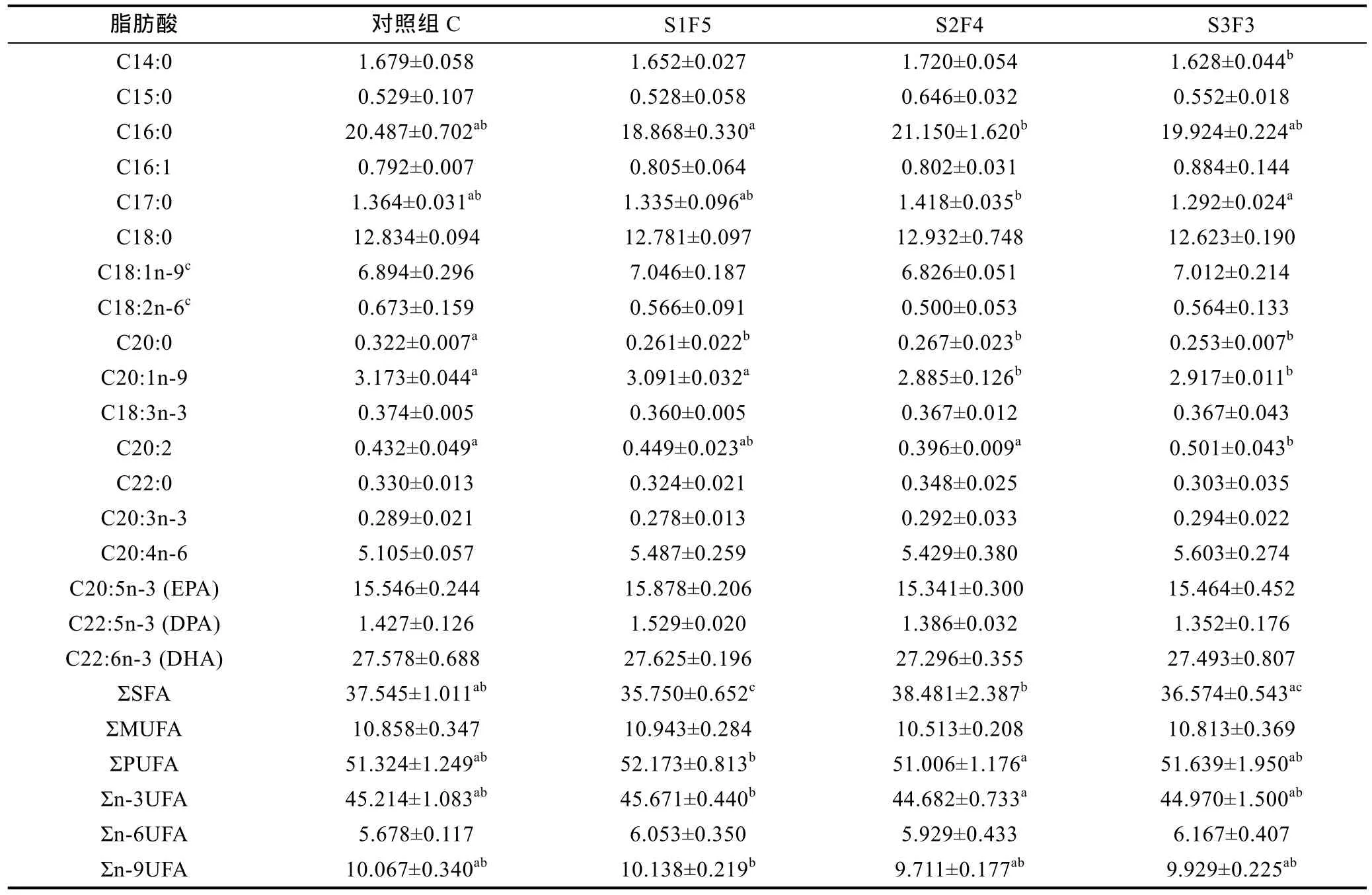
表4 周期性饥饿再投喂对曼氏无针乌贼幼体脂肪酸的影响Tab.4 Effects of periodical starvation-refeeding on fatty acid composition of juvenile S. japonica
3.3 周期性饥饿再投喂对曼氏无针乌贼幼体体组成的影响
在饥饿期间, 水产动物利用其自身储存物质来维持新陈代谢, 不同水产动物对储存能量的利用型式和次序是不同的(Kim et al, 1995)。有的主要以脂肪作为能量来源(林小涛等, 2004; 楼宝等, 2006), 有的主要以糖类作为能量来源(沈文英等, 2003), 也有的主要以蛋白质作为能量来源(Mehner et al, 1994; 阿荣等, 2013)。本研究结果表明, 周期性饥饿再投喂对曼氏无针乌贼幼体灰分含量没有影响。在“饥饿+喂食”总持续时间相等的前提下, 随着饥饿时间的延长,粗蛋白和粗脂肪含量均呈显著下降趋势, 表明曼氏无针乌贼幼体均主要依靠消耗蛋白质和脂肪来维持生命活动; 而粗脂肪含量较粗蛋白含量下降更为明显, 说明曼氏无针乌贼幼体首先消耗脂肪, 随着饥饿时间的延长开始启动蛋白质作为能量来源, 这与胡子鲇(邓利等, 1999)、吉富罗非鱼(秦志清等, 2011)的耗能模式一致。同时, 在周期性饥饿再投喂过程中,水分含量呈现显著上升趋势, 这可能是由于曼氏无针乌贼幼体在饥饿期间主要以粗蛋白和粗脂肪作为能量来源, 使得两者含量相应降低, 从而导致水分含量相应升高。对比4种成分在不同处理组下的含量变化, 可得出曼氏无针乌贼幼体的生化组成均能在短时间(饥饿时间不超过 2d)饥饿再投喂后恢复到对照组C水平, 说明短时间饥饿(饥饿时间不超过2d)不会影响曼氏无针乌贼幼体的营养质量; 而长时间饥饿再投喂(饥饿时间3d以上)时, 则不能恢复到对照组C水平。
3.4 周期性饥饿再投喂对曼氏无针乌贼幼体氨基酸的影响
氨基酸在水产动物的正常生命代谢中起着重要的作用。当水产动物受到饥饿胁迫时, 可利用氨基酸转化成葡萄糖的形式提供能量, 表现为氨基酸总量和必需氨基酸总量均呈现不同程度的下降趋势(Shiau et al, 2001; 柳敏海等, 2009)。然而不同水产动物利用氨基酸的次序也存在差异, 如 大鳍 鱯 受到短期饥饿后, 优先动用必需氨基酸作为能量来源, 而随着饥饿延长, 被优先保留的非必需氨基酸进而参与能量供应(马珊等, 2010)。关于饥饿后再投喂对试验动物氨基酸含量的影响研究报道较少, 本试验针对周期性饥饿再投喂对曼氏无针乌贼幼体氨基酸含量的变化进行了研究。研究结果显示, 三种处理下氨基酸总量和必需氨基酸总量均与对照组C差异不显著, 表明不同的饥饿再投喂组合对曼氏无针乌贼幼体的氨基酸含量没有影响, 这与点带石斑鱼饥饿再投喂后, 各处理组(除饥饿10d以外)与对照组氨基酸含量差异不显著的结果相似(陈波等, 2008)。
鲜味氨基酸包括 2种呈鲜味的特性氨基酸 Asp和Glu, 以及2种呈甘味的特性氨基酸Gly和Ala(李世凯等, 2012)。本研究中, 三种周期性饥饿再投喂处理下4种鲜味氨基酸含量均与对照组C没有显著差异,这也说明周期性饥饿再投喂处理并没有降低曼氏无针乌贼幼体的营养品质。三种周期性饥饿再投喂处理下Cys和Trp含量均显著高于对照组C, 是否由于这两种氨基酸检测方法有别于其余16种氨基酸的检测方法有关, 有待于进一步考证。
3.5 周期性饥饿再投喂对曼氏无针乌贼幼体脂肪酸的影响
饥饿胁迫下水产动物会消耗自身脂肪酸来提供能量, 首先利用的是饱和脂肪酸(SFA), 其次为低不饱和脂肪酸(MUFA), 最后动用高不饱和脂肪酸(PUFA)(柳敏海等, 2009;马珊等, 2010)。关于饥饿后再投喂对试验动物脂肪酸含量的影响研究报道亦较少,本试验研究了周期性饥饿再投喂对曼氏无针乌贼幼体脂肪酸含量的影响。结果表明, 三种不同饥饿再投喂处理下, S1F5组 SFA含量显著低于对照组C(P<0.05), 其余两组与对照组C差异不显著(P>0.05);而三种处理下MUFA、PUFA与对照组C均差异不显著(P>0.05)。结合三种脂肪酸总量的变化可看出, 在周期性饥饿过程中, SFA优先被利用; 随着饥饿时间的延长, SFA与MUFA、PUFA交替作为能量来源, 这与大受到饥饿胁迫时消耗脂肪酸种类的顺序相似(马珊等, 2010)。而S1F5组SFA含量显著低于对照组C, 是否与短时间饥饿胁迫下SFA的优先供能强度有关, 有待于进一步考证。
从主要营养成分的角度分析, 三种周期性饥饿再投喂处理下EPA、DPA和DHA的含量均与对照组C没有差异, 即主要的营养成分没有缺失, 这也说明三种处理对曼氏无针乌贼幼体的主要营养成分无影响。
4 结论
综合上述讨论结果, 在短时间饥饿(S2F4)条件下,不仅对曼氏无针乌贼幼体的营养组成没有产生显著影响, 同时达到了完全补偿生长状态, 而且可有效地降低劳动强度及饵料投喂量, 进而降低生产成本。但是, 在长时间饥饿(S3F3)状态下, 不但降低了曼氏无针乌贼幼体的部分营养质量, 也不利于个体生长。
曼氏无针乌贼在后期养殖过程中主要以摄食杂鱼杂虾为主, 饵料投喂不足, 难以满足正常摄食需求;饵料投喂过量, 残饵、粪便及排泄物等容易引起水质恶化, 引发病害。本实验结论不仅可以科学指导投喂方式, 进而从源头控制养殖污染, 还可以节省劳动力及劳动强度, 以期为曼氏无针乌贼高效投喂模式提供借鉴, 促进曼氏无针乌贼产业的高效健康可持续发展。
马 珊, 姜海波, 姚俊杰, 2010. 短 期饥饿对大生化组成、氨基酸和脂肪酸组成的影响. 水生态学杂志, 3(2): 61—65
王 岩, 2001. 海水养殖罗非鱼补偿生长的生物能量学机制.海洋与湖沼, 32(3): 233—239
尹 飞, 王春琳, 宋微微, 2005. 曼氏无针乌贼幼体生态因子耐受性的研究. 湛江海洋大学学报, 25(4): 39—43
邓 利, 张 波, 谢小军, 1999. 南方鲇继饥饿后的恢复生长.水生生物学报, 23(2): 167—173
史会来, 平洪领, 张 涛等, 2016. 养殖曼氏无针乌贼(Sepiella japonica)的两性异形及判别模式的建立. 海洋与湖沼,47(4): 838—846
乐可鑫, 汪 元, 彭瑞冰等, 2016. 饥饿和再投喂对虎斑乌贼幼体存活、生长和消化酶活力的影响. 应用生态学报,27(6): 2002—2008
乔秋实, 蒋广震, 刘文斌等, 2011. 周期性饥饿再投喂对建鲤(Cyprinus carpio var. Jian)生长、体组成、消化酶的影响.海洋与湖沼, 42(3): 367—373
闫喜武, 姚 托, 张跃环等, 2009. 冬季饥饿再投喂对菲律宾蛤仔生长、存活和生化组成的影响. 应用生态学报, 20(12):3063—3069
李世凯, 江 敏, 戴习林等, 2012. 凡纳滨对虾池塘水质及对虾肌肉品质的对比分析. 上海海洋大学学报, 21(6):955—964
李志华, 谢 松, 王军霞等, 2008. 日本沼虾继饥饿后补偿生长研究. 四川动物, 27(3): 335—339
李君丰, 田贵成, 王万连等, 2007. 饥饿对日本囊对虾补偿生长及生化组成的影响. 大连水产学院学报, 22(1): 67—71
李星颉, 戴健寿, 唐志跃, 1985. 曼氏无针乌贼 Sepiella maindroni de Rochebrune怀卵量及生殖力. 浙江水产学院学报, 4(1): 1—7
杨 凤, 张跃环, 闫喜武等, 2008. 饥饿和再投喂对青蛤(Cyclina sinensis)幼虫生长、存活及变态的影响. 生态学报,28(5): 2052—2059
吴立新, 董双林, 2000. 水产动物继饥饿或营养不足后的补偿生长研究进展. 应用生态学报, 11(6): 943—946
吴常文, 董智勇, 迟长凤等, 2010. 曼氏无针乌贼(Sepiella maindroni)繁殖习性及其产卵场修复的研究. 海洋与湖沼,41(1): 39—46
沈文英, 寿建昕, 2003. 鱼类补偿生长的研究进展. 水利渔业,23(4): 40—42
张升利, 尤宏争, 杨 璞等, 2010. “饥饿—投喂—……”重复处理对星斑川鲽摄食、生长、生化组成以及能值指标的影响.饲料工业, 31(22): 28—33
阿 荣, 吴立新, 姜志强等, 2013. 周期性饥饿再投喂对大菱鲆幼鱼生长、生化组成和能量收支的影响. 大连海洋大学学报, 28(5): 462—467
陈 波, 柳敏海, 施兆鸿等, 2008. 饥饿和再投饲对点带石斑鱼幼鱼脂肪酸和氨基酸组成的影响. 上海水产大学学报,17(6): 674—679
范 帆, 尹 飞, 彭士明等, 2011. 饥饿胁迫对曼氏无针乌贼幼体的影响. 生态学杂志, 30(10): 2262—2268
林小涛, 周小壮, 于赫男等, 2004. 饥饿对南美白对虾生化组成及补偿生长的影响. 水产学报, 28(1): 47—53
柳敏海, 罗海忠, 傅荣兵等, 2009. 短 期饥饿胁迫对 鮸 鱼生化组成、脂肪酸和氨基酸组成的影响. 水生生物学报, 33(2):230—235
秦志清, 林建斌, 樊海平等, 2011. 饥饿和补偿生长对吉富罗非鱼摄食、生长及体成分的影响. 集美大学学报(自然科学版), 16(4): 252—257
唐逸民, 李星颉, 戴健寿等, 1986a. 浙江近海曼氏无针乌贼资源增殖及繁殖保护的研究. 浙江水产学院学报, 5(2):99—104
唐逸民, 吴常文, 1986b. 曼氏无针乌贼生物学特性及渔场分布变化. 浙江水产学院学报, 5(2): 165—170
常抗美, 吴常文, 吕振明等, 2008. 曼氏无针乌贼增养殖的开发与利用研究进展. 中国水产, (3): 55—56
常抗美, 吴常文, 吕振明等, 2009. 曼氏无针乌贼胚胎发育与人工育苗技术的研究. 浙江海洋学院学报(自然科学版),28(3): 257—263
崔奕波, 1989. 鱼类生物能量学的理论与方法. 水生生物学报,13(4): 369—383
章承军, 刘 健, 陈锦辉等, 2010. 饥饿再投喂对缢蛏消化酶活力和抗氧化能力的影响. 水产学报, 34(7): 1106—1112
蒋霞敏, 陆珠润, 何海军等, 2010. 几种生态因子对曼氏无针乌贼野生和养殖卵孵化的影响. 应用生态学报, 21(5):1321—1326
谢小军, 邓 利, 张 波, 1998. 饥饿对鱼类生理生态学影响的研究进展. 水生生物学报, 22(2): 181—188
楼 宝, 毛国民, 骆季安等, 2006. 不同的饥饿时间对黑鲷补偿生长的影响. 浙江海洋学院学报(自然科学版), 25(4):385—389
楼 宝, 史会来, 毛国民等, 2008a. 重复性“饥饿—喂食—再饥饿—再喂食—……”处理对鲈鱼补偿生长的影响. 现代渔业信息, 23(5): 16—18, 28
楼 宝, 史会来, 胡则辉等, 2008b. 饥饿和再投喂对日本黄姑鱼生长及其体生化组成的影响. 水生生物学报, 32(2):280—285
Ali M, Nicieza A, Wootton R J, 2003. Compensatory growth in fishes: a response to growth depression. Fish and Fisheries,4(2): 147—190
Cui Z H, Wang Y, Qin J G, 2006. Compensatory growth of group-held gibel carp, Carassius auratus gibelio (Bloch),following feed Deprivation. Aquaculture Research, 37(3):313—318
His E, Seaman M N L, 1992. Effects of temporary starvation on the survival, and on subsequent feeding and growth, of oyster (Crassostrea gigas) larvae. Marine Biology, 114(2):277—279
Jobling M, Meløy O H, dos Santos J et al, 1994. The compensatory growth response of the Atlantic cod: effects of nutritional history. Aquaculture International, 2(2): 75—90
Kim M K, Lovell R T, 1995. Effect of restricted feeding regimens on compensatory weight gain and body tissue changes in channel catfish Ictalurus punctatus in ponds. Aquaculture,135(4): 285—293
Mehner T, Wieser W, 1994. Energetics and metabolic correlates of starvation in juvenile perch (Perca fluviatilis). Journal of Fish Biology, 45(2): 325—333
Mlglavs L, Jobling M, 1989. Effects of feeding regime on food consumption, growth rates and tissue nucleic acids in juvenile Arctic charr, Salvelinm alpinus, with particular respect to compensatory growth. Journal of Fish Biology,34(6): 947—957
Ribeiro F F, Tsuzuki M Y, 2010. Compensatory growth responses in juvenile fat snook, Centropomus parallelus Poey,following food deprivation. Aquaculture Research, 41(9):e226—e233
Shiau C Y, Pong Y J, Chiou T K et al, 2001. Effect of starvation on free histidine and amino acids in white muscle of milkfish Chanoschanos. Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology,128(3): 501—506
Wang Y, Cui Y B, Yang Y X, 2000. Compensatory growth in hybrid tilapia, Oreochromis mossambicus × O. niloticus,reared in seawater. Aquaculture, 189(1-2): 101—108
Wu L X, Dong S L, Wang F et al, 2001. The effect of previous feeding regimes on the compensatory growth response in Chinese shrimp, Fenneropenaeus chinensis. Journal of Crustacean Biology, 21(3): 559—565
