金乌贼(Sepia esculenta)繁殖模式的分子学鉴定*
2018-01-22汪金海郑小东
汪金海 韩 松, 郑小东①
(1. 中国海洋大学水产学院 青岛 266003; 2. 天津耀华中学 天津 300040)
金乌贼(Sepia esculenta), 俗称乌鱼、墨鱼, 隶属于软体动物门(Mollusca)、头足纲(Cephalopoda)、乌贼目(Sepiida), 自日本海到菲律宾群岛的 40—100m浅海区域均有分布(Okutani, 2005)。在我国, 金乌贼广泛分布于黄海、渤海、东海以及南海海域, 在海洋渔业中占有重要地位。目前有关金乌贼的形态学(郑小东等, 2002; 韩松等, 2010)、胚胎发育(李嘉泳,1965)、人工繁育与营养(郑小东等, 2003; 赵厚钧等,2004)、增殖放流(郝振林等, 2008)以及遗传多样性(Zheng et al, 2007, 2009)等方面已开展了诸多研究,但是有关繁殖方式、交配模式等繁殖行为学研究鲜有报道。
近年来, 由于近海环境恶化和过度捕捞造成我国沿海金乌贼资源量锐减。有效维持甚至提高人工繁育群体的遗传多样性水平, 避免后代因奠基者效应引发自交衰退, 是水产工作者亟需解决的课题。交配期是头足类繁殖行为的重要时期, 时间相对短暂, 却具有复杂的求偶、交配和繁殖策略, 体现了无脊椎动物交配系统和性别决定体系的进化趋势(Hanlon et al,1996)。动物的一雌多雄交配体系, 又称多父本婚配(polyandry), 能够为子代提供诸多的遗传效益(Neff et al, 2005), 显著影响有效种群数量(Karl, 2008), 对于母本的诸多益处主要表现在精子充足, 由于精子竞争而产生更优质后代、获得更优基因以及保障子代具有较高变异以适应环境变化等(Uller et al, 2008)。Sugg等(1994)证实多雄交配模式使参与繁殖的有效雄性数量达到最大化, 从而减缓遗传变异衰退速度,保持物种遗传多样性。Martinez等(2000)研究表明大西洋鲑的多雄交配模式显著增加了有效群体大小, 防止了近交的快速积累。多父本婚配对种群遗传多样性的积极贡献在更多海洋贝类中得到证实(Paterson et al,2001; Brante et al, 2011; Lombardo et al, 2012; Xue et al,2014; 杨智鹏等, 2015)。由此可见, 动物的繁殖策略及方式在维护种群数量起到不可替代的作用。
鉴于此, 本文进行了金乌贼室内繁育, 观察繁殖行为, 同时检测精子多态性, 并通过微卫星 DNA标记技术对亲体和幼体进行亲权鉴定, 旨在确定金乌贼的繁殖模式, 在人工繁育中有效利用多父本交配的遗传规律为渔业管理提供理论支持, 缓解由于过度捕捞带来的资源枯竭。
1 材料与方法
1.1 成体及幼体样本
2009 年 5—7 月, 在青岛海域(35°N, 119°E)捕获金乌贼亲体 22只, 室内圆形水泥池中暂养促熟, 使其交配产卵, 根据形态学判定混养群体中雌性共有 4只(依照死亡先后顺序编号为F1, F2, F8和F18; F1和F2采捕后不久死亡, 未产卵), 雄性18只, 共获得受精卵1000余粒。受精卵于20—24°C水温下培育, 经30d孵化获得金乌贼幼体, 随机选取87只幼体作为子一代, 将幼体置于 95%酒精中固定, 以备 DNA提取用于亲子鉴定。
1.2 精荚采集
从F2个体口膜下方纳精囊处(图1b)取出粘连在上面的精荚 46个, 分别挤压精荚, 将其中的精团放入1.5mL离心管, 提取DNA。

图1 金乌贼交配Fig.1 Mating behavior of S. esculenta注: a. 头对头交配; b. 雌体口膜下方纳精囊(黑色箭头示)
1.3 DNA提取和扩增
采用CTAB法(Winnepenninckx et al, 1993)从0.1g金乌贼成体腕肌肉提取DNA; 幼体DNA采用Chelex法(Li Q et al, 2003)提取; 精荚DNA首先使用含1%二硫苏糖醇(DTT)和PK酶的SDS缓冲液消化(Carter et al,2000), 再按照 CTAB法提取 DNA。微卫星引物选取Zheng等(2007)的 8个位点(编号为 DQ656584,DQ656585, DQ656587—DQ656591, DQ656594)。PCR产物用 6%变性 PAGE电泳, 银染显色, 冰醋酸固定,烘干以读取数据。
1.4 数据分析
精团DNA用8对微卫星引物进行扩增, PCR反应产物通过PAGE电泳展现。最后对比得出与雌性交配的雄性的微卫星片段长度, 一个位点如果发现二个以上不同长度的微卫星片段, 那么就有至少2个雄性金乌贼参与了雌性金乌贼的交配, 从而确定金乌贼的交配方式上是否存在一雌多雄。
同时, 通过相同的引物对金乌贼亲本和幼体DNA模板进行PCR扩增, 扩增产物通过PAGE展现,比对幼体和亲本微卫星 DNA片段长度确定亲本, 从而判定在受精过程中是否存在一雌多雄现象。
以分子量标记物Marker (10bp DNA Ladder)为标准, 利用Labwork4.5软件(Kumar et al, 2004)完成扩增片段大小和基因型读取。
2 结果与分析
2.1 亲权鉴定
根据繁殖行为学观察得知, 其中 42个幼体的母本是F8个体。通过对8个位点的微卫星片段长度对比, 发现其潜在的父本是 M4和 M5(表 1)。32个幼体是由M4受精的, 占总幼体数的76.2%, 另外10个幼体是由M5受精的, 占总幼体数的23.8%(图 2), 两个雄性均在交配结束后死亡。另外45个幼体的母本是F18。通过对各个位点的微卫星片段长度进行对比,发现潜在父本是M12和M13(表 1)。28个幼体是由M12受精的, 占总幼体数的62.2%; 另外17个幼体是由M13受精的, 占总幼体数的37.8%(图2), 两个雄性均在交配结束后死亡。F18产卵孵化出的幼体中, 在Secu75、Secu113两个位点, 还发现除M12和M13以外的其他等位基因(“?”表示, 占总幼体数的2%), 表明可能还存在其他潜在的父本, 由此确定金乌贼在受精过程中存在一雌多雄现象(图2)。

图2 幼体来自不同受精雄性及在总数中所占比例Fig.2 The rates of offsprings fathered by alternative males
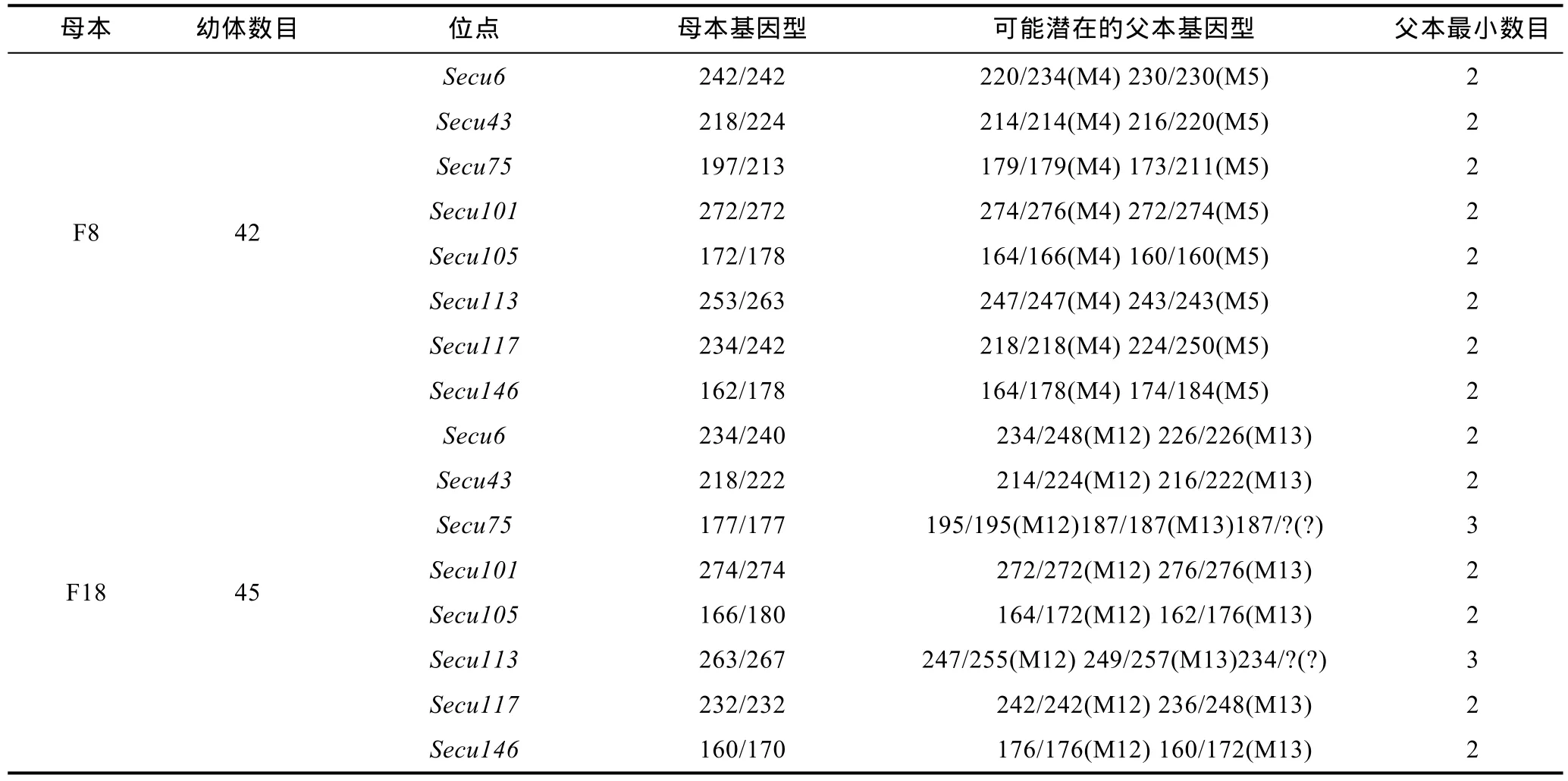
表1 金乌贼潜在父本在8个位点基因型Tab.1 The genotypes of putative possible males for 8 loci in the population of S. esculenta
2.2 精子DNA微卫星分析
采用8个微卫星DNA位点对精荚DNA进行PCR反应, 发现每个位点存在3个等位基因, 表明F8个体与多个雄性交配, 每次交配的精子会储存在纳精囊中, 确定金乌贼在交配方式上存在一雌多雄现象。
3 讨论
3.1 金乌贼繁殖模式
一雌多雄的交配现象在头足类比较常见, 如枪鱿类的 Loligo bleekeri, L. vulgaris, L. reynaudi, L.pealeii通常与多个雄性进行交配, 导致多重亲子关系(Buresch et al, 2001; Shaw et al, 2004; Iwata et al,2005)。在无针乌贼Sepiella japonica中也发现了雌性和多个雄性进行交配的现象(Wada et al, 2006)。虽然Wada等(2005)证实金乌贼在繁殖期, 雄性和雌性都与两个及两个以上的异性交配, 存在“多夫多妻制”,但其实验结果来自行为学观察, 而本实验通过 DNA分子标记技术从亲子鉴定和精子多态性检测两方面相互验证了金乌贼的交配模式。由精子多态性检测结果可知, 雌性获得的精子来自于非单一雄性个体,F18产卵孵化出的幼体中, 在 Secu75、Secu113两个位点, 还发现了除M12、M13以外的其他等位基因(表1), 可能还存在第三个潜在的父本, 这与 Naud等(2005)从精子多态性角度揭示了澳洲乌贼S.apama与2—5个雄性个体交配的实验结果相吻合, 也说明了从精子探索其交配模式的可行性。实验过程中, 我们观察到金乌贼“头对头”交配方式(图 1a), 交配过程中静止不动, 持续时间大约2min 43s, Arakawa(1960)等人也观察到金乌贼以“头对头”方式触腕相互缠绕交配, 整个过程持续超过 2min, 除此之外, “头对头”交配方式在无针乌贼S. japonica (Wada et al, 2006)和乌贼S. officinalis (Hanlon et al, 1999)中也可见到, 但后者交配可持续 10min。实验记录时, 我们根据父本死亡时间先后顺序编号, M4和 M5是 F8子代的父本,M12和M13是F18子代的父本, M4、M5和M12、M13分别是紧紧相邻的参与交配受精的雄性, 观察发现M4、M5; M12、M13的死亡时间临近(M4和M12的死亡时间分别早于 M5和 M13), 由此推测雌性金乌贼接受交配的时间短暂并且集中。
3.2 精子竞争行为
实验结果显示, 相对于M5和M13, M4 (76.2%子代的父本)和M12 (62.2%子代的父本)(图2)拥有更多的子代, 暗示参与受精的精子大部分来自于 M4和M12,这可能与精子竞争行为有关。所谓“精子竞争”,即两个及两个以上的雄性的精子争取和同一卵子受精(Siva-Jothy, 2002), 精子竞争行为与很多生物学因素相关联, 如: 繁殖行为、进化、行为生理学, 其实质上是一种行为学现象, 是一种用来保证自己精子高受精率的繁殖策略(Hanlon et al, 1998)。精子替代是金乌贼的主要精子竞争行为, Wada等(2005)室内观察到金乌贼交配前使用第三对腕刮去雌性口膜纳精囊处精子的行为, 但不同于 S. officinalis (Boal, 1997;Hanlon et al, 1999)和 S. apama (Hall et al, 2002)通过漏斗喷水冲洗残留的精子。S. japonica也习惯在受精之前用右四腕移除口膜附近的精子, 但其移除时间比其他乌贼要短(Wada et al, 2006)。尽管精子移除能够有效的降低精子竞争, 但还是存在大量未除净的精团, 表明精子移除是不彻底的(Wada et al, 2005),物种选择完全或部分移除精子依靠生物和生态变量,比如纳精囊的形态学结构和与雌性的交配时间(Simmons et al, 1998), 金乌贼的精子移除之所以时间短、不完全, 很可能与其争取更多的交配时间、避免竞争者打断交配有关。
当前实验虽没能观察到雄性移除精子的行为,但交配完的雄性没有马上离开, 而是逗留在雌性旁边, 直到雌性产完卵后才离开, 这属于交配后对雌性的临时保护, 有利于阻止其他雄性接近, 同时在保护期间通过多次重复交配增加自身精子储存在雌体的概率, 有效提高受精率(Hall et al, 2002)。虽然有关昆虫精子替代的实验结果表明, 最后与雌性交配的雄性是绝大多数后代的父本, 即“后进先出”原则(Waage, 1979; Simmons et al, 1998), 但是乌贼类精子替代效应尚不清楚。本实验中, 虽然 M4(M12)先于M5(M13)与 F8(F18)完成交配, 但前者拥有更多的子代(图 2), 这并不遵循“后进先出”原则, 其主要原因可能是雄性在转移精子至雌性纳精囊处, 即刻成功完成受精, 大大降低后来竞争者的影响(Wada et al,2005)。除了常见的精子替代行为, Norman等(1999)还观察到一种很有趣的精子竞争现象, 个体小的雄性澳洲乌贼伪装成雌性, 一方面避免参与交配雄性的攻击, 另一方面可以趁外来竞争者来袭时趁机与个体较大的雌性交配, 以获得有效的交配机会。
3.3 雌性选择行为
雌性的选择行为主要包括对雄性和精子的选择,雌性乌贼通过嗅觉暗示来选择雄性个体, 或用喷水、喷墨离开的方式直接拒绝想要接近的雄性(Boal,1997; Boal et al, 1999)。本实验中, 雌性金乌贼选取参与受精的精子均来自纳精囊(图 1), 这与雌性更倾向于利用纳精囊精子有关(Naud et al, 2005; Wada et al,2005)。Naud等(2005)指出澳洲乌贼利用纳精囊精子(首先被利用)的频率是体内受精囊精子的 4倍, 这一选择与这两个储精点的结构和位置有关, 纳精囊位分布于口腔边缘, 较容易利用, 而体内受精囊内的精子利用时须通过孔射出体外, 但当纳精囊精子的数量较低时, 受精囊内的精子将会被利用。另外, 雌性隐秘选择也具有重要作用(Xue et al, 2014)。
4 结论
本研究首次通过 DNA微卫星标记技术, 从分子水平上探索了金乌贼的繁殖模式。精子多态性和亲权鉴定结果显示, 金乌贼的交配模式存在一雌多雄。无论是精子竞争还是雌性选择行为, 都是为了丰富金乌贼多雄的交配模式, 其目的是能获得高质量的可育子代, 从而保证种群的结构稳定和遗传多样性。因此, 金乌贼存在一雌多雄的交配模式对保持种群的基因多样性具有促进作用, 较高的等位基因遗传多样性对种群结构和数量必将起到积极作用(Buresch et al, 2001)。同时, 高频率的多重亲子关系能够有效增加种群的规模和数量, 为数量处于变动中的种群保持一个高水平的基因多样性水平(Zane et al, 1999)。金乌贼种群由于渔业压力和环境因素的影响, 其种群数量处于不断的变动中, 一雌多雄的繁殖模式是对进化、环境压力的适应, 对于确保种群数量和多样性水平起到关键作用。此外,金乌贼种群中是否存在多雌多雄繁育行为,需要进一步观察和验证。
致谢 青岛胶南市海洋与渔业局王承彬副局长在实验场地方面提供了便利, 中国科学院海洋研究所薛东秀博士对本文提出了宝贵意见和建议, 中国海洋大学水产学院钱耀森硕士参与了部分实验工作,谨致谢忱。
李嘉泳, 1965. 金乌贼(Sepia esculenta Hoyle)在我国黄渤海的结群生殖洄游和发育. 见: 太平洋西部渔业研究委员会第六次全体会议论文集. 北京: 科学出版社, 61—92
杨智鹏, 于 红, 于瑞海等, 2015. 中国沿海脉红螺群体遗传多样性及其遗传结构. 水产学报, 39(10): 1443—1449
郑小东, 王如才, 2002. 中国沿海九种头足类齿舌的形态学.水产学报, 26(5): 417—422
郑小东, 杨建敏, 王海艳等, 2003. 金乌贼墨汁营养成分分析及评价. 动物学杂志, 38(4): 32—35
赵厚钧, 魏邦福, 胡 明等, 2004. 金乌贼受精卵孵化及不同材料附着基附卵效果的初步研究. 海洋湖沼通报, 11(3):64—68
郝振林, 张秀梅, 张沛东等, 2008. 金乌贼荧光标志方法的研究. 水产学报, 32(4): 577—583
韩 松, 郑小东, 李 琪等, 2010. 金乌贼(Sepia esculenta)精子超微结构和低温损伤电镜观察. 海洋与湖沼, 41(4):483—488
Arakawa K, 1960. Miscellaneous notes on Mollusca (2): mating and spawning habits of some marine Molluscs. Venus, 21(1):72—78
Boal J G, 1997. Female choice of males in cuttlefish (Mollusca:Cephalopoda). Behaviour, 134(13—14): 975—988
Boal J G, Hylton R A, Gonzalez S A et al, 1999. Effects of crowding on the social behavior of cuttlefish (Sepia officinalis). Contemporary Topics in Laboratory Animal Science, 38(1): 49—55
Brante A, Fernández M, Viard F, 2011. Microsatellite evidence for sperm storage and multiple paternity in the marine gastropod Crepidula coquimbensis. Journal of Experimental Marine Biology and Ecology, 396(2): 83—88
Buresch K M, Hanlon R T, Maxwell M R et al, 2001.Microsatellite DNA markers indicate a high frequency of multiple paternity within individual field-collected egg capsules of the squid Loligo pealeii. Marine Ecology Progress Series, 210: 161—165
Carter K L, Robertson B C, Kempenaers B, 2000. A differential DNA extraction method for sperm on the perivitelline membrane of avian eggs. Molecular Ecology, 9(12):2149—2150
Hall K, Hanlon R, 2002. Principal features of the mating system of a large spawning aggregation of the giant Australian cuttlefish Sepia apama (Mollusca: Cephalopoda). Marine Biology, 140(3): 533—545
Hanlon R T, Ament S A, Gabr H, 1999. Behavioral aspects of sperm competition in cuttlefish, Sepia officinalis (Sepioidea:Cephalopoda). Marine Biology, 134(4): 719—728
Hanlon R T, Messenger J B, 1996. Cephalopod Behaviour.Cambridge: Cambridge University Press, 4—8
Iwata Y, Munehara H, Sakurai Y, 2005. Dependence of paternity rates on alternative reproductive behaviors in the squid Loligo bleekeri. Marine Ecology Progress Series, 298: 219—228
Karl S A, 2008. The effect of multiple paternity on the genetically effective size of a population. Molecular Ecology,17(18): 3973—3977
Kumar S, Tamura K, Nei M, 2004. Integrated software for Molecular Evolutionary Genetics Analysis and sequence alignment. Briefings in Bioinformatics, 5: 150—163
Li Q, Park C, Kijima A, 2003. Allelic transmission of microsatellites and application to kinship analysis in newly hatched Pacific abalone larvae. Fisheries Science, 69(5):883—889
Lombardo R C, Takeshita F, Abe S et al, 2012. Mate choice by males and paternity distribution in offspring of triple-mated females in Neptunea arthritica (Gastropoda: Buccinidae).Journal of Molluscan Studies, 78(3): 283—289
Martinez J L, Moran P, Perez J et al, 2000. Multiple paternity increases effective size of southern Atlantic salmon populations. Molecular Ecology, 9(3): 293—298
Naud M J, Shaw P W, Hanlon R T et al, 2005. Evidence for biased use of sperm sources in wild female giant cuttlefish(Sepia apama). Proceedings of the Royal Society B:Biological Sciences, 272(1567): 1047—1051
Neff B D, Pitcher T E, 2005. Genetic quality and sexual selection:an integrated framework for good genes and compatible genes. Molecular Ecology, 14(1): 19—38
Norman M D, Finn J, Tregenza T, 1999. Female impersonation as an alternative reproductive strategy in giant cuttlefish.Proceedings of the Royal Society B: Biological Sciences,266(1426): 1347—1349
Okutani T, 2005. Cuttlefishes and Squids of the World. Tokyo:National Cooperative Association of Squid Processors, 253
Paterson I G, Partridge V, Buckland-Nicks J, 2001. Multiple paternity in Littorina obtusata (Gastropoda, Littorinidae)revealed by microsatellite analyses. The Biological Bulletin,200(3): 261—267
Shaw P W, Sauer W H H, 2004. Multiple paternity and complex fertilization dynamics in the squid Loligo vulgaris reynaudii.Marine Ecology Progress Series, 270: 173—179
Simmons L W, Siva-Jothy M T, 1998. Sperm Competition in Insects: Mechanisms and the Potential for Selection. London:Academic Press, 341—434
Siva-Jothy M T, 2002. Sperm competition and its evolutionary consequences in the insects. Nature, 417(6885): 122
Sugg D W, Chesser R K, 1994. Effective population sizes with multiple paternity. Genetics, 137(4): 1147—1155
Uller T, Olsson M, 2008. Multiple paternity in reptiles: patterns and processes. Molecular Ecology, 17(11): 2566—2580
Waage J K, 1979. Dual function of the damselfly penis: sperm removal and transfer. Science, 203(4383): 916—918
Wada T, Takegaki T, Mori T et al, 2005. Sperm displacement behavior of the cuttlefish Sepia esculenta (Cephalopoda:Sepiidae). Journal of Ethology, 23(2): 85—92
Wada T, Takegaki T, Mori T et al, 2006. Reproductive behavior of the Japanese spineless cuttlefish Sepiella japonica. Venus,65(3): 221—228
Winnepenninckx B, Backeljau T, De Wachter R, 1993. Extraction of high molecular weight DNA from molluscs. Trends in Genetics, 9(12): 407
Xue D X, Zhang T, Liu J X, 2014. Microsatellite evidence for high frequency of multiple paternity in the marine gastropod Rapana venosa. PLoS One, 9(1): e86508
Zane L, Nelson W S, Jones A G et al, 1999. Microsatellite assessment of multiple paternity in natural populations of a live-bearing fish, Gambusia holbrooki. Journal of Evolutionary Biology, 12(1): 61—69
Zheng X D, Ikeda M, Barinova A et al, 2007. Isolation and characterization of microsatellite DNA loci from the golden cuttlefish, Sepia esculenta Hoyle (Cephalopoda). Molecular Ecology Resources, 7(1): 40—42
Zheng X D, Ikeda M, Kong L F et al, 2009. Genetic diversity and population structure of the golden cuttlefish, Sepia esculenta(Cephalopoda: Sepiidae) indicated by microsatellite DNA variations. Marine Ecology, 30(4): 448—454
