环境光色对白条双锯鱼(Amphiprion frenatus)幼鱼生长和体色的影响*
2018-01-22马本贺孙志宾马爱军李伟业徐志进王孙建华夏丹丹
马本贺 孙志宾 马爱军① 于 宏 李伟业 徐志进王 婷 孙建华 夏丹丹
(1. 中国水产科学研究院黄海水产研究所 农业部海洋渔业可持续发展重点实验室 青岛市海水鱼类种子工程与生物技术重点实验室 青岛 266071; 2. 上海海洋大学水产与生命学院 上海 201306; 3. 青岛海洋科学与技术国家实验室海洋生物学与生物技术功能实验室 青岛 266071; 4. 浙江省舟山市水产研究所 舟山 316111)
白条双锯鱼(Amphiprion frenatus), 隶属于硬骨鱼纲(Osteichthyes), 辐鳍亚纲(Actinopterygii), 鲈形目(Perciformes), 雀鲷科(Pomacentridae), 海葵鱼亚科(Amphiprioninae), 双锯鱼属(Amphiprion), 主要分布在太平洋、红海、印度洋等浅海海域。白条双锯鱼俗称“红小丑”, 是最常见的海水性观赏鱼类, 因体色与红番茄相似, 在欧美地区也被称“番茄小丑”, 因其美丽的外观和较容易饲养的生活习性受到众多海水水族爱好者的青睐。
体型和体色是衡量观赏鱼观赏价值和市场价格的重要因素, 改善体色是观赏鱼养殖中的一项主要目标。观赏鱼的体色主要由类胡萝卜素和黑色素决定,黑色素存在于黑色素细胞中, 包括真黑色素和褪黑色素两种, 由体内酪氨酸酶调控产生。动物自身无法合成类胡萝卜素, 只能靠摄入含有类胡萝卜素的食物来维持机体需要的类胡萝卜素。类胡萝卜素是一类由碳氢链组成的烯烃化合物, 按照分子组成, 类胡萝卜素分为两类, 分别是含氧的叶黄素和不含氧的胡萝卜素。鱼类的体色和遗传、环境、营养等因素均有密切关系。国内外对观赏鱼的体色研究较多,包括鱼类体色改变机理以及改善方法等。Ho等(2013)研究了膳食中添加酯化虾青素对公子小丑鱼(Amphiprion ocellaris)色素聚集、类胡萝卜素积累的变化, 以及类胡萝卜素的各组成成分在公子小丑鱼皮肤中随时间变化的影响。陈超等(2014)研究了工厂化养殖模式下豹纹鳃棘鲈(Plectropomus leopardus)的早期色素转变过程, 并观察了螺旋藻粉和虾青素两种添加剂对其幼鱼生长和体色变化的影响。Ueshima等(1998)通过对孔雀鱼(Poecilia reticulata)皮肤色素细胞的相撞杂交试验, 结果表明黑色素细胞内黑色素受等位基因B和b控制。光照作为一种重要的生态因子, 对养殖鱼类的摄食、运动、代谢、生长、繁殖等一系列的生理生态都有着举足轻重的影响作用。不同生态习性的鱼类对光照的敏感性不同, 根据鱼类感光的界限, 可以把光照趋于分为不良感光区、良好感光区、微弱感光区和不感光区四个部分。光照对养殖鱼类的影响主要表现在光照强度、光色和光照周期(Owen et al, 2010)。促进鱼类养殖健康高效的运行, 前提是必须了解养殖鱼类对光照的适宜范围, 探究养殖鱼类的最适光照环境在实际生产中有着至关重要的积极意义。目前尚未见有关不同色光对白条双锯鱼影响的研究报道。本试验通过研究不同颜色光照对白条双锯鱼幼鱼生长和体色的影响, 以期为白条双锯鱼的健康的人工养殖环境提供理论依据和参考。
1 材料与方法
1.1 实验材料
试验所用白条双锯鱼幼鱼来源于舟山市水产研究所科研基地, 于1000L圆桶中暂养一周, 挑选体重(0.7353±0.1245)g、全长(3.569±0.2995)cm 的幼鱼 150尾, 体型相似、体表无伤痕、摄食及活动正常。
1.2 试验方法
在循环水养殖条件下, 试验设置红色、黄色、蓝色、绿色、白色五个光照组(表 1), 每组三个重复。红色、黄色、蓝色、绿色为试验组, 白色光为对照组。在室内长方形玻璃缸(80cm×50cm×40cm)中进行, 玻璃缸四周用厚遮光纸遮光处理, 上面用硬纸板盖住。每缸内壁贴附三盏3W的 Led射灯。经照度计测量,在中午 12:00, 玻璃缸遮光处理后, 黑暗环境下缸内照度≤10 lx。
1.3 饲养管理
试验开始时, 将150尾规格整齐的白条双锯鱼幼鱼平均分到15个养殖玻璃缸中(图1)。预实验7d, 试验120d。试验期间水温26—28, ℃盐度27—29, pH 8.0—8.4, 溶氧≥6mg/L, 氨氮<0.2mg/L。光照周期为14L : 10D, 光照时间为6:00—20:00; 每天喂食四次,投饵时间分别为: 7:00、10:00、14:00、17:00。11:00和 18:00虹吸残饵粪便, 并加入等量备好的海水, 养殖器具在使用前后消毒清洁。除光照外其他因素保持一致, 每日观察试验的摄食及活动状况。
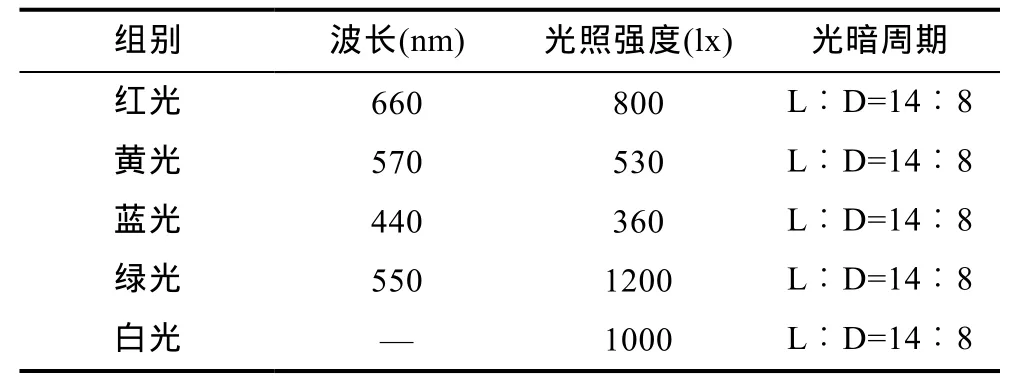
表1 光照试验组Tab.1 The experiment groups of light type

图1 循环水养殖系统模式图Fig.1 Schematic diagram of recirculating aquaculture system
1.4 样品采集与测定
试验结束时, 试验鱼空腹24h后称取重量。每组选取6尾中等体型、健壮活泼的试验鱼, 在冰盘中解剖分别取得红色皮肤(背部)、白色皮肤、肌肉、眼睛、肝脏各组织, 分别称重后放入 1.5mL离心管, 一份加入9倍质量体积比的PBS (pH 7.4), 另一份不作处理,两份样品用液氮迅速冷冻后放入–80℃冰箱保存待测。
1.5 指标测定及方法
1.5.1 生长性能指标
存活率=实验结束时鱼尾数/实验开始时鱼尾数×100%;
增重率= (末体质量–初始体质量)/初始体质量×100%;
特定生长率= (ln末体质量–ln初始体质量)/试验天数×100%;
1.5.2 胡萝卜素含量的测定 应用双抗体夹心法,使用鱼胡萝卜素酶联免疫分析试剂盒测定胡萝卜素含量。用纯化的鱼胡萝卜素抗体包被微孔板, 形成固相抗体, 将含有胡萝卜素的样品依次加入包被单抗的微孔中与辣根过氧化物酶(HRP)标记的胡萝卜素抗体结合, 形成抗体-抗原-酶标抗体复合物, 温育结束用洗涤液彻底洗净后加底物三甲基硼(TMB)显色。三甲基硼(TMB)在辣根过氧化物酶(HRP)的催化作用下转变成蓝色, 最后在酸的作用下转变成黄色。溶液颜色的深浅和样品中的胡萝卜素含量呈正相关关系。
加入PBS的冷冻样品取出融化后, 再加入10倍质量体积比的PBS (pH 7.4), 冰浴匀浆充分后, 低温离心20min (3500r/min), 仔细收集上清液, 以上操作均在冰板上进行。按照试剂盒说明书步骤进行操作,使用酶标仪在 450nm处测定吸光度 OD值。以标准物的浓度为横坐标, OD值为纵坐标绘出标准曲线,由标准曲线计算出样品的胡萝卜素浓度。
1.5.3 叶黄素含量的测定 使用鱼叶黄素(Lutein)酶联免疫分析试剂盒测定叶黄素含量。按照试剂盒说明书步骤进行操作, 使用酶标仪在450nm处测定OD值。以标准物的浓度为横坐标, OD值为纵坐标绘出标准曲线, 由标准曲线计算出样品的叶黄素浓度。
1.5.4 酪氨酸酶活性的测定 取出直接冷冻的组织, 在室温下加入5.0mL的PBS (pH=6.8), 冰浴匀浆充分后低温离心25min (8000r/min), 取上清液作为酪氨酸酶粗提液。酪氨酸酶活性测定参照丁玉庭等(1999)的测定方法并略作修改: 在2.5mL测活体系中,先加入刚配制的 0.5mL 3mg/L的 L-DOPA, 再加入28℃预热的酪氨酸酶粗提液2.0mL。混合后立即用紫外分光光度计于475nm处测定吸光度OD0值, 10min后再次测定各样品的OD10值。
酪氨酸酶活力计算公式:

其中, V为样品体积(mL); T为时间(min)
1.6 数据处理
采用SPSS20.0软件和Microsoft Excel对实验数据进行统计学分析, 结果数值采用“Means±SD”表示,先对数据作单因素方差分析(one-way ANOVA), 组间若有显著差异, 再做 Duncan’s多重比较, P<0.05表示差异显著。
2 结果与分析
2.1 光色对白条双锯鱼幼鱼生长的影响
2.1.1 光色对白条双锯鱼末重的影响 试验结束时, 各光照组试验鱼最终体重均有不同程度的增加,各组体重红光组>黄光组>白光组>蓝光组>绿光组。组间试验鱼最终体重差异显著(P<0.05)。红光组体重最大, 显著高于蓝光组、绿光组(P<0.05)。在黄光、蓝光、绿光和白光各组间无显著性差异(P>0.05)。
2.1.2 光色对白条双锯鱼存活率的影响 由图 3可知, 五组试验鱼成活率均在90%以上, 各组试验鱼成活率不尽相同, 组间白条双锯鱼存活率差异不显著(P>0.05)。根据观察, 在一个群体中, 体型瘦小的小丑鱼偶尔受到雌鱼的追咬, 造成体表伤痕、行动迟缓、背鳍和尾鳍的残缺, 影响正常摄食和生长, 并在一段时间后死去。这种由于小丑鱼群体生活习性导致的致死, 认为与光照因素无直接关系。白条双锯鱼幼鱼在红色、黄色、蓝色、绿色、白色五种光照下均能生存, 光色对白条双锯鱼的存活没有显著影响(P>0.05)。

图2 不同处理组试验鱼最终体重Fig.2 The final weight of different lights in trial fish

图3 不同光色对试验鱼存活率的影响Fig.3 The effects of different light colors on survival rate of trial fish
2.1.3 光色对白条双锯鱼增重率的影响 如图 4,根据试验结果显示: 红光组白条双锯鱼增重率最大,绿光组增重率最小, 增重率由大到小排列顺序为: 红光组>黄光组>白光组>蓝光组>绿光组。红光组、黄光组和白光组增重率分别显著大于蓝光组、绿光组(P<0.05)。红光对白条双锯鱼增重率影响最大, 红光组增重率比蓝光组显著提高 16.96%, 比绿光组显著提高 19.94%; 比黄光组、白光组分别提高 9.14%、8.05%, 差异不显著(P>0.05)。黄光组增重率白光组低1.01%, 两组增重率接近。蓝光、绿光组增重率分别显著低于白光组(P<0.05)。
2.1.4 光色对白条双锯鱼特定生长率的影响 光色对白条双锯鱼特定生长率的影响如图5所示。五组试验鱼特定生长率分别为红光组(0.87±0.05)%/d、黄光组(0.82±0.04)%/d、蓝光组(0.78±0.04)%/d、绿光组(0.82±0.10)%/d、白光组(0.83±0.04)%/d。红光组特定生长率最大, 高于白光组, 其余组均低于白光组; 蓝光组特定生长率最小。各试验鱼组间特定生长率差异不显著(P>0.05)。
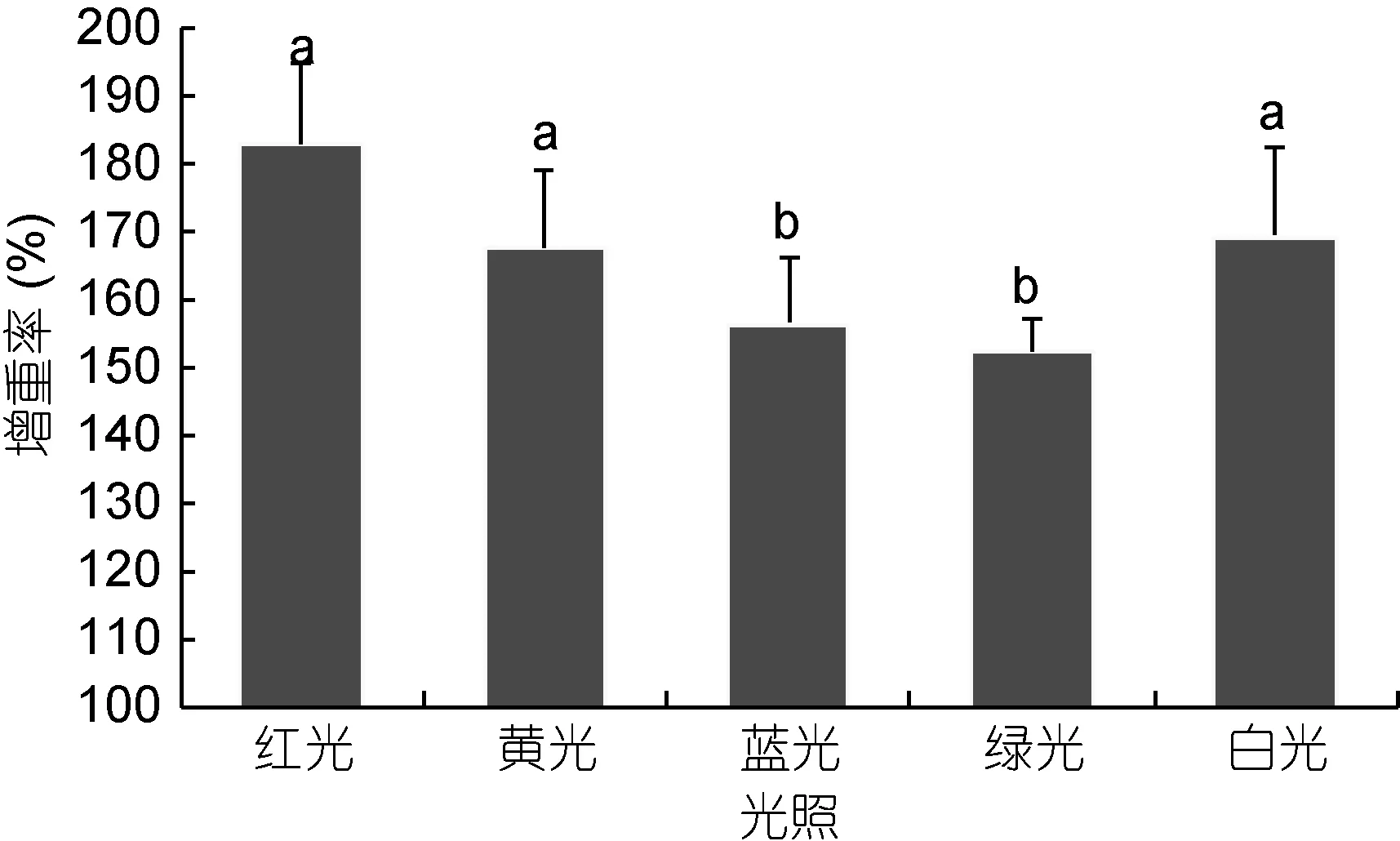
图4 不同光色对试验鱼增重率的影响Fig.4 The effects of different light colors on weight gain rate of trial fish
2.2 光色对眼斑双锯鱼幼鱼体色的影响
2.2.1 光色对白条双锯鱼胡萝卜素含量的影响实验结束时, 各试验组白条双锯鱼红皮、白皮、眼睛、肌肉、肝脏中胡萝卜素平均含量见表2。对红皮中胡萝卜素含量而言, 红光组显著高于黄光、蓝光、绿光三个组(P<0.05); 与白光组差异不显著(P>0.05); 黄光组和绿光组与白光组无显著性差异(P>0.05); 蓝光组显著低于白光组(P>0.05)。白皮中胡萝卜素含量白光组最高, 红光组略低, 绿光组最低; 各组间差异不显著(P>0.05)。眼睛中胡萝卜素含量从高到低依次为白光组、红光组、蓝光组、黄光组、绿光组; 组间差异不显著(P>0.05)。肝脏中胡萝卜素含量各组间差异不显著(P>0.05), 红光组最高, 黄光组次之; 蓝光组、绿光组和白光组三组之间大约持平。肌肉中胡萝卜素含量蓝光组最高, 绿光组最低; 组间差异不显著(P>0.05)。

图5 不同光色对试验鱼特定生长率的影响Fig.5 The effects of different light colors on specific growth rate of trial fish
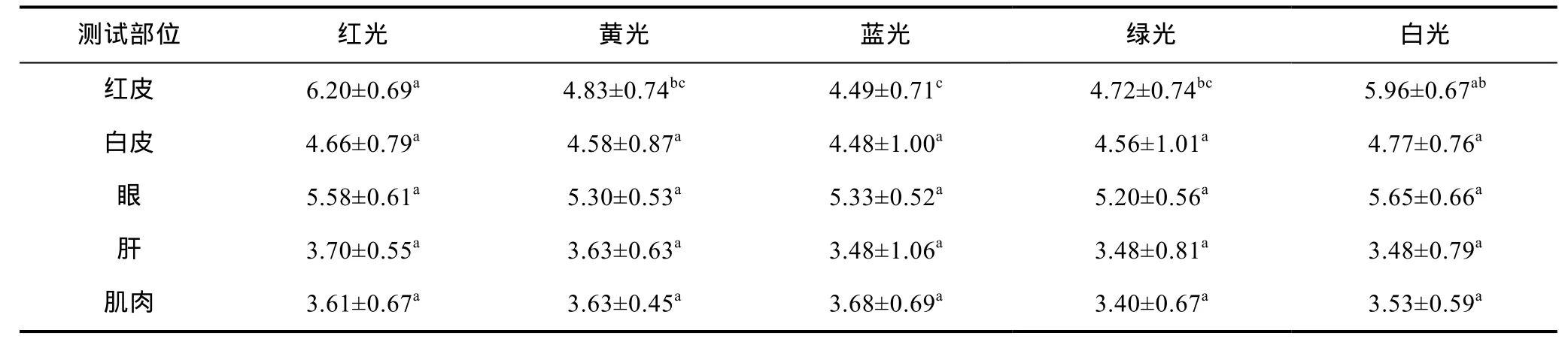
表2 光色对试验鱼胡萝卜素含量的影响(ng/g)Tab.2 The effects of different light colors on carotene of trial fish (ng/g)
2.2.2 光色对白条双锯鱼幼鱼叶黄素含量的影响 根据表3所示结果显示。红皮中叶黄素含量在黄光组最高,达到(1.25±0.29)ng/g, 在白光组最低, 含量为(1.17±0.23)ng/g。白光组的白皮中叶黄素含量高于其他光照组白皮中叶黄素含量。眼睛中叶黄素含量黄光组最高, 蓝光组最低。肝脏中叶黄素含量各试验组基本持平。肌肉中叶黄素含量: 白光组>黄光组>红光组>蓝光组>绿光组。在本试验中光色对白条双锯鱼叶黄素含量无显著性影响(P>0.05)。
2.2.3 光色对白条双锯鱼幼鱼酪氨酸酶活性的影响各组试验鱼酪氨酸酶活性的差异见表4。在皮肤、眼睛、肌肉组织中, 各试验组间酪氨酸酶活性无显著性差异(P>0.05)。在肝脏中, 白光组酪氨酸酶活性最高(22.23±2.18)U/mL, 最低为红光组的(18.18±2.03)U/mL,比白光组显著降低 22.3%(P<0.05); 其他组之间无显著性差异(P>0.05)。光色对试验组间不同组织酪氨酸酶活性的影响不同。
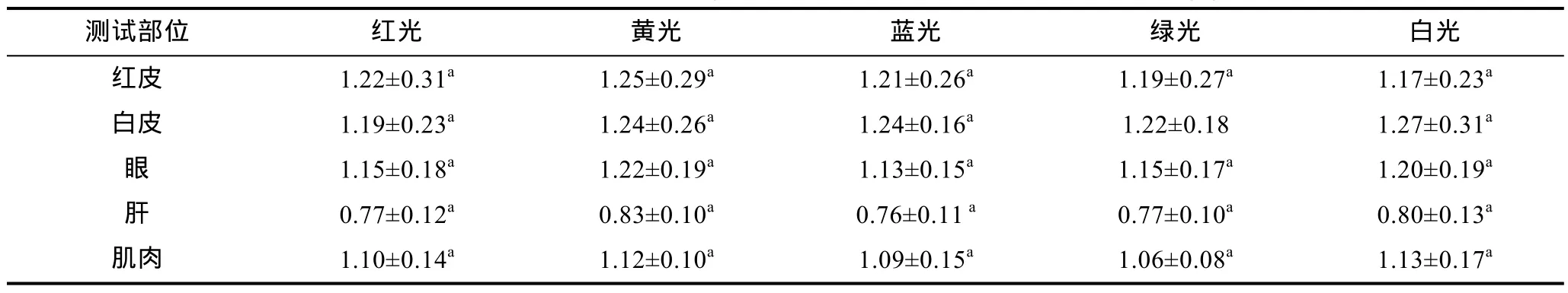
表3 光色对试验鱼叶黄素含量的影响(ng/g)Tab.3 The effects of different light colors on lutein content of trial fish (ng/g)
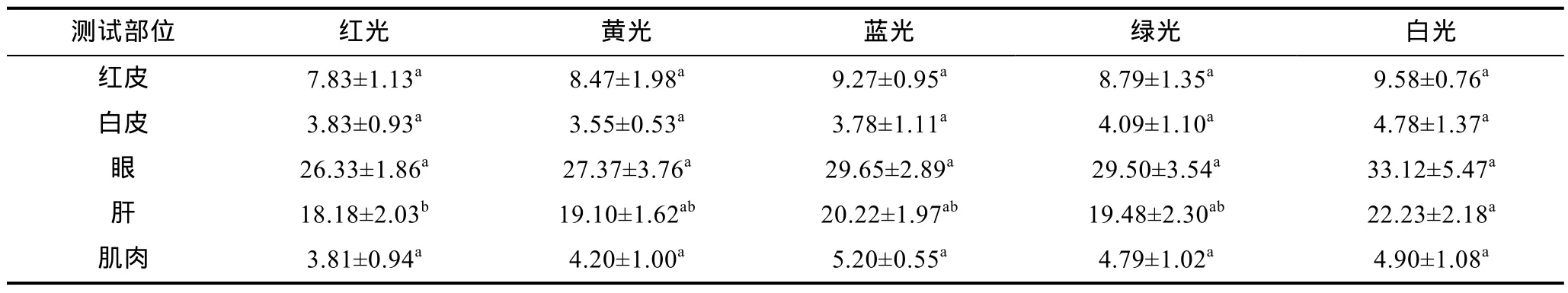
表4 光色对试验鱼酪氨酸酶活性的影响(U/mL)Tab.4 The effects of different light colors on tyrosinase activity of trial fish (U/mL)
3 讨论
3.1 光色对白条双锯鱼幼鱼生长的影响
光色作为重要的环境因子, 对水生动物摄食、行为、生理生殖各方面有着重要的作用。不同单色光的中心波长不同, 按波长大小划分顺序依次为: 红光>橙光>黄光>绿光>蓝光>紫光。其中紫色光波长短, 能级高, 不利于水生动物的正常生长发育。水生动物对光照环境做出的行为反应可概括为“趋光性”和“避光性”, 也称为“正趋光性”和“负趋光性”。曼氏无针乌贼(Sepiella maindroni)(王萍等, 2009)对红光和绿光的趋光率明显高于白光和橙光。刺参(Stichopus japonicus)(隋佳佳, 2008)对橙色、黄色光表现出正趋光性, 对蓝色、绿色光表现出负趋光性; 在红光照射下得特定生长率显著高于绿色光照下(P<0.05)。同一种类个体在不同的生长阶段对光色的敏感性也有差别。龙虾(Palinuridae)( Fanjul-Moles et al, 1992)具有两套独立的感光系统, 分别对应着短波感应和长波感应, 感光系统会随着生长而发生变化, 导致在发育前期和发育后期对光色的选择性不同。在不同密度下, 养殖对象对光色的适应性也有所改变。Karakatsouli等(2010)发现在鳞鲤(Cyprinus carpio)的循环水养殖模式下,红光对低密度养殖有利, 蓝光则有助于高密度养殖。在自然光、黄光、蓝光、绿光四种环境中, 中国明对虾(Fenneropenaeus chinensis)在自然光下特定生长率最大; 在蓝光下摄食率最大, 但是特定生长率最小;王芳(2004)认为中国明对虾在蓝光下食物转化效率低下, 加之大部分的能量通过动能消耗导致了生长速度显著低于其他试验组。
试验鱼在不同光色环境中的反应不同, 在初次光照时应激反应最为明显。白光组试验鱼多聚集在中下层或底层游动, 远离光源; 红光下试验鱼的反应和白光组相似; 蓝光组和绿光组试验鱼大部分在中上层聚集; 黄光组试验鱼分布比较均匀, 无明显聚群现象。经过数小时后, 各组试验鱼对光照的反应逐渐减弱, 直至消失。试验结果表明白条双锯鱼在不同颜色光照下均能保持较高的存活率。光色对增重率有重要影响, 适当的红色光照可以促进增重率的提高。各试验组中红光组试验鱼特定生长率最大, 高于自然光照组; 蓝光组试验鱼的特定生长率最低。本试验中特定生长率各组间无显著性差异(P>0.05), 这可能与白条双锯鱼特殊的生态习性有关, 在一个群体中个体强壮的两条幼鱼分别迅速发育为雌鱼和雄鱼, 性别分化的亲鱼会抑制群体中其他鱼类的生长发育, 导致各组试验鱼的特定生长率相似。相比较而言, 白条双锯鱼幼鱼在红光中更有宜于生长。
3.2 光色对白条双锯鱼幼鱼体色的影响
体色对于水生动物捕食、求偶、伪装、警戒、调节等有重要的作用( Sköld et al, 2013)。鱼类体色由色素细胞和色素含量决定, 控制体色的因素分为内源性因素和外源性因素两大类。水产动物体色变化分为形态学变化和生理学变化。水产动物体表色素主要由黑色素和类胡萝卜素构成, 黑色素的生物合成是由酪氨酸酶催化体内酪氨酸羟化而启动的一系列生化反应过程, 酪氨酸酶活性是黑色素生成能力的间接反映。类胡萝卜素则通过摄食积累在体内, 鱼类对类胡萝卜素的代谢有两种类型。投喂增色饲料可以在不同程度上改善鱼类体色。用添加虾青素的饲料投喂虹鳟(Oncorhynchus mykiss)(Nickell et al, 1998)可使其肌肉中类胡萝卜素含量显著高于普通饲料组。刘浩亮(2013)通过对红罗非鱼(Red Tilmpa)投喂不同增色饲料发现不同的添加剂对组间试验鱼体色的影响效果差异显著; 组内试验鱼类胡萝卜素含量和酪氨酸酶活性具有组织差异性; 红罗非鱼皮肤中类胡萝卜素和酪氨酸酶活性呈负相关关系。Ho等(2013)对一月龄公子小丑鱼幼鱼每天投喂含有不同浓度虾青素的饲料, 虾青素的浓度依次为: 40、60、80、160mg/kg, 饲养90d后发现投喂80和160mg/kg虾青素饲料的试验鱼比投喂低含量虾青素饲料的试验鱼在体色上有显著改善。周邦维(2014)研究了豹纹鳃棘鲈在红光、蓝光、全黑暗和昼夜光四种光照下皮肤色素的变化, 发现该鱼皮肤中胡萝卜素含量、叶黄素含量、黑色素含量均在昼夜光中达到最高, 并且黑色素含量和胡萝卜素含量出现同幅增减的关系。本试验中白条双锯鱼皮肤中胡萝卜素在红光中含量高于其他光照组; 叶黄素含量酪氨酸酶活性在各组间差异不显著。组内不同组织间色素沉积和酪氨酸酶活性差异显著。光色对鱼类色素的影响是一个缓慢的过程, 其调控机制有待进一步研究。在本试验中, 红光能促进白条双锯鱼类胡萝卜素在体内的累积, 有利于体色的改善。
丁玉庭, 杨更生, 1999. 外加因子对黑豚皮酪氨酸酶活性的影响. 食品科学, (4): 12—14
王 芳, 2004. 光照对中国明对虾(Fenneropenaeus chinensis)生长的影响及其机制. 青岛: 中国海洋大学博士学位论文,28—41
王 萍, 吴常文, 童懿宏, 2009. 光照对曼氏无针乌贼行为习性的影响. 河北渔业, (11): 3—6
刘浩亮, 2013. 饲料色素对红罗非鱼类胡萝卜素含量和酪氨酸酶活力影响的研究. 南京: 南京农业大学硕士学位论文,15—24
陈 超, 吴雷明, 李炎璐等, 2014. 豹纹鳃棘鲈(Plectropomus leopardus)早期形态与色素变化及添加剂对其体色的影响.渔业科学进展, 35(5): 83—90
周邦维, 2014. 主要营养素源及光色对工业养殖豹纹鳃棘鲈生长、肤色及生理指标的效应研究. 青岛: 中国科学院研究生院(海洋研究所)硕士学位论文, 55—60
隋佳佳, 2008. 光色对刺参(Apostichopus jponicus)行为、生长以及不同规格刺参代谢的影响. 青岛: 中国海洋大学硕士学位论文, 32—39
Fanjul-Moles M L, Miranda-Anaya M, Fuentes-Pardo B, 1992.Effect of monochromatic light upon the erg crcadian rhythm during ontogeny in crayfish (Procambarus clarkii).Comparative Biochemistry and Physiology Part A:Physiology, 102(1): 99—106
Ho A L F C, O’Shea S K, Pomeroy H F, 2013. Dietary esterified astaxanthin effects on color, carotenoid concentrations, and compositions of clown anemonefish, Amphiprion ocellaris,skin. Aquaculture International, 21(2): 361—374
Karakatsouli N, Papoutsoglou E S, Sotiropoulos N et al, 2010.Effects of light spectrum, rearing density and light intensity on growth performance of scaled and mirror common carp Cyprinus carpio reared under recirculating system conditions. Aquacultural Engineering, 42(3): 121—127
Nickell D C, Bromage N R, 1998. The effect of timing and duration of feeding astaxanthin on the development and variation of fillet colour and efficiency of pigmentation in rainbow trout (Oncorhynchus mykiss). Aquaculture,169(3—4): 233—246
Owen M A G, Davies S J, Sloman K A, 2010. Light colour influences the behaviour and stress physiology of captive tench (Tinca tinca). Reviews in Fish Biology and Fisheries,20(3): 375—380
Sköld H N, Aspengren S, Wallin M, 2013. Rapid color change in fish and amphibians-function, regulation, and emerging applications.Pigment Cell & Melanoma Research, 26(1): 29—38
Ueshima G, Nakajima M, Fujio Y, 1998. A study on the inheritance of body color and chromatophores in the guppy Poecilia reticulata. Tohoku Journal of Agricultural Research,48(3—4): 111—122
