水稻耐金属离子胁迫的QTL分析
2018-01-22林晗徐江民胡瑚倩郑安徐婉璐漏平王跃星曾大力饶玉春
林晗 徐江民 胡瑚倩 郑安 徐婉璐 漏平 王跃星 曾大力,* 饶玉春, ,*
水稻耐金属离子胁迫的QTL分析
林晗1, #徐江民1, #胡瑚倩1, #郑安1徐婉璐1漏平1王跃星2曾大力2,*饶玉春1, 2,*
(1浙江师范大学 化学与生命科学学院, 浙江 金华 321004;2中国水稻研究所 水稻生物学国家重点实验室, 杭州 310006;#共同第一作者;*通讯联系人, E-mail: dalizeng@126.com; ryc@zjnu.cn )
本研究旨在筛选与水稻苗期耐不同金属离子连锁的分子遗传标记,为探讨水稻耐不同金属离子胁迫的遗传研究提供参考。以典型籼粳交(春江06/台中本地1号)双单倍体(DH)群体为材料,系统考查该群体及其双亲耐4种金属离子(Fe2+、Cd2+、Al3+、Na+)胁迫的情况,利用业已构建并完善的该群体加密的分子连锁图谱,对耐这4种金属离子胁迫的QTL进行检测分析。另外,利用实时定量PCR技术检测处理前后相关基因的表达变化情况。发现耐各种金属离子胁迫的QTL共8个,分别位于水稻第1、2、4、6、9、10和11染色体上,其中Fe2+处理后检测到的QTL贡献率最大,达到24.47%(阈值为7.78),位于第1染色体上RM1297-RM1061,同时对该区间与耐胁迫相关基因的表达分析发现这些基因在处理前和处理后表达水平存在不同程度的差异;Cd2+处理后检测到1个QTL,位于第1染色体上;Al3+处理后检测到QTL共5个,分别位于第2、4、6、10、11染色体上;Na+处理后检测到QTL有1个,位于第9染色体上。根据不同金属离子胁迫处理后DH群体的表型差异进行QTL分析,发现耐各种金属离子胁迫的QTL共8个,并初步定位于各染色体的遗传标记区间,这为精细定位并克隆相应QTL,进而探明水稻耐金属离子胁迫QTL的分子调控机制奠定了基础。
水稻;抗性;金属胁迫;QTL分析
水稻是主要粮食作物,其产量和质量对国家粮食安全和社会稳定发展至关重要[1-3]。20世纪以来,随着人口数量大幅增长,工业生产规模的不断扩大,城市化的快速发展,农业生产中化肥、农药等的应用,土壤重金属污染现象日趋严重,其中包括Cu2+、Fe2+、Al3+、Cd2+、Na+等金属离子对作物产量的影响。研究表明,我国目前有近2000万hm2的农田存在重金属污染问题,全国每年因重金属污染而减产粮食1000多万t,经济损失至少200亿元[4]。作为一类持久性潜在有毒污染物,稻田金属离子污染不仅导致水稻生长发育受阻,影响水稻的加工和食味品质[5],更为严重的是有毒金属在水稻体内大量累积,可能污染食物链并危及生态安全,对人和动物的生命和健康构成严重威胁[6]。
稻田金属污染治理目标,尤其是重金属离子,不仅要控制它的来源,减少工业废水、废渣等的排放,加强环境监测,抑制金属对水稻的毒害,提高其产量,更重要的是减少它对各金属元素的吸收,抑制其进入食物链[7-8]。要实现这一目标,就必须了解水稻对土壤各金属元素吸收、运输和分配的规律及其机理;另一方面应加强相关基因或相关抗性QTL的鉴定、分离、克隆、组织结构及其启动子活性研究,以便利用基因工程的方法改良水稻的耐金属能力[9-10]。目前,对于水稻耐金属相关的研究鲜有报道。在亚铁毒害方面,研究者主要是通过株高、根长、根鲜质量、叶片棕色化及叶绿素含量等指标来评价水稻的耐受性,目前,报道的与耐铁毒害相关的QTL有2、、、等[11]。在植物镉耐性方面的QTL分析较少,骆旭添[12]利用Lemont/Dular重组自交系(RIL)群体对水稻耐镉性进行QTL分析,结果检测到27个与耐镉相关的QTL位点,其中有16个为加性位点,6个为上位性及其与环境互作位点,有12个集中于第1染色体上。此外,Ueno等[13-14]报道了一个控制镉含量相关的基因,其编码了一个重金属ATP酶家族运输蛋白,该基因通过控制Cd的转运来调控植株体内镉的含量。在耐盐研究方面,目前共检测到900多个耐盐相关的QTL,但目前报道的精细定位或图位克隆的QTL主要有位于水稻第1染色体上的和两个位点[15],基因编码HKT(High-affinity K+transporter)家族的离子转运蛋白(OsHKT1;5),主要存在于水稻根的木质部薄壁细胞中,具有专一性运输Na+的功能[16];是同时控制水稻植株Na+、K+含量和Na+/K+的主效QTL[17]。另外,随着分子生物学及图位克隆的发展,一些耐盐突变体逐渐被挖掘,有些已经被精细定位,其作用机制也已明晰,如、、、和等。耐铝性研究也是随着现代化工业废水污染而被研究者所重视,一些控制水稻耐铝的相关基因也逐步被发现,并且这些基因的功能以及缓解水稻铝毒害的途径也逐步被认知,如、、、、和等。编码核苷酸结合结构域,编码跨膜结构域,二者形成的复合物是一种功能类似于细菌型ABC转运子。这个转运子特异性转运尿苷二磷酸葡萄糖(UDP-glucose),为水稻去铝毒所必需[18]。是一个特异参与抗铝毒过程的转录因子,它通过调控下游的包括所有以上抗铝毒基因在内的31个基因的表达来解铝毒[19]。是影响水稻铝耐性的重要基因,其编码的蛋白质与柠檬酸的转运相关[20]。基因编码的转运体主要在水稻根尖细胞的细胞膜上表达,能将外界的铝离子转运至细胞内,从而增加细胞内的铝含量[21]。编码的ABC转运体主要在植物根部细胞的液泡膜上表达,能将植物中的铝转运至液泡中固定,从而减轻铝毒[22]。前期我们分析了水稻耐Cu2+胁迫的QTL定位,共检测到7个与铜胁迫有关的QTL,分别位于水稻第1、2、3和7染色体上,其中贡献率最大的QTL为第2染色体上的,变异解释率为14.60%[23]。虽然近年有关水稻中耐金属基因QTL定位的研究取得了一定的进展,但由于水稻抗逆性的遗传机理较为复杂,存在着复杂的上位性互作等遗传机制,且所检测到的耐金属离子胁迫的QTL的贡献值较小,所以对耐各种金属离子胁迫相关基因的精细定位和克隆研究一直进展较慢。
本研究利用一对典型的籼粳交F1经花药培养产生的双单倍体(DH)群体,用不同浓度Fe2+、Al3+、Cd2+、Na+溶液处理两亲本,找出使某个相关性状的量化值差异最大的浓度,随后用该浓度同样处理DH群体,对各个子代该性状的量化值进行统计分析,并利用业已构建的分子连锁图谱进行QTL区间分析,旨在揭示水稻耐各种金属离子的遗传机制,为精细定位并克隆相关基因奠定基础,并为构建耐金属离子水稻品种提供参考。
1 材料与方法
1.1 实验材料
亲本为粳稻品种春江06和籼稻品种台中本地1号(TN1)。两个亲本杂交后,对F1进行花药离体培养,再经化学试剂秋水仙素处理,共获得纯合、稳定的二倍体(DH系)120个株系,组成DH群体。
1.2 水稻种子的萌发与培养
取亲本水稻种子进行表面消毒(70%酒精2 min,10% NaClO 30 min),再用去离子水冲洗数次,水中浸种2 d,中途换水一次。再在37℃培养箱催芽2 d,挑选露白一致的种子播种于PCR板内并移入光照培养箱内水培,14 h光照/10 h黑暗培养,用于后续的逆境胁迫处理实验。
1.3 四种金属离子最佳胁迫浓度的确定
四种金属离子的胁迫选用3叶期且长势较一致的幼苗各10株。将FeSO4母液配制成0、0.25×103、0.75×103、1.25×103、1.75×103、2.5×103mg/L六个浓度梯度,以无菌水为对照。pH维持在4.5~5.0之间,光照培养箱里胁迫培养4 d,测量根长,计算根相对伸长率,当根的相对伸长率接近50%时的处理浓度确定为最佳胁迫浓度[3]。CdCl2母液配制成0、1、5、10、25、50 μmol/L六个浓度梯度,以无菌水为对照,调节pH为5.0~5.1,光照培养箱里胁迫培养4 d后测量根长,计算根相对伸长率[24]。AlCl3母液配制成0、25、50、100、200 μmol/L五个浓度梯度,以无菌水为对照。光照培养箱下胁迫培养4 d后测量根长,计算根相对伸长率[20]。NaCl母液配制成0、60、100、140、180、220 mmol/L六个浓度梯度[25],以无菌水为对照。光照培养箱里胁迫培养3 d后,以叶片1/2以上面积枯黄作为幼苗枯死标准,统计幼苗枯死率。
1.4 DH群体耐不同金属离子胁迫的考查
取DH群体各株系水稻种子500粒萌发,萌发后播种于PCR板内并移入光照培养箱内水培,3叶期开始处理,为了保证处理前幼苗生长状态的一致性,挑选长势一致且无明显差异的幼苗进行胁迫处理。依据各金属离子处理亲本时的流程来处理DH群体各株系,Fe2+和Cd2+胁迫处理后测定并统计子代根长,Al3+胁迫处理后统计子代根相对伸长率及平均伸长量,Na+胁迫处理后统计子代枯死率。
1.5 连锁图谱的加密和QTL定位
在本实验室前期构建的分子连锁图谱的基础上,又在遗传距离较大的标记区间内,开发新的标记,进一步完善DH群体的分子标记连锁图谱。从中选取178个均匀分布在12条染色体上的标记构建连锁图谱,该连锁图谱总共覆盖1674.80 cM,平均图距为9.44 cM。利用该加密后的分子连锁图谱进行QTL区间作图分析,采用软件MapMaker/Exp 3.0b和MapMaker/QTL 1.1B对4种金属离子胁迫的表型数据进行了QTL分析。以检出限(LOD) 2.5作为阈值,若标记区间LOD≥2.5,则认为该区间LOD值的最高处对应的位点为该性状的1个QTL。同时,计算了QTL对各金属抗性的贡献率和加性效应。
1.6 基因表达定量分析
取铁离子胁迫处理4 d和未处理的两亲本水稻叶片,叶片总RNA的提取按照植物总RNA提取试剂盒(RNeasy Plant Mini Kit, QIAGEN,Cat No.74904)说明书进行;按照逆转录试剂盒(ReverTra Ace®qPCR RT Kit, TOYOBO, Cat No. FSQ-101)说明书反转录成cDNA。根据QTL结果在第1染色体的区间内,通过水稻基因组数据库(http://rice. plantbiology.msu.edu/)的数据信息我们挑选了与胁迫相关的预测基因。相关引物序列见表1。利用实时荧光定量PCR(qRT-PCR)方法,分析各基因在两亲本处理前和处理后的表达差异。以作为内参基因,每个反应做3个平行复孔,采用2方法进行相对定量分析[26],重复做3次独立反应。实时PCR仪器为7500实时PCR体系(Applied Biosystems, Life Technologies)。对所得到的实验数据通过Excel和SPSS 19.0软件进行统计分析,采用检验比较不同数据间的差异。qRT-PCR体系(20 μL)包括cDNA模板2 μL,SYBR qPCR混合液(TOYOBO) 10 μL,正反引物(10 μmol/L)各0.8 μL,ddH2O补足至20 μL。qRT-PCR扩增程序如下:95℃下30 s;95℃下5 s;55℃下10 s;72℃下15 s,40个循环。

表1 实时荧光定量PCR的引物序列
2 结果与分析
2.1 四种金属离子最佳胁迫浓度的确定
两个亲本水稻经FeSO4梯度浓度胁迫处理,以无菌水为对照,观察亲本之间表型差异,计算得出每个胁迫浓度下的根相对伸长率。从表型性状来看,春江06叶片发黄甚至变焦黑,受胁迫表现明显,而TN1长势良好几乎不受亚铁胁迫影响。从数据上看,1.75×103mg/LFe2+胁迫下水稻根相对伸长率最接近50%,因此确定该浓度为最佳胁迫浓度(图1-A)。CdCl2梯度浓度和无菌水处理双亲4 d之后,计算每个胁迫浓度下的相对根伸长率。结果表明,双亲在5.0 μmol/L Cd2+处理下差异最显著(图1-B),此时春江06的相对根伸长率为31.68%,受害明显,TN1为84.76%与无菌水处理下的根伸长率差不多,几乎不受Cd2+胁迫,因此确定该浓度为最佳胁迫浓度。经Al3+浓度梯度处理亲本幼苗4 d后,发现以50 μmol/L胁迫处理时两亲本之间出现最大差异(图1-C),TN1也表现出更耐铝毒,因而确定50 μmol/L为最佳胁迫浓度。用6个梯度浓度的NaCl溶液对双亲进行胁迫处理,结果表明经0.14 μmol/L Na+胁迫处理后的枯死率差异显著(图1-D),此时春江06与TN1枯死率差值最大为43.75百分点。
2.2 DH群体耐各金属离子胁迫的考查
利用四种金属离子的最佳胁迫浓度(1.75×103mg/L FeSO4、5.0 μmol/L CdCl2、50 μmol/L AlCl3、0.14 μmol/LNaCl)胁迫处理整个DH群体的后代各株系,并系统考查了DH群体萌发期对应表型值数据和相关参数的测定和记录,同时用灭菌水处理作对照。根据后代的表型值,发现120个DH株系对各金属离子胁迫的耐受性表现为连续正态分布(图2),并且存在一些个体有超亲现象,适合QTL区间 法作图。
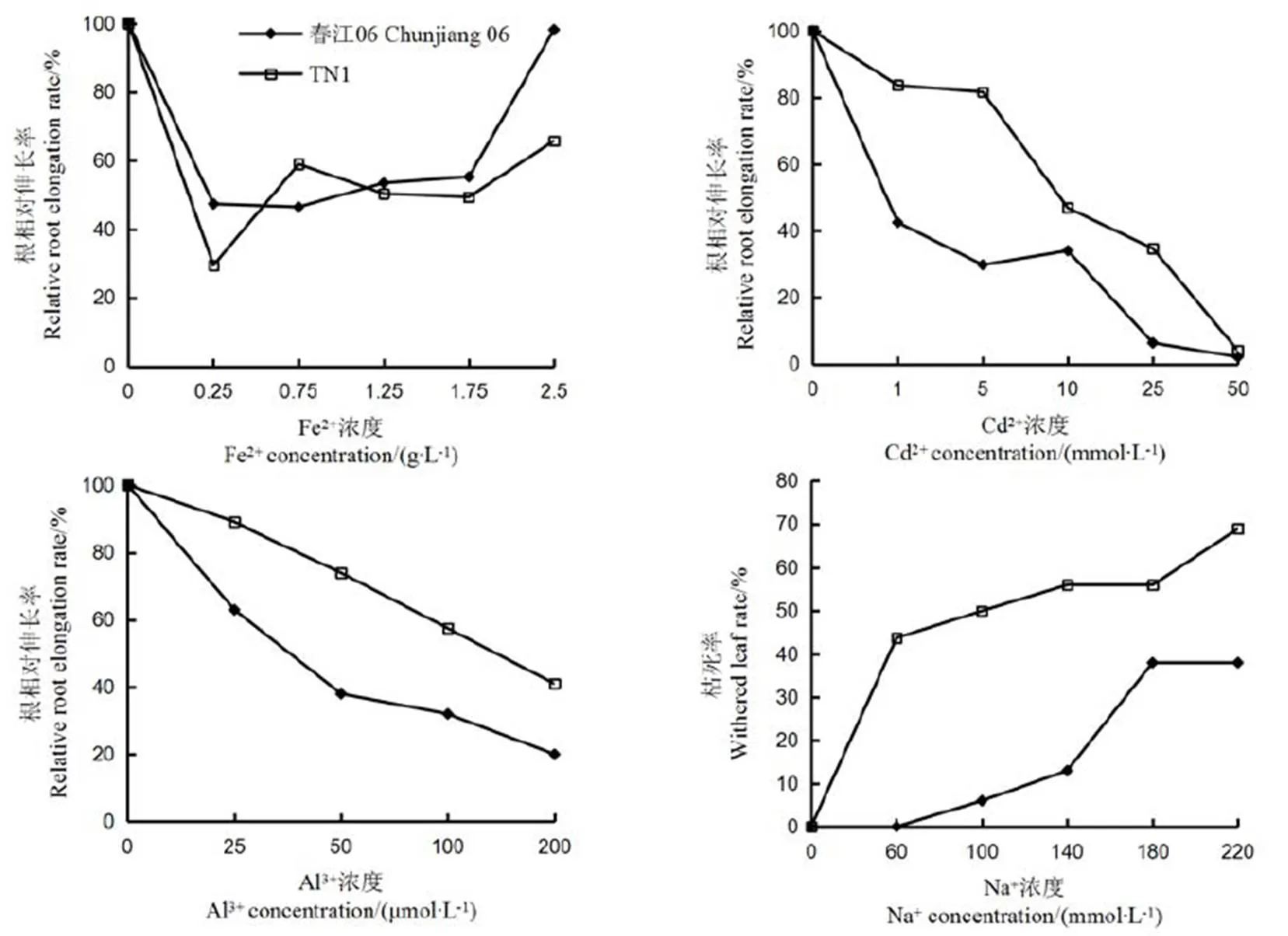
图1 不同浓度的金属离子胁迫处理对春江06和TN1根系生长的影响
Fig. 1. Effects of metal ion stress at different concentrations on root growth of Chunjiang 06 and TN1.

CJ06–春江06。
Fig. 2. Frequency distribution of DH lines under different concentrations of metal ions.

图3 水稻耐金属离子胁迫QTL的染色体定位
Fig. 3. Location of QTLs detected for metal ion tolerance.
2.3 QTL定位分析
利用已构建的分子连锁图谱,对四种金属离子胁迫DH群体的表型数据进行了QTL检测。一共发现了耐各种金属离子胁迫的QTL 8个(表2、图3),分别位于水稻第1、2、4、6、9、10和11染色体上,其中经FeSO4溶液处理后检测到与根长相关的QTL贡献率最大,达到了24.47%(阈值为7.78),位于第1染色体上RM1297-RM1061的标记区间;经CdCl2溶液处理后,在第1染色体上RM3411-RM212的标记区间内检测到与根长相关的QTL一个,其贡献率为6.4%,说明这两个QTL区间对水稻的根长调控密切相关,在亚铁胁迫中有一定的耐性。经AlCl3溶液处理后检测到QTL共5个,包括与水稻根平均伸长量相关的QTL 2个及与水稻根相对伸长率相关的QTL 3个,其中与水稻根平均伸长量相关的QTL分别位于第4染色体上SSIII-1-RM3306的标记区间内(阈值为11.11)和第6染色体上RM1370-SBE1(阈值为9.29)的标记区间内,而与水稻根相对伸长率相关的QTL分别位于第2染色体上RM324-RM341的标记区间内(阈值为11.66)、第10染色体上RM1083-SSII-1的标记区间内(阈值为8.68)及第11染色体上RM286-RM1812的标记区间内(阈值为8.84)。经NaCl溶液处理后检测到与水稻叶片枯死率相关的QTL共1个,贡献率为12.21%,位于第9染色体上RM1026-RM205的标记区间内。

表2 DH群体中水稻萌发期耐金属离子胁迫QTL定位
2.4 耐铁相关基因的表达分析
通过不同金属离子对DH群体处理后的表型数据进行QTL分析,结果发现耐Fe2+QTL贡献率最大,达到了24.47%。并将该QTL初步定位于第1染色体的RM1297-RM106区间内。为了分析该区间与耐铁离子相关的可能基因,我们对该区间的可能基因进行了初步的总结(表3)。这些基因包括了编码甲基转移酶基因、转录因子家族基因、锌指蛋白基因等。进一步通过实时荧光定量PCR对这些基因在Fe2+离子处理亲本前和处理后的表达进行分析,结果显示(图4),亲本在Fe2+离子处理后这些基因表达水平存在不同程度的差异,基因LOC_Os01g50110、LOC_Os01g50720、LOC_Os01g50940、LOC_ Os01g51260和LOC_Os01g52450在TN1处理后发生了最显著性的上调表达,而春江06在处理前和处理后没有发生非常明显的变化。其中,基因LOC_Os01g50110和LOC_Os01g51260的变化最大,上调表达15倍以上。另外,基因LOC_Os01g50060、LOC_Os01g50360、LOC_Os01g52110和LOC_ Os01g52160在TN1和春江06处理后下调表达。
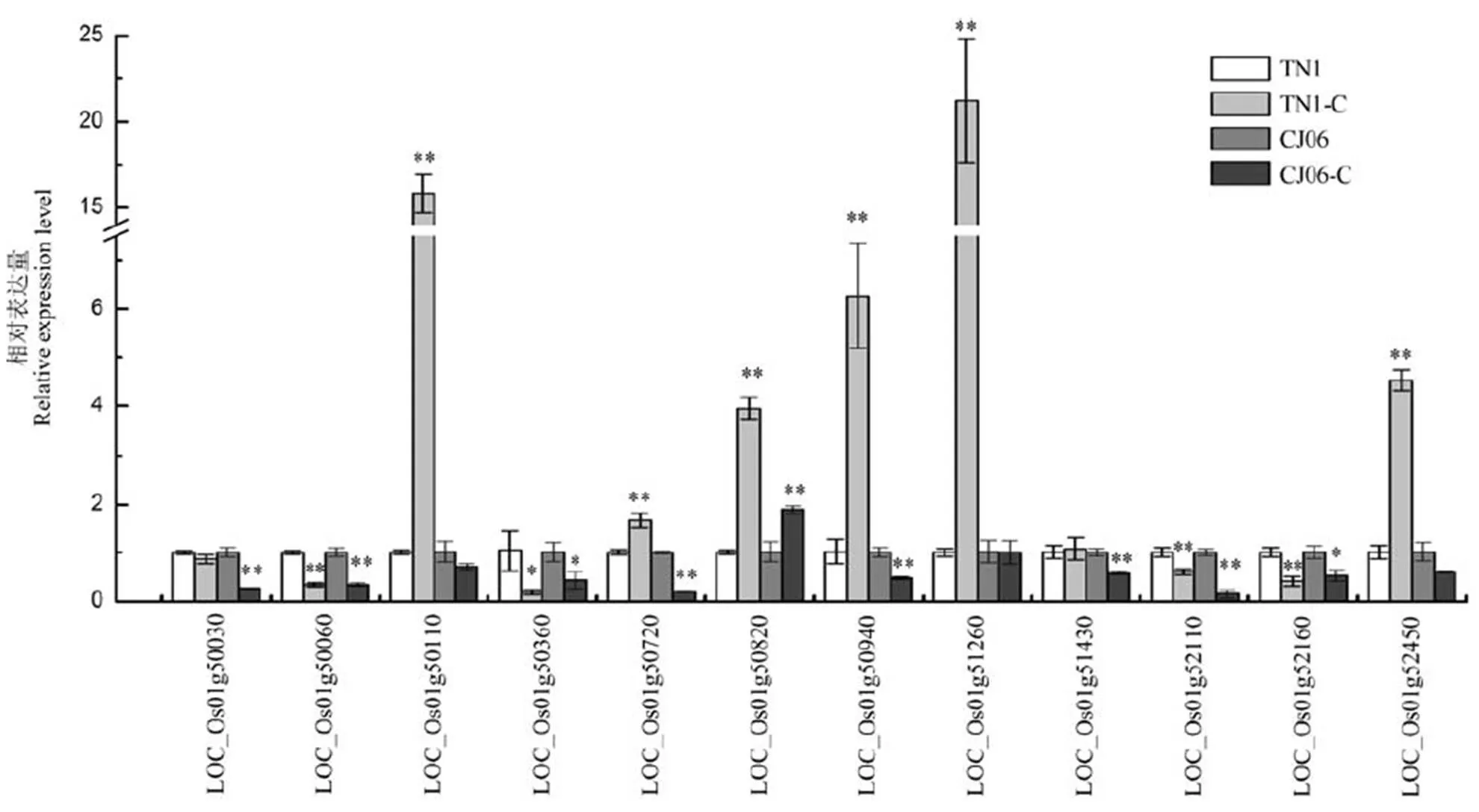
TN1-C和春江06-C代表1.75×103 mg/L铁离子处理。*,**分别表示铁离子处理与对照间差异达0.05和0.01显著水平。
Fig. 4. Expression analysis of Fe2+tolerance genes.

表3 水稻第1染色体中预测的耐铁相关基因
3 讨论
水稻作为我国主要的粮食作物之一,其高产、稳产对我国社会发展具有重要意义。我国水稻生产已从数量型向质量型转化,人们对食用大米的质量要求也不断提高,这对水稻科研与生产都提出了很高的要求。但随着稻田重金属污染的日益严重,水稻的产量和品质都有所受损[27-28]。因此,伴随着金属污染的治理,改良水稻的耐金属能力已引起国内外许多学者的高度重视。本研究利用一套DH群体为供试材料,对水稻耐Fe2+、Al3+、Cd2+和Na+的QTL进行检测分析。一共发现了耐各种金属离子胁迫的QTL 8个,分别位于水稻第1、2、4、6、9、10和11染色体上。
表达性状易受多种因素的影响,同一性状的QTL在实验材料、环境及处理时间不同的情况下QTL检测结果也会存在一定的偏差。在本研究中,经Fe2+溶液处理后检测到与根长相关的QTL位于第1染色体上的RM1297-RM1061区间内,与Dufey等[29]检测到控制叶片棕色指数的QTL(标记区间为RM443-RM403)和气孔阻力相关QTL(标记区间为RM246-RM473a)位点距离较近,虽然所用标记不一致,但位点相邻,这说明在标记RM1297附近很可能存在调控水稻耐铁胁迫的位点,此外该研究团队还在第2染色体上RM492-RM561区间和第7染色体上RM455-RM429的标记区间内检测到与耐铁相关的QTL。叶红霞等[30]以幼苗的相对苗高为指标检测到了4个与亚铁胁迫相关的QTL位点,即--、-、-和-,分别位于第1、3、6和9染色体上,可解释14.96%的表型变异。本研究经Cd2+胁迫处理后检测到一个与根长相关的QTL,也是位于第1染色体,标记区间为RM3411-RM212,该区间与骆旭添[12]在第1染色体所定位到的区间RM220-RM283不重叠。陈志德等[31]以耐镉粳稻品种韭菜青、镉敏感籼稻品种IR26及一个由该两亲本杂交后代通过单粒传法构建的RIL群体为材料检测到9个与幼苗耐Cd胁迫相关的QTL,分别位于第1、2、7和11染色体上,其中位于第7染色体上的QTL(标记区间为RM6872-RM11)和(标记区间为6872-RM11)的表型变异贡献率分别达18.02%和15.24%,在第7染色体上同样区间还检测到另一个QTL,其表型变异贡献率达13.48%,在第1染色体还检测到一个QTL(标记区间为RM3482-RM3362),其表型变异贡献率达10.06%,其余位点的表型变异贡献率均低于10.0%。
本研究还检测到一个耐盐胁迫的QTL,其贡献率为12.21%,位于第9染色体上RM1026-RM205的标记区间内。目前已检测到的耐盐QTL中,以第1、2、6、7染色体上定位的耐盐性QTL居多,第10、11染色体上较少;其中有一部分为主效QTL,对表型变异的贡献率最大可达到48.5%;且研究主要集中在苗期耐盐上,对生殖生长时期的研究较少。对比其他学者的研究结果,孙勇等[32]利用IR64/Tarmom molaii构建的回交导入系群体对水稻苗期耐盐性进行QTL定位,定位了影响水稻6个苗期耐盐相关性状的QTL共23个,分别位于第1、2、3、4、6、7、9、10、11、12染色体上,其中第9染色体上的QTL位点在RM316-RM219的标记区间内,这与我们的定位区间存在一定的偏离。Thomson等[17]检测到16个表型贡献率在20%以上的幼苗期耐盐QTL,其中,有5个QTL的表型贡献率在50%以上。汪斌等[33]利用H359和Acc8558构架重组自交系群体对水稻苗期耐盐性进行了QTL定位。共定位到13个QTL,分别位于第1、2、5、6、7和12染色体上,对表型变异的总贡献率达60.88%,其中位于第1染色体的效应最大,表型变异贡献率达45%。
在本研究中,经Al3+处理后检测到耐铝胁迫相关的QTL最多,共5个,分布在第2、4、6、10、11染色体上。将本研究定位到的耐铝胁迫相关QTL与以往其他学者定位的结果进行比较,发现有些耐铝胁迫的区间与本研究检测到的区间有重叠。褚绍尉等[34]利用广东高州普通野生稻与铝敏感品种华粳籼74构建的高世代回交群体BC3F3,在水稻第4染色体RM255标记处检测到耐铝毒胁迫的QTL,与本实验检测到的耐铝毒胁迫的区间有重叠。沈圣泉等[35]利用珍汕97B/密阳46构建RIL群体及其遗传图谱,在第11染色体RZ816-RG118区间内检测到耐铝胁迫QTL,该区间与本实验检测到的耐铝胁迫的区间类似。Ma等[36]利用RFLP标记在第2染色体短臂R2510-R2460之间及第6染色体短臂端S1520-G200之间各定位到1个耐铝毒QTL,褚绍尉等[34]在第2染色体长臂端标记RM450-RM6之间及在第6染色体短臂端标记RM111-RM25之间各定位到1个耐铝胁迫QTL,据此可以判断本研究的定位结果,在第2染色体及在第6染色体各定位到的QTL属于不同的QTL。另外,本研究在第10染色体上RM1083-SSII-1的标记区间内定位到一个QTL,该QTL对表型贡献率为8.68%,在前人研究中未发现第10染色体上的QTL,由此推断本研究所定位于第10染色体上的QTL很可能是1个新的耐铝QTL。
总的来看,本研究利用台中本地1号和春江06构建的DH群体定位到8个耐不同金属离子相关的QTL,其中耐亚铁相关的QTL与耐铝相关的QTL的增效基因来自TN1,其他QTL的增效基因来自春江06。
在QTL研究分析中,重复性高,贡献率大的QTL往往存在较大的挖掘空间。本研究中,分布在第1染色体上的抗性位点最多,其中,耐Fe2+的QTL贡献率最大,达到了24.47%。因此我们对该区间与耐金属离子胁迫相关基因进行定量分析,结果发现基因LOC_Os01g50110、LOC_Os01g50720、LOC_Os01g50940、LOC_Os01g51260以及LOC_Os01g52450在TN1处理后发生了最显著的上调表达。根据水稻基因组数据库(http://rice.plantbiology.msu.edu/)数据信息,基因LOC_Os01g50110、LOC_Os01g50720和LOC_Os01g51260属于MYB转录因子家族基因,其中有研究报道称基因LOC_Os01g50110对种子的成熟有着重要的调控作用[37];LOC_Os01g50940编码了一个类基因,其在水稻真菌性病害防卫反应中发挥着重要的调控作用[38];LOC_Os01g52450编码一个己糖激酶。MYB转录因子家族在植物的生长发育、形态建成、耐胁迫性及次生代谢等方面都起着重要的调控作用[39-40]。研究发现与耐亚铁胁迫相关的基因主要包括Fe缺陷诱导基因、Fe运输相关基因、H2O2运输和降解相关基因以及烟草胺生物合成相关基因等[41-42],亚铁处理水稻幼苗的基因芯片结果分析发现相关的MYB转录因子出现上调表达[43],在该基因家族中未曾有报道与耐亚铁毒害相关的QTL。本研究发现在处理亲本TN1后,两个转录因子基因LOC_Os01g50110和LOC_Os01g51260的表达量明显上调,因此,我们推测这两个基因极有可能参与耐铁胁迫调控。这只是我们的初步推测,但是转录因子家族基因是否在调控耐亚铁毒害的功能中发挥功能还需要进一步的实验验证。为了更精确地定位到与耐亚铁毒害相关基因,我们接下来将构建这个QTL的代换系,同时,还挑选了100多份常规品种进行Fe2+处理,而后做一个小型的全基因组关联分析,希望能找到耐Fe2+胁迫的基因。
整体上看,本研究检测到的水稻金属胁迫耐性QTL,为进一步利用分子标记辅助进行水稻金属胁迫耐性品种的选育创造了条件。纵观水稻耐金属离子胁迫的文献资料,前人研究结果与我们检测到的与金属胁迫相关的QTL均有不同之处,其原因可能是所用遗传材料及其群体不同,以致双亲的遗传差异不同,或者是因为所用遗传图谱的标记不同,造成不同试验结果难于比对,还有可能是因为所用遗传分析方法的局限性,忽略了上位性等影响要素等。因此,通过开展更多有关水稻金属胁迫耐性的QTL分析,并借助与之紧密连锁的比较完善的分子标记可望有效地聚合这些QTL。这是水稻科研工作者面临的挑战。
[1] Zhang H, Zhang J, Yan J, Gou F, Mao Y, Tang G, Botella J R, Zhu J K. Short tandem target mimic rice lines uncover functions of miRNAs in regulating important agronomic traits., 2017, 114(20): 5277-5282.
[2] Zeng D, Tian Z, Rao Y, Dong G, Yang Y, Huang L, Leng Y, Xu J, Sun C, Zhang G, Hu J, Zhu L, Gao Z, Hu X, Guo L, Xiong G, Wang Y, Li J, Qian Q. Rational design of high-yield and superior-quality rice., 2017, 3: 17031.
[3] 张赓. 还原性铁、锰对水稻生长影响及其在冷浸田中毒害的消减措施研究. 武汉: 华中农业大学, 2013.
Zhang G. Effects of Fe2+and Mn2+on rice growth and the abatement measures in logging water soil. Wuhan: Huazhong Agricultural University, 2013. (in Chinese with English abstract)
[4] 陈慧茹. 土壤重金属暴露对水稻和玉米体内重金属分布的影响. 合肥: 安徽大学, 2015.
Chen H R. The Influence on distribution of heavy meatals in rice and maize with exposure of soil heavy meatals. Hefei: Anhui University, 2015. (in Chinese with English abstract)
[5] 王恒. 吉林省土壤—水稻系统环境质量分析评估及重金属复合污染研究. 北京:中国科学院研究生院, 2014.
Wang H. Soil quality and heavy metals contamination in soil-rice system in Jilin Province. Beijing: Graduate School of Chinese Academy of Sciences, 2014. (in Chinese with English abstract)
[6] 吴迪, 杨秀珍, 李存雄, 周超, 秦樊鑫. 贵州典型铅锌矿区水稻土壤和水稻中重金属含量及健康风险评价. 农业环境科学学报, 2013, 32(10):1992-1998.
Wu D, Yang X Z, Li C X, Zhou C, Qin F X. Concentrations and health risk assessments of heavy metals in soil and rice in Zinc-lead mining area in Guizhou Province, China., 2013, 32(10): 1992-1998. (in Chinese with English abstract)
[7] 袁玲花, 徐加宽, 严士敏, 韩妍, 赵江宁, 王余龙, 董桂春, 杨连新. 土壤铜胁迫对不同籼型水稻品种产量和品质的影响. 农业环境科学学报, 2008, 27(2): 435-441.
Yuan L H, Xu J K, Yan S M, Han Y, Zhao J N, Wang Y L, Dong G C, Yang L X. Effects of soil Cu stress on grain yield and quality of Indica rice cultivars., 2008, 27(2): 435-441. (in Chinese with English abstract)
[8] 曹方彬. 水稻重金属积累的品种与环境效应及调控技术研究. 杭州: 浙江大学, 2014.
Cao F B. Cultivar and environmental effects and regulation of heavy metal accumulation in rice. Hangzhou: Zhejiang University, 2014. (in Chinese with English abstract)
[9] 卢志红, 朱美英, 石庆华, 潘晓华, 徐丰华, 邱俊. 硫硅配施对铜胁迫下水稻幼苗生长及其吸收累积铜的影响. 江西农业大学学报, 2013, 35(6): 1134-1139.
Lu Z H, Zhu M Y, Shi Q H, Pan X H, Xu F H, Qiu J. Effect of sulfur and silicon fertilizer on growth and absorption of copper in rice seedling under copper stress., 2013, 35(6): 1134-1139. (in Chinese with English abstract)
[10] 饶玉春, 郑婷婷, 马伯军, 钱前, 曾大力. 微量元素铁、锰、铜对水稻生长的影响及缺素防治. 中国稻米, 2012, 18(4): 31-35.
Rao Y C, Zheng T T, Ma B J, Qian Q, Zeng D L. Effects of trace elements iron, manganese and copper on rice growth and prevention and control of nutrient deficiency., 2012, 18(4): 31-35. (in Chinese with English abstract)
[11] Wu L B, Mohamad Y S, Gregorio G, Mathias M, Becker M. Genetic and physiological analysis of tolerance to acute iron toxicity in rice., 2014, 7: 8.
[12] 骆旭添. 水稻苗期耐镉胁迫的QTL定位及其与环境互作效应分析. 福州: 福建农林大学, 2007.
Luo X T. QTL mapping for seeding Cd tolerance in rice(L.) and analysis of QTL×environment interaction. Fuzhou: Fujian Agricultural and forestry University, 2005. (in Chinese with English abstract)
[13] Ueno D, Koyama E, Kono I, Jian M. Identification of a novel major quantitative trait locus controlling distribution of Cd between roots and shoots in rice., 2009, 50(12): 2223-2233.
[14] Ueno D, Yamaji N, Kono I, Huang C F, Ando T, Yano M, Ma J F. Gene limiting cadmium accumulation in rice., 2010, 107(38): 16500-16505.
[15] 井文, 章文华. 水稻耐盐基因定位与克隆及品种耐盐性分子标记辅助选择改良研究进展. 中国水稻科学, 2017, 31(2): 111-123.
Jing W, Zhang W. Research progress on gene mapping and cloning for salt tolerance and variety improvement for salt tolerance by molecular marker-assisted selection in rice., 2017, 31(2): 111-123. (in Chinese with English abstract)
[16] Ren Z, Gao J, Li L, Cai X, Huang W, Chao D, Zhu M, Wang Z, Luan S, Lin H. A rice quantitative trait locus for salt tolerance encodes a sodium transporter., 2005, 37(10): 1141-1146.
[17] Thomson M J, de Ocampo M, Egdane J, Rahman M A, Sajise A G, Adorada D L, Tumimbang-Raiz E, Blumwald E, Seraj Z I, Singh R K, Gregorio G B, Ismail A M. Characterizing the Saltol quantitative trait locus for salinity tolerance in rice., 2010, 3(2): 148-160.
[18] Huang C F, Yamaji N, Mitani N, Yano A M, Nagamura B Y. A bacterial-type ABC transporter is involved in aluminum tolerance in rice., 2009, 21(2): 655-667.
[19] Yamaji N, Huang C F, Nagao S, Yano S, Sato Y, Nagamura Y. A zinc finger transcription factor ART1 regulates multiple genes implicated in aluminum tolerance in rice., 2009, 21(10): 3339-3349.
[20] Yokosho K, Yamaji N, Fujii-Kashino M, Ma J F. Retrotransposon-mediated aluminum tolerance through enhanced expression of the citrate transporter., 2016, 172(4): 2327-2336.
[21] Li J Y, Liu J, Dong D, Jia X, McCouch S R, Kochian L V. Natural variation underlies alterations in Nramp aluminum transporter (NRAT1) expression and function that play a key role in rice aluminum tolerance., 2014, 111(17): 6503-6508.
[22] Huang C F, Yamaji N, Chen Z C, Ma J F. A tonoplast-localized half-size ABC transporter is required for internal detoxification of aluminum in rice., 2012, 69(5): 857-867.
[23] 饶玉春, 杨窑龙, 李晓静, 马伯军, 曾大力. 水稻萌发期耐Cu2+胁迫的QTL定位. 浙江师范大学学报: 自然科学版, 2013, 36(2): 198-204.
Rao Y C,Yang Y L, Li X J, Ma B J, Zeng D L. QTL analysis on copper-resistant at germination stage in rice (L.)., 2013, 36(2): 198-204. (in Chinese with English abstract)
[24] Zeng F, Wu X, Qiu B, Wu F, Jiang L, Zhang G. Physiological and proteomic alterations in rice (L.) seedlings under hexavalent chromium stress., 2014, 240(2): 291-308.
[25] Li C H, Wang G, Zhao J L, Zhang L Q, Ai L F, Han Y F, Sun D Y, Zhang S W, Sun Y. The receptor-like kinasemediates salt sensitivity by activating MAPK3/6 and regulating ethylene homeostasis in rice., 2014, 26(6): 2538-2553.
[26] Livak K J, Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-∆∆CTmethod., 2001, 25: 402-408.
[27] Holmgren G G S, Meyer M W, Cahney R L, Daniels R B. Cadmium, lead, zinc, copper and nickel in agricultural soils of the United States of America., 1993, 22: 335-348.
[28] Xu J K, Yang L X, Wang Z Q, Wang Y L. Toxicity of copper rice growth and accumulation of copper in rice grain in copper contaminated soil., 2006, 62(4): 602-607.
[29] Dufey I, Hiel M P, Hakizimana P, Draye X, Lutts S, Koné B, Dramé K N, Konaté K A, Sie M, Bertin P. Multienvironment quantitative trait loci mapping and consistency across environments of resistance mechanisms to ferrous iron toxicity in rice., 2012, 52(2): 539-550.
[30] 叶红霞, 李梅, 庄杰云, 沈圣泉. 水稻幼苗对多浓度Fe2+胁迫的QTL联合检测. 分子植物育种, 2007, 5(1): 105-109.
Ye H X, Li M, Zhuang J Y, Shen S Q. Analysis of gene effects of tolerance to high Fe2+stress at seedling stage in rice., 2007, 5(1): 105-109. (in Chinese with English abstract)
[31] 陈志德. 水稻不同品种耐镉性鉴定及耐镉胁迫相关性状的QTL定位. 南京: 南京农业大学, 2010.
Chen Z D. Mapping of cadmium tolerance and resistance to cadmium stress related traits in different rice varieties. Nanjing: Nanjing Agricultural University, 2010. (in Chinese with English abstract)
[32] 孙勇, 臧金萍, 王韵, 朱苓华. 利用回交导入系群体发掘水稻种质资源中的有利耐盐QTL. 作物学报, 2007, 33(10): 1611-1617.
Sun Y, Zang J P, Wang Y, Zhu L H. Mining favorable salt-tolerant QTL from rice germplasm using a backcrossig introgression line population., 2007, 33(10): 1611-1617. (in Chinese with English abstract)
[33] 汪斌, 兰涛, 吴为人. 盐胁迫下水稻苗期Na+含量的QTL定位. 中国水稻科学, 2007, 21(6): 585-590.
Wang B, Lan T, Wu W R. Mapping of QTLs for content in rice seedlings under salt stress., 2007, 21(6): 585-590. (in Chinese with English abstract)
[34] 褚绍尉, 王林, 刘桂富, 刘向东, 卢永根, 傅雪琳. 广东高州普通野生稻耐铝性及其QTL定位. 华北农学报, 2013, 28 (3): 12-18.
Chu S W, Wang L, Liu G F, Liu X D, Lu Y G, Fu X L. Aluminum tolerance identification and QTL mapping inindigenous to Gaozhou., 2013, 28 (3): 12-18. (in Chinese with English abstract)
[35] 沈圣泉, 庄杰云, 舒小丽, 包劲松, 夏英武. 水稻幼苗耐Al3+胁迫的QTL定位分析. 作物学报, 2006, 32(4): 479-483.
Shen S Q, Zhuang J Y, Shu X L, Bao J S, Xia Y W. Analysis of QTLs mapping of tolerance to high Al3+stress at seedling stage in rice., 2006, 32(4): 479-483. (in Chinese with English abstract)
[36] Ma J F, Shen R, Zhao Z, Wissuwa M, Takeuchi Y, Ebitani T, Yano M. Response of rice to Al stress and identification of quantitative trait loci for Al tolerance., 2002, 43(6): 652-659.
[37] Suzuki A, Suzuki T, Tanabe F, Toki S, Washida H, Wu C Y, Takaiwa F. Cloning and expression of five myb- related genes from rice seed., 1997, 198(1-2): 393-398.
[38] Ogawa S, Miyamoto K, Nemoto K, Sawasaki T, Yamane H, Nojiri H, Okada K., an essential factor for JA-inductive sakuranetin production in rice, interacts with MYC2-like proteins that enhance its transactivation ability., 2017, 7: 40175.
[39] Dubos C, Stracke R, Grotewold E, Weisshaar B, Martin C, Lepiniec L. MYB transcription factors in., 2010, 15(10): 573-581.
[40] Wang R, Jing W, Xiao L, Jin Y, Shen L, Zhang W. The rice high-affinity potassium transporter1;1 is involved in salt tolerance and regulated by an MYB-type transcription factor., 2015, 168(3): 1076-1090.
[41] Nozoye T, Inoue H, Takahashi M, Ishimaru Y, Nakanishi H, Mori S, Nishizawa N K. The expression of iron homeostasis- related genes during rice germination., 2007, 64(1-2): 35-47.
[42] Wu L B, Ueda Y, Lai S K, Frei M. Shoot tolerance mechanisms to iron toxicity in rice (L.)., 2017, 40(4): 570-584.
[43] Quinet M, Vromman D, Clippe A, Bertin P, Lequeux H, Dufey I, Lutts S, Lefèvre I. Combined transcriptomic and physiological approaches reveal strong differences between short- and long-term response of rice () to iron toxicity., 2012, 35(10): 1837-1859.
Identifying of QTLs for Resistance to Metal Irons Stress in Rice
LIN Han1,#, XU Jiangmin1,#, HU Huqian1,#, ZHENG An1, XU Wanlu1, LOU Ping1, WANG Yuexing2, ZENG Dali2,*, RAO Yuchun1,2,*
(1College of Chemistry and Life Sciences, Zhejiang Normal University, Jinhua 321004, China;2China National Rice Research Institute, State Key Laboratory of Rice Biology, Hangzhou 310006, China;#These authors contributed equally to the work;*Corresponding author, E-mail: dalizeng@126.com, ryc@zjnu.cn)
The molecular markers linked to the tolerance of various metal ions during rice seeding stage were screened for the purpose of discussing the genetic basis of the resistance to different metal ions.A rice double haploid(DH) population, derived from a typical-cross(Chunjiang 06/TN1) via the anther culture was used to analyze the resistance of four metal ions(Fe2+, Cd2+, Al3+, Na+) in DH population and its parents, then the quantitative trait loci (QTL) for the resistance of the four metal ions were identified using an available and complete molecular linkage map. In addition, real-time quantitative PCR was used to detect the expression of related genes before and after treatment.A total of 8 QTLs for resistance to metal ions stress were detected, which were localized on chromosomes 1, 2, 4, 6, 9, 10 and 11. Among them, one QTL with the greatest contribution for resistance to Fe2+treatment(24.47%, threshold is 7.78) located in the region RM1297-RM1061 on chromosome 1. Meanwhile, the expression analysis of the genes related to stress tolerance in this interval showed that these genes had different expression levels before and after treatment. One QTL was detected after Cd2+treatment, which was located on chromosome 1. Five QTLs were detected after Al3+treatment, which were located on chromosomes 2, 4, 6, 10 and 11 respectively. And one QTL was detected after Na+treatment, which was located on chromosome 9.According to the QTL analysis of phenotypic differences among DH groups which were treated with different metal ions, eight QTLs for resistance to various metal ions were detected. It laid the foundation for the fine mapping and cloning of the corresponding QTL and exploring the QTL molecular regulation mechanism of the resistance to different metal ions in rice.
rice; resistance; metal ion stress; QTL analysis
10.16819/j.1001-7216.2018.7075
Q343.1+5; S511.034
A
1001-7216(2018)01-0023-12
2017-06-20;
2017-08-21。
国家转基因生物新品种培育重大科技专项(2016ZX08009003-003-008);浙江省自然科学基金资助项目(LY16C130001);浙江省科协育才工程资助项目(2017YCGC008);水稻生物学国家重点实验室开放资助项目。
