超声辅助花生蛋白-低聚异麦芽糖接枝改性的研究
2018-01-22奥文芳王承明李克超张乃片王小燕华中农业大学食品科技学院武汉430070
奥文芳,王承明,李克超,张乃片,张 瑶,王小燕(华中农业大学 食品科技学院,武汉430070)
花生蛋白是一种优质的植物蛋白资源,几乎包括人体必需的8种氨基酸,不含营养抑制物质,是继大豆蛋白之后最具有广阔发展前景的蛋白质[1]。但是,我国每年900多万t的热榨花生粕大部分被用作饲料或肥料,而这些花生粕的蛋白质含量达到40%~50%[2],利用其提取花生蛋白,可为食品工业提供高蛋白食品原料,有利于提高花生粕的附加值。
花生蛋白由于含有90%盐溶性蛋白,在弱酸性条件下溶解度很低,要想将其与其他营养物质复配使用较为困难。蛋白质改性是通过对蛋白质的物化性质进行改善修饰,从而达到改善蛋白质的结构和功能性质的目的[3]。当前,蛋白质改性研究主要集中在化学改性方面,如糖基化、酰化、脱酰胺、磷酸化、共价交联等[4]。其中,糖基化改性仅通过加热不需要催化剂即能自发进行,是蛋白质改性的理想方式之一[5]。蛋白质的糖基化实质就是蛋白质分子与糖分子通过Maillard反应共价结合[5],从而使蛋白质的起泡性[6]、溶解性[7]、乳化性[8]、凝胶性[9]和抗氧化性等显著增强[10],在食品工业中有较好的应用前景。
目前,花生蛋白糖基化改性主要是研究还原糖的种类和糖链的长度[11]影响,未见低聚异麦芽糖的改性花生蛋白,并且超声辅助处理方式的研究相对较少。超声辅助有利于蛋白质自由氨基暴露[12],使低聚异麦芽糖易于改性花生蛋白,提高接枝改性程度,改善花生蛋白的功能性质,扩大其应用范围。所以本研究探讨超声辅助处理对花生蛋白-低聚异麦芽糖的接枝改性的影响,并通过结构分析接枝改性和超声辅助效果,为花生蛋白改性提供理论依据。
1 材料与方法
1.1 试验材料
1.1.1 原料与试剂
花生粕(热榨)由湖北鲁花花生油公司提供;低聚异麦芽糖由上海源叶生物科技有限公司提供。
赖氨酸,Biosharp公司;邻苯二甲醛(OPA),国药集团化学试剂有限公司;其余试剂均为分析纯。
1.1.2 仪器与设备
UV1750紫外分光光度计,日本岛津公司;Nexus 470红外光谱仪,美国梅特勤公司;J-1500圆二色谱仪,日本JASCO;F-4600荧光光谱仪,日本日立公司;KQ 2200DB 型数控超声波清洗器。
1.2 试验方法
1.2.1 花生粕的预处理
称取60 g经粉碎过80目筛的花生粕粉末置于索氏提取器中,加入适量的石油醚(60~90℃),在70℃水浴8 h以达到脱脂的目的,晾干备用。
1.2.2 花生蛋白(PPI)的提取
采用碱溶酸沉的方法提取花生蛋白[11],通过凯氏定氮法测得其蛋白质含量为79.35%。
1.2.3 超声辅助花生蛋白-低聚异麦芽糖接枝改性
参考Diftis等[13]的方法,稍作改动。称取适量的花生蛋白和低聚异麦芽糖按一定质量比混合均匀后溶解于磷酸盐缓冲液中定容,得到蛋白质质量浓度为5 mg/mL的溶液。将该溶液在pH 9.0条件下超声处理后用冷水迅速冷却,得到糖基化改性与超声辅助改性结合的花生蛋白接枝物(U-PPI-IMO)。
1.2.4 样品的制备
传统加热改性的花生蛋白(M-PPI):反应温度70℃,反应时间90 min,pH 9.0,反应后的溶液于超滤管中离心得到悬浊液,冷冻干燥获得固体样品。
糖基化改性与传统加热改性结合得到的花生蛋白复合物(M-PPI-IMO):花生蛋白与低聚异麦芽糖的质量比1∶3,反应温度70℃,反应时间90 min,pH 9.0,反应后的溶液于超滤管中离心得到悬浊液,冷冻干燥获得固体样品。
超声辅助改性的花生蛋白(U-PPI):超声温度70℃,超声时间90 min,pH 9.0,超声功率160 W,反应后的溶液于超滤管中离心得到悬浊液,冷冻干燥获得固体样品。
糖基化改性与超声辅助改性结合得到的花生蛋白复合物(U-PPI-IMO):花生蛋白与低聚异麦芽糖的质量比1∶3,超声温度70℃,超声时间90 min,超声功率160 W,pH 9.0,反应后的溶液于超滤管中离心得到悬浊液,冷冻干燥获得固体样品。
1.2.5 接枝度的测定
邻苯二甲醛(OPA)试剂配制:将40 mg OPA溶于1 mL甲醇后与25 mL 0.1 mol/L四硼酸钠溶液(pH 9.5),2.5 mL 20%SDS溶液和100 μLβ-巯基乙醇混合,用去离子水定容至50 mL,现用现配[14]。
测定方法:将4 mL OPA试剂加入到300 μL样品溶液中,35℃下反应2 min后用紫外分光光度计在340 nm处测定吸光度(y),以赖氨酸(质量浓度x)为标准物作标准曲线计算出样品中的自由氨基含量,其标准曲线方程为y=1.618x+0.033 4,R2=0.999 7。利用以下公式计算接枝度:
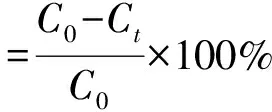
式中:C0为未反应时自由氨基的含量;Ct为反应时间t时自由氨基的含量。
1.2.6 傅里叶变换红外光谱分析
将样品与溴化钾以 1∶100 混合,研成粉末压成薄片后,用傅里叶红外光谱作全波段(4 000~400 cm-1)扫描32次,分辨率为4 cm-1。
1.2.7 远紫外圆二色谱分析
将样品用0.01 mol/L、pH 7.0磷酸钾盐缓冲液配制成质量浓度为0.1 mg/mL的溶液,室温下在190~250 nm 范围内进行圆二色谱扫描,扫描速率为 100 nm/min,磷酸钾盐缓冲液作为空白对照。测定蛋白质的平均椭圆度,进而计算出蛋白质的二级结构。
1.2.8 内源荧光光谱分析
将样品用0.01 mol/L、pH 7.0的磷酸盐缓冲液配制成质量浓度为0.1~0.2 mg/mL的溶液,在固定激发波长280 nm、扫描速度1 200 nm/min、发射波长范围300~400 nm、狭缝宽度5 nm、扫描电压700 V条件下测定其荧光强度。
2 结果与分析
2.1 单因素试验
2.1.1 花生蛋白与低聚异麦芽糖的质量比对花生蛋白糖基化改性的影响
在超声温度60℃、超声时间60 min、超声功率100 W、pH 9.0条件下,研究花生蛋白与低聚异麦芽糖的质量比(简称质量比)对花生蛋白超声辅助糖基化改性的影响,结果如图1所示。

图1 花生蛋白与低聚异麦芽糖的质量比对花生蛋白糖基化改性的影响
由图1可知,随着质量比的增加,花生蛋白的接枝度呈现先上升后基本持平的趋势。这可能是在质量比1∶1到1∶3的过程中花生蛋白和低聚异麦芽糖充分结合,接枝度增加;质量比1∶3之后随着糖分子的增加,溶液浓度增大,分子间的碰撞概率减少,所以接枝度变化很小。因此,选择花生蛋白与低聚异麦芽糖的质量比为1∶3较合适。
2.1.2 超声功率对花生蛋白糖基化改性的影响
在质量比1∶3、超声温度60℃、超声时间60 min、pH 9.0条件下,研究超声功率对花生蛋白超声辅助糖基化改性的影响,结果如图2所示。
由图2可知,随着超声功率的增加,花生蛋白的接枝度呈现先增加后基本持平的趋势。其原因可能是由于随着超声功率的增加,超声波产生的空化效应、热效应以及机械剪切作用也在增大,蛋白质分子发生了机械性振荡,破坏了蛋白质分子的空间结构,使维持原来有序螺旋结构的次级键断开,肽链展开,分子结构变得疏松,内部自由氨基暴露,花生蛋白的接枝度增加;此外,还可能是因为超声波处理打断了蛋白质分子表面的自由氨基群与邻近的羧基群之间的静电引力[15],使蛋白质分子彼此分散,不易聚集。因此,选择超声功率160 W较为合适。
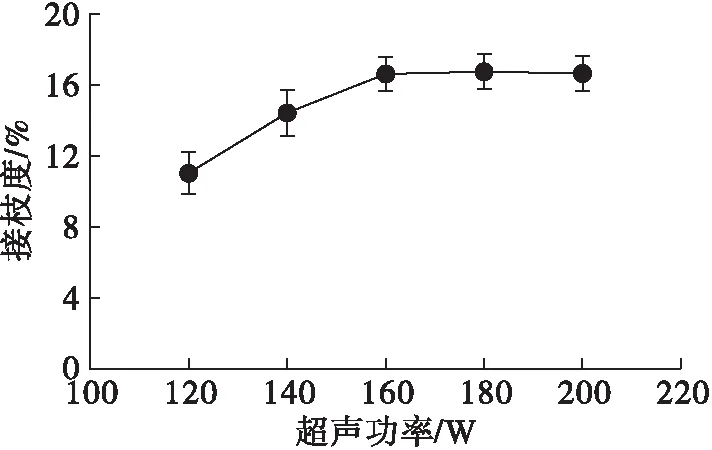
图2 超声功率对花生蛋白糖基化改性的影响
2.1.3 超声温度对花生蛋白糖基化改性的影响
在质量比1∶3、超声功率160 W、超声时间60 min、pH 9.0条件下,研究超声温度对花生蛋白超声辅助糖基化改性的影响,结果如图3所示。

图3 超声温度对花生蛋白糖基化改性的影响
由图3可知,随着超声温度的升高,花生蛋白的接枝度呈现先上升后下降的趋势。这可能是因为随着超声温度的升高,花生蛋白的溶解度增大,自由氨基浓度也随之增大,同时适当的高温利于肽链展开,内部自由氨基暴露,花生蛋白与糖分子碰撞次数增加,有利于糖基化反应。但是,在过高的温度下蛋白质聚集或变性,所以自由氨基的含量又降低。因此,选择超声温度65℃较为合适。
2.1.4 超声时间对花生蛋白糖基化改性的影响
在质量比1∶3、超声功率160 W、超声温度65℃、pH 9.0条件下,研究超声时间对花生蛋白超声辅助糖基化改性的影响,结果如图4所示。
由图4可知,随着超声时间的延长,花生蛋白的接枝度呈现先上升后下降的趋势。这可能是因为随着超声时间的延长,超声波产生的空化、机械剪切和热作用使得花生蛋白中维持蛋白质高级结构的次级键破坏,肽链变得疏松,同水分子结合能力增强,花生蛋白的溶解度增加,利于糖基化反应的发生。在90 min后,随着超声时间的延长,花生蛋白的疏水性基团增多,花生蛋白重新聚集,所以花生蛋白经历了先解离后聚合的过程。因此,在超声时间90 min时,花生蛋白的接枝度达到最大。
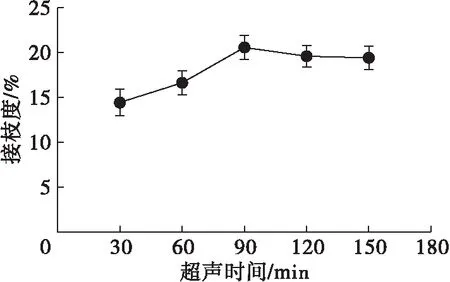
图4 超声时间对花生蛋白糖基化改性的影响
2.2 响应面试验
根据Box-Behnken 原理,以超声功率(A)、超声温度(B)、超声时间(C)为因素,花生蛋白的接枝度(Y)为响应值,在质量比1∶3、pH 9.0条件下进行三因素三水平的响应面试验,其中因素水平见表1,响应面试验设计及结果见表2。

表1 因素水平
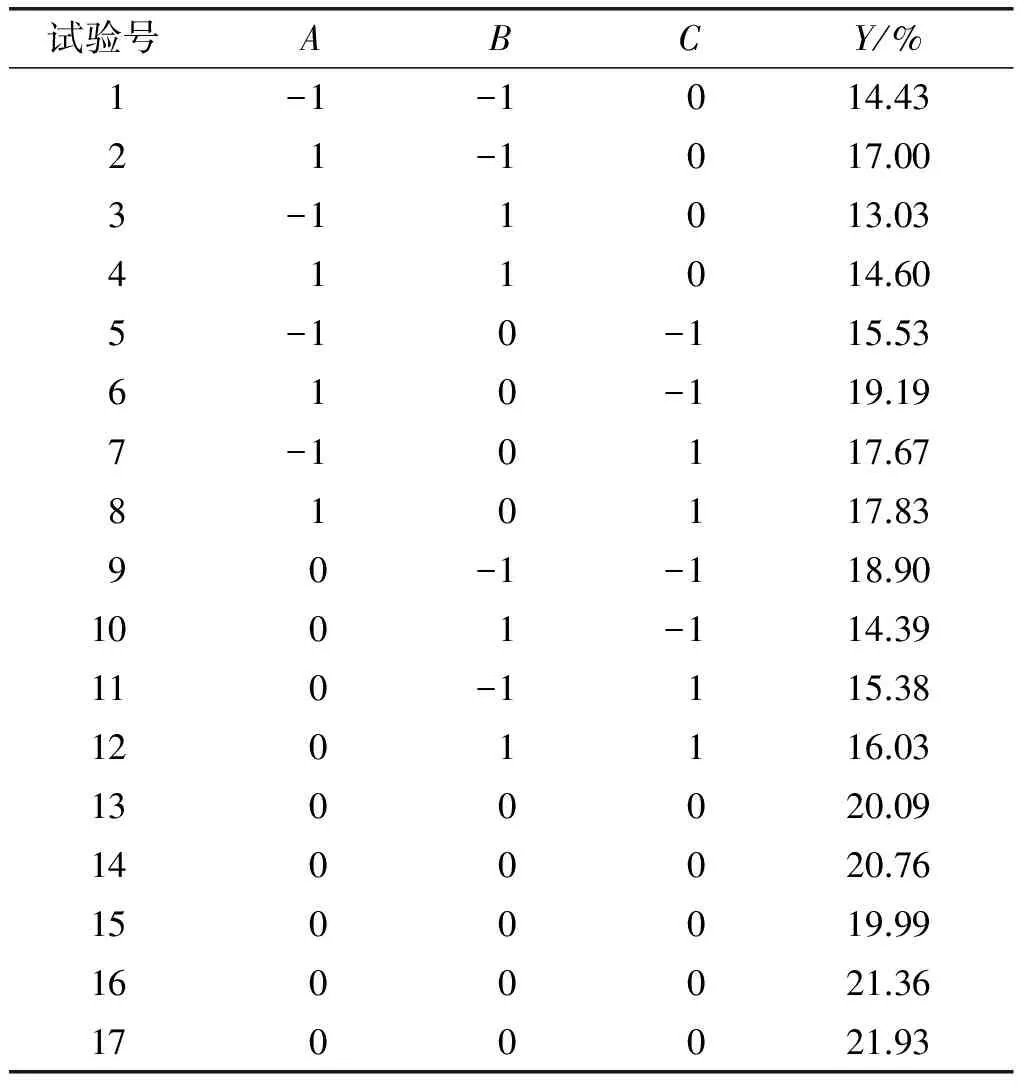
表2 响应面试验设计及结果
利用软件Design-Expert 8.0.6对该试验结果进行回归拟合,得到了关于花生蛋白-低聚异麦芽糖接枝度对各影响因子的二次多项回归模型方程:Y=20.83+1.00A+0.96B-0.14C-0.25AB-0.88AC+1.29BC-2.34A2-3.72B2-0.93C2。
对该回归模型进行方差分析,结果见表3。

表3 回归模型方差分析
注:**表示相关性极显著P<0.01;*表示相关性显著P<0.05。
由表3可知,该回归模型的P=0.000 2,相关系数R2为0.969 9,说明该回归模型拟合成功,拟合度达96.99%,效果极显著;该回归模型的失拟项P=0.739 7>0.05不显著,该拟合方程可靠,可用来预测超声辅助花生蛋白-低聚异麦芽糖糖基化改性的接枝度。
经过对超声辅助花生蛋白-低聚异麦芽糖接枝改性的条件进行优化,其最优参数为超声功率164.4 W、超声温度69℃、超声时间90.89 min,此时花生蛋白的接枝度为20.93%。为验证该回归模型的可靠性,确定试验条件为超声功率160 W、超声温度70℃、超声时间90 min,此条件下花生蛋白的接枝度为21.30%。
2.3 傅里叶变换红外光谱分析
花生蛋白(PPI)及其接枝物(PPI-IMO)的红外光谱图如图5所示。

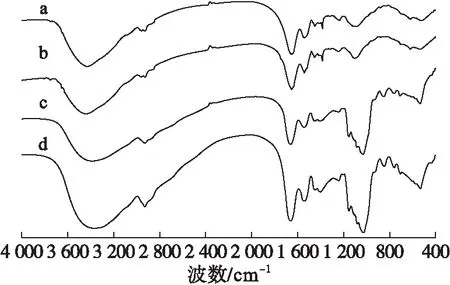
注:a.M-PPI;b.U-PPI;c.M-PPI-IMO;d.U-PPI-IMO。下同。
图5花生蛋白及其接枝物的傅里叶变换红外光谱图
2.4 远紫外圆二色谱分析
利用圆二色谱测定蛋白质的二级结构。圆二色谱测定的花生蛋白及其接枝物在溶液中的二级结构如图6所示。

图6 花生蛋白及其接枝物的远紫外圆二色谱图
由图6可知,接枝物的二级结构发生显著变化,最大负吸收峰减弱,并且负峰的吸收波长位置向长波长方向偏移。根据图6计算溶液中蛋白质分子各种结构所占的比例。花生蛋白及其接枝物的α-螺旋、β-折叠、β-转角及无规则卷曲的相对含量如表4所示。
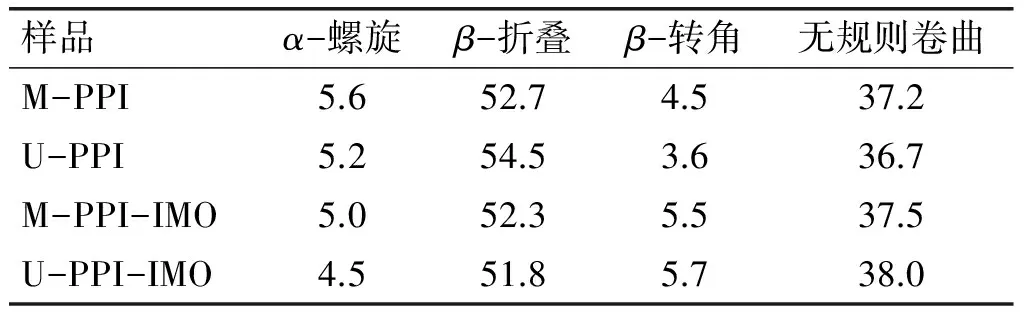
表4 花生蛋白及其接枝物的二级结构及相对含量 %
由表4可知,接枝物的α-螺旋和β-折叠均有所减少,而β-转角和无规则卷曲结构增加,尤其经超声作用的接枝物结构变化更大,比M-PPI-IMO更为松散。这说明在超声作用下,蛋白质分子展开,更多的自由氨基暴露,低聚异麦芽糖与之共价结合,花生蛋白从有序向无序的状态转变,更加明显地修饰了接枝物的二级结构。由以上分析可知,超声辅助糖基化更能改变蛋白质的二级结构,提高接枝度。
2.5 内源荧光光谱分析
蛋白质的内源荧光主要是由芳香族氨基酸残基形成的,并且极性环境会影响生色团基团的基态和激发态能级,减少激发态的能量,引起发射谱的红移。花生蛋白及其接枝物的内源荧光光谱如图7所示。
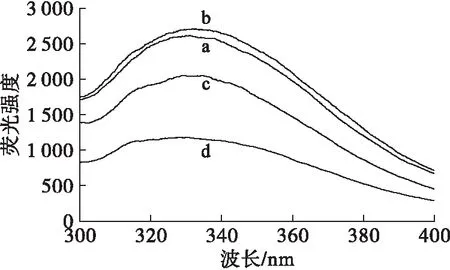
图7 花生蛋白及其接枝物的内源荧光光谱
由图7可知,接枝物与花生蛋白相比,均发生了不同程度的蓝移,特别是U-PPI-IMO的蓝移程度较大。一方面可能是花生蛋白在超声作用下,花生蛋白的肽链伸展程度强于M-PPI,使芳香族氨基酸分子的侧链基团从非极性环境逐渐暴露于极性水溶液中,蛋白质荧光发射峰的λmax逐渐增大,蛋白质构象变化的程度也增大,结构更加松散;另一方面可能是花生蛋白与低聚异麦芽糖接枝较高,大量的羟基遮蔽了蛋白质分子内部的芳香族氨基酸,同时蛋白质分子内部重新折叠,使得色氨酸所处的非极性更强。综上所述可知,超声辅助糖基化使得花生蛋白的芳香族氨基酸所处的微环境的非极性强于M-PPI-IMO,结构也更为松散。
3 结 论
在超声辅助条件下,花生蛋白和低聚异麦芽糖发生了糖基化反应,花生蛋白接枝改性成功,其最佳改性条件为花生蛋白与低聚异麦芽糖的质量比 1∶3、超声功率160 W、超声温度70℃、超声时间90 min、pH 9.0,此条件下花生蛋白的接枝度为21.30%。通过观察花生蛋白及其接枝物的红外光谱、圆二色谱、荧光光谱,可知花生蛋白与低聚异麦芽糖发生了共价结合,并且与传统热处理方式相比,超声作用更容易使花生蛋白的结构从有序向无序状态转变,自由氨基暴露,从而接枝度较高。
[1] 刘传富, 张兆静. 花生蛋白及其在食品中的应用[J]. 中国食物与营养, 2005(1): 24-25.
[2] 赵晓燕, 孙秀平, 陈锋亮,等. 花生蛋白的研究进展与开发利用现状[J]. 中国粮油学报, 2011, 26(12): 118-122.
[3] CHEN L, CHEN J S, REN J Y,et al. Effects of ultrasound pretreatment on the enzymatic hydrolysis of soy protein isolates and on the emulsifying properties of hydrolysates[J]. J Agric Food Chem, 2011, 59(6): 2600-2609.
[4] 刘岩. 物理及酶法改善热压榨花生粕蛋白功能特性的研究[D]. 广州:华南理工大学, 2011.
[5] 刘娟,卢蓉蓉. 酪蛋白湿法糖基化改性研究[J]. 食品与发酵工业, 2008, 34(10): 49-52.
[6] TIM J W, MARY A. Rheology of whey protein-dextran conjugate films at the air/water interface[J]. Food Hydrocoll, 2007, 21(7): 1072-1080.
[7] JIMÉNEZ-CASTAO L, LPEZ-FANDIO R, OLANO A, et al. Study onβ-lactoglobulin glycosylation with dextran: effect on solubility and heat stability[J]. Food Chem, 2005, 93(4): 689-695.
[8] LIU Y, ZHAO G L, ZHAO M M, et al. Improvement of functional properties of peanut protein isolate by conjugation with dextran through Maillard reaction[J]. Food Chem, 2012, 131(3): 901-906.
[9] 闵维.大豆蛋白/多糖复合凝胶流变学及微结构研究[D].广州:华南理工大学, 2010.
[10] SARA I F S M, WIM M F J, MARTINUS A J S. A review of Maillard reaction in food and implications to kinetic modelling[J]. Trends Food Sci Technol, 2011, 11(9/10): 364-373.
[11] LIA W W, ZHAO H B, HE Z Y ,et al. Modification of soy protein hydrolysates by Maillard reaction: effects of carbohydrate chain length on structural and interfacial properties[J]. Colloids Surf B Biointerf, 2016, 138: 70-77.
[12] LI C, HUANG X J, Peng Q, et al. Physicochemical properties of peanut protein isolate-glucomannan conjugates prepared by ultrasonic treatment[J]. Ultrason Sonochem, 2014, 21(5): 1722-1727.
[13] DIFTIS N, KIOSSEOGLOU V. Improvement of emulsifying properties of soybean protein isolate by conjugation with carboxymethyl cellulose[J]. Food Chem, 2003, 81(1): 1-6.
[14] CATERINA D, MARIA T G, ROCCO R, et al. Spectrophotometric assay usingo-phtaldialdehyde for the determination of transglutaminase activity on casein[J]. Food Chem, 2002, 78(3): 363-368.
[15] KRASAECHOL N, SANGUANDEEKUL R, DUANGMAL K,et al. Structure and functional properties of modified threadfin bream sarcoplasmic protein[J]. Food Chem, 2008, 107(1): 1-10.
