苜蓿黄酮对脂多糖诱导下奶牛乳腺上皮细胞凋亡的影响
2018-01-19占今舜陈小连詹康苏效双赵国琦
占今舜,陈小连,詹康,苏效双,赵国琦*
(1.扬州大学动物科学与技术学院,江苏 扬州 225009;2.江西省农业科学院畜牧兽医研究所,江西 南昌 330200)
乳腺上皮细胞是合成和分泌乳汁主要场所,当奶牛该组织在金黄葡萄球菌、大肠杆菌和链球菌等病原菌感染下,会产生乳房炎,进而导致产奶量和乳品质下降。脂多糖(lipopolysaccharide,LPS)又称内毒素,是革兰氏阴性菌如大肠杆菌等细胞壁中的一种成分,当细菌死亡溶解时,其释放出来会使乳腺组织等产生损伤[1]。Shi等[2]研究发现,奶牛乳腺上皮细胞的活性随着LPS浓度和培养时间的延长而降低;细胞的谷胱甘肽过氧化物酶(GSH-Px)、超氧化物歧化酶(SOD)和过氧化氢酶(CAT)活性随着LPS浓度的升高呈降低趋势,而丙二醛(MDA)含量则呈升高趋势。Sun等[3]发现,奶牛乳腺上皮细胞在10 μg·mL-1LPS刺激下,其细胞膜的渗透性增加,促进细胞凋亡。朱丽萍等[4]发现,奶牛乳腺上皮细胞在1 μg·mL-1LPS处理3~24 h后可显著增加炎症因子(TNF-α和IL-1β)的表达。以上结果说明,LPS的刺激可促使乳腺上皮细胞的抗氧化能力下降,增加细胞膜的通透性,进而导致细胞凋亡。
黄酮类物质是含有2-苯基色原酮结构,以C6-C3-C6为碳架的一类化合物,是植物一种重要的次生代谢产物,广泛存在于植物的根、茎、叶和花、果实中[5]。张城等[6]研究发现,软骨细胞经LPS处理后,细胞增殖活性降低,细胞IL-1β、iNOS、P53基因mRNA的表达升高,而添加1 μg·mL-1金雀异黄酮能够提高增殖活性和降低这些基因的表达。姜念等[7]发现,4′,5,7-三羟基异黄酮能够拮抗人主动脉内皮细胞经LPS处理后引起的活力降低及ephrinB2和IL-6 mRNA的表达增加。另外,黄芪(Astragalusmembranaceus)总黄酮能够抗小鼠RAW264.7细胞经LPS诱导的炎症反应[8]。结果表明,黄酮类物质能够提高细胞活性,发挥抗炎症的作用。紫花苜蓿(Medicagosativa)被称为“牧草之王”,是一种豆科多年生草本植物。苜蓿中黄酮含量较高,据报道,45个紫花苜蓿品种中有70%以上品种的总黄酮含量为0.6%~0.9%[9]。之前研究发现,在正常培养和热应激情况下,添加75 μg·mL-1的苜蓿黄酮能够提高体外培养奶牛乳腺上皮细胞的活性,改善抗氧化能力和抑制细胞凋亡[10-11]。黄酮类化合物具有抗炎症作用,但不同种类可能作用存在差异。因此,本试验研究在LPS刺激下,苜蓿黄酮对奶牛乳腺上皮细胞凋亡的影响,为苜蓿黄酮的应用提供参考。
1 材料与方法
1.1 材料
脂多糖(LPS,血清型O55:B5)购于美国Sigma公司,试验所用苜蓿黄酮和奶牛乳腺上皮细胞与文献[11]相同。
1.2 试验方法
1.2.1细胞活性检测 试验于2016年7月开始进行,细胞活性采用CCK-8法进行检测。试验方法如下:试验分为4组,即基础培养基(Con)、基础培养基中加入1 μg·mL-1的LPS(L)、基础培养基中加入1 μg·mL-1的LPS和75 μg·mL-1苜蓿黄酮(L+F)、基础培养基中加入75 μg·mL-1苜蓿黄酮(F),每组5个重复,其中苜蓿黄酮用二甲基亚砜[DMSO(索莱宝,北京)]完全溶解,4个处理组中的DMSO含量低于2‰。在96孔板中,接种100 μL·孔-1的细胞悬液,悬液中含有1×104个的乳腺上皮细胞,然后在37 ℃,5% CO2培养箱中进行培养。待细胞完全贴壁后,去除培养基,磷酸盐缓冲溶液(PBS)清洗两次后加入不同处理的培养基100 μL·孔-1。细胞培养12和24 h后,每孔加入10 μL CCK-8溶液(购于上海碧云天公司),在培养箱中孵育3 h后,用酶标仪测定450 nm处的吸光值,然后计算细胞活性。
细胞相对活性=(As-A0)/(Ac-A0)×100%
式中:As为试验组的OD值;Ac为对照组的OD值;A0为空白组(只有培养基)的OD值。
1.2.2活性氧(ROS)的检测 细胞内的ROS采用DCFH-DA检测探针(购于南京建成生物工程研究所)来检测。DCFH-DA本身没有荧光,可以自由穿过细胞膜,进入细胞内后,可以被细胞内的酯酶水解生成DCFH。而DCFH不能通透细胞膜,从而使探针很容易被装载到细胞内。细胞内的ROS可以氧化无荧光的DCFH生成有荧光的DCF。检测DCF的荧光就可以知道细胞内活性氧的水平。取密度为1×105个·mL-1细胞接种到12孔板中,在37 ℃,5% CO2培养箱中进行培养24 h,去除培养基,PBS清洗两次,试验分组同上。细胞培养12 h后,去除细胞培养基,PBS清洗,然后加入含有DCFH-DA(稀释1000倍)培养基1 mL孵育1 h。细胞孵育之后,加入胰酶消化细胞(消化时间4 min),加入培养基终止消化,制成悬液。将细胞悬液进行1500 r·min-1离心5 min收集细胞,然后用PBS清洗一次,加入200~300 μL PBS重悬细胞,然后用流式细胞仪进行检测,检测由扬州大学检测中心完成。
1.2.3炎症因子基因的检测 取密度为5×105个·mL-1细胞接种到6孔板,在37 ℃,5% CO2培养箱中进行培养24 h,去除培养基,PBS清洗两次,试验分组同上。细胞培养12 h后,去除细胞培养基,然后提取RNA。细胞RNA提取、cDNA合成和RT-PCR等的方法和条件同文献[12]。引物由Invitrogen公司合成,炎症因子相关基因引物序列见表1。

表1 引物设计Table 1 Primer design
1.2.4凋亡相关蛋白的检测 取密度为5×105个·mL-1细胞接种到6孔板,在37 ℃,5% CO2培养箱中进行培养,当每孔细胞铺满时,将培养基去除,PBS清洗两次,试验分组同上。细胞培养12 h后,去除细胞培养基,提取细胞蛋白,然后进行Western bolt检测。一抗:p53购于英国Abcam公司,GAPDH、p38、P-p38和Caspase3购于美国Cell Signaling Technology公司;二抗(羊抗鼠、羊抗兔)购于美国Cell Signaling Technology公司。检测方法如下:
1)根据蛋白分子量的大小配制相应的SDS分离胶(10%~12%),将分离胶打入制胶板中,加入无水乙醇,室温放置40 min凝胶后,去除乙醇,加入浓缩胶,插入梳子后室温放置40 min。
2)将制好的胶转入电泳槽中进行电泳,蛋白样品上样量为30 μg,电泳条件为140 V,15 min;110 V,65 min。
3)根据蛋白分子量的大小和参照Marker进行切胶,铺膜,然后在电压100 V下转膜80 min。
4)转膜结束后,根据蛋白分子量的大小和参照Marker进行剪膜,然后进行封闭2 h,封闭结束后用杂交膜清洗液清洗3次。
5)加入一抗在冰上进行孵育12~16 h,结束后用杂交膜清洗液清洗3次。
6)加入二抗在摇床上孵育2 h,用杂交膜清洗液清洗3次后再用双色红外激光成像系统对膜进行扫描、成像,最后利用Image J软件进行灰度值分析,然后根据目的蛋白与GAPDH比值进行结果计算。
1.3 数据处理
基因相对表达量采用2-ΔΔCt方法进行计算[13],用Excel 2007进行试验数据处理,采用IBM SPSS Statistics 21.0单因素方差分析(ANOVA),LSD法多重比较,P<0.05表示差异显著,P<0.01表示差异极显著。
2 结果与分析
2.1 苜蓿黄酮对脂多糖刺激下细胞活性的影响
从图1中可知,细胞培养12 h时,L组的细胞相对活性极显著低于其他各组(P<0.01);培养24 h时,F组的细胞相对活性极显著低于对照组(P<0.01),而显著高于其他两组(P<0.05)。结果表明,苜蓿黄酮能够抑制LPS刺激12 h细胞活性的下降。
2.2 苜蓿黄酮对脂多糖刺激下细胞ROS的影响
从图2中可知,与对照组相比,其他各组的ROS浓度极显著升高(P<0.01);而与L组相比,L+F组和F组的ROS浓度显著降低(P<0.05)。结果表明,苜蓿黄酮能够降低LPS刺激下细胞内ROS浓度。
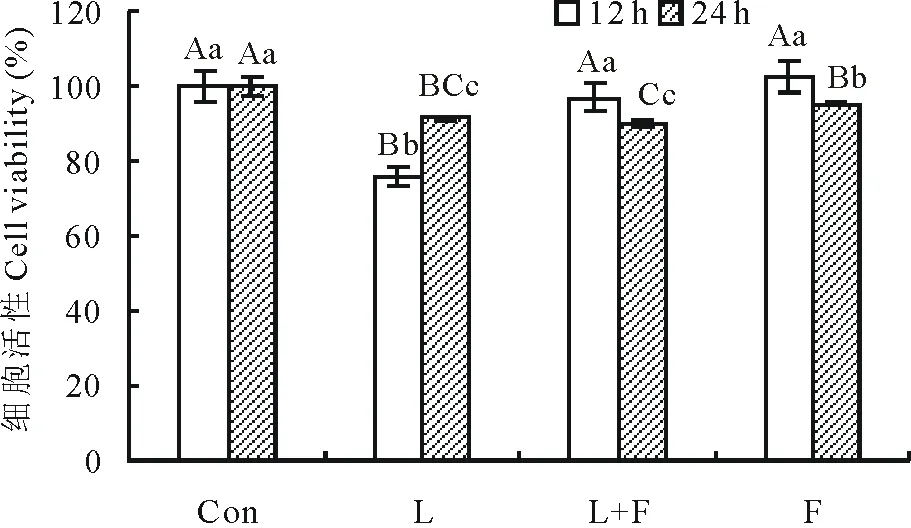
图1 苜蓿黄酮对LPS刺激12和24 h下奶牛乳腺上皮细胞活性的影响Fig.1 Effect of alfalfa flavonoids on cell viability of BMECs induced by LPS for 12 and 24 h
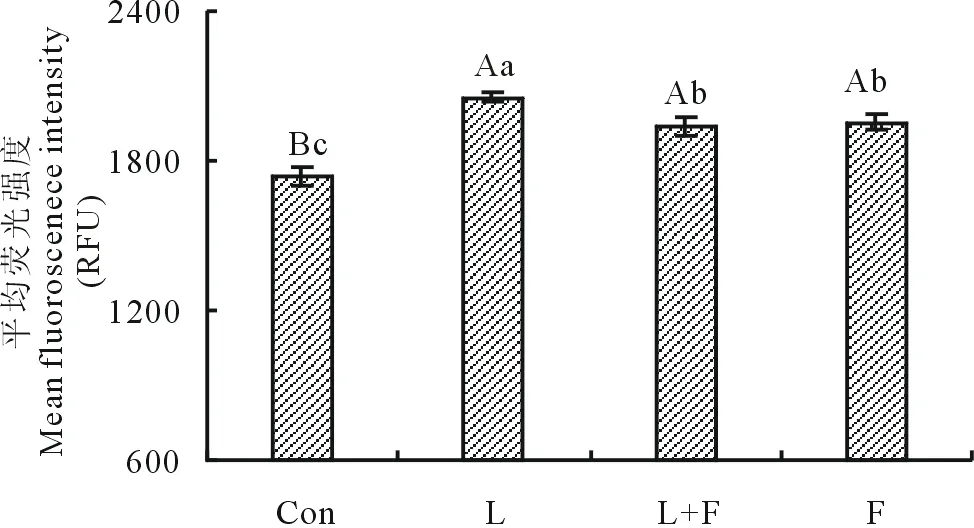
图2 苜蓿黄酮对LPS刺激下细胞内ROS水平的影响Fig.2 Effect of alfalfa flavonoids on the level of ROS in BMECs induced by LPS
Con为对照组、L为脂多糖组、L+F为脂多糖加苜蓿黄酮组、F为苜蓿黄酮组。不同小写字母表示差异显著(P<0.05),不同大写字母表示差异极显著(P<0.01),相同字母表示差异不显著(P>0.05)。下同。Con is the control group, L is the LPS group, L+F is the LPS and alfalfa flavonoids group, F is the alfalfa flavonoids group. Values with different lowercase letters mean significant difference (P<0.05),values with different capital letters mean highly significant difference (P<0.01) and the same letter mean no significant difference (P>0.05).The same below.
2.3 苜蓿黄酮对脂多糖刺激下细胞炎症因子基因表达的影响
从表2中可知,与对照组相比,L组IL-1β、IL-6、TNF-α、TLR2、TLR4和MyD88的表达均极显著升高(P<0.01),而F组无显著性差异;与L组相比,L+F组IL-1β(P<0.01)、IL-6(P<0.05)、TNF-α(P<0.01)和TLR2(P<0.01)的表达显著降低。结果表明,苜蓿黄酮能够下调LPS刺激下细胞炎症因子的表达,提高细胞的抗炎症作用。
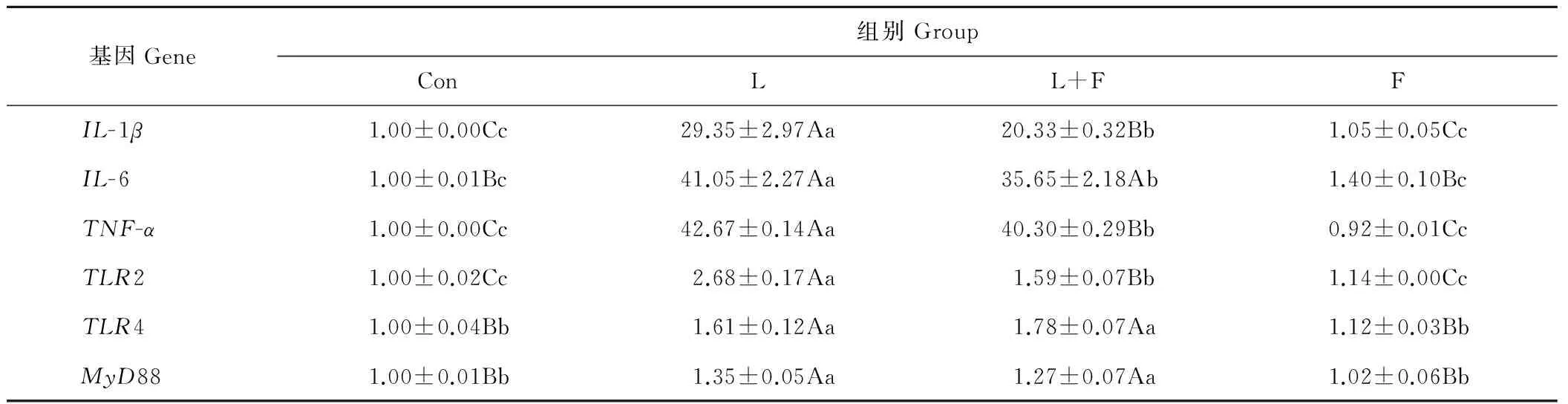
表2 苜蓿黄酮对LPS刺激下细胞炎症因子基因表达的影响Table 2 Effect of alfalfa flavonoids on gene expression of inflammatory factors in cells stimulated by LPS
注:同行不同小写字母表示差异显著(P<0.05),不同大写字母表示差异极显著(P<0.01),相同字母表示差异不显著(P>0.05)。下同。
Note: In the same row, values with different lowercase letters mean significant difference (P<0.05),values with different capital letters mean highly significant difference (P<0.01) and the same letter mean no significant difference (P>0.05).The same below.
2.4 苜蓿黄酮对脂多糖刺激下细胞凋亡蛋白表达的影响

图3 Western blot 结果Fig.3 The results of Western blot
利用软件对图3的条带进行计算,结果见表3。与对照组相比,在LPS刺激下,p53(P<0.01)、Caspase3(P<0.01)、p38(P<0.05)和P-p38(P<0.01)蛋白的表达显著升高,而添加苜蓿黄酮能够显著降低p53和p38蛋白的表达(P<0.05)。与对照组相比,在没有LPS刺激下,添加苜蓿黄酮显著升高了Caspase3蛋白的表达。结果表明,LPS能够促进细胞凋亡蛋白的表达,而苜蓿黄酮能够下调LPS刺激下细胞凋亡蛋白的表达,抑制细胞凋亡。

表3 苜蓿黄酮对LPS刺激下细胞凋亡蛋白表达的影响Table 3 Effect of alfalfa flavonoids on expression of apoptosis protein in cells stimulated by LPS
3 讨论
脂多糖能够降低细胞的存活率,抑制细胞增殖。刘立新等[14]研究发现,LPS能够抑制奶牛乳腺上皮细胞的增殖。王亨等[15]发现,添加100 mg·L-1的LPS能够显著抑制奶牛乳腺上皮细胞的增殖。本试验得到相似结果。之前的研究发现[10-11],在正常培养和热应激下,添加苜蓿黄酮能够提高奶牛乳腺上皮细胞活性。之前有报道称,奶牛乳腺上皮细胞活性随LPS浓度的升高呈下降趋势,且随着培养时间的延长,活性也呈下降趋势[2]。研究发现,低浓度雌激素能够促进奶牛乳腺上皮细胞的增殖,并可以提高SOD活性来发挥抗氧化作用,而高浓度则抑制细胞增殖和降低抗氧化能力,引起细胞损伤[16]。而紫花苜蓿黄酮以木犀草素、槲皮素、染料木黄酮等黄酮类物质为主,而这些物质均能发挥植物雌激素的作用[17],在本试验中,苜蓿黄酮能够提高LPS刺激12 h奶牛乳腺上皮细胞的活性,而对刺激24 h的效果不明显。可能是因为LPS作用时间太长对细胞损伤较大,而且苜蓿黄酮随着培养时间的延长可能发挥类雌激素作用,进而抑制细胞的增殖。说明苜蓿黄酮能够减缓LPS对细胞的损伤,而且可能存在时间依赖性。LPS能够导致奶牛乳腺上皮细胞的GSH-Px、SOD和CAT活性降低,而升高MDA含量[2]。而之前试验发现[10-11],苜蓿黄酮能够提高细胞抗氧化酶类的活性,因此,苜蓿黄酮提高细胞活性可能与其提高细胞抗氧化能力有关。
LPS是一种重要的炎症反应因子,能够诱导TNF-ɑ、IL-1β、IL-6等细胞因子参与炎症反应。Chanput等[18]研究发现,槲皮素、杨梅酮、圣草酚、柚皮素、芦丁和芹黄素均能够降低单核细胞炎症因子TNF-ɑ、IL-1β、IL-8和IL-10基因的表达。另外,黄芪总黄酮、染料木黄酮和芫花总黄酮均能够抑制RAW264.7细胞TNF-ɑ、IL-1β和IL-6的分泌,从而发挥抗炎[8,19-20]。本试验结果与其相似,表明苜蓿黄酮亦发挥了抗炎症的作用。Toll样受体家族(TLRs)能够与不同病原体相关分子模式结合,导致下游目的基因的活化,进而诱导免疫应答的发生。在此过程中存在两种信号转导通路,即依赖MyD88和非依赖MyD88。除TLR3为非依赖MyD88,其他均为依赖MyD88[21]。Li等[22]研究发现,芒果苷能够抑制LPS诱导口腔上皮细胞TLR2和TLR4的过表达,抑制NF-κB、p38和JNK的表达。Feng等[23]发现,大豆黄酮能够抑制LPS诱导小鼠肺组织的TLR4、MyD88的过表达和NF-κB活性。Sun等[24]研究发现,黄芩苷可能通过抑制TLR2和TLR4/MyD88/p38/NF-κB信号来达到抗炎作用。另外,山姜素可能通过抑制TLR4调节NF-κB信号通路来发挥抗炎作用,从而抑制LPS诱导小鼠发生乳房炎[25]。从本试验的结果来看,苜蓿黄酮降低了TLR2和MyD88基因表达和p38蛋白表达。结果说明,苜蓿黄酮可能通过抑制TLR2/MyD88/p38信号,降低炎症因子的表达,从而达到抗炎症的作用。
张宸豪等[26]研究发现,随着LPS浓度增加,RAW264.7细胞内ROS的水平也增加。本试验也发现,在LPS刺激下,细胞内的ROS浓度升高。邓伟等[27]研究发现,橙皮素能够抑制LPS诱导H9C2心肌细胞ROS产生,说明黄酮类物质具有降低细胞ROS浓度的功能。从本试验结果来看,在LPS刺激下,苜蓿黄酮发挥抑制细胞内ROS产生的作用,这可能与其提高细胞抗氧化酶类活性有关。细胞内的ROS能够与细胞膜的双磷脂分子层及膜蛋白相结合,增加细胞膜通透性,导致DNA受损,进而促使细胞凋亡和死亡。Caspases家族中的大多数成员是开启细胞凋亡的效应子,其中Caspase 3被认为是凋亡的关键蛋白酶,其一旦被激活,细胞凋亡就不可避免。从本试验结果看,在LPS刺激下,苜蓿黄酮虽降低细胞Caspase-3蛋白的表达,但未达到显著性差异,说明苜蓿黄酮对Caspase-3蛋白的表达影响不大。然而,在正常培养下,苜蓿黄酮显著提高了细胞Caspase-3蛋白的表达,原因可能是苜蓿黄酮发挥了类雌激素作用,导致细胞氧化,提高ROS浓度所致。p53是一种抑癌基因,其主要功能是通过促进DNA修复蛋白的转录合成来完成DNA损伤的修复。当该修复无法完成时,p53会促使凋亡相关蛋白如Fas、Apaf-1、Bax等的表达,进而导致细胞凋亡。另外,p53能够与Bcl-xL、Bcl-2的结合或者直接结合并激活Bak,诱导Bak寡聚,进而导致细胞色素C释放和促进细胞凋亡。细胞内的ROS浓度增加,会促使p53基因表达升高,进而促进细胞凋亡[28]。p38丝裂原活化蛋白激酶(p38MAPK)是丝氨酸/苏氨酸激酶高度相关的蛋白激酶超家族,其是细胞内一种重要的信号传导系统,能够被LPS所激活。p38MAPK能够通过提高c-myc表达、磷酸化p53、参与Fas/Fasl介导的凋亡、诱导Bax转位和增强TNF-α表达等来促进细胞凋亡[29]。从本试验发现,在LPS刺激下,p53和p38蛋白的表达升高,而添加苜蓿黄酮能够抑制它们的表达。说明在LPS刺激下,苜蓿黄酮可能通过降低细胞内的ROS浓度,抑制p53和p38蛋白的表达,进而抑制细胞的凋亡。
在LPS刺激下,苜蓿黄酮能够降低奶牛乳腺上皮细胞内ROS的浓度,抑制p53和p38等凋亡蛋白的表达,从而抑制细胞凋亡,提高细胞活性。另外,苜蓿黄酮可能通过抑制TLR2/MyD88/p38信号,进而降低TNF-ɑ、IL-1β和IL-6等炎症因子基因的表达,从而发挥抗炎症的作用。
References:
[1] Piotrowska-Tomala K K, Siemieniuch M J, Szóstek A Z,etal. Lipopolysaccharides, cytokines, and nitric oxide affect secretion of prostaglandins and leukotrienes by bovine mammary gland epithelial cells. Domestic Animal Endocrinology, 2012, 43(4): 278-288.
[2] Shi H, Guo Y, Liu Y,etal. Theinvitroeffect of lipopolysaccharide on proliferation, inflammatory factors and antioxidant enzyme activity in bovine mammary epithelial cells. Animal Nutrition, 2016, 2(2): 99-104.
[3] Sun Y, Li L, Wu J,etal. Bovine recombinant lipopolysaccharide binding protein (BRLBP) regulated apoptosis and inflammation response in lipopolysaccharide-challenged bovine mammary epithelial cells (BMEC). Molecular Immunology, 2015, 65(2): 205-214.
[4] Zhu L P, Yang W H, Ren T T,etal. The expression of NF-κB and IκB-α induced by LPS in bovine mammary epithelial cells. Chinese Journal of Veterinary Medicine, 2016, 52(5): 14-17.
朱丽萍, 杨文浩, 任婷婷, 等. 脂多糖诱导奶牛乳腺上皮细胞中炎性因子和核转录子- κB的表达. 中国兽医杂志, 2016, 52(5): 14-17.
[5] Testai L. Flavonoids and mitochondrial pharmacology: A new paradigm for cardioprotection. Life Sciences, 2015, 135: 68-76.
[6] Zhang C, Song Y, Zhang Y,etal. Antagonistic action to inhibition of lipopolysaccharide-treated chondrocyte proliferation and anti-inflammatory action of genistein. Chinese Journal of Biologicals, 2011, 24(2): 184-186.
张城, 宋勇, 张艺, 等. 金雀异黄酮对脂多糖处理的软骨细胞增殖抑制的拮抗及抗炎作用. 中国生物制品学杂志, 2011, 24(2): 184-186.
[7] Jiang N, Zhou X B, Ou G W,etal. Effects of 4′, 5, 7 trihydroxyisoflavone on mRNA expression of ephrinB2 and IL-6 induced by LPS in human aortic en-dothelial cells. Journal of Modern Medicine & Health, 2016, 32(7): 966-968.
姜念, 周雪冰, 欧刚卫, 等. 4′, 5, 7-三羟基异黄酮对LPS诱导的人主动脉内皮细胞ephrinB2及IL-6 mRNA表达的影响. 现代医药卫生, 2016, 32(7): 966-968.
[8] Zhang X, Guo Z, Zhang C,etal. Effect of total flavonoids ofAstragaluson secretion levels of cytokines in LPS-induced RAW264.7 cell. Chinese Veterinary Science, 2015, 45(3): 321-324.
张贤, 郭泽, 张冲, 等. 黄芪总黄酮对脂多糖体外诱导的RAW264.7细胞的细胞因子和NO分泌水平的影响. 中国兽医科学, 2015, 45(3): 321-324.
[9] Gao W W. Study on the Bioactivity of Alfalfa and the Influence Factors to Its Flavonoids and Saponins. Beijing: Chinese Peking Union Medical College, 2004.
高微微. 苜蓿生物活性及影响其黄酮和皂苷成分因素的研究. 北京: 中国协和医科大学, 2004.
[10] Su X S, Zhan J S, Zhan K,etal. Proliferation stimulus and antioxidant effect of alfalfa flavonoids on dairy cow mammary epithelial cells culturedinvitro. Acta Prataculturae Sinica, 2015, 24(12): 139-145.
苏效双, 占今舜, 詹康, 等. 苜蓿黄酮对体外培养的奶牛乳腺上皮细胞增殖与抗氧化的影响. 草业学报, 2015, 24(12): 139-145.
[11] Zhan J S, Wei M J, Su X S,etal. Effects of alfalfa flavonoids on bovine mammary epithelial cell culturesinvitrounder heat stress. Acta Prataculturae Sinica, 2016, 25(4): 159-165.
占今舜, 魏明吉, 苏效双, 等. 苜蓿黄酮对热应激下体外培养奶牛乳腺上皮细胞凋亡的影响. 草业学报, 2016, 25(4): 159-165.
[12] Zhan J S, Liu M M, Zhan K,etal. Effects of alfalfa flavonoids on lactoprotein, milk fat and lactose synthesis in bovine mammary epithelial cells. Chinese Journal of Animal Science, 2017, 53(1): 91-95.
占今舜, 刘明美, 詹康, 等. 苜蓿黄酮对奶牛乳腺上皮细胞乳蛋白、乳脂和乳糖合成的影响. 中国畜牧杂志, 2017, 53(1): 91-95.
[13] Zhan J S, Liu M M, Su X S,etal. Effects of alfalfa flavonoids on the production performance, immune system, and ruminal fermentation of dairy cows. Asian-Australasian Journal of Animal Sciences, 2017, 30(10): 1416-1424.
[14] Liu L X, Lin Y, Zhang L,etal. Cytotoxicity of LPS and effects on milk protein synthesis in dairy cow mammary epithelial cells. Journal of Northeast Agricultural University, 2015, 46(6): 61-66.
刘立新, 林叶, 张莉, 等. 脂多糖对奶牛乳腺上皮细胞毒性作用及乳蛋白合成的影响. 东北农业大学学报, 2015, 46(6): 61-66.
[15] Wang H, Meng X, Qiu C W,etal. The innate immune responses of bovine mammary epithelial cells stimulated by lipopolysaccharide. Chinese Journal of Veterinary Science, 2010, 30(3): 398-401.
王亨, 孟霞, 邱昌伟, 等. 脂多糖诱导奶牛乳腺上皮细胞先天性免疫反应. 中国兽医学报, 2010, 30(3): 398-401.
[16] Chen J, Wang G L, Li L,etal. Effects of estrogen on proliferation and antioxidation in bovine (Bostaurus) mammary epithelial cells. Journal of Agricultural Biotechnology, 2013, 21(2): 216-222.
陈静, 王根林, 李莲, 等. 雌激素对奶牛乳腺上皮细胞增殖及抗氧化性的影响. 农业生物技术学报, 2013, 21(2): 216-222.
[17] Zhu J M, Li N, Zhang Y J,etal. The research progress of alfalfa flavonoids. Prataculturae Science, 2009, 26(9): 156-162.
朱见明, 李娜, 张亚军, 等. 苜蓿黄酮的研究进展. 草业科学, 2009, 26(9): 156-162.
[18] Chanput W, Krueyos N, Ritthiruangdej P. Anti-oxidative assays as markers for anti-inflammatory activity of flavonoids. International Immunopharmacology, 2016, 40: 170-175.
[19] Wang X Q, Ji G Y, Jiang Z Q. Effects of genistein on inflammatory factors, adenosine monophosphate-activated protein kinase phosphorylation in lipopolysaccharides-treated RAW264. 7 cells. Acta Nutrimenta Sinica, 2012, 34(2): 177-180.
王小倩, 纪桂元, 蒋卓勤. 染料木黄酮对脂多糖诱导的RAW264. 7细胞炎症因子、腺苷酸激活蛋白激酶磷酸化的影响. 营养学报, 2012, 34(2): 177-180.
[20] Zhang D D, Ling S, Zhang H P,etal. The study on mechanism of the total flavonoids fromDaphnegenkwa. Shanghai Journal of Traditional Chinese Medicine, 2010, 8: 58-62.
章丹丹, 凌霜, 张洪平, 等. 芫花总黄酮的抗炎机制研究. 上海中医药杂志, 2010, 8: 58-62.
[21] Gao M, Ao Y, Luan X H. Progress on negative regulatory mechanism of Toll-like receptor signal transduction. Progress in Veterinary Medicine, 2015, 36(1): 96-101.
高明, 敖越, 栾新红. Toll样受体信号转导的负调控机制研究进展. 动物医学进展, 2015, 36(1): 96-101.
[22] Li H, Wang Q, Chen X M,etal. Mangiferin inhibits lipopolysaccharide-induced production of interleukin-6 in human oral epithelial cells by suppressing toll-like receptor signaling. Archives of Oral Biology, 2016, 71: 155-161.
[23] Feng G, Sun B, Li T Z. Daidzein attenuates lipopolysaccharide-induced acute lung injury via toll-like receptor 4/NF-kappaB pathway. International Immunopharmacology, 2015, 26(2): 392-400.
[24] Sun J Y, Li D L, Yan D,etal. Baicalin inhibits toll-like receptor 2/4 expression and downstream signaling in rat experimental periodontitis. International Immunopharmacology, 2016, 36: 86-93.
[25] Chen H, Mo X, Yu J,etal. Alpinetin attenuates inflammatory responses by interfering toll-like receptor 4/nuclear factor kappa B signaling pathway in lipopolysaccharide-induced mastitis in mice. International Immunopharmacology, 2013, 17(1): 26-32.
[26] Zhang C H, Wang Y H, Wang C W,etal. Reactive oxygen species participated in the activation induced cell apoptosis of mice macrophage RAW264.7 provoked by LPS. Chinese Journal of Veterinary Medicine, 2014, 50(11): 24-27.
张宸豪, 王月华, 王长文, 等. 活性氧参与脂多糖诱导小鼠巨噬细胞RAW264.7活化诱导凋亡. 中国兽医杂志, 2014, 50(11): 24-27.
[27] Deng W, Liu Y, Chen C G,etal. Effect of hesperetin on the level of reactive oxygen speries in H9C2 cardiomyocytes which induced by lipopolysaccharide. Journal of Medical Research, 2014, 43(11): 36-38.
邓伟, 刘源, 陈昌贵, 等. 橙皮素对脂多糖诱导H9C2心肌细胞活性氧水平的影响. 医学研究杂志, 2014, 43(11): 36-38.
[28] Li W J, Pan Q J, Li M Y. Research progress of p53 gene and its function. Letters in Biotechnology, 2014, 25(2): 282-285.
李文娟, 潘庆杰, 李美玉. p53基因及其功能研究进展. 生物技术通讯, 2014, 25(2): 282-285.
[29] Zhuang Q Y, Liu J, Han J H. Functions and mechanisms of the p38 MAP Kinase pathway. Chinese Journal of Cell Biology, 2013, 35(2): 123-133.
庄秋宇, 刘俊, 韩家淮. p38丝裂原活化蛋白激酶的功能与调控机制. 中国细胞生物学学报, 2013, 35(2): 123-133.
