放牧强度对若尔盖高寒草甸土壤有机质和微生物的影响
2018-01-19常晶晶徐丽薛晶月杨浩何念鹏张晋京
常晶晶,徐丽,薛晶月,杨浩,何念鹏,张晋京
(1.吉林农业大学资源与环境学院,吉林 长春 130118;2.中国科学院地理科学与资源研究所生态系统网络观测与模拟重点实验室,北京 100101;3.中国科学院成都生物研究所,四川 成都 610041)
土壤不仅是植物生长的载体,也是植物生长必需养分的供给者;长远来说,土壤有机质与微生物的结构(或含量),将很大程度影响和制约区域的植被生产力[1-2]。土壤有机质是植物和微生物养分供应的重要组分,也是衡量土壤肥力水平的一项重要指标[3]。同时,土壤微生物虽然只占土壤有机质3%左右,但作为动植物残体和土壤有机质转化的重要驱动力,在土壤有机质周转和养分循环中起着重要作用[4]。土壤微生物含量丰富且种类繁多,作为土壤环境变化的敏感指标,能够反映土壤受扰动情况[5-6]。
若尔盖高寒草甸位于青藏高原东缘,是我国高寒草地生态系统的重要组成部分[7]。过去几十年,受自然环境和人类活动影响,如全球暖化、鼠害、过度放牧、人类生产生活等,导致该地区高寒草甸生态系统严重退化,对土壤和植被生产力均造成显著影响[8-13]。近年来,科学家围绕放牧对高寒草甸生态系统地上植被的影响方面开展了一系列研究工作[14-18],然而,当前有关不同放牧强度对若尔盖高寒草甸土壤肥力和微生物结构特征影响的研究却较少。
许多研究已表明在青藏高原地区通过控制放牧强度、降低鼠害等措施能显著增加草地植被覆盖度[19-20]。因此,本研究以草地植被盖度作为放牧强度的划分依据,从植被、土壤和微生物角度系统地分析探讨了不同放牧强度对土壤有机质和土壤微生物含量、结构的影响,为高寒草甸退化治理、生态脆弱带高寒草甸的可持续发展提供一些启示。
1 材料与方法
1.1 研究区域概况
若尔盖位于青藏高原的东缘,地理坐标于E 102°08′-103°39′,N 32°56′-34°19′之间,海拔3400~3800 m,平均3500 m。该地区属大陆性高原寒温带湿润半湿润季风气候,严寒湿润、霜冻期长、四季变化不明显[21]。年平均气温0.7 ℃,年平均降水量656.8 mm,年均日照长度2389 h,年均蒸发量1232 mm。高寒草甸植被以高山嵩草(Kobresiapygmaea)、垂穗披碱草(Elymusnutans)、早熟禾(Poapratensis)、蓼属(Polygonumspp.)等植物为主[22]。
1.2 野外取样
2013年7月中下旬,在四川省若尔盖县典型高寒草甸内,以封育样地为中心,根据植被退化状况,分别设置了3条样带(1~2 km);根据不同植被覆盖度在每条样带设置了5个样地(20 m×20 m),分别代表其植被盖度为0%~20%、20%~40%、40%~60%、60%~80%和80%~100%共5个干扰强度(D1,D2,D3,D4,D5,干扰强度逐渐降低)。在每个样地,随机设置了3个调查样方(50 cm×50 cm);其中,3个样方分物种调查盖度、高度、频度,并齐地面收获每个物种的地上部分,在65 ℃烘干至恒重后测定地上生物量。随后,用直径为7 cm土钻,钻取0~10 cm土壤样品。土壤样品过2 mm筛,手工挑去可见的根系、凋落物碎屑及小石粒等。
1.3 室内测试
1.3.1土壤理化性质的测定 土壤pH、氧化还原电位、电导率采用1∶2.5的土水比,用ULTRAMETERⅡTM6PFCEpH计测定。利用variou MAX CN元素分析仪测定土壤全氮(total nitrogen, TN)和全碳(total carbon, TC)。土壤有机质(soil organic matters, SOM)含量采用重铬酸钾容量法测定[23]。
1.3.2土壤微生物群落组成的测定 土壤微生物群落结构组成采用磷脂脂肪酸生物标记法(PLFA)进行测定[24]。具体实验步骤如下:称取相当于 8 g 干土重的鲜土(根据含水量进行调整),加入磷酸缓冲液(体积=5 mL-土壤含水量mL)、6 mL三氯甲烷和12 mL甲醇,振荡2 h。在25 ℃下,离心(10 min,3000 r·min-1),将上层离心液倒入分液漏斗,同时加12 mL三氯甲烷和12 mL磷酸缓冲液到分液漏斗中,静置分层,吸取下层有机相;上述过程重复提取2次。将提取的混合溶液置于硅胶柱中,分别用三氯甲烷,丙酮和甲醇冲洗。弃去氯仿和丙酮洗出液,将甲醇洗出液(磷脂脂肪酸)吹干(32 ℃水浴和N2浓缩)。然后,在碱性条件下水解为磷脂脂肪酸甲酯;再利用TRACE GC Ultra TM色谱仪进行测定。在上机测试前,消解液密封放入冰箱-20 ℃保存。
根据测定数据计算细菌、真菌、放线菌 PLFAs的浓度(nmol·g-1干重),具体是以每种磷脂脂肪酸的百分比反映各样品中细菌、真菌和放线菌等的相对含量,以磷脂脂肪酸的总浓度(nmol·g-1干重)表示微生物生物量。
实验测定各干扰强度样地土壤中的PLFA均含17种(16:0、18:0、14:0、15:0、17:0、16:1w7c、cy17:0、cy19:0、i15:0、a15:0、i16:0、i17:0、18:2w6、18:1w9c、10Me16:0、10Me18:0、20:00),其中属于细菌的磷脂脂肪酸生物标记:16:0、18:0、14:0、15:0、17:0[24];属于真菌的磷脂脂肪酸生物标记:18:2w6、18:1w9c[25];属于放线菌的磷脂脂肪酸生物标记:10Me16:0、10Me18:0[25];属于革兰氏阳性菌(G+)的磷脂脂肪酸生物标记:i15:0、a15:0、i16:0、i17:0[26];属于革兰氏阴性菌(G-)的磷脂脂肪酸生物标记:cy17:0、cy19:0[26];20:00代表其他微生物[25]。
1.4 实验数据处理与分析
1.4.1植被物种多样性及微生物多样性指数的计算 本研究将物种丰富度(S)、多样性Shannon-Wiener指数(H)、Pielou均匀度指数(J)通过相关系数,分析各指数的相关性。各指数的计算方法如下[27-29]:
1)Shannon-Wiener指数(H): 植被物种多样性指数与土壤微生物多样性指数均以本公式计算得到。
式中:Pi=Ni/N,Ni为种i的个体数,N为所在群落的所有物种的个体数之和;S为所在群落中物种出现的频次, 即丰富度。
2)Pielou均匀度指数(J)
式中:S为丰富度。
1.4.2数据处理 采用SPSS 17软件,对不同干扰强度下的土壤理化性质和微生物量进行数据处理与统计分析。采用单因素方差(one-way ANOVA )和Duncan检验不同放牧强度下植被的物种丰富度指数、多样性指数、均匀度指数、土壤理化性质、微生物含量及微生物多样性指数间的差异。以微生物群落的各磷脂脂肪酸生物标记浓度为样本对不同干扰强度进行聚类分析,其中采用欧氏距离中的最近距离法计算。用Pearson 相关系数分析地上植被、土壤理化性质及微生物各因子间的相关性。统计分析的显著水平为P=0.05。
2 结果与分析
2.1 放牧强度对高寒草甸地上植被的影响
随着放牧强度的减弱,优势种变化不明显,植被高度在放牧强度最低的D5处达到最大(7.10 cm),植被盖度显著增加,地上生物量越来越大(表1),D1、D4、D5之间差异显著(P<0.05)。植被的物种丰富度指数随放牧强度减弱呈上升趋势,而物种均匀度指数趋势相反(图1),在D5处最小,且D1、D2、D3和D4之间差异不显著(P>0.05)。物种多样性指数表现为D4>D2>D3>D1>D5。
2.2 放牧强度对高寒草甸土壤理化性质的影响
整体来看,随着放牧强度的减弱,土壤有机质含量、土壤全碳、全氮含量和土壤碳氮比呈增加趋势,在D5处达到最大值,其中不同放牧强度间土壤全碳含量均差异显著(表2,P<0.05),土壤有机质含量在D1、D3、D4、D5处差异显著,土壤全氮含量D1、D2、D4之间差异不显著,D3和D5差异不显著。高寒草甸土壤整体呈酸性,电导率和氧化还原电位等均在放牧强度较轻(D5)时更大。
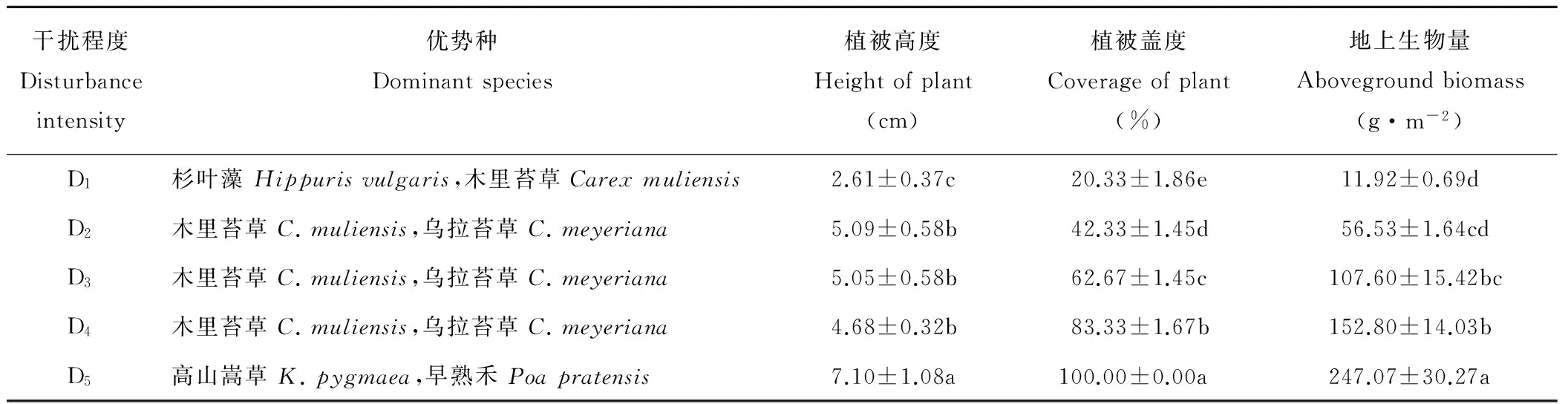
表1 不同放牧强度下草地植物群落优势种、高度、盖度、地上生物量的变异(平均值±标准偏差,n=3)Table 1 The dominant species, height, coverage, and aboveground biomass of plant under different grazing intensity (mean±SD, n=3)
注:同列不同字母表示差异显著 (P<0.05)。下同。
Note: Different small letters in the same column indicate significant differences at theP<0.05 level. The same below.

图1 不同放牧程度若尔盖高寒草甸的植被物种丰富度指数、多样性指数及均匀度指数(平均值±标准偏差,n=3)Fig.1 The richness diversity, Shannon-Wiener diversity and Pielou evenness indices of vegetation species under different grazing intensity (mean±SD, n=3) 不同字母表示差异显著 (P<0.05)。下同。Different letters indicate significant differences at the P<0.05 level. The same below.
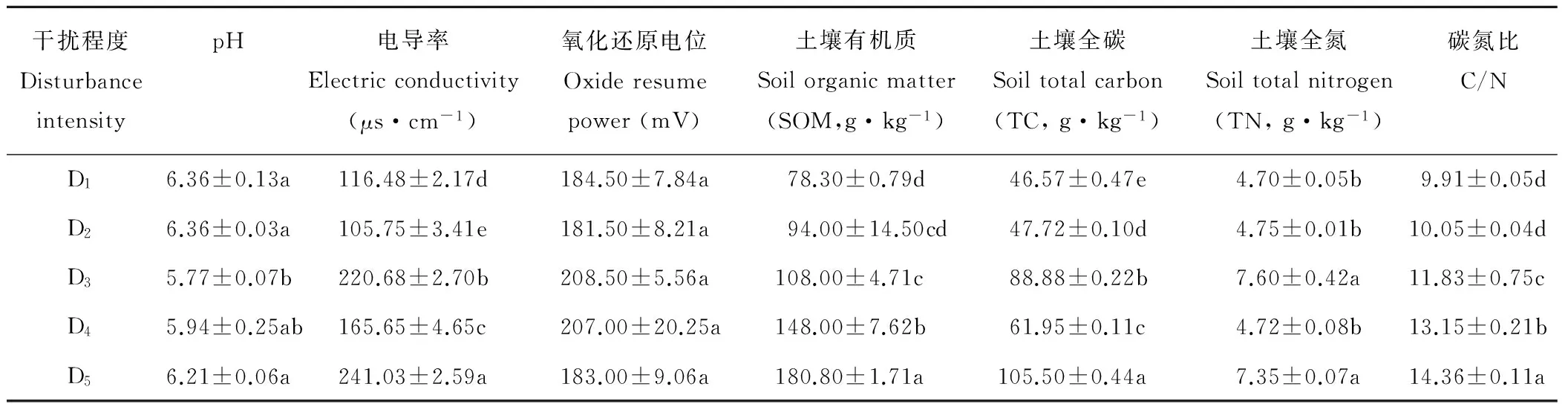
干扰程度DisturbanceintensitypH电导率Electricconductivity(μs·cm-1)氧化还原电位Oxideresumepower(mV)土壤有机质Soilorganicmatter(SOM,g·kg-1)土壤全碳Soiltotalcarbon(TC,g·kg-1)土壤全氮Soiltotalnitrogen(TN,g·kg-1)碳氮比C/ND16.36±0.13a116.48±2.17d184.50±7.84a78.30±0.79d46.57±0.47e4.70±0.05b9.91±0.05dD26.36±0.03a105.75±3.41e181.50±8.21a94.00±14.50cd47.72±0.10d4.75±0.01b10.05±0.04dD35.77±0.07b220.68±2.70b208.50±5.56a108.00±4.71c88.88±0.22b7.60±0.42a11.83±0.75cD45.94±0.25ab165.65±4.65c207.00±20.25a148.00±7.62b61.95±0.11c4.72±0.08b13.15±0.21bD56.21±0.06a241.03±2.59a183.00±9.06a180.80±1.71a105.50±0.44a7.35±0.07a14.36±0.11a
2.3 放牧强度对土壤微生物的影响
实验测定各放牧强度样地土壤中的PLFA均含17种(图2),除16:1w7c、18:2w6和18:1w9c外,其余磷脂脂肪酸生物标记均在D5处含量最高,在D2处含量最低;而16:1w7c在D4处含量最高,D3最低。18:1w9c和10Me18:0在不同放牧强度下含量均小于0.05 nmol·g-1。
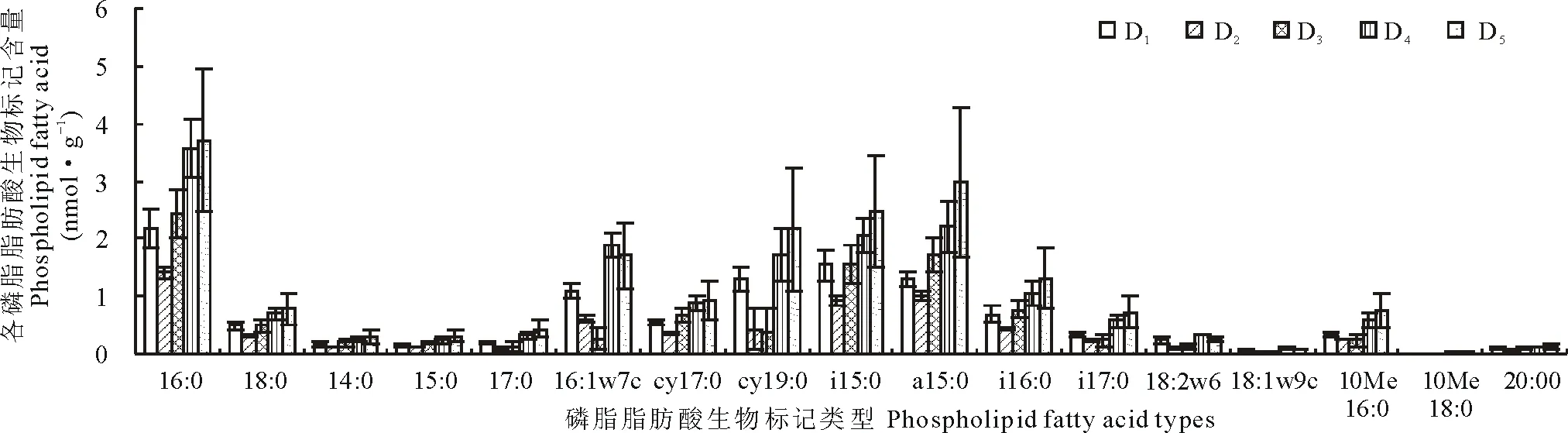
图2 不同放牧强度下磷脂脂肪酸含量变化(平均值±标准偏差,n=3)Fig.2 Changes of phospholipid fatty acid (PLFA) in different grazing intensity (mean±SD, n=3)
土壤磷脂脂肪酸总含量及各类微生物含量(真菌、细菌、放线菌)总体上随着放牧强度的增加呈现先降低后增加的变化趋势,其中细菌含量>放线菌含量>真菌含量(图3)。在D2处,细菌、真菌、放线菌含量均最低;在放牧强度最轻的D5样地,土壤细菌、真菌和放线菌含量最高(图3)。各类微生物含量中D2与D5之间均具有显著差异(图3,P<0.05)。不同放牧强度下,革兰氏阳性菌(G+)含量大于革兰氏阴性菌(G-)含量(图4),且均在D5处达到最大值,D2处最小。不同放牧强度下,G+与G-含量比各不相同,在D3处最大,D4处最小。
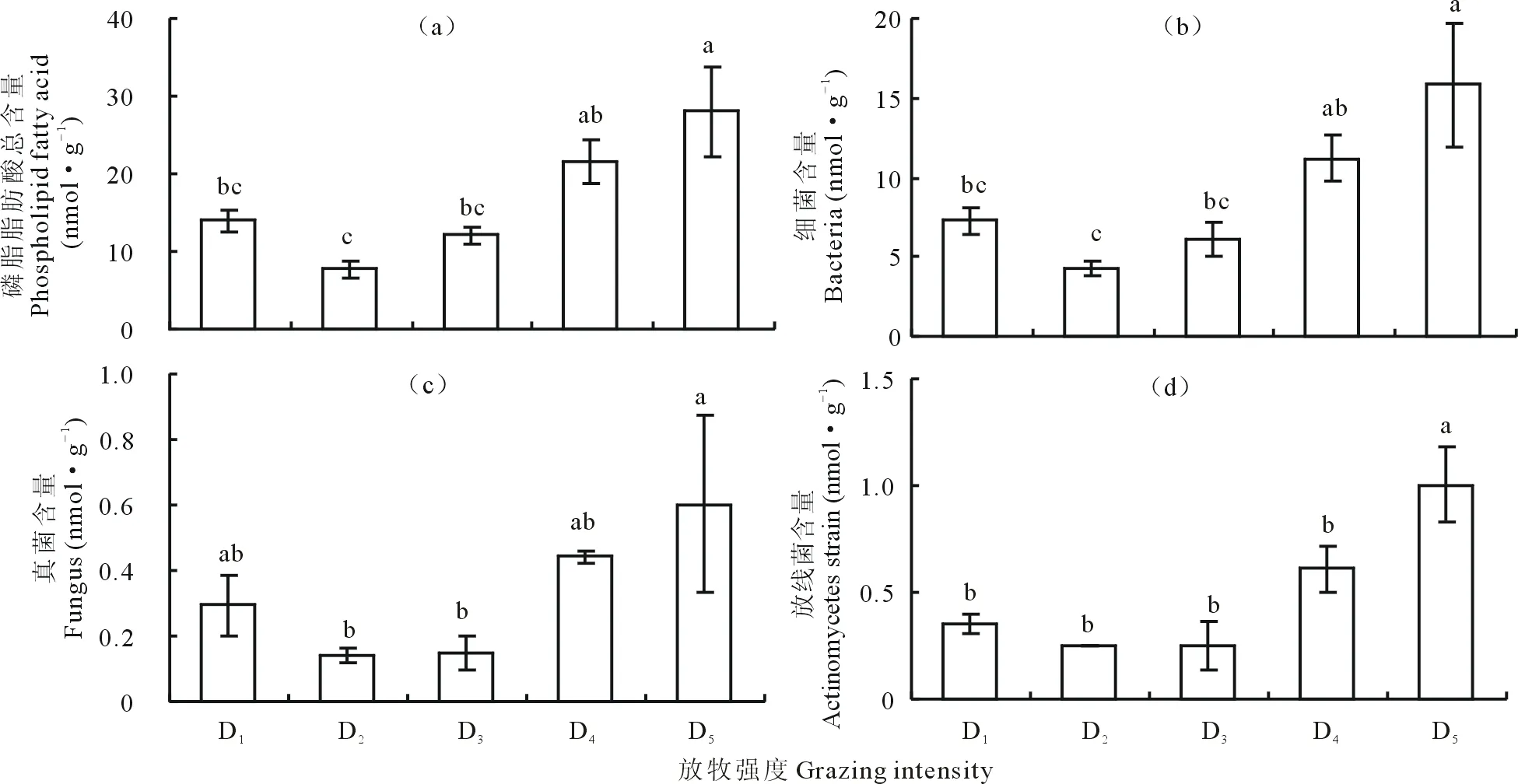
图3 不同干扰程度下若尔盖高寒草甸土壤中磷脂脂肪酸总含量、细菌、真菌及放线菌数量变化(平均值±标准偏差,n=3)Fig.3 Content of PLFA, bacteria, fungi and actinomycetes under grazing disturbances in Zoige alpine meadow soil (mean±SD, n=3)
以磷脂脂肪酸生物标记作为数量测度,引入生态学多样性指数的计算方法得到的微生物多样性指数表现为D5>D4>D1>D2>D3,且D2与其他放牧强度差异均不显著(P>0.05),D3与D1、D4、D5之间差异显著(图5,P<0.05)。微生物群落生物标记的聚类分析能清晰直观地反映不同放牧强度之间的远近关系,其中D4与D5之间的欧氏距离最短(图6),可以将其分为2类:第1类,D4和D5,具有较高的微生物物种多样性指数;第2类,D1、D2和D3,具有相对较低的微生物物种多样性指数。
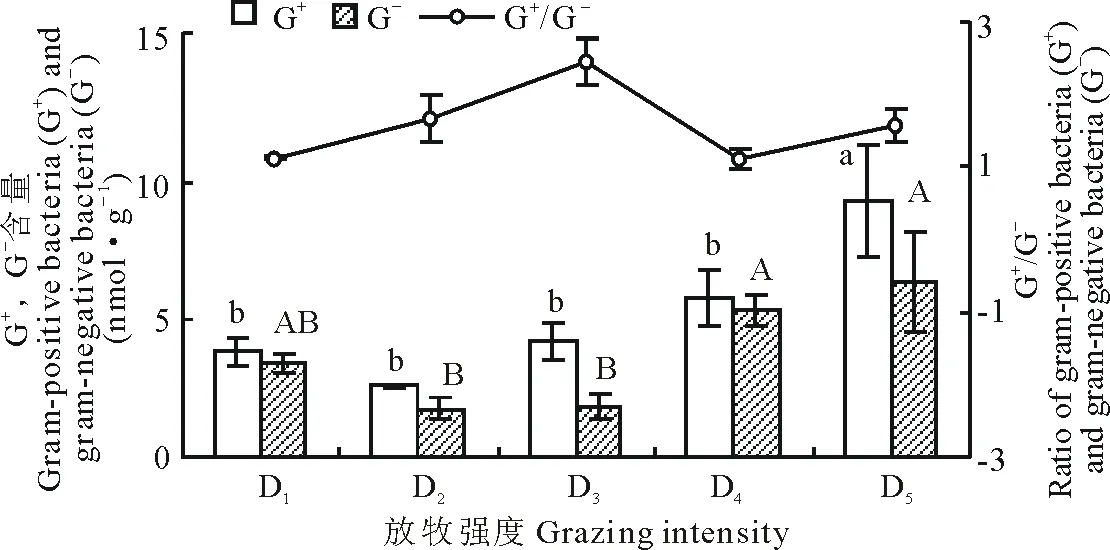
图4 不同放牧程度下若尔盖高寒草甸土壤中革兰氏阳性菌(G+)及革兰氏阴性菌(G-)含量及G+/G-的变化(平均值±标准偏差,n=3)Fig.4 Changes of gram-positive bacteria (G+), gram-negative bacteria (G-)and G+/G- under different grazing intensity in Zoige alpine meadow soil (mean±SD, n=3)
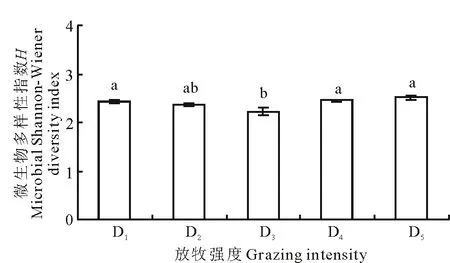
图5 不同放牧强度下若尔盖高寒草甸土壤微生物的多样性指数(平均值±标准偏差,n=3)Fig.5 Changes of soil microbial Shannon-Wiener diversity index in Zoige alpine meadow soil under different grazing intensity (mean±SD, n=3)
2.4 土壤微生物与地上植被和土壤有机质的关系
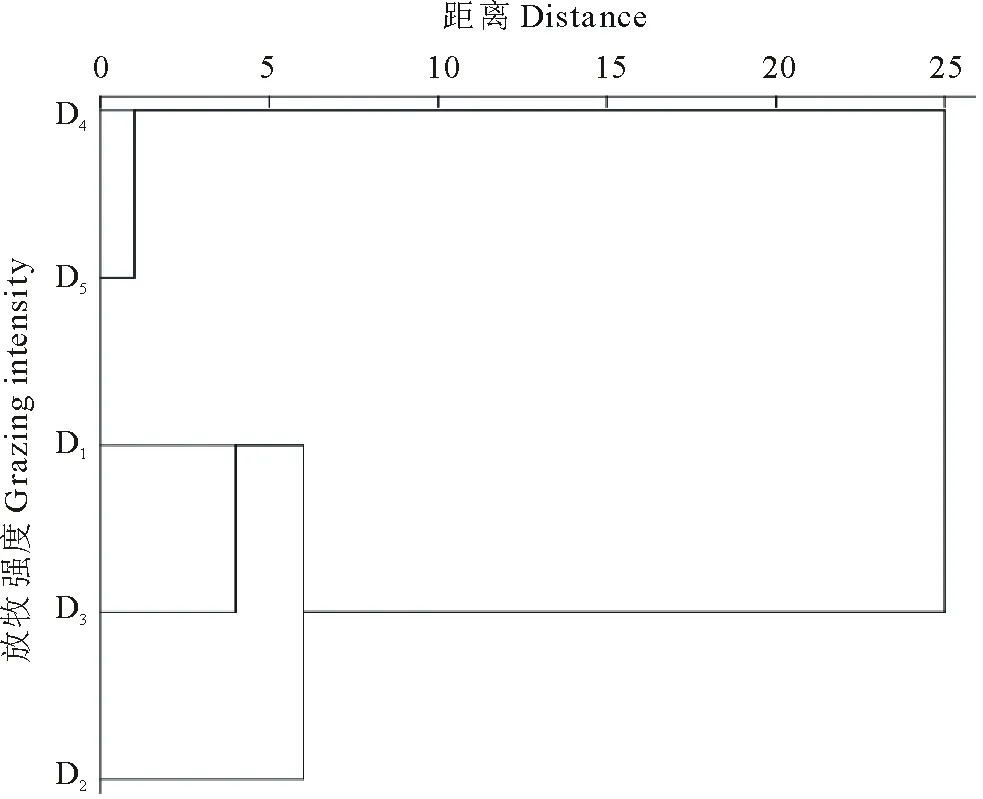
图6 基于微生物群落PLFAs生物标记对不同放牧强度的聚类分析 Fig.6 Cluster analysis of PLFAs based on microbial community for different grazing intensity plots
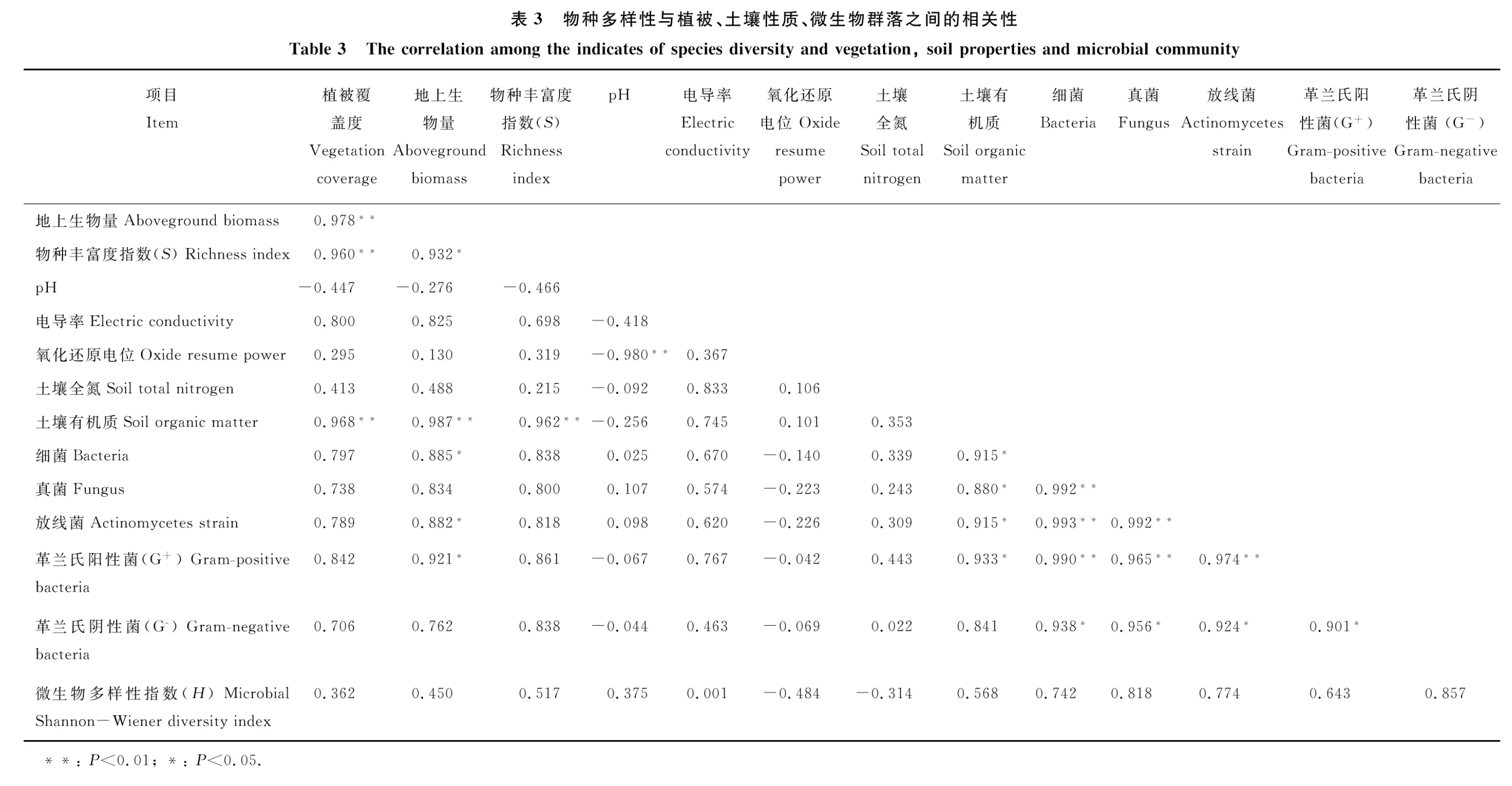
植被覆盖度与地上生物量、物种丰富度和土壤有机质呈极显著的正相关关系(表3,P<0.01)。地上生物量与土壤有机质呈极显著的正相关关系(表3,P<0.01);与物种丰富度呈显著的正相关关系。土壤细菌、放线菌、革兰氏阳性菌(G+)随地上生物量的增加显著增加(P<0.05);真菌与地上生物量呈正相关关系,但不显著。植被的物种丰富度与土壤有机质呈极显著的正相关关系(P<0.01);pH与氧化还原电位呈极显著负相关关系(P<0.01);细菌、真菌、放线菌和G+之间呈极显著的正相关关系(P<0.01),与革兰氏阴性菌(G-)呈显著正相关关系(表3,P<0.05),且均与有机质呈显著正相关关系(P<0.05)。
3 讨论
3.1 高寒草甸土壤有机质对放牧强度的响应机制
高寒草甸在不同放牧干扰下逐渐退化,且土壤的化学性质也随之改变。若尔盖高寒草甸的土壤有机质含量随着放牧强度的增加逐渐降低,不同放牧强度下土壤有机质含量间差异显著(P<0.05),变化范围为78.3~180.8 g·kg-1。放牧干扰强度影响土壤容重,主要表现为牲畜的踩踏使得土壤孔隙减少,土壤容重增加[30]。此外,牲畜践踏和取食也会破坏植被、毁坏幼苗,造成植被盖度下降和以凋落物形式进入土壤的有机质输入量降低[31-32]。罗亚勇等[7]研究甘肃省玛曲县不同退化程度高寒草甸时发现土壤有机质含量随退化程度的增强而逐渐降低;Yao等[33]发现青海省的高寒草甸土壤有机碳含量随着草地退化程度的增强而降低。本研究结果与此一致,其原因是高寒草甸土壤-植被是草地生态系统结构和功能的基础,高寒草甸土壤有机质主要来源于植被枯枝落叶、根系、微生物体及其分解合成的腐殖质;土壤又为植物生长提供养分、水分等生长必需品,因此当干扰强度较小时,植被覆盖度增加,枯枝落叶等向土壤输入的有机质也随之增加。
3.2 放牧干扰对土壤微生物群落的影响
随着放牧强度的增强,若尔盖高寒草甸土壤微生物含量整体表现为逐渐降低的趋势,这与谭红妍等[34]的研究结果相近。出现这一现象的原因可能是:1)微生物生长所需要的养分主要来源于土壤有机质的分解,而土壤有机质随放牧强度的增强而减少。2)植被与土壤微生物之间存在竞争关系,当植被较少时,竞争较小,土壤养分多被微生物利用。3)根据谢尔福德耐性定律(Shelford):任何一种环境因子对生物都有一个耐受性范围,生物的机能在最适点或接近最适点时发生作用,趋向这两端时就减弱,进而抑制,即土壤微生物对环境因素有一定的需求范围,当低于或高于这一范围时,微生物难以存活或活性显著下降。4)共生、互生、捕食等关系存在于土壤微生物之间,同时还存在一定的拮抗作用,即可能某种细菌产生挥发性产物,影响其他微生物的生长和酶活性等[35]。需要指出的是:本研究只在植被生长高峰期进行了取样,难以揭示微生物群落变化的季节动态,需要在未来研究中给予关注。由于所设置3条样带距离仅在几公里范围之内,其不同季节的温度、水分等因素的变化规律基本相似,因此,本研究结论能较好地反映放牧干扰对若尔盖高寒草甸土壤微生物影响的整体趋势,类似的研究结果已在内蒙古典型草地被报道[34]。
土壤微生物与地上植被密切相关,地上植被通过影响有机质输入调控土壤有机质含量,进而影响土壤微生物。Hu等[36]研究发现喀斯特地貌地区植树造林后土壤微生物含量增加,本研究在若尔盖高寒草甸地区的实验结果与此类似。土壤微生物主要受土壤有机质的影响,石红霄等[37]的研究证实了青藏高原较适的土壤有机质含量促进土壤微生物的生长。焦晓光等[38]在研究不同有机质含量的农田土壤微生物的生态特征时发现随着土壤有机质的增加,细菌和放线菌含量显著升高,而真菌含量随有机质含量的增加而降低。此外,土壤颗粒大小不同对土壤微生物含量也存在一定的影响,小于细菌自身直径3倍的孔隙中不存在细菌,细菌主要存在于0.5~5.0 μm大小的孔隙中,而真菌主要生存在相对较大的孔隙内[35]。
4 结论
本研究利用聚类分析揭示了不同放牧干扰强度之间土壤微生物群落结构(含量)的远近关系,探讨了不同放牧强度对土壤有机质和微生物的响应机制,同时也分析探讨了植被-土壤-微生物群落之间的相关性。本研究发现随着放牧强度的增加,土壤有机质及各类土壤微生物含量均呈降低的变化趋势,因此建议当地牧民能适当降低放牧强度以保护土壤肥力的长期供应能力。此外,该研究从提高土壤肥力的角度为治理已退化高寒草甸提供了部分理论依据,也建议未来在治理和评估已退化高寒草甸的恢复成效时,应考虑土壤有机质和土壤微生物等反映土壤质量的指标。
References:
[1] Lal R. Soil carbon sequestration impacts on global climate change and food security. Science, 2004, 304(5677): 1623-1627.
[2] van der Heijden M G A, Bardgett R D, van Straalen N M. The unseen majority: soil microbes as drivers of plant diversity and productivity in terrestrial ecosystems. Ecology Letters, 2008, 11(3): 296-310.
[3] Bremer E, Janzen H H, Johnston A M. Sensitivity of total, light fraction and mineralizable organic matter to management practices in a lethbridge soil. Canadian Journal of Soil Science, 1994, 74(2): 131-138.
[4] Garcia C, Hernandez T. Impacts of carbon and flooding on soil microbial communities: phospholipid fatty acid profiles and substrate utilization patterns. Microbial Ecology, 1997, 35: 265-278.
[5] Wu Y P, Ma B, Zhou L,etal. Changes in the soil microbial community structure with latitude in eastern China, based on phospholipid fatty acid analysis. Applied Soil Ecology, 2009, 43(2/3): 234-240.
[6] Brockett B F T, Prescott C E, Grayston S J. Soil moisture is the major factor influencing microbial community structure and enzyme activities across seven biogeoclimatic zones in western Canada. Soil Biology & Biochemistry, 2012, 44(1): 9-20.
[7] Luo Y Y, Meng Q T, Zhang J H,etal. Species diversity and biomass in relation to soil properties of alpine meadows in the eastern Tibetan Plateau in different degradation stages. Journal of Glaciology and Geocryology, 2014, 36(5): 1298-1305.
罗亚勇, 孟庆涛, 张静辉, 等. 青藏高原东缘高寒草甸退化过程中植物群落物种多样性、生产力与土壤特性的关系. 冰川冻土, 2014, 36(5): 1298-1305.
[8] Wang M, Li Y, Bai X Z,etal. The impact of global warming on vegetation resources in the hinterland of the Qinghai-Tibet Plateau. Journal of Natural Resources, 2004, 19(3): 331-336.
王谋, 李勇, 白宪洲, 等. 全球变暖对青藏高原腹地草地资源的影响. 自然资源学报, 2004, 19(3): 331-336.
[9] Cui Q H, Jiang Z G, Liu J K,etal. A review of the cause of rangeland degradation on Qinghai-Tibet plateau. Pratacultural Science, 2007, 24(5): 20-26.
崔庆虎, 蒋志刚, 刘季科, 等. 青藏高原草地退化原因述评. 草业科学, 2007, 24(5): 20-26.
[10] Wang J B, Zhang D G, Cao G M,etal. Regional characteristics of the alpine degradation succession on the Qinghai-Tibetan plateau. Acta Prataculturae Sinica, 2013, 22(2): 1-10.
王建兵, 张德罡, 曹广民, 等. 青藏高原高寒草甸退化演替的分区特征. 草业学报, 2013, 22(2): 1-10.
[11] Li X L, Gao J, Brierley G,etal. Rangeland degradation on the Qinghai-Tibet plateau: implications for rehabilitation. Land Degradation & Development, 2013, 24(1): 72-80.
[12] Qin Y, Chen J J, Yi S H. Plateau pikas burrowing activity accelerates ecosystem carbon emission from alpine grassland on the Qinghai-Tibetan Plateau. Ecological Engineering, 2015, 84: 287-291.
[13] Harris R B. Rangeland degradation on the Qinghai-Tibetan plateau: a review of the evidence of its magnitude and causes. Journal of Arid Environments, 2010, 74(1): 1-12.
[14] Wang B S, Ga M J, Zhang Y. Study on the forming mechanism of “black beach” degraded alpine meadow on Qinghai-Tibetan plateau and the research progress on its restoration. Grassland and Turf, 2007, (2): 72-77.
王宝山, 尕玛加, 张玉. 青藏高原“黑土滩”退化高寒草甸草原的形成机制和治理方法的研究进展. 草原与草坪, 2007, (2): 72-77.
[15] Lan Y R. Introduction trial on australianoat swan in Guinan, Qinghai. Qinghai Prataculture, 2004, 13(1): 27-30.
兰玉蓉. 青藏高原高寒草甸草地退化现状及治理对策. 青海草业, 2004, 13(1): 27-30.
[16] Zhao G F, Yu C Q, Wu J X,etal. Research progress on restoration and management of degraded alpine meadow in Qinghai-Tibet plateau. Guizhou Agricultural Sciences, 2013, 41(5): 125-129.
赵贯锋, 余成群, 武俊喜, 等. 青藏高原退化高寒草地的恢复与治理研究进展. 贵州农业科学, 2013, 41(5): 125-129.
[17] Jiao J C, Yang W Q, Zhong X,etal. Factors of retrogradation in Ruoergai Wetland and its conservation strategies. Journal of Sichuan Forestry Science and Technology, 2007, 28(1): 98-103.
焦晋川, 杨万勤, 钟信, 等. 若尔盖湿地退化原因及保护对策. 四川林业科技, 2007, 28(1): 98-103.
[18] Dong Q M, Zhao X Q, Wu G L,etal. A review of formation mechanism and restoration measures of “black-soil-type” degraded grassland in the Qinghai-Tibetan Plateau. Environmental Earth Sciences, 2013, 70(5): 2359-2370.
[19] Wang D, Liu Y, Wu G L,etal. Effect of rest-grazing management on soil water and carbon storage in an arid grassland (China). Journal of Hydrology, 2015, 527: 754-760.
[20] Munoz M A, Faz A, Acosta J A,etal. Effect of south American grazing camelids on soil fertility and vegetation at the Bolivian Andean grasslands. Agriculture, Ecosystems & Environment, 2015, 207: 203-210.
[21] Zhao N, Zhang H X, Wang R M,etal. Effect of grazing intensity on temperature sensitivity of soil nitrogen mineralization in Zoige alpine meadow. Acta Ecologica Sinica, 2014, 34(15): 4234-4241.
赵宁, 张洪轩, 王若梦, 等. 放牧对若尔盖高寒草甸土壤氮矿化及其温度敏感性的影响. 生态学报, 2014, 34(15): 4234-4241.
[22] Wu P F, Zhang H Z, Cui L W,etal. Response of soil macrofauna communities to degradation of alpine meadow. Acta Pedologica Sinica, 2013, 50(4): 786-799.
吴鹏飞, 张洪芝, 崔丽巍, 等. 大型土壤动物群落对高寒草甸退化的响应. 土壤学报, 2013, 50(4): 786-799.
[23] Lao J C. Handbook of Soil Chemical Analysis. Beijing: Agriculture Press, 1988.
劳家柽. 土壤农化分析手册. 北京: 农业出版社, 1988.
[24] Xu J W, Yu G R, Zhang H Z,etal. The variations in soil microbial communities, enzyme activities and their relationships with soil organic matter decomposition along the northern slope of Changbai Mountain. Soil Ecology, 2014, 86: 19-29.
[25] Frostegard A, Baath E. The use of phospholipid fatty acid analysis to estimate bacterial and fungal biomass in soil. Biology and Fertility of Soils, 1996, 22(1/2): 59-65.
[26] Djukic I, Zehetner F, Mentler A,etal. Microbial community composition and activity in different alpine vegetation zones. Soil Biology & Biochemistry, 2010, 42(2): 155-161.
[27] Alatalo R V. Problems in the measurement of evenness in ecology. Oikos, 1981, 37(2): 199-204.
[28] Shannon C E. A mathematical theory of communication. Bell System Technical Journal, 1948, 27(3): 379-423.
[29] Zak J C, Willig M R, Moorhead D L,etal. Functional diversity of microbial communities-A quantitative approach. Soil Biology & Biochemistry, 1994, 26(9): 1101-1108.
[30] Jia S H, Wang C Z, Sun Z T,etal. Study on grassland dark sandy chestnut compaction by grazing intensity and grazing season. Acta Agrestia Sinica, 1999, 7(3): 217-221.
贾树海, 王春枝, 孙振涛, 等. 放牧强度和时期对内蒙古草原土壤压实效应的研究. 草地学报, 1999, 7(3): 217-221.
[31] Zeng F P, Peng W X, Song T Q,etal. Changes in vegetation after 22 years’ natural restoration in the karst disturbed area in northwest Guangxi. Acta Ecologica Sinica, 2007, 27(12): 5110-5119.
曾馥平, 彭晚霞, 宋同清, 等. 桂西北喀斯特人为干扰区植被自然恢复22年后群落特征. 生态学报, 2007, 27(12): 5110-5119.
[32] Milchunas D G, Lauenroth W K. Quantitative effects of grazing on vegetation and soils over a global range of environments. Ecological Monographs, 1993, 63(4): 327-366.
[33] Yao Z Y, Zhao C Y, Yang K S,etal. Alpine grassland degradation in the Qilian mountains, China-A case study in Damaying grassland. Catena, 2016, 137: 494-500.
[34] Tan H Y, Yan R R, Yan Y Q,etal. Phospholipid fatty acid analysis of soil microbial communities under different grazing intensities in meadow steppe. Acta Prataculturae Sinica, 2015, 24(3): 115-121.
谭红妍, 闫瑞瑞, 闫玉春, 等. 不同放牧强度下温性草甸草原土壤微生物群落结构PLFAs分析. 草业学报, 2015, 24(3): 115-121.
[35] Hu Y L, Wang S L, Yan S K. Research advances on the factors influencing the activity and community structure of soil microorganism. Chinese Journal of Soil Science, 2006, 37(1): 170-176.
胡亚林, 汪思龙, 颜绍馗. 影响土壤微生物活性与群落结构因素研究进展. 土壤通报, 2006, 37(1): 170-176.
[36] Hu N, Li H, Tang Z,etal. Community size, activity and C∶N stoichiometry of soil microorganisms following reforestation in a Karst region. European Journal of Soil Biology, 2016, 73: 77-83.
[37] Shi H X, Yu J L. Quantity of microbes in the different vegetation types on the Qinghai-Tibetan plateau. Chinese Journal of Soil Science, 2012, 43(1): 47-51.
石红霄, 于健龙. 青藏高原不同植被类型土壤微生物数量及影响因子. 土壤通报, 2012, 43(1): 47-51.
[38] Jiao X G, Gao C S, Sui Y Y,etal. Research on soil microbial ecology under different soil organic matter levels in farmland. Scientia Agricultura Sinica, 2011, 44(18): 3759-3767.
焦晓光, 高崇升, 隋跃宇, 等. 不同有机质含量农田土壤微生物生态特征. 中国农业科学, 2011, 44(18): 3759-3767.
