气相色谱-串联质谱法测定无烟气烟草中N,N-二甲基亚硝胺
2018-01-19,,,,
, , , ,
(上海烟草集团有限责任公司, 上海 200082)
N,N-二甲基亚硝胺(NDMA)是亚硝胺类化合物的一种,可经消化道、呼吸道迅速吸收,经皮肤吸收缓慢,主要引起肝脏损害,具有很强的动物致癌性和致突变性[1-4]。目前认为NDMA是由广泛存在于环境中的二甲胺(DMA)和亚硝酸盐作用形成的[5]。除在食品、化妆品、水中被广泛报道,NDMA在烟草等中也有检出[6-9]。2012年,NDMA被美国食品药品监督管理局(FDA)列入烟草制品及烟气中潜在的致癌物名单[10]。无烟气烟草制品是指未经燃烧过程而直接通过口腔或鼻腔吸食消费的烟草制品。目前,无烟气烟草制品等已经成为烟草行业的一个重要发展方向。无烟气烟草制品的原料主要为烟草,因此可能由原料引入NDMA或在生产制造的热处理过程中产生NDMA。国际烟草科学研究合作中心(CORESTA)也将NDMA列入无烟气烟草制品中重点关注的化学成分[11],NDMA日益受到重视。但烟草行业内目前还未建立相应的检测方法。为进一步加强产品安全监控,建立无烟气烟草制品中NDMA的准确、可靠、快速、灵敏的检测方法十分必要。
NDMA虽然存在广泛,但含量极低,其相对分子质量仅为74,且挥发性较强,给检测工作带来一定挑战。目前对痕量NDMA的准确定量,是研究人员的主要研究方向。由于热能分析(TEA)检测器对含氮化合物有高选择性,因此气相色谱法(TEA)[12-15]成为了NDMA的常用方法,但由于其功能单一、专用性强,一般实验室很难配备。液相色谱-串联质谱法(LC-MS/MS)具有较高的灵敏度和较强的排除干扰能力,近年来也逐渐有研究人员使用[16-20],但液相色谱-串联质谱联用仪价格昂贵,维护成本高。气相色谱-质谱法(GC-MS)因使用简便,成本低,也可作为NDMA的常用检测方法[8,21],但GC-MS灵敏度不足,需要浓缩等过程,检测痕量NDMA受到一定限制。近年来,科研人员引入了配有化学电离源的气相色谱-串联质谱法(GC-MS/MS)测定亚硝胺类化合物,特异性强、灵敏度高,均取得了良好效果[22-25]。本工作采用气相色谱-三重四极杆串联质谱法(化学电离源),实现了无烟气烟草中NDMA的测定。
1 试验部分
1.1 仪器与试剂
Agilent 7890A型和7000B型气相色谱-三重四极杆串联质谱仪;SW12H型超声波仪;RJ-50G型离心机。固相萃取小柱(500 mg/3 mL)。
NDMA标准储备溶液:100 mg·L-1。
NDMA标准溶液:0.2,0.5,1.0,5.0,10 μg·L-1。
D6-N,N-二甲基亚硝胺(D6-NDMA)内标储备溶液:1.0 mg·L-1,标准溶液中内标质量浓度为5 μg·L-1。
甲醇、二氯甲烷均为色谱纯。
1.2 仪器工作条件
1) 色谱条件 DB-WAX石英毛细管色谱柱(30 m×0.25 μm,0.25 μm);进样口温度为200 ℃;不分流进样,进样量为2 μL;载气为氦气,流量为1.2 mL·min-1。程序升温:初始温度为40 ℃,保持3 min;以10 ℃·min-1速率升温至120 ℃;再以40 ℃·min-1速率升温至240 ℃,保持3 min。
2) 质谱条件 正电压化学电离(PCI)模式,反应气体为氨气;传输线温度为240 ℃,离子源温度为200 ℃;电子能量为120 eV;碰撞气为氮气,流量1.5 mL·min-1;扫描方式为多反应监测(MRM)。其余质谱参数见表1,其中“*”表示定量离子。
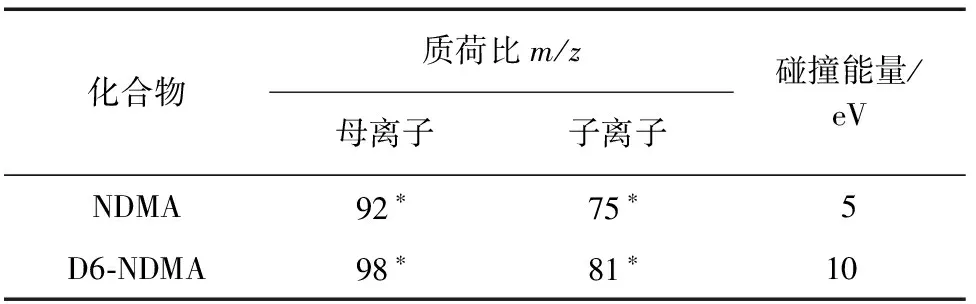
表1 质谱参数Tab. 1 MS parameters
1.3 试验方法
称取无烟气烟草试样0.500 g,加入二氯甲烷10 mL及1.0 mg·L-1内标储备溶液10 μL,超声30 min,再以5 000 r·min-1转速离心3 min,取上清液过0.45 μm有机相滤膜,待进行萃取液净化。采用硅固相萃取柱净化,净化程序为:硅固相萃取柱用甲醇3 mL活化,二氯甲烷6 mL平衡后,取滤液5 mL过柱,弃去直接流出液,再用2 mL甲醇洗脱,收集洗脱液按仪器工作条件进行测定。
2 结果与讨论
2.1 色谱及质谱条件的选择
氨的化学电离比较简单,通常只有唯一的准分子离子峰,碎片较少,主要反应离子为[NH4]+,是一种良好的亲电加成试剂,因此可作为良好的化学电离源反应气。NDMA属强碱性化合物,分子中氮上的孤对电子进攻质子化的氨[NH4]+发生亲电加成,产生质量数为92的加合离子[M+NH4]+,在离子源中发生中性丢失,产生质量数为75的[M+H]+离子,NDMA的质谱图见图1。

图1 NDMA的质谱图Fig. 1 MS spectrum of NDMA
采用子离子扫描方式,进行二级质谱分析,对子离子进行优化选择,确定碰撞能量等质谱参数,使亚硝胺化合物的分子离子峰与特征碎片离子产生的离子对强度达到最大,质谱参数见1.2节。1.0 μg·L-1NDMA标准溶液(内标5 μg·L-1)和实际样品的MRM色谱图见图2。
由图2可知:NDMA信号已经很强,说明氨气作为反应气的软电离方式具有极高的灵敏度;化学电离源具有很好的选择性。

(a) 1.0 μg·L-1 NDMA标准溶液(内标5 μg·L-1) (b) 实际样品 图2 NDMA的色谱图Fig. 2 Chromatograms of NDMA
同时,试验分别考察了非极性色谱柱(DB-5MS,5%二苯基-95%二甲基硅氧烷)、中等极性色谱柱(DB-35MS,35%二苯基-65%二甲基硅氧烷)、强极性色谱柱(DB-WAX聚乙二醇;DB-624,6%氰丙基-94%甲基)对NDMA的分离效果,其色谱图见图3。

(a) DB-5MS (b) DB-35MS

(c) DB-WAX (d) DB-624图3 不同色谱柱分离时的色谱图Fig. 3 Chromatograms with different chromatographic columns
由图3可知:非极性色谱柱DB-5MS及中等极性色谱柱DB-35MS对NDMA的保留效果较差,极性色谱柱DB-WAX、DB-624保留效果均较好,但DB-WAX峰形较好。试验选用DB-WAX色谱柱。
2.2 样品前处理条件的选择
超声是一种常用的效率较高的提取方法。试验采用超声提取方式对样品进行提取。试验考察了甲苯、二氯甲烷、丙酮、乙醇、甲醇等不同极性的有机试剂对无烟气烟草中N,N-二甲基亚硝胺的提取效果。结果表明:二氯甲烷与甲醇作为提取剂时,提取效果较好,甲醇萃取出了更多的杂质物质。试验选择二氯甲烷作为提取剂。
试验考察了超声时间依次为10,20,30,40 min时对提取效果的影响。结果表明:随超声时间的延长,提取出的NDMA越多;当超声时间为30 min时,提取出的NDMA达到最多;继续延长超声时间,提取出的NDMA保持稳定。试验选择超声时间为30 min。
烟草萃取液成分复杂,为减少样品对仪器的污染,试验在仪器分析前进行萃取液净化。因为NDMA属于极性化合物,文献中多采用极性的固相萃取(SPE)柱进行净化[8,23,26-28],基本过程是将上样液通过极性SPE柱,NDMA等极性化合物保留在SPE柱上,其他物质随流出液流出,接着再用极性试剂进行洗脱,将NDMA从SPE柱上洗脱下来,达到净化的目的。试验考察了HLB小柱(聚合物填料)、Frorisil小柱(硅藻土填料)、硅柱(硅胶填料)等3种常用的适用于极性化合物分离的SPE小柱的净化效果。
结果表明:上述3种SPE小柱净化时,NDMA的回收率依次为96.9%,92.0%,99.1%,测定值的相对标准偏差(RSD)依次为2.6%,12%,2.2%。可以看出,硅柱回收率最优,且结果较为稳定。另外,硅柱对NDMA有较好的保留且最后可被洗脱得较完全,HLB柱的上样流出液中可检测到NDMA。试验选用硅柱。
硅柱净化前后的色谱图见图4。
另外,依次用甲醇1 mL进行洗脱,收集每1 mL洗脱液进行测定。试验发现,甲醇2 mL便可以基本完全将待测物从SPE小柱上洗脱下来。试验选择洗脱体积为2 mL,同时,还有一定的浓缩效果,无需再进行浓缩复溶等环节。
2.3 标准曲线、检出限和测定下限
按仪器工作条件对NDMA标准溶液系列进行测定,并绘制标准曲线。结果表明:NDMA的线性范围为0.2~10 μg·L-1,线性回归方程为y=0.203 3x-0.010 6,相关系数为0.999 9。
采用最低浓度标准溶液重复进样10次,取其3倍标准偏差计算方法的检出限(3s)为0.018 ng·g-1,以10倍标准偏差计算方法的测定下限(10s)为0.060 ng·g-1。

(a) 净化前

(b) 净化后图4 硅柱净化前后的色谱图Fig. 4 Chromatograms before and after purification of Si column
2.4 方法的精密度和回收试验
按试验方法对无烟气烟草样品进行测定,并进行加标回收试验,其结果见表2。
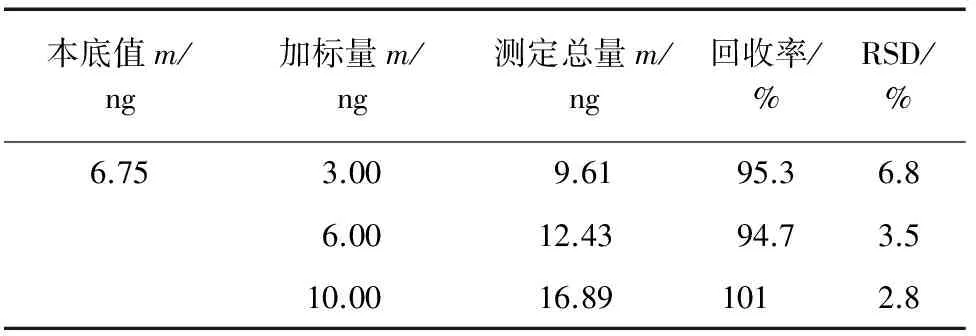
表2 精密度和回收试验结果(n=5)Tab. 2 Results of tests for precision and accuracy(n=5)
由表2可知:加标回收率为94.7%~101%,RSD为2.8%~6.8%。
另外,进行5 d的日间重复性试验,结果显示5 d的测定值依次为7.21,6.80,6.75,7.19,6.58 ng·g-1,相对标准偏差为4.1%。
2.5 样品分析
按试验方法对12种无烟气烟草样品进行测定,测定值依次为6.75,6.38,6.55,6.70,6.75,7.17,6.60,5.75,3.04,4.26,5.21,4.35 ng·g-1。
本工作采用气相色谱-串联质谱法测定无烟气烟草中N,N-二甲基亚硝胺的含量。本方法的重复性、加标回收率均符合要求,操作简便、灵敏度高,适合于无烟气烟草制品中NDMA的测定。
[1] MA F J, ZHANG Z B, JIANG J L, et al. Chromium(Ⅵ) potentiates the DNA adducts (O-6-methylguanine) formation ofN-nitrosodimethylamine in rat: Implication on carcinogenic risk[J]. Chemosphere, 2015,139:256-259.
[2] BABERSCHKE N, STEINBERG C, SAUL N. Low concentrations of dibromoacetic acid andN-nitrosodimethylamine induce several stimulatory effects in the invertebrate model Caenorhabditis elegans[J]. Chemosphere, 2015,124:122-128.
[3] SUN H, YU L H, WEI H L, et al. A novel antihepatitis drug, bicyclol, prevents liver carcinogenesis in diethylnitrosamine-initiated and phenobarbital-promoted mice tumor model[J]. Journal of Biomedicine and Biotechnology, 2012,2012:1-9.
[4] LIN H L, HOLLENBERG P F.N-nitrosodimethylamine-mediated formation of oxidized and methylated DNA bases in a cytochrome P450 2E1 expressing cell line[J]. Chemical Research in Toxicology, 2001,14(5):562-566.
[5] LV C L, LIU Y D, ZHONG R G. Theoretical investigation ofN-nitrosodimethylamine formation from dimethylamine nitrosation catalyzed by carbonyl compounds[J]. Journal of Physical Chemistry A, 2009,113(4):713-718.
[6] 邓其馨,黄朝章,张建平,等.液相色谱串联质谱法测定烟用香精香料中的亚硝胺[J].现代食品科技, 2014(1):195-199.
[7] 费桂琴,陈山丹,白桦,等.高效液相色谱-串联质谱法测定玩具弹性体中13种N-亚硝胺[J].理化检验-化学分册, 2015,51(11):1529-1533.
[8] 刘志健,蔡锦安,陈志,等.固相微萃取-气相色谱-质谱法测定橡胶密封圈中8种N-亚硝胺含量[J].理化检验-化学分册, 2016,52(6):643-647.
[9] 封棣,易馨如,杨慧敏,等.顶空-固相微萃取-气相色谱-质谱法测定乳胶避孕套中亚硝胺的模拟迁移量[J].理化检验-化学分册, 2014,50(6):670-674.
[10] FDA. Harmful and potentially harmful constituents in tobacco products and tobacco smoke: Established list[J]. Federal Register, 2012,77(64):20027-20034.
[11] BUNCH J E. CORESTA reference products 2010 analysis[J]. Tennessee: American Snuff Company, 2014.
[12] 周劼,刘洪伟,彭俊,等.气相色谱-热能分析联用仪测医用橡胶手套中可迁移亚硝胺成分的含量[J].今日药学, 2013(8):480-483.
[13] ANDRADE R, REYES F G R, RATH S. A method for the determination of volatileN-nitrosamines in food by HS-SPME-GC-TEA[J]. Food Chemistry, 2005,91(1):173-179.
[14] DALLINGA J W, KRUL C A M, TENFELDE A, et al. Determination ofN-nitrosodimethylamine in artificial gastric juice by gas chromatography-mass spectrometry and by gas chromatography-thermal energy analysis[J]. European Journal of Cancer Prevention, 2001,10(3):265-268.
[15] DUTRA C B, ANDRADE R, REYES F G R, et al. Determination of volatileN-nitrosamines in sausages by HS-SPME-GC-TEA[J]. Toxicology Letters, 2006,164(3):274-275.
[16] 陈婷,温裕云,欧延,等.固相萃取净化及超高效液相色谱-串联质谱法测定橡胶制品中的13种N-亚硝胺[J].色谱, 2014,32(1):89-94.
[17] 刘津津,廖晓斌,周真明,等.高效液相色谱串联质谱法测定含藻水氯化消毒后7种亚硝胺物质[J].分析化学, 2015,43(4):502-506.
[18] 朱翔,李伟,刘玉灿,等.超高效液相色谱-三重四极杆质谱联用仪同时检测水中9种亚硝胺[J].分析测试学报, 2014,33(8):866-872.
[19] KOSAKA K, ASAMI M, OHKUBO K, et al. Determination of aN-nitrosodimethylamine precursor in water using ultra-high performance liquid chromatography-tandem mass spectrometry[J]. Analytical Sciences, 2015,31(8):769-772.
[20] 芮晓东,胡守毅,曹红云,等.匀浆提取-超高效液相色谱-串联质谱法测定烟草中亚硝胺含量[J].理化检验-化学分册, 2013,49(5):593-596.
[21] 杨荣静,卫碧文,高欢,等.气相色谱-正化学电离质谱法检测婴儿奶嘴中N-亚硝胺物质的迁移量[J].理化检验-化学分册, 2013,49(12):1423-1427.
[22] 许渝谨.固相萃取-气相色谱-正化学离子源质谱法检测水中9种亚硝胺类消毒副产物[D].青岛:青岛理工大学, 2012.
[23] 幸苑娜,倪宏刚,王欣,等.气相色谱-正化学源质谱法测定橡胶中N-亚硝胺及其前体物的迁移量[J].分析化学, 2011,39(7):1065-1070.
[24] U.S. Environmental Protection Agency (EPA) Method 521 Determination of nitrosamines in drinking water by solid phase extraction and capillary column gas chromatography with large volume injection and chemical ionization tandem mass spectrometry (MS/MS)[S].
[25] 顾文博,周宛虹,陆怡峰,等.气相色谱-三重四极杆串联质谱法测定卷烟烟气中的烟草特有亚硝胺[J].烟草科技, 2013(10):43-48.
[26] 何淑娟,赵丽敏,李强,等.气相色谱-质谱法测定肉制品中的9种挥发性N-亚硝胺类物质[J].肉类研究, 2015(1):27-30.
[27] 冯桂学,刘莉,顿咪娜,等.固相萃取-气相色谱-质谱法测定水中10种嗅味物质的含量[J].理化检验-化学分册, 2017,53(5):502-506.
[28] 王雪平,闫凯.固相萃取-气相色谱-质谱法测定饮用水中15种农药残留量[J].理化检验-化学分册, 2017,53(4):437-441.
