表面活性剂及其复配体系对漆酶活性和稳定性的影响
2018-01-19张淑琴任大军何小勇张晓晴
刘 海,张淑琴,任大军,叶 俊,何小勇,张晓晴
(武汉科技大学资源与环境工程学院,湖北 武汉,430081)
漆酶是一种含铜的多酚氧化酶,广泛存在于细菌、真菌及植物中,它在降解木质素、生物漂白、污水处理、生物感应器、生物燃料电池等方面具有广阔的应用前景[1]。通过固定化、化学修饰或基因工程等技术可以提高酶的活性和稳定性,其中就包括表面活性剂改性技术[2]。表面活性剂是一类由亲水基和疏水基组成的相对平衡的不对称化合物,与酶结合后通过静电作用和疏水作用调节酶电荷,使得酶构象及活性中心发生改变,从而影响酶的活性和稳定性。表面活性剂与酶组成的混合体系在食品和饮料加工、医药工程和化妆品等应用领域的重要性日益突出[3]。另外,由于混合表面活性剂体系往往比单一表面活性剂具有更优越的性能,故目前对于表面活性剂复配行为的研究也有较多报道[4-6]。
本文主要研究5种表面活性剂Brij-35(十二烷基聚乙二醇醚,非离子型)、Tween-80(非离子型)、TX-100(Triton X-100,非离子型)、AOT(2-乙基己基琥珀酸酯磺酸钠,阴离子型)、甜菜碱(十二烷基甜菜碱,两性离子型)对漆酶活性和稳定性的影响,探讨漆酶的最佳反应温度和pH值,同时通过Brij-35与其他表面活性剂组建不同类型的复配体系,分析在表面活性剂复配体系中漆酶的活性与稳定性变化。
1 试验材料与方法
1.1 试剂与仪器
漆酶(1.07U/mg)、ABTS、AOT、TX-100、Tween-80均购自Sigma公司;Brij-35、甜菜碱等由国药集团化学试剂有限公司生产。试剂均为分析纯。
主要仪器包括电热恒温油浴锅(DU-20型)、紫外可见分光光度计(UV-2550型)、日立荧光光谱仪(F-4600型)及pH酸度计等。
1.2 漆酶活性测定方法
漆酶的催化活性检测采用ABTS显色分光光度法,以0.5 mmol/L的ABTS为反应底物,以0.1 mol/L的乙酸-乙酸钠为缓冲体系[7]。反应体系为3.0 mL,依次取pH=3.5的乙酸-乙酸钠缓冲溶液1.5 mL、漆酶待测液1.0 mL、ABTS溶液0.5 mL,于25(±1) ℃用紫外可见分光光度计测其420 nm处的吸光度,重复测量12次,每次间隔15 s。将每分钟转化1 μmol底物定义为1个酶活力单位U。
本文试验均设置空白对照组,试验结果中漆酶相对活性以空白对照组的漆酶活性为基准进行计算。
1.3 表面活性剂类型及浓度对漆酶活性的影响测定方法
单一表面活性剂:分别配制Brij-35、Tween-80、TX-100、AOT、甜菜碱的浓度为0.4、0.8、1.2、1.6、2.0 mmol/L,然后等体积加入0.1 U/mL的漆酶溶液组成漆酶混合液,以不添加表面活性剂的漆酶溶液为对照组。在25(±1) ℃、pH=3.5的条件下与底物ABTS反应,测定酶活性。
表面活性剂复配体系:将不同浓度Brij-35(0.4、0.8、1.2、1.6、2.0 mmol/L)分别与对应浓度的AOT、TX-100、Tween-80、甜菜碱按体积比1∶1进行复配,然后等体积加入0.1 U/mL的漆酶溶液组成漆酶混合液,其他测定条件同上。
1.4 温度对漆酶活性的影响及漆酶热稳定性测定方法
恒温油浴锅的控制温度分别设为20、30、40、50、60、70、80 ℃,将添加了单一表面活性剂(1.0 mmol/L)或表面活性剂复配体系(1.0 mmol/L)的漆酶溶液(表面活性剂和漆酶溶液等体积配比)以及空白对照组置于其中,恒温水浴30 min后取出,冷却至25(±1) ℃,在pH=3.5条件下测定其活性。
漆酶热稳定性测定:将上述各漆酶混合液分别在40、50、60 ℃恒温水浴,每隔1 h取样测定其活性,条件同上。
1.5 pH值对漆酶活性的影响及漆酶酸碱稳定性测定方法
用乙酸-乙酸钠缓冲液将1.4节中配制的漆酶混合液以及空白对照组的pH值分别调制为2.5~7.0,静置30 min后,在25(±1) ℃下测定其活性。
漆酶酸碱稳定性测定:将上述调制的pH值为3.0、3.5、4.0、4.5、5.0的各漆酶混合液在25 ℃水浴保温,每隔1 h取样测定其活性,条件同上。
1.6 稳态荧光光谱测定方法
漆酶的稳态荧光光谱试验采用直径为1.0 cm的石英样品池,溶液浓度为3.0 g/L。选取激发波长为284 nm,扫描范围为300~500 nm。激发和发射带宽均为5 nm,响应时间为1 s,中速扫描。样品检测前在室温下培养1 h。空白样品在统一条件下测量,最终结果均排除空白样品的影响。
2 试验结果
2.1 表面活性剂类型和浓度对漆酶活性的影响
单一表面活性剂的类型和浓度对漆酶活性的影响如图1所示。从图1中可以看出,浓度为0.4 mmol/L的Brij-35使漆酶相对活性比空白对照组(相对活性为100%)提高了约13个百分点,而随着Brij-35浓度的继续增大,漆酶相对活性逐渐降低,但在Brij-35为2.0 mmol/L的条件下,漆酶相对活性比空白对照组仍高出约5个百分点。以Tween-80为表面活性剂时,随着其浓度的增大,漆酶相对活性逐渐下降;Tween-80浓度低于1.2 mmol/L时,漆酶活性略高于空白对照组;Tween-80浓度高于1.2 mmol/L时,漆酶活性比空白对照组有所降低。加入TX-100时,漆酶相对活性随TX-100浓度的增大先升后降,且TX-100浓度为1.2 mmol/L时漆酶活性最高。以AOT为表面活性剂时,漆酶相对活性随AOT浓度的增大而显著下降,当AOT浓度为2.0 mmol/L时,漆酶相对活性降到80%以下。随着甜菜碱浓度的增大,漆酶相对活性变化不明显,但高浓度甜菜碱对漆酶活性还是有抑制作用。
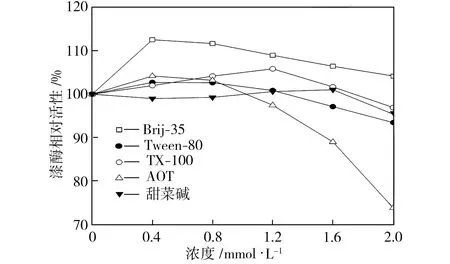
图1 单一表面活性剂的类型和浓度对漆酶活性的影响
Fig.1Effectsoftypeandconcentrationofsingle-componentsurfactantsonlaccaseactivity
表面活性剂复配体系的类型和浓度对漆酶活性的影响如图2所示。对于Brij-35/Tween-80复配体系,在其浓度由0.4 mmol/L增加到1.2 mmol/L时,漆酶相对活性缓慢下降;在其浓度由1.2 mmol/L增至2.0 mmol/L时,漆酶相对活性下降较快。对于Brij-35/TX-100复配体系,随其浓度的增大,漆酶相对活性先升后降,Brij-35/TX-100浓度为0.8 mmol/L时漆酶活性最高。随着Brij-35/AOT复配体系浓度的增大,漆酶活性开始缓慢降低,而当Brij-35/AOT浓度超过1.2 mmol/L时,漆酶活性显著下降。Brij-35/甜菜碱复配体系的浓度对漆酶活性影响较小,与仅添加甜菜碱时规律相似。

图2表面活性剂复配体系的类型和浓度对漆酶活性的影响
Fig.2Effectsoftypeandconcentrationofmixedsurfactantsonlaccaseactivity
2.2 温度对漆酶活性的影响及漆酶热稳定性
在20~80 ℃范围内检测未添加表面活性剂的空白对照组、添加单一表面活性剂或表面活性剂复配体系的漆酶溶液的活性,以空白对照组中漆酶最高活性为100%,计算不同温度下的漆酶相对活性,结果见表1。从表1中可以看出,不论是添加单一表面活性剂还是表面活性剂复配体系,漆酶的最佳反应温度均为40 ℃。在20~50 ℃范围内,漆酶相对活性在70%以上(空白对照组除外);当温度超过60 ℃时,漆酶相对活性降低较多;当温度达到80 ℃时,漆酶相对活性低于10%,接近于完全失活。此外,在20~50 ℃范围内,添加表面活性剂复配体系的漆酶相对活性均高于添加对应单一表面活性剂的漆酶相对活性。

表1 温度对漆酶相对活性的影响
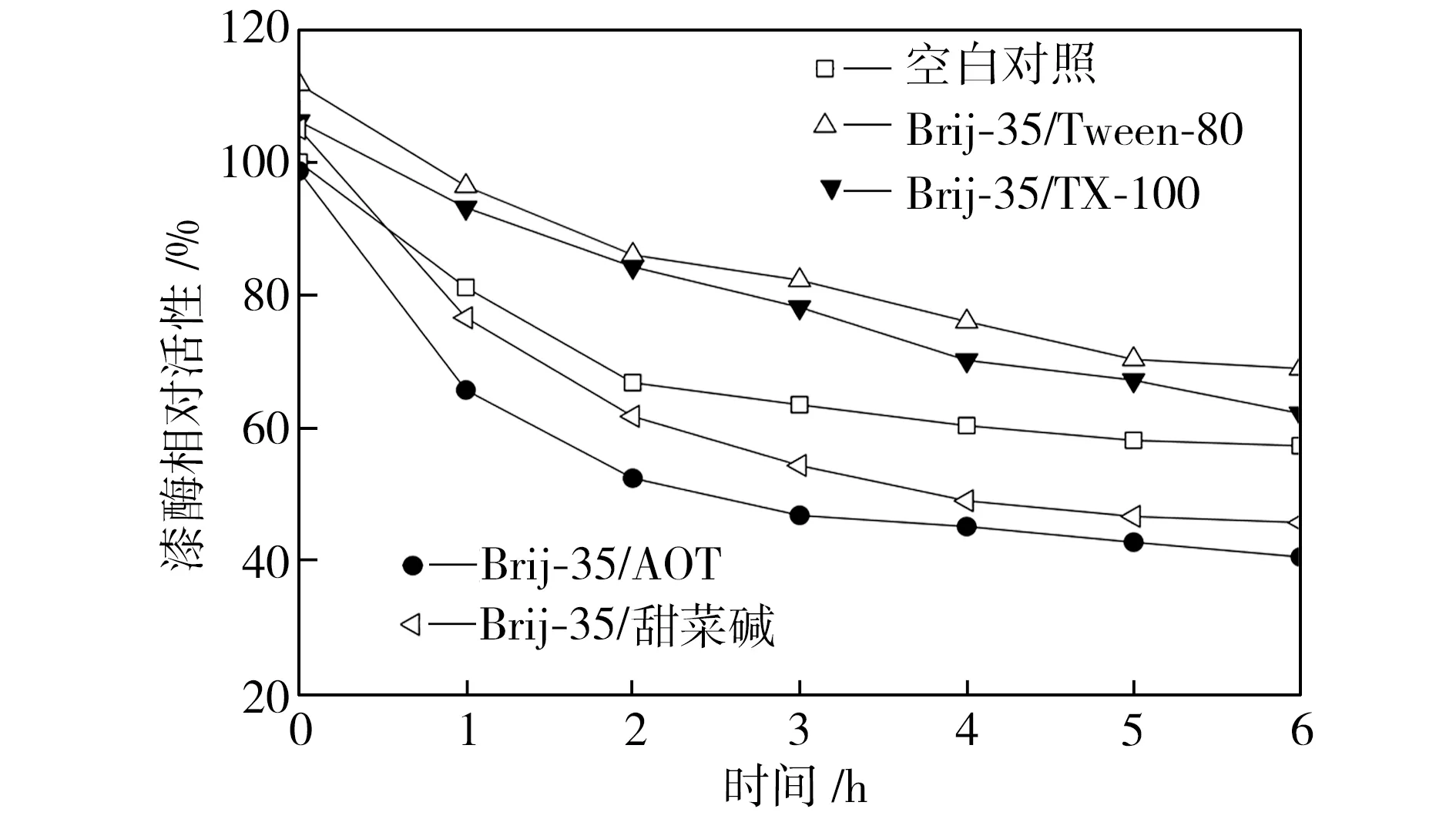
在40、50、60 ℃下恒温水浴不同时间后,检测添加表面活性剂复配体系的漆酶活性,以40 ℃初始时测得的空白对照组活性为100%,计算漆酶相对活性,得到漆酶的热稳定性曲线,如图3所示。从图3中可以看出,在合适条件下表面活性剂复配体系可以提高漆酶的热稳定性,恒温水浴6 h后,大部分添加表面活性剂的漆酶的活性都维持在一个相对较高的水平,并且在40 ℃时漆酶的热稳定性提升更为显著。总体而言,针对这4种表面活性剂复配体系,漆酶在Brij-35/TX-100及Brij-35/Tween-80复配体系中热稳定性较好,在Brij-35/AOT复配体系中的热稳定性较差。
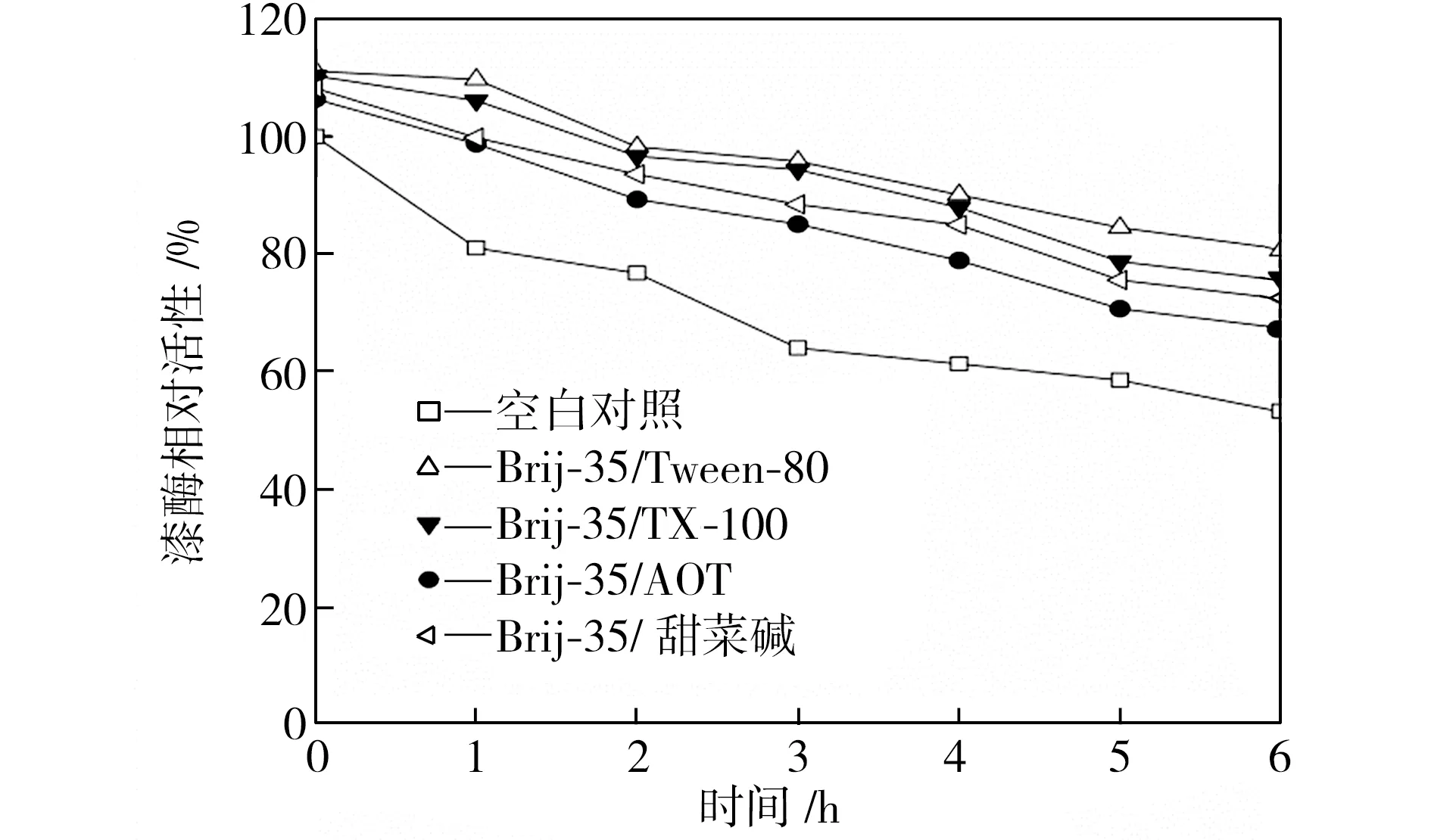
(a)40 ℃
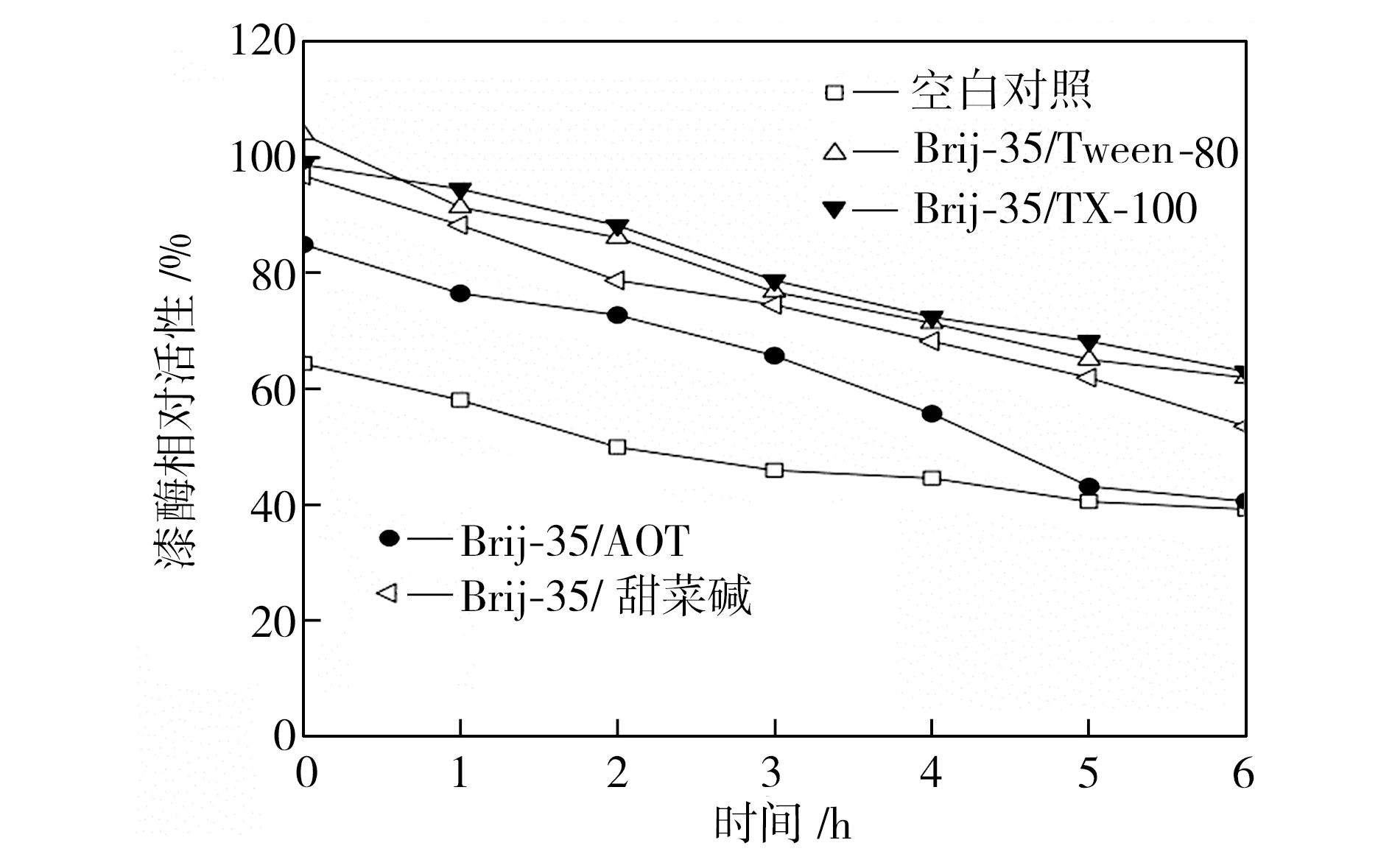
(b)50 ℃
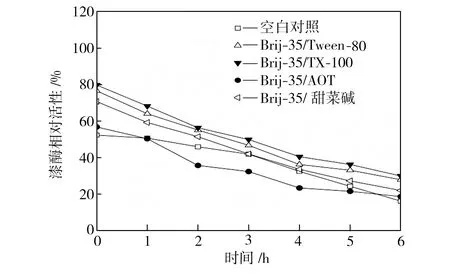
(c)60 ℃
Fig.3Effectofmixedsurfactantsonthethermalstabilityoflaccase
2.3 pH值对漆酶活性的影响及漆酶酸碱稳定性
在pH值为2.5~7.0的范围内,检测未添加表面活性剂的空白对照组、添加单一表面活性剂或表面活性剂复配体系的漆酶溶液的活性,以空白对照组中漆酶最高活性为100%,计算不同pH值下的漆酶相对活性,结果见表2。由表2可见,空白对照组中漆酶最适宜的pH值为3.0,加入表面活性剂后,最佳pH值基本没有变化,但是加入AOT或Brij-35/AOT复配体系时,漆酶最佳pH值从3.0变为3.5。在pH值为3.5~4.5的范围内,表面活性剂的存在使漆酶的活性均有较大程度的提高;当pH值超过5.0时,漆酶的相对活性低于50%,表面活性剂对漆酶活性的影响不明显;当pH值达到7.0时,漆酶接近完全失活。

表2 pH值对漆酶相对活性的影响
在pH值为3.0~5.0的范围内,检测25 ℃水浴不同时间的空白对照组和添加表面活性剂复配体系的漆酶溶液的活性,以pH=3.0条件下初始时测得的空白对照组活性为100%,计算漆酶相对活性,得到漆酶的酸碱稳定性曲线,如图4所示。从图4中可以看出,与空白对照组相比,在Brij-35/TX-100和Brij-35/Tween-80复配体系中,漆酶的酸碱稳定性提高了;在Brij-35/甜菜碱和Brij-35/AOT复配体系中,漆酶的酸碱稳定性降低了。
(a) pH=3.0
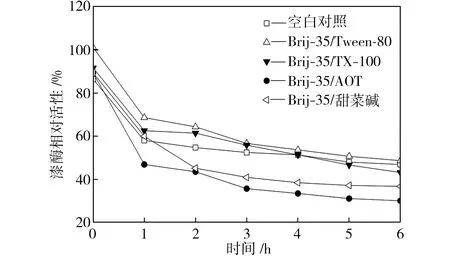
(b) pH=3.5
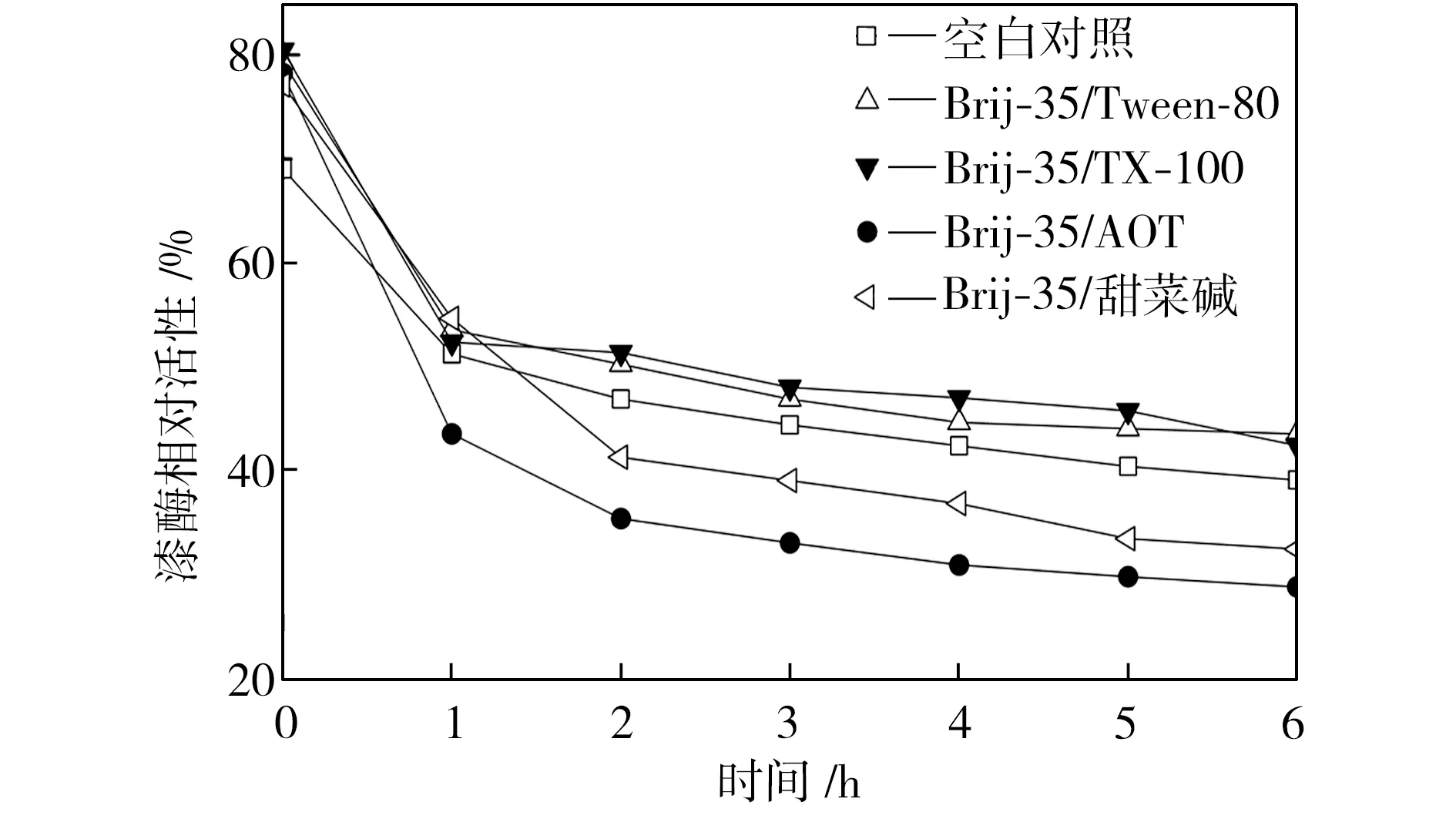
(c) pH=4.0
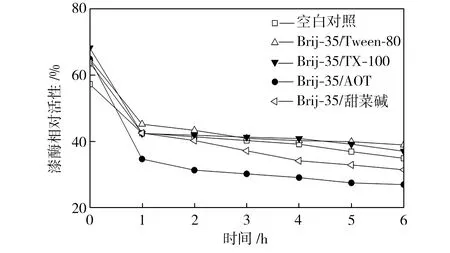
(d) pH=4.5
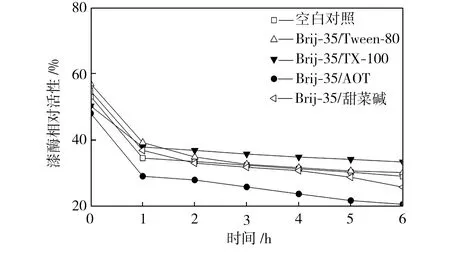
(e) pH=5.0
Fig.4Effectofmixedsurfactantsontheacid-alkalistabilityoflaccase
2.4 漆酶的荧光光谱分析
添加表面活性剂及其复配体系的漆酶荧光光谱如图5所示,由于TX-100的存在使漆酶荧光图谱无法正常检测,故图5中不包括加入TX-100和Brij-35/TX-100的漆酶对应的谱线。从图5(a)可以看出,加入单一表面活性剂后,漆酶的最大荧光激发波长未发生红移,但荧光强度发生改变,按表面活性剂排序依次为Tween-80>Brij-35>甜菜碱>空白对照组>AOT。这可能是由于表面活性剂头部基团与漆酶的活性基团相互作用,使漆酶中能够产生内源荧光的氨基酸残基的微环境发生变化而引起的[8]。当Tween-80存在时,漆酶的疏水性氨基酸残基暴露于非极性(或极性较小)的环境中,漆酶的荧光强度最高;当AOT存在时,漆酶的疏水性氨基酸残基暴露于极性环境中,漆酶荧光强度最低。从图5(b)可以看出,漆酶的荧光强度按表面活性剂复配体系排序依次为Brij-35/Tween-80>Brij-35/甜菜碱>Brij-35/AOT,这与单一表面活性剂存在时漆酶的荧光强度变化趋势大致相同。
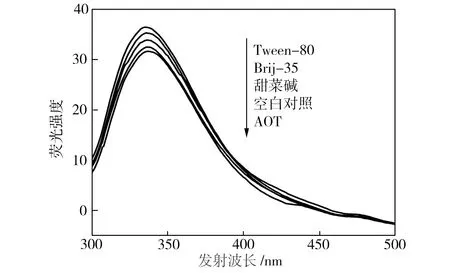
(a)单一表面活性剂

(b)表面活性剂复配体系
3 讨论
表面活性剂对漆酶活性的影响方式主要表现为以下几个方面:①表面活性剂可能与酶促反应底物竞争酶的活性中心;②表面活性剂可能使酶的外部反应条件发生改变;③表面活性剂浓度较高时,溶液中的胶束增多,导致底物在胶束中的分配增加,从而减少了可反应的有效底物浓度。漆酶与表面活性剂之间的相互作用主要包括静电作用和疏水作用,这与酶的自身结构和电荷性质以及表面活性剂的化学性质有关[9]。静电作用发生在表面活性剂的头部基团和酶的带电氨基酸残基之间;疏水作用发生在表面活性剂的烷基链与酶的疏水性氨基酸残基之间。这些相互作用使得酶构象及活性中心发生改变,从而影响酶的活性和稳定性。
在本研究中,表面活性剂及其复配体系的浓度增至2.0 mmol/L时,漆酶活性均有不同程度降低,可能是因为高浓度的表面活性剂减少了与漆酶反应的有效底物浓度。在合适条件下,表面活性剂复配体系提高了漆酶的热稳定性,这可能是由于表面活性剂头部基团与漆酶的活性中心产生相互作用,减弱了温度对酶的不利影响,从而有益于酶催化性能的稳定。
4种表面活性剂复配体系互相比较,Brij-35/Tween-80和Brij-35/TX-100复配体系中漆酶稳定性较好,Brij-35/AOT复配体系中漆酶稳定性最差。由于AOT是阴离子型表面活性剂,能形成负电荷胶束,更容易与漆酶的活性中心结合,使漆酶的酶学特性和物理特性发生改变,对漆酶产生不稳定作用[10]。AOT及其复配体系的存在使漆酶的最佳pH值从3.0增加到3.5,也归因于AOT引起的酶构象变化。甜菜碱对漆酶的影响与AOT类似,但甜菜碱是两性离子型表面活性剂,在形成阴离子胶束时也形成了阳离子胶束,减少了部分阴离子胶束对漆酶的影响,故加入甜菜碱的漆酶稳定性要好于加入AOT的漆酶稳定性。而TX-100与Tween-80具有非离子特性,与漆酶之间存在疏水作用,使漆酶的疏水性氨基酸残基暴露于非极性(或极性较小)的环境中,从而导致漆酶较稳定,这与表面活性剂及其复配体系存在时的漆酶荧光光谱测试结果相吻合。
4 结论
(1)表面活性剂对漆酶的催化性能产生影响,但不同类型和浓度的表面活性剂及其复配体系对漆酶活性的影响方式不同,主要取决于表面活性剂头部基团的离子性质。
(2)添加本文所研究的几种表面活性剂及其复配体系后,漆酶的最佳反应温度(40 ℃)没有改变,最佳pH值(3.0)也基本没变,但在AOT存在时,漆酶的最佳pH值变为3.5。
(3)通过Brij-35与其他表面活性剂组建的复配体系,在合适条件下可以提高漆酶的活性和稳定性。比较而言,在非离子型与非离子型表面活性剂复配体系(Brij-35/Tween-80,Brij-35/TX-100)中,漆酶的稳定性最佳。
[1] Majeau J A, Brar S K, Tyagi R D. Laccases for removal of recalcitrant and emerging pollutants[J]. Bioresource Technology,2010,101(7):2331-2350.
[2] 熊亚红,高敬忠,郑坚鹏,等.提高漆酶稳定性的化学修饰方法的研究[J].化学研究与应用,2011,23(8):985-990.
[3] 于跃,张剑.纤维素酶与表面活性剂的相互作用及其在洗涤剂中的应用[J].化工学报,2016,67(7):3023-3031.
[4] 刘景林,林毅,褚莹,等.新型阴离子表面活性剂的合成及其反胶束体系的酶催化性能[J].化学学报,2004,62(20):1998-2002.
[5] 张玉霞,赵继华,杜中玉,等.AOT/TritonX-100混合反胶束体系中假丝酵母脂肪酶催化蓖麻油水解的活性[J]. 物理化学学报,2007,23(9):1483-1486.
[6] Zhu Hongbo, Aitken M D. Surfactant-enhanced desorption and biodegradation of polycyclic aromatic hydrocarbons in contaminated soil[J]. Environmental Science and Technology,2010, 44(19):7260-7265.
[7] Champagne P P, Nesheim M E, Ramsay J A. A mechanism for NaCl inhibition of reactive blue 19 decolorization and ABTS oxidation by laccase[J]. Applied Microbiology and Biotechnology,2013, 97(14):6263-6269.
[8] 王欣欣,李艳,安丽萍,等.光谱法研究Zn2+对枸杞超氧化物歧化酶活力和结构的影响[J].光谱学与光谱分析,2017,37(5):1455-1459.
[9] 梁运姗,袁兴中,曾光明,等.表面活性剂在逆胶束酶反应系统中的作用机制[J].中国科学:化学,2011, 41(5): 763-772.
[10] Azimi M, Nafissi-Varcheh N, Mogharabi M, et al. Study of laccase activity and stability in the presence of ionic and non-ionic surfactants and the bioconversion of indole in laccase-TX-100 system[J].Journal of Molecular Catalysis B: Enzymatic,2016,126(4):69-75.
