基于改进模糊C均值算法的颈动脉超声图像分割
2018-01-19张琦珺滕建辅
李 锵,张琦珺,关 欣,滕建辅
基于改进模糊C均值算法的颈动脉超声图像分割
李 锵,张琦珺,关 欣,滕建辅
(天津大学微电子学院,天津 300072)
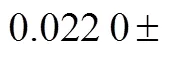
超声图像分割;内中膜厚度测量;模糊C均值;隐马尔可夫随机场模型;感兴趣区域
心血管疾病(cardiovascular diseases,CVDs)是危害人类生命健康的首要因素,需早期发现、合理干预.CVDs的初期表现为在多种致病因素的作用下,动脉壁中内中膜厚度(intima media thickness,IMT)增加的现象.颈部主动脉(common carotid artery,CCA)血管是动脉硬化的常见部位,其位置靠近皮肤表层且近似与皮肤平行,容易测量.相关研究[1]表明:CCA血管壁的IMT可以作为评估心血管疾病早期病变程度的重要指标.超声成像具有实时性、可重复性、无侵入、成本低、成像快速等优点,是临床中颈动脉检查的首选成像方式.相对其他医学成像方式超声图像噪声较多,由于超声回波散射的影响,实验研究中通常选取成像效果较好的远端血管壁的内中膜结构进行测量.超声图像中颈动脉血管具有如下特性:①健康血管的内中膜厚度在一定距离内比较均匀,且血管形态近似平直;②血管成像横贯图像;③远端血管壁处于图像中心靠下的位置;④血管壁和管腔的灰度分别呈现较亮、较暗的特点.
IMT手动测量方法非常耗时,且测试结果受测量者主观判断的影响很大,不适合实验研究.从1988年Pignoli等[2]首次提出计算机辅助IMT测量算法开始,专家学者提出了多种自动测量方法代替人工手动测量.分析已有的算法,IMT测量通常可分为2个主要步骤:①提取感兴趣区域(region of interesting,ROI);②获取内中膜轮廓.计算机辅助IMT测量的实现方法涉及多种图像处理的原理和技术,主要有边缘检测[2-3]、活动轮廓模型[4-6]、动态规划[7-8]、霍夫变换[9]、随机场模型[10]、神经网络[11-12]及模糊聚类[13]等.在Xu等[9]提出的方案中,使用霍夫变换建立初始内中膜轮廓,并采用改进的双Snake(Dual Snake,DS)模型演化初始轮廓,获取最终的内中膜边界;随机场模型的方法是利用邻近像素进行统计建模的方法,Xiao等[10]利用马尔可夫随机场模型迭代初始标号场,分割颈动脉图像;Menchón-Lára等[11]提出一种基于神经网络的全自动IMT测量算法,并在此基础上将自动编码和深度学习引入算法,提升IMT测量的效率[12].从总体上看,计算机辅助的IMT测量方法精度越来越高,实时性越来越好,人工参与程度越来越低,随着各方面技术的发展,利用计算机辅助诊断治疗的目标也越来越近.
传统模糊C均值(fuzzy C means,FCM)算法结合了模糊技术,可以有效地处理医学影像中存在的部分容积效应,但分割过程存在效率较低、对噪声敏感等问题,导致使用传统FCM算法分割超声颈动脉图像时不能获得可靠的分割结果,因此本文提出一种结合隐马尔可夫随机场模型(hidden Markov random field,HMRF)和FCM的颈动脉自动分割方法,分割过程无需人工干预.算法包括2个关键步骤:①基于先验知识自动提取感兴趣区域;②采用基于HMRF改进的FCM算法分割图像,获取最终内中膜轮廓.步骤①是自动分割的前提,步骤②是自动分割的关键.
1 预处理
CCA超声图像如图1所示.方框区域从上到下的结构依次为管腔、内膜、中膜和外膜,其中管腔-内膜边界(lumen-intima interface,LII)与中膜-外膜边界(media-adventitia interface,MAI)间的距离为IMT.
本文提出的颈动脉超声图像分割流程如图2所示,其中ROI提取和图像滤波为预处理阶段,随后在处理后的图像上进行IMT测量,该测量过程的具体实现为:建立初始内中膜轮廓、使用改进算法分割图像并经计算获取IMT.
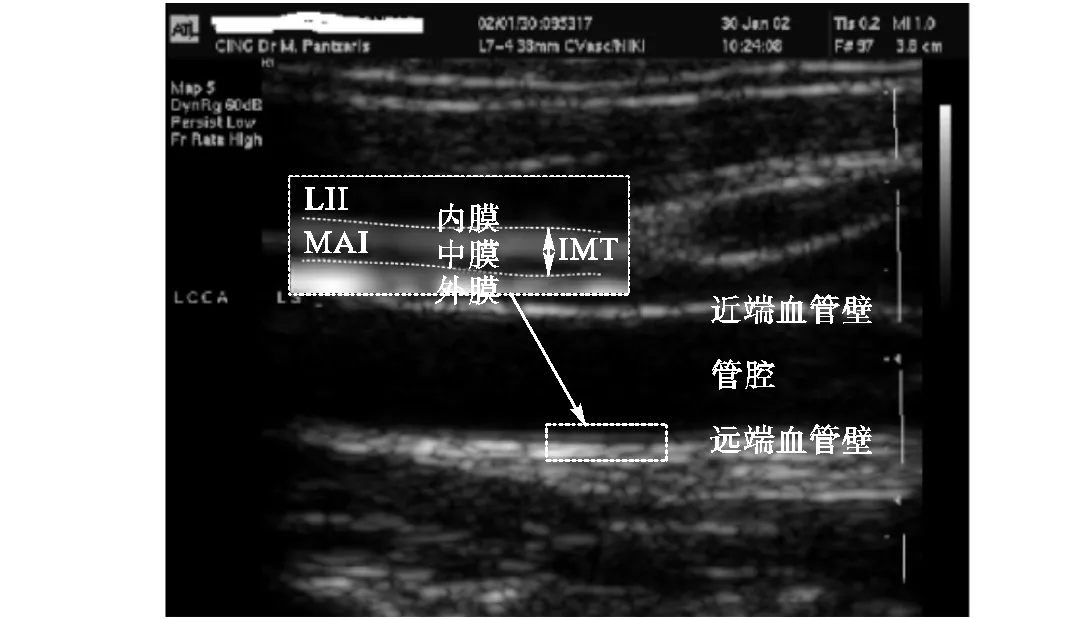
图1 CCA超声图像
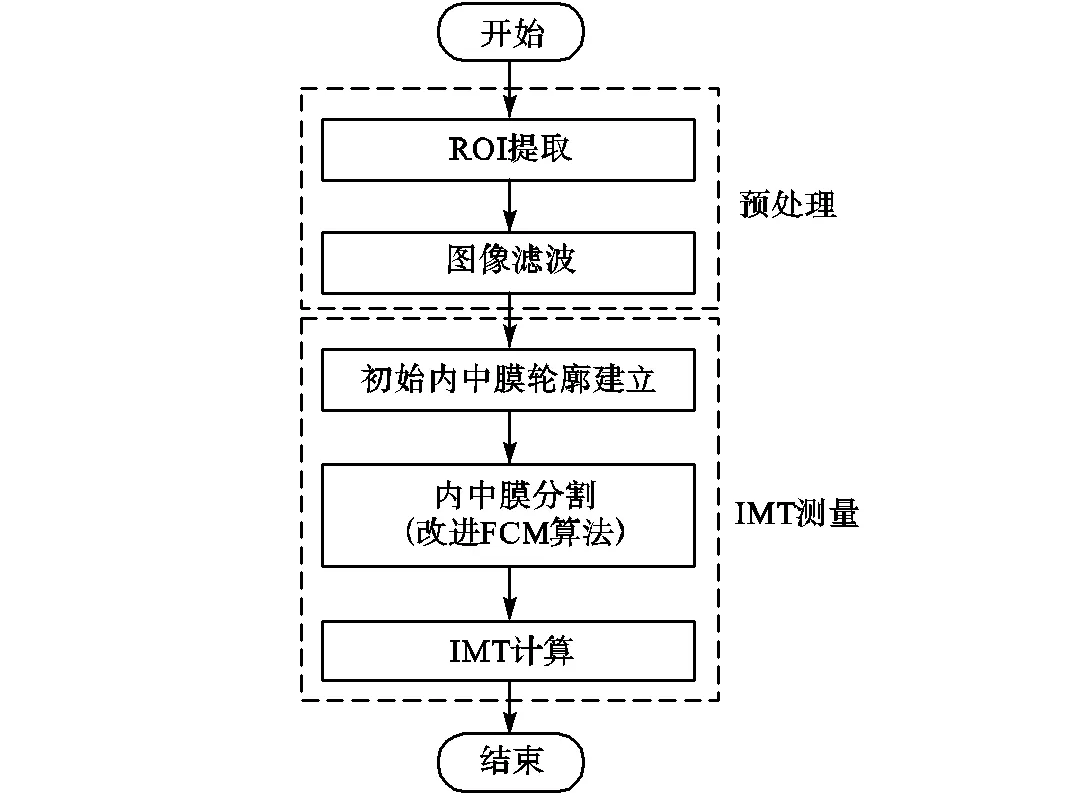
图2 颈动脉超声图像分割流程
1.1 提取ROI
ROI提取可以提高图像分割效率,根据ROI提取过程是否有人工干预,可将现有的IMT测量算法分为两类:半自动(semi-automatic,SA)测量算法和全自动(fully automatic,FA)测量算法.目前ROI自动提取算法大多仅依据图像灰度信息实现,这样的方法存在一定的失误率,为了在复杂的背景下快速、准确地提取ROI,本文提出了一种结合图像灰度信息和血管形态信息的ROI提取算法.算法的具体步骤 如下.
步骤1 图像裁剪.原始超声颈动脉图像中包含仪器信息、病人信息等对IMT测量无用的文字标识,需要去除.文字标识位置固定,根据远端血管壁位于图像中下方的位置特性,选取320×300像素大小的区域,作为待处理图像.图3(a)是裁剪后的超声图像.

(1)
步骤3 阈值处理.理想情况下,超声图像血管壁和管腔的灰度差别较大.根据图像灰度统计规律,使用最大类间差(OTSU)算法[14]自动获取最优阈值,然后利用该阈值分割边缘图获取二值图像,如图3(c)所示.
步骤4 形态学闭运算.为了连接包含大量边缘的区域,采用闭形态学算子填补二值图像的孔洞.
步骤5 验证区域.采用连通分量分析法提取二值图像中各区域的最小外接矩形和重心坐标.依据血管形态信息筛选检测到的区域:血管壁横跨图像,所在连通域的外接矩形宽度近似等于图像宽度;远端血管壁区域重心相对较低,重心纵坐标数值较大.图3(d)中用“+”号标记可能的血管壁区域,其中红色“+”号标记的区域为真正的感兴趣区域.
步骤6 ROI提取.健康颈动脉血管的IMT约在0.5~1.0,mm的范围内,对应超声图像中的约8~16个像素点,考虑到血管可能存在弯曲和病变的情况,以远端血管壁区域外接矩形的位置为标准,向上、向下分别取20、60个像素,作为ROI的上、下边界.图3(e)是远端血管壁的ROI图像.
1.2 图像滤波
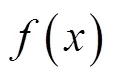
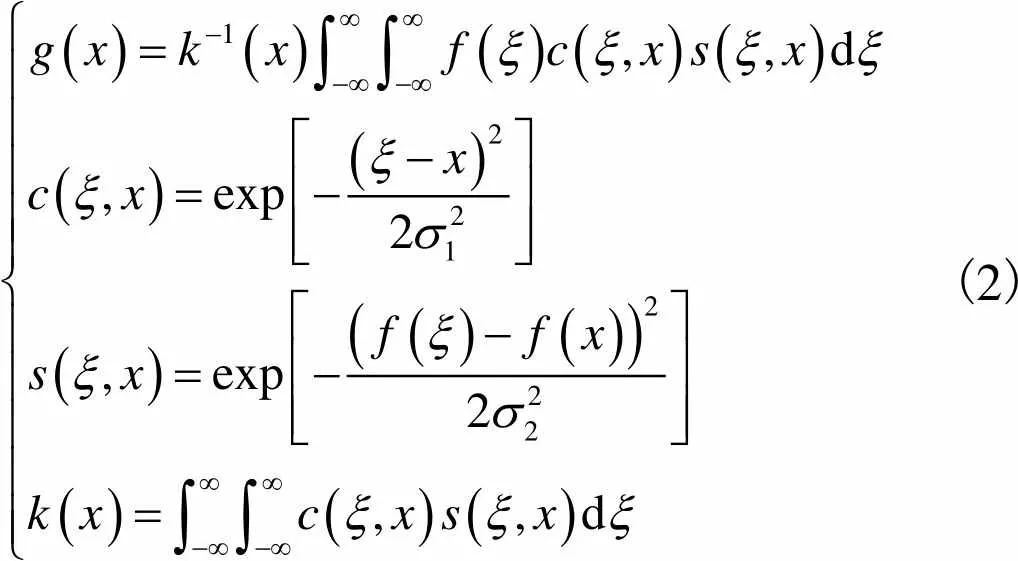
(2)
2 IMT测量
2.1 基于HMRF改进的FCM算法
1973年Dunn[16]提出了基于模糊技术的FCM聚类算法,随后被Bezdek等推广,1999年Ahmed将改进的FCM算法应用到图像分割领域,之后出现了许多应用于图像分割的改进FCM算法.FCM将模糊技术融入K均值聚类算法,从本质上讲FCM算法是通过最小化像素到聚类中心的加权距离实现图像分割,该加权距离又被称为目标函数,其表达式为

(3)
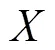
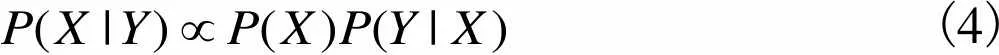
(4)

(5)
其中改进的距离函数为
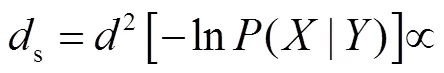
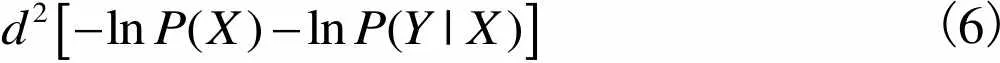
(6)
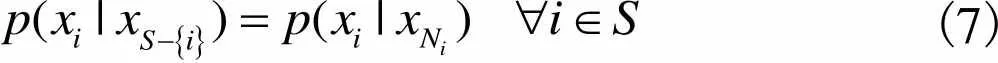
(7)
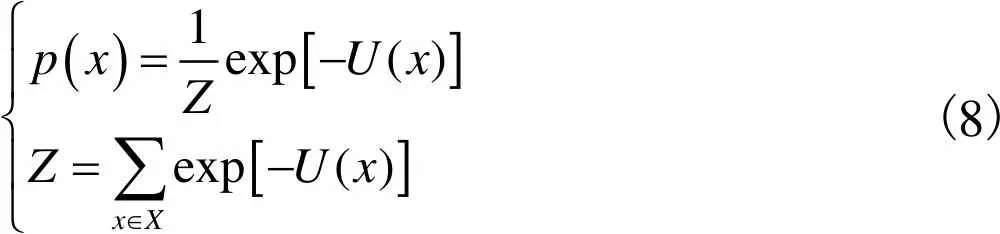
(8)
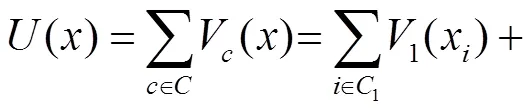

(9)
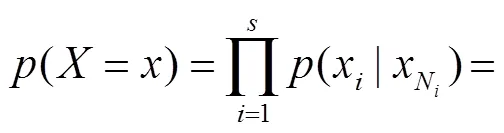
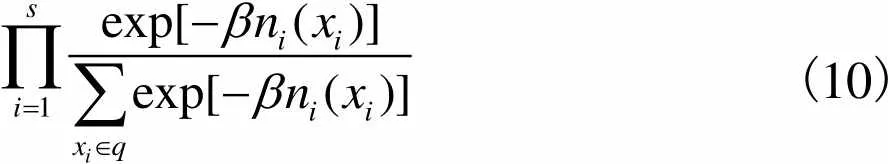
(10)
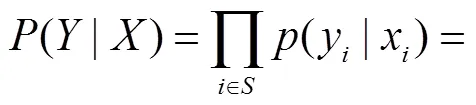
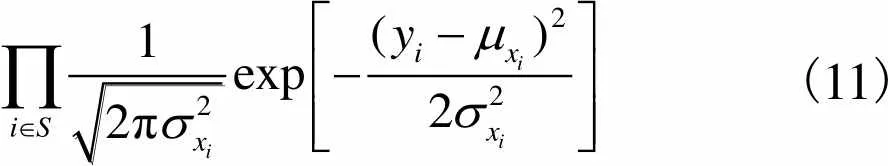
(11)
由式(9)和式(10)可推出
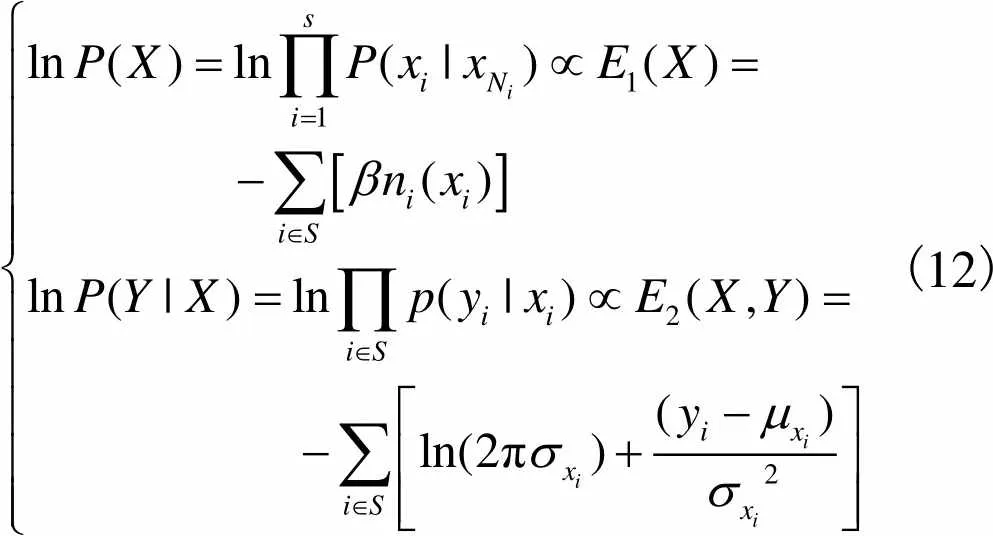
(12)
至此,可以得到改进的距离函数为
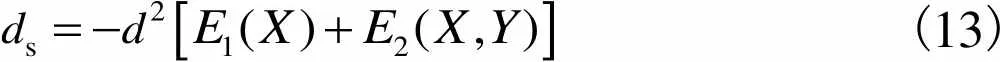
(13)
2.2 建立初始内中膜轮廓
阈值处理后的二值图像中包含有效的边缘信息,利用这一信息追踪初始内中膜边界.具体步骤如下.
步骤1 区域定位.提取对应二值图像的ROI,内中膜边界所在区域横跨图像,其外接矩形宽度近似等于图像宽度,利用这一先验信息定位并标记两条内中膜边界所在区域.
步骤2 获取初始轮廓.根据最小二乘原理分别对已定位的边缘区域内的像素进行拟合,建立LII和MAI的初始轮廓.图4(a)为初始内中膜轮廓,其中上方的虚线为LII初始边界,下方的虚线为MAI初始边界.
需要注意的是,内中膜所在区域的灰度值相对外膜较小,同时超声图像较低的分辨率使得二值图像中LII所在区域存在不完整甚至消失的情况,此时需要选取MAI区域进行边界拟合得到初始MAI,并将MAI向上平移到梯度值之和最大的位置作为初始LII的估计.
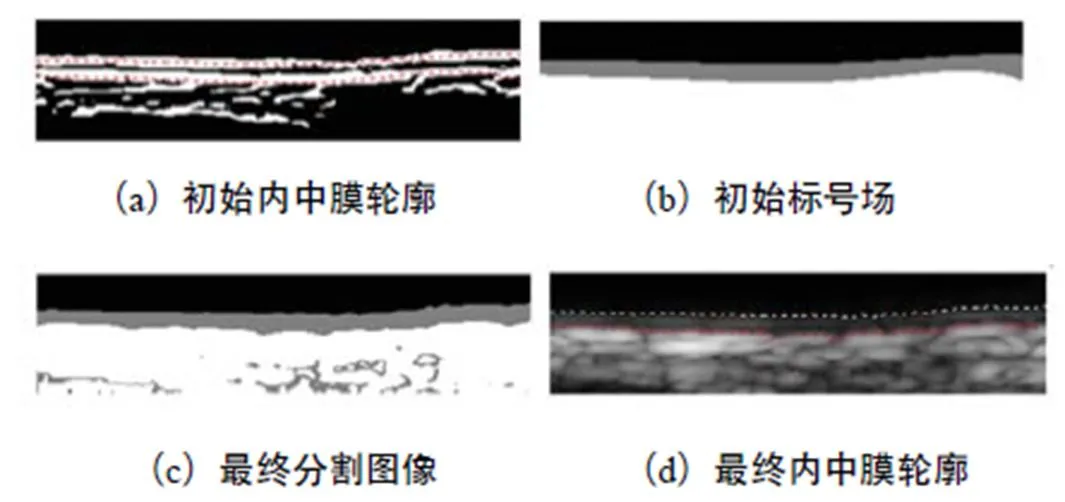
图4 IMT测量
2.3 获取最终内中膜轮廓
步骤1 建立初始标号场.为实现内中膜分割,首先需要建立待分割图像的初始标号场.根据预估的初始内中膜轮廓位置,将管腔区域标记为1,内中膜区域标记为2,其他区域标记为3.初始标号场如图4(b)所示.
步骤2 获取初始聚类中心.根据待测图像的灰度直方图峰值检测思想获取图像峰值,通过相似性计算筛选关联图中像素最多的(聚类数目)个峰值,计算峰值区间内灰度值的加权平均作为初始聚类中心.
步骤3 获取最终内中膜轮廓.使用本文提出的改进FCM分割图像.将颈动脉分割为管腔、内中膜和外膜3个部分,如图4(c)所示,根据分割结果标记最终内中膜轮廓,最终轮廓在图4(d)中给出.
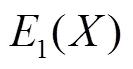
2.4 IMT计算
超声图像中的远端血管壁通常近似水平,因此采用平均绝对距离(mean absolute distance,MAD)计算IMT,即标记为MAI和LII的像素点纵坐标差的平均值.
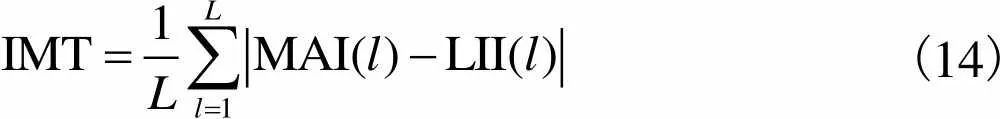
(14)
3 实验结果
3.1 实验数据
本文实验采用的超声图像库由塞浦路斯神经研究院(Cyprus Institute of Neurology of Nicosia,Cyprus)提供,共包含来自不同测试者的80张超声图像,测试者年龄段分布为26~95岁,平均年龄为54岁.超声图像由美国Advanced Technology Laborato-ries 生产的ATL HDI-3000超声扫描仪采集.该仪器配备了64个高分辨率单元和38,mm的宽带阵列,采用多元超声扫描技术,扫描头的工作频率范围为4~7,MHz,传输焦距范围为0.8~1.1,cm,声学孔径为10×8,mm.所采集的图像分辨率为576像素×768像素,像素灰度级为256,像素密度为16.66像素/mm.为保证IMT测量的准确性,曼海姆公约建议应该在没有斑块的远端血管壁测量,因此图像库中不包含出现斑块等严重病变的情况.
3.2 IMT分割质量评价方法
实验中采用绝对误差来评估不同测量结果的一致性,即

(15)
Person相关系数来衡量数据集合之间的相关性,相关系数越大,两个数据集合间的相似性越强. Pearson相关系数定义为
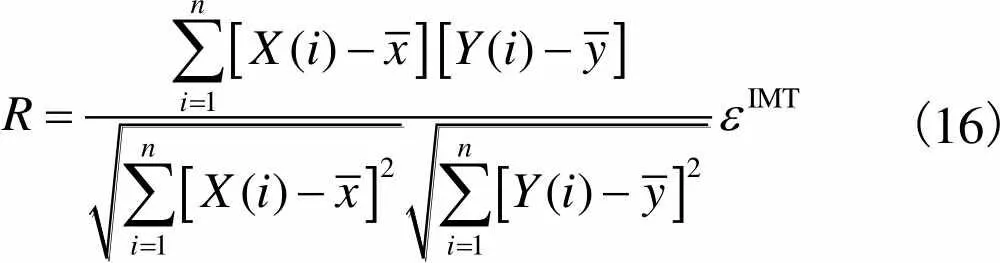
(16)
3.3 改进FCM算法性能分析
在本文提出的自动IMT测量算法中使用HMRF建立图像的空间模型,为FCM算法分割图像提供空间约束.
为了比较传统FCM算法与改进后FCM算法的分割性能,并说明改进算法的稳定性,实验中选取了几种典型的、成像形态不理想的血管图像:血管弯曲程度较高(Ⅰ)、血管壁内中膜成像不连续(Ⅱ)、内中膜存在组织间干扰(Ⅲ)以及内中膜厚度较薄(Ⅳ).
在相同的环境下分别使用两种算法分割这些血管图像,分割结果如图5所示.对比两种算法的分割结果,传统FCM算法在几种情况下均存在分割不完整甚至完全失效的情况,从分割结果无法提取完整内中膜边界信息;相比较来说,本文提出的改进FCM算法在4种血管形态不理想的情况下都能得到较可靠的分割结果,且由分割结果能够容易地获取较完整的内中膜轮廓.实验结果表明本文提出的基于HMRF模型改进的FCM算法对血管形态鲁棒,适应性较强,其性能相对传统算法有较大改进.
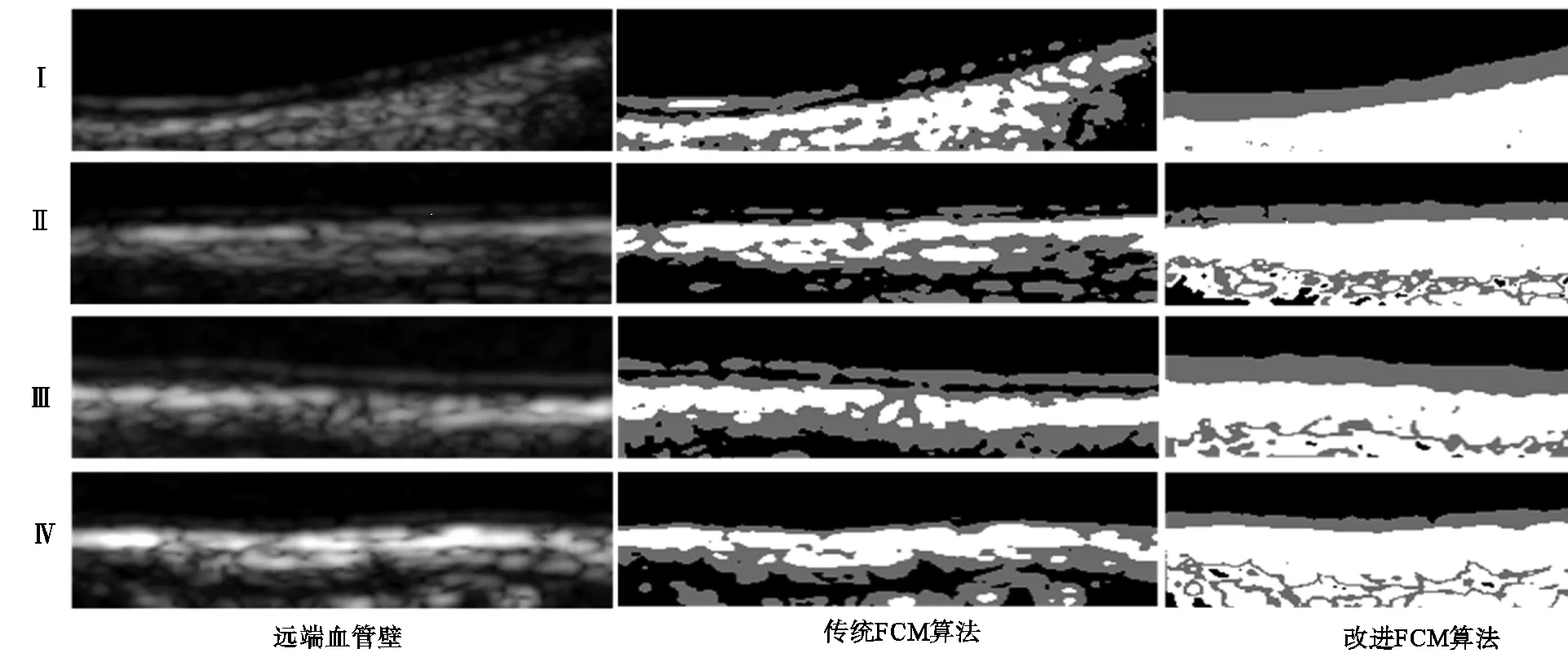
图5 不同形态血管的分割结果对比
3.4 IMT测量结果分析
用于算法的性能评估的真实IMT数据库,即真实值(ground truth,GT)通过手动测量的方法获取:由两名专家(Ex1和Ex2)对图像库中的80张颈动脉超声图像分别进行两次IMT测量,两次测量的时间间隔为10,a,取4次测量的平均值作为GT-IMT.
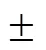
表1 IMT手动测量结果
Tab.1 IMT results of manual measurement
表2 IMT自动测量结果
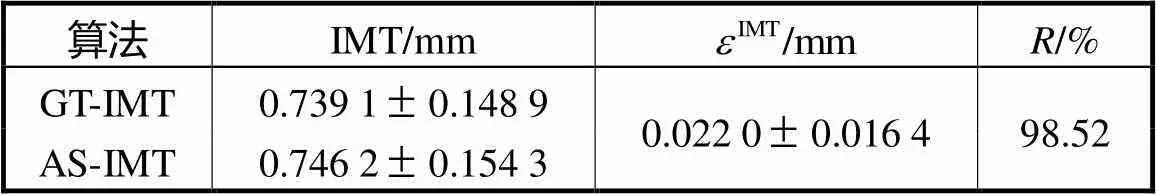
Tab.2 IMT results of automatic measurement
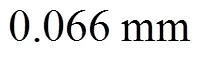
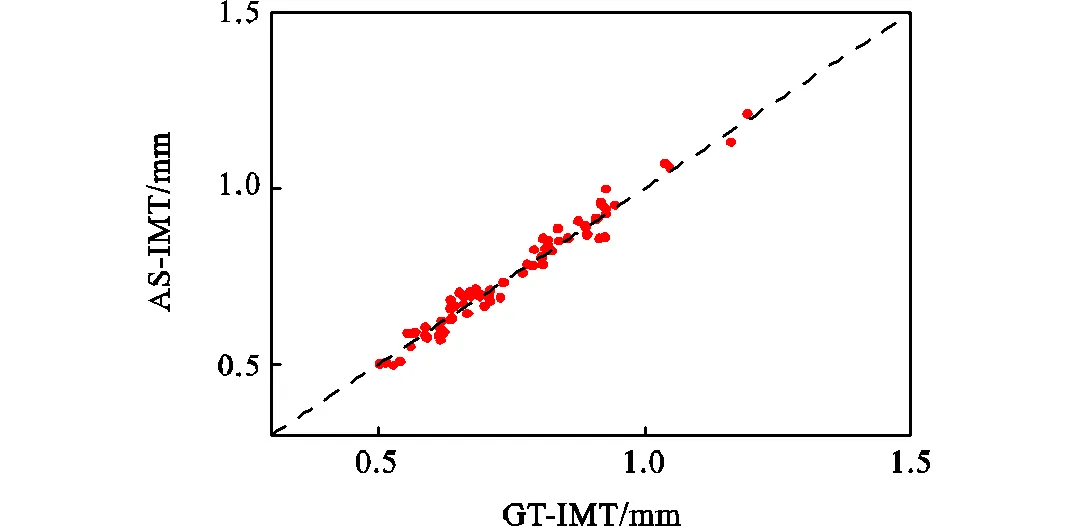
图6 GT-IMT与AS-IMT结果的散点图
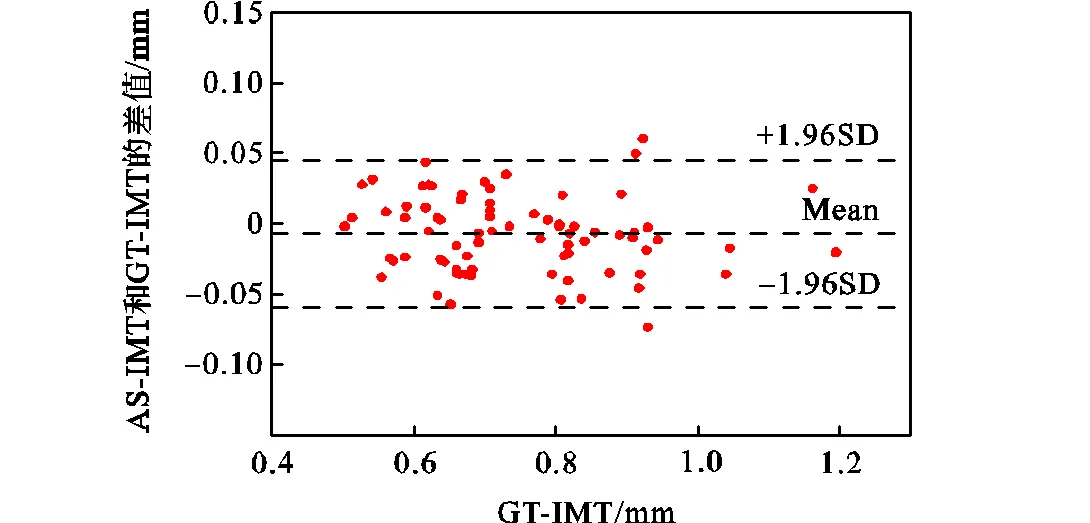
图7 GT-IMT和AS-IMT的Bland-Altman图
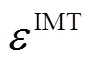
表3 与已有的算法比较
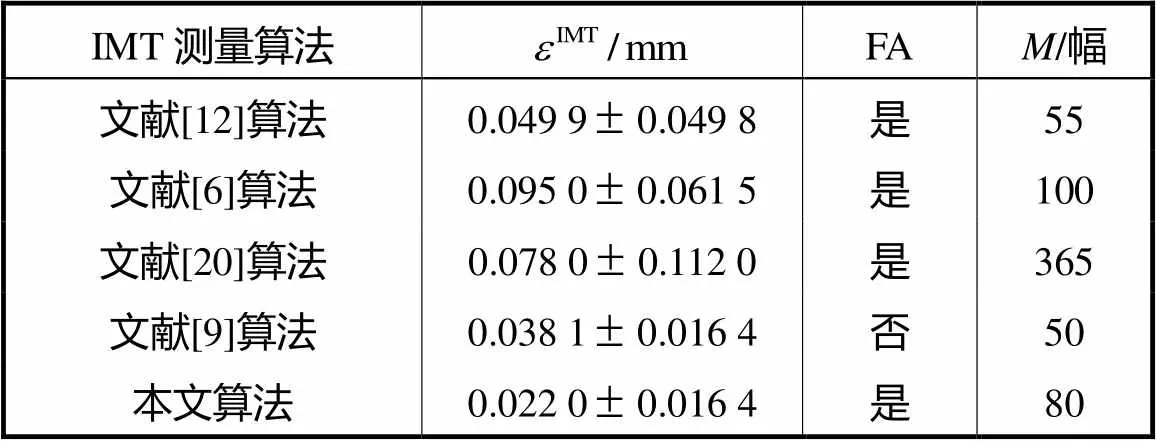
Tab.3 Comparison with previous algorithms
本文设计的IMT自动测量算法基于血管壁的灰度和形态特征自动提取ROI,实现了IMT的全自动测量;在图像分割时,使用HMRF建立图像的空间模型,并引入FCM算法为聚类过程提供空间约束,改进算法图像噪声的鲁棒性较强,在多种复杂的图像条件下都能获得较准确的分割结果.与其他几种算法相比,本文提出的全自动颈动脉超声图像分割方法的误差更小,分割结果精度相对较高.
4 结 语
本文提出一种基于改进FCM算法的超声颈动脉内中膜厚度检测方法,该方法依据先验信息自动提取ROI,减轻了人工提取ROI的负担,并采用基于HMRF改进的FCM算法分割远端血管壁图像,获取较准确内中膜轮廓,改进FCM算法结合了FCM算法和HMRF的优势,对图像噪声及血管形态鲁棒.本文算法由Matlab开发,在配置为Windows 8.1 Intel Core i7-4790 CPU @3.60,GHz的计算机上运行.实验中平均每张图像的处理时间为0.680,2,s,其中ROI提取阶段平均耗时0.205,5,s,内中膜分割阶段平均耗时0.262,7,s,分割算法具有较高的运行效率.实验结果表明,本文提出的颈动脉内中膜自动测量方法分割结果较准确,可以为颈动脉内中膜厚度的临床辅助诊断提供帮助.
[1] Simon A,Gariepy J,Chironi G,et al,Intima-media thickness:A new tool for diagnosis and treatment of cardiovascular risk[J].,2002,20(2):159-169.
[2] Pignoli P,Longo T. Evaluation of atherosclerosis with B-mode ultrasound imaging[J].,1988,32(3):166-173.
[3] Touboul P J,Prati P,Scarabin P Y,et al. Use of monitoring software to improve the measurement of carotid wall thickness by B-mode imaging[J].,1992,10(5):37-42.
[4] Cheng D C,Schmidt-Trucksäss A,Cheng K S,et al. Using snakes to detect the intimal and adventitial layers of the common carotid artery wall in sonographic images[J].,2002,67(1):27-37.
[5] Loizou C P,Pattichis C S,Pantziaris M,et al. Snakes based segmentation of the common carotid artery intima media[J].,2007,45(1):35-49.
[6] Petroudi S,Loizou C,Pantziaris M,et al. Segmentation of the common carotid intima-media complex in ultrasound images using active contours[J].,2012,59(11):3060-3069.
[7] Faita F,Gemignani V,Bianchini E,et al. Real-time measurement system for evaluation of the carotid intima-media thickness with a robust edge operator[J].,2008,27(9):1353-1361.
[8] Li Q,Zhang W,Guan X,et al. An improved approach for accurate and efficient measurement of common carotid artery intima-media thickness in ultrasound images[J].,2014(1):740328-1-8.
[9] Xu X,Zhou Y,Cheng X,et al. Ultrasound intima-media segmentation using Hough transform and dual snake model[J].,2012,36(3):248-258.
[10] Xiao L,Li Q,Bai Y,et al. Automated measurement method of common carotid artery intima-media thickness in ultrasound image based on Markov random field mod-els[J].,2015,35(5):651-660.
[11] Menchón-Lara R M,Bastida-Jumilla M C,Morales-Sánchez J,et al. Automatic detection of the intima-media thickness in ultrasound images of the common carotid artery using neural networks[J].,2014,52(2):169-181.
[12] Menchón-Lara R M,Sancho-Gómez J L. Fully automatic segmentation of ultrasound common carotid artery images based on machine learning[J].,2015,151:161-167.
[13] Rosati S,Balestra G,Molinari F. Rough set based approach for IMT automatic estimation[J].,2012,14(4):211-216.
[14] Otsu N. A threshold selection method from gray-scale histograms[J].,1979,9(1):62-66.
[15] Tomasi C,Manduchi R. Bilateral filtering for gray and color images[C]//. Bombay,India,1998:839.
[16] Dunn J. A fuzzy relative of the ISODATA process and its use in detecting compact well-sparated cluster[J].,1973,3(3):32-57.
[17] 张小峰. 基于模糊聚类算法的医学图像分割技术研究[D]. 济南:山东大学计算机科学与技术学院,2014.
Zhang Xiaofeng. Research of Medical Image Segmentation Based on Fuzzy Clustering Algorithms[D]. Jinan:School of Computer Science and Technology,Shandong University,2014(in Chinese).
[18] Chatzis S P,Varvarigou T A. A fuzzy clustering approach toward hidden Markov random field models for enhanced spatially constrained image segmentation[J].,2008,16(5):1351-1361.
[19] Clifford P. Markov random fields in statistics[J]1990,14(1):19-32.
[20] Molinari F,Pattichis C S,Zeng G,et al. Completely automated multiresolution edge snapper—A new technique for an accurate carotid ultrasound IMT measurement:Clinical validation and benchmarking on a multi-institutional database[J].,2012,21(3):1211-1222.
(责任编辑:王晓燕)
Segmentation of Carotid Intima Media in Ultrasound Images Using Improved Fuzzy C Means Algorithm
Li Qiang,Zhang Qijun,Guan Xin,Teng Jianfu
(School of Microelectronics,Tianjin University,Tianjin 300072,China)
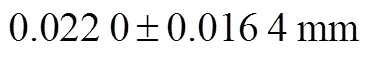
ultrasound image segmentation;intima-media thickness(IMT)measurement;fuzzy C means(FCM);hidden Markov random field(HMRF)model;region of interest(ROI)
10.11784/tdxbz201612044
2016-12-19;
2017-03-08.
李 锵(1974— ),男,博士,教授,liqiang@tju.edu.cn.
张琦珺,zqjyx@tju.edu.cn.
国家自然科学基金资助项目(61471263).
the National Natural Science Foundation of China(No.,61471263).
