木质纤维素薄膜制备与酶解过程的QCM-D分析
2018-01-19苏荣欣陈眯眯黄仁亮王梦凡何志敏
苏荣欣,陈眯眯,黄仁亮,齐 崴,王梦凡,何志敏
木质纤维素薄膜制备与酶解过程的QCM-D分析
苏荣欣1, 2, 3, 4,陈眯眯1, 2,黄仁亮1, 2,齐 崴1, 2, 3, 4,王梦凡1, 2,何志敏1, 2
(1. 天津大学化工学院,天津 300350;2. 化学工程联合国家重点实验室(天津大学),天津 300350;3. 天津化学化工协同创新中心,天津 300350;4. 天津市膜科学与海水淡化技术重点实验室,天津 300072)
耗散型石英晶体微天平(QCM-D)是基于石英晶体的压电效应对其电极表面质量变化进行测量的仪器,已被证明是一种高灵敏的在线表界面过程分析工具.本文综述了近年来木质纤维素薄膜制备及应用QCM-D研究其酶解过程的分析进展,分别从薄膜制备、纤维素酶吸附(纤维素、木质素、混合底物)、酶解历程分析、动力学建模等4个方面进行简要介绍.上述研究成果有助于理解纤维素酶与木质纤维素的相互作用规律,为设计新型复配酶制剂、深刻理解纤维素酶解机制提供基础和指导.
木质纤维素;纤维素酶;石英晶体微天平;膜;吸附;水解
如何将人类经济社会由高度依赖化石能源逐渐转变为循环开发可再生能源,是建设可持续性绿色经济社会和减少全球温室气体排放的中心议题[1].利用基于酶催化的生物精炼技术,将木质纤维素(自然界含量最丰富的可再生资源)分子中的糖单元释放出来,并进一步合成为液态燃料和生物基化学品,逐步建立可循环绿色经济模式,对解决当前全球能源危机、资源匮乏、环境污染、气候变暖等问题均具有极为重要的意义[2].木质纤维素是一类由纤维素、半纤维素和木质素3种长链高分子相互交织在一起的“类钢筋混凝土”复杂大分子[3],结构极为致密,性质高度顽抗.这种特殊的复杂结构进一步要求:只有多种纤维素酶有效协同,逐步破解各种长链高分子,才能高效转化木质纤维素[4].因此,木质纤维素酶解转化过程是一个高度复杂的反应体系,具有底物结构复杂、酶制剂种类多样、反应过程影响因素多等特点.只有深入分析纤维素酶与木质纤维素的相互作用,才能更好地设计复配酶制剂,促进纤维素乙醇的商业化开发.
目前,研究人员采用旋转涂膜法[5-9]、自组装单分子层法[10]、LB(Langmuir-Blodgett)膜法[11-13]等制备了表面光滑、吸附牢固且全面均匀覆盖基底、性质稳定的纤维素、木质素和木质纤维素薄膜,再通过椭偏仪[14-17]、中子反射仪[18-19]、表面等离子共振谱仪[8, 20]、石英晶体微天平[6-7,10,21]、原子力显微镜[22-23]等对薄膜性质及其表面酶吸附与酶催化过程进行分析.椭偏仪、中子反射计、原子力显微镜分别可表征测量薄膜的厚度、水分含量和表面形貌.但这些方法不能定量表征纤维素酶在薄膜表面的吸附量和水解效果.表面等离子共振谱仪虽然能提供薄膜质量与时间的关系,但是不能反映薄膜结构.QCM-D是在线表界面吸附与动力学研究的分析工具,具有纳克级的灵敏度,可同时确定薄膜质量和结构变化的信息.因此可实时跟踪分析金膜表面的成膜过程、吸附行为和降解历程,已在木质纤维素成膜、纤维素酶吸附、酶解历程分析等方面得到广泛应用.
1 QCM-D的工作原理
QCM-D作为一种检测精度可达纳克级别的表界面分析仪器,可通过测量石英压电振子(具有压电效应的石英晶体)在外加电场下振动频率的变化考察晶片表面上的质量变化.耗散因子的变化可提供表面坚硬度的变化.
如图1所示,QCM-D利用的是石英晶体的逆压电效应原理[24].QCM-D的核心部件是石英晶体传感器.当传感器两端施加电压时,石英晶体会在共振频率处引发一个小的剪切振动.如果在晶体表面上吸附一层薄膜,晶体的振动就会减弱,且振动幅度或频率与薄膜的厚度和密度息息相关.


图1 QCM-D的工作原理示意
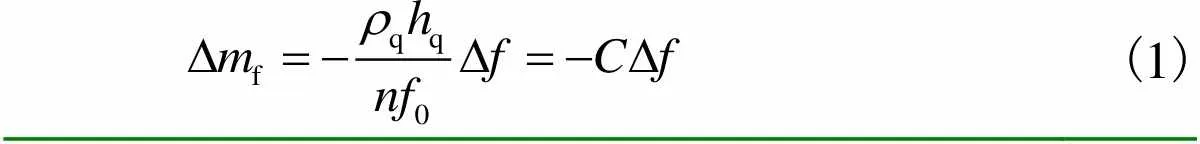
(1)
方程(1)即Sauerbrey方程[25].式中:Df=Df,/q,为单位面积的质量变化,即面密度变化;q为石英晶体表面面积;q为石英晶体的密度;q为石英晶体厚度;为倍频;0为基频;D为频率变化;=qq/0,当石英晶体的厚度确定时,为常数.
方程(1)仅适用于足够薄(相对于石英晶体)、足够刚性且均匀铺展的吸附层.对于柔软或具有黏弹性质的膜,由于不能完全耦合谐振晶体,根据Sauerbrey方程得到的测量值会明显低于实际质量,且无法提供黏弹性膜的特性.因此,定义了耗散因子,用于表示吸附在传感器表面的膜层黏弹特性,即

(2)
式中:dis是一个周期的能量耗散;sto是振荡时储存的能量.值越大,表明晶体上的薄膜越柔软,吸附层黏弹性越大,即能量耗散越高说明膜的黏度系数和弹性模量越低[26].
在QCM-D传感芯片表面吸附木质纤维素薄膜,通入纤维素酶溶液,通过观察和的变化,可分析酶在薄膜表面的吸附、水解、脱附等行为.此外还可运用Sauerbrey方程定量计算薄膜表面上酶的吸附量和纤维素水解量.
图2是用QCM-D检测25,℃下外切纤维素酶(Cel7A,10,mg/L)在纤维素薄膜上吸附/脱附行为引起的频率值和耗散因子变化的典型曲线[5].图中选用第3倍频的频率变化值(Δ3)和耗散因子变化值(Δ3).在缓冲溶液中添加6,g/L葡萄糖来抑制纤维素酶的水解,只观察环境条件下酶的吸附和脱附行为.图中,Cel7A的吸附导致薄膜上质量增加,频率值下降.30,min后,通入缓冲溶液,上升,表示Cel7A被洗脱.耗散因子反映薄膜黏弹性的变化,吸附阶段由于蛋白的吸附使其黏弹性增加,因而上升,而洗脱阶段由于蛋白洗脱暴露出坚硬的纤维素薄膜而刚性增加,因而下降.
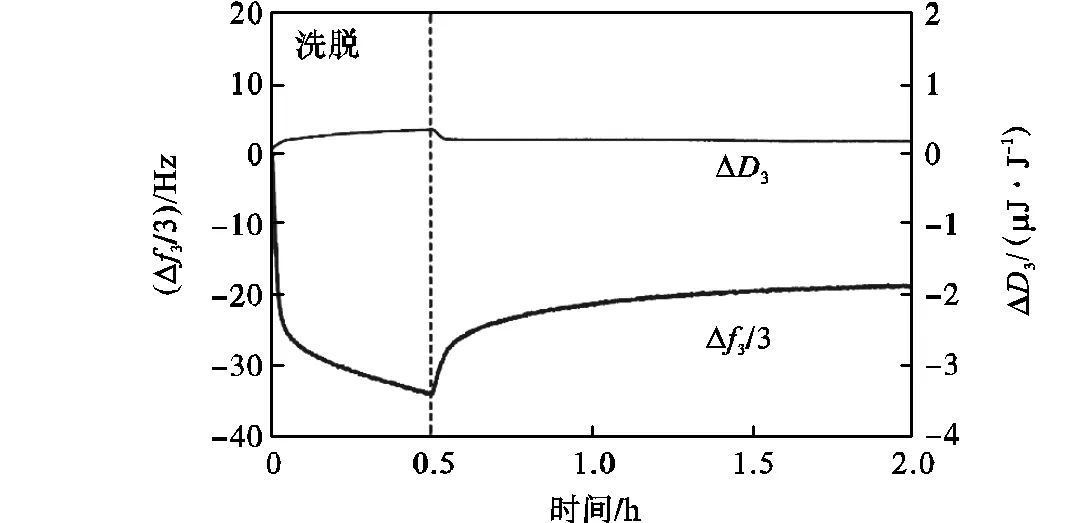
图2 外切纤维素酶Cel7A在纤维素薄膜上的吸附/脱附曲线
2 木质纤维素薄膜制备与分析
利用QCM-D分析木质纤维素表面酶吸附与水解行为,首先必须在QCM传感器表面制备一层厚度极薄(小于几百纳米)、表面光滑、吸附牢固且均匀覆盖基底的木质纤维素薄膜.由于木质纤维素是一类由纤维素、半纤维素和木质素3种长链高分子相互交织在一起的复杂大分子,许多学者通过旋转涂膜法、自组装单分子层法、化学连接法等制备纤维素薄膜、木质素薄膜、木质纤维素薄膜或者混合膜(见表1),并分析了这些薄膜的结构特点.
旋转涂膜法具有操作简单,能快速制备均匀、牢固的薄膜等优点,应用最为广泛.LB膜法的优点是制得的薄膜能够完全覆盖基底且具有最小的粗糙度,膜厚可通过涂布层数精确调控,但缺点是需要精密的仪器,且需要选择合适的溶剂相和面下相,耗时长,不便于大批量生产.因此,研究人员普遍采用旋转涂膜法制备厚度低于100,nm的薄膜用于检测.
2.1 纤维素薄膜制备
将纤维素溶于N-甲基氧化吗啡(NMMO)[5, 8]、离子液体[8, 27]等非衍生化溶剂中,通过旋转涂膜的方式,可获得均匀的纤维素薄膜.此外,Tham等[10]在QCM-D传感芯片表面先修饰聚乙烯亚胺(PEI),再通入微晶纤维素悬浮液,制得牢固的自组装纤维素薄膜.Orelma等[28]则先在芯片表面旋涂一层聚苯乙烯,运用水平方向Langmuir-Schaeffer沉积技术在芯片表面修饰三甲基硅烷基纤维素(TMSC),去甲硅基后得到纤维素薄膜.
不同来源的纤维素均可通过旋转涂膜法制备用于QCM-D检测的薄膜,纤维素薄膜厚度因原料不同,分布在5~50,nm.在旋转涂膜之前,在芯片表面修饰阳离子聚电解质,利用静电相互作用可制得稳定、牢固的纤维素薄膜.此外,同一种纤维素溶解在不同溶剂中可制备结晶度为15%,~85%,的薄膜[8].
2.2 木质素薄膜制备
木质素薄膜的表面性质与木质素来源、木质素的提取方法、溶解木质素的溶剂和制膜方法有关.
将木质素溶于氨水[29-31]、1,4-二恶烷[9,31-33]等溶剂中,形成均一的溶液,取一定量木质素溶液置于QCM-D传感芯片表面,溶剂在高速离心力下连续蒸发并径向流动,最终在芯片表面形成均一、固态的木质素薄膜.根据旋转涂膜法制备的薄膜,与基底有很强的黏附力,膜厚因木质素提取方法不同而有明显差异[32].
采用LB膜法可把木质素一层一层地涂布到指定衬底上.Pasquini等[11]以从甘蔗渣中提取的木质素为原料,将木质素溶于DMA(N,N-二甲基乙酰胺)和氯仿的混合溶液中,制得的LB膜因木质素提取方法不同而表现出不同的特性.用丙酮-氧、苏打、乙醇-水、丙酮/水/硫酸提出的木质素LB薄膜粗糙度分别为0.30,nm、1.25,nm、0.24,nm、3.80,nm.
2.3 木质纤维素薄膜制备
木质纤维素薄膜主要通过旋转涂膜的方式制得.近年来,许多学者通过在QCM-D传感器表面修饰一层PEI[10, 34-36],利用其提供的阳离子环境,增加QCM-D传感芯片的亲水性,再采用亚氯酸钠[36]、加压热水[34]、蒸汽爆破[35]等处理不同来源的木质纤维素,采用旋转涂膜法制得的木质纤维素薄膜厚度可达10,nm左右[34-36].
此外,为了尽可能模拟自然界中木质纤维素的实际存在形式,研究人员通过混配的方式制备了不同组成的混合膜.将纤维素、半纤维素、木质素衍生化,把其中的两种或多种成分溶于同一种溶液,旋转涂膜,之后脱去甲硅基、乙酰基等衍生化基团,形成不同组成和比例含量的木质纤维素混合膜.
Strasser等[37]将木质素棕榈酸酯(LP)与TMSC按不同比例溶于三氯甲烷溶液,旋转涂膜,在HCl蒸气中去甲硅基,制备不同组分含量的LP/纤维素混合膜.结果表明:降低TMSC含量、脱甲硅基后,混合膜厚均减小;混合膜中纤维素的含量对静态接触角(SCA)影响很小(约为40°),但脱甲硅基后,SCA减小.这可能是因为去甲硅基后,纤维素部分解聚,链流动性增加重排而形成更为致密的结构[38].
Hoeger等[39]将乙酰化木质素(AcL)和TMSC溶于氯仿,旋涂,分别在HCl和氨气中脱甲硅基和乙酰基,得到纤维素/木质素混合膜.总体上,脱乙酰基和甲硅基后,薄膜粗糙度均增加;薄膜中木质素含量越高,水接触角和粗糙度越大,当木质素质量分数占50%,时,水接触角和粗糙度分别可以达55°±1°、(4.4±0.2)nm.
Martín-Sampedro等[40]用三醋酸纤维素(CTA),与AcL溶于氯仿,旋转涂膜,室温下在氨气氛围中脱乙酰基,CTA转化为纤维素,AcL转化为木质素,最终形成纤维素/木质素混合膜.随着木质素含量的增加,膜粗糙度增加,水接触角增大;脱乙酰基后,混合膜粗糙度也增加.用CTA代替TMSC,旋转涂膜后,只需一步脱去乙酰基即可,操作更简便.
Kumagai等[36]结合亚氯酸钠处理(SCT)和机械颤动处理日本扁柏软木粉,通过旋转涂膜制得半纤维素和木质素含量较高的木质纤维素(LCNF)薄膜.结果表明,经过8,h的SCT,LCNF薄膜厚度可降到(10.6±0.8)nm,粗糙度降到(3.34±0.13)nm.
表1 木质纤维素薄膜制备与分析

Tab.1 Preparation and characterization of lignocellulosic thin films
3 纤维素酶吸附分析
在木质纤维素酶解过程通常需要三类酶共同作用,即:①外切纤维素酶,主要水解结晶型纤维素链,从还原端或非还原端水解释放纤维二糖;②内切纤维素酶,随机水解无定形纤维素,释放纤维寡糖形成新的还原端;③β-葡萄糖苷酶,它主要水解纤维二糖和纤维寡糖及其他低聚糖,产生葡萄糖.其中,外切纤维素酶和内切纤维素酶分子内一般都包含吸附域CBD和催化域CD,可通过CBD结合到木质纤维素上[41-42];而β-葡萄糖苷酶则不包含吸附域CBD[43-44].
3.1 纤维素酶在纤维素薄膜上的吸附行为
美国加州大学伯克利分校Maurer等[5]采用QCM-D分析了外切纤维素酶(Cel7A)和内切纤维素酶(Cel7B)在纤维素表面的竞争性吸附行为.发现在一定的浓度范围内,Cel7A和Cel7B酶浓度越高,用QCM-D观察到的频率下降越多,酶在纤维素表面吸附量越大.在相同浓度下,Cel7A在纤维素表面吸附引起频率下降更多,说明Cel7A与纤维素之间具有更强的亲和力.
此外,研究发现不同来源的纤维素酶在纤维素表面表现出不同的吸附-反应特性.包含CBD的内切酶会穿透纤维素薄膜作用,使得能量耗散减小,薄膜刚性增加[18-19];纤维素表面吸附表面活性剂后,不会影响CBH-I在其表面的水解[32].
Maurer等[5]根据一级反应动力学方程,做出合理的假设,再用龙格-库塔算法在有限范围内迭代,求出Cel7A和Cel7B的吸附、脱附、不可逆吸附速率常数(A、D、I),并以此为基础构建了Langmuir吸附动力学模型,与用QCM-D测出的实验结果拟合很好.两种酶I相似,考虑到Cel7A和Cel7B有相似的结合位点,这可能是因为与纤维素羟基结合的CBD区氨基酸残基不同导致的;Cel7A熵值大于Cel7B,解释了Cel7A有更高的Langmuir平衡常数、与纤维素有更强的亲和力.
另外,Cel7A、Cel7B混合酶在纤维素表面的动力学模型也被建立[45].该模型包括两种酶竞争性吸附、不可逆结合、络合、协同作用.对Cel7A和Cel7B来说,限速步骤分别是络合和吸附;在25,℃下,Cel7A与Cel7B浓度比为2∶1时,纤维素膜降解速率最大.
外切和内切纤维素酶主要通过CBD特异性吸附在纤维素薄膜上.用QCM-D可以观察到酶的吸附引起频率值下降,能量耗散增加.外切酶和内切酶的结构不同,因而引起频率和耗散值的减小和增加量也不同[5, 40].此外,用QCM-D观察到通入缓冲溶液,吸附的纤维素酶不能被完全洗脱下来,说明纤维素酶会由于局部变性不可逆吸附在纤维素薄膜上[5, 14].
3.2 纤维素酶在木质素薄膜上的吸附行为
蛋白质主要通过疏水相互作用非特异性吸附在木质素薄膜上[32-33].Rahikainen等[31]指出:外切纤维素酶Cel7A在木质素表面的吸附经历两个过程,先快速吸附、再缓慢连接,频率值先快速增加之后逐渐减小,最终下降值约为18,Hz;而Cel7A催化域则只有一个缓慢吸附的过程,该吸附引起频率值变化约为7,Hz.因此,Cel7A在木质素上起始快速吸附主要由其吸附域(CBD)发生作用.研究发现CBD的3个芳香族酪氨酸残基可通过疏水相互作用与木质素连 接[31].此外,木质素的组成和结构不同,与酶的亲和力也不同.蒸汽爆破(SE)处理使得木质素中酚羟基增加,酶吸附增多[31];羧基增加使得木质素更亲水,因此酶吸附量减小[46-47];木质素中紫丁香/愈创木单体比例越少,纤维素酶在木质素上吸附越多[48];降低木质素表面的粗糙度,增加润湿性,酶吸附变少[32];木质素上离子化基团可使酶吸附量随着pH值增大而下降[49].
木质素是化学多相聚合物,因此不同位点上的结合行为也不同.Cel7B在木质素表面的吸附更符合两点转换模型[21],即内切酶以两个不同的速率吸附在木质素薄膜上多个不同的位点,之后蛋白会脱附或者不可逆结合在木质素表面,两点转换模型如图3所示.

图3 内切纤维素酶Cel7B的两点转换模型
木质素由3种单体醇(松柏醇、芥子醇和对香豆醇)通过化学键结合形成聚酚类天然高分子物质,具有高度的疏水性.木质素薄膜越疏水,纤维素酶在木质素上的吸附越多.纤维素酶的CBD和CD共同影响其在木质素上的吸附[31, 40].
3.3 纤维素酶在木质纤维素薄膜上的吸附行为
在木质纤维素薄膜中,纤维素含量越高,外切纤维素酶吸附引起频率下降越多[40].而内切纤维素酶则对木质素有更强的亲和力,因而当木质纤维素薄膜中木质素含量增加,内切纤维素酶的吸附量也增加[40].
纤维素酶在木质纤维素上吸附行为受木质纤维素组成结构、各组分比例以及纤维素酶种类的影响.一般来说,外切酶在纤维素含量高的木质纤维素薄膜上吸附较多,而内切酶在木质素含量高的木质素薄膜上吸附较多.
4 木质纤维素酶解行为分析
QCM-D可用于研究纤维素酶在木质纤维素膜上的催化过程,实时监测纤维素酶在木质纤维素膜上的吸附和纤维素的酶解,并可进一步研究纤维素酶解动力学.表2总结了近年来应用QCM-D分析木质纤维素吸附和酶解行为的研究进展.
表2 纤维素酶的吸附与水解行为分析

Tab.2 Analysis of adsorption and hydrolysis of cellulases
Martín-Sampedro等[40]指出,外切纤维素酶首先在纤维素薄膜表面吸附,使得薄膜黏弹性增加,质量增加.随后,在薄膜表面水解,薄膜逐渐变薄,黏弹性也略微下降.最后,纤维素酶扩散到薄膜内部,水分子浸润,纤维素分子溶胀,薄膜黏弹性增加.与外切纤维素酶不同,内切纤维素酶作用初期主要以水解为主,随后才逐渐表现为吸附[40, 50].
在木质素薄膜表面,外切与内切纤维素酶主要通过疏水相互作用进行不可逆吸附.与外切纤维素酶具有隧道形的活性位点相比,内切纤维素酶含有更开放的位点,因此表现出对木质素具有更强的亲和力[51].
在木质纤维素薄膜表面,纤维素含量越高,外切纤维素酶吸附量越多,并在吸附过程中伴随着水解.内切纤维素酶作用于纤维素链内部产生纤维糊精,而外切纤维素酶则作用于还原性末端,从链端切纤维二塘单元,两者协同水解纤维素.但由于木质素的存在,纤维素酶无效吸附,因此水解效率下降[40].
5 结 语
QCM-D具有操作简便、快捷、可以实时在线定量跟踪监测等优点.本文总结了近年来在QCM-D传感芯片上纤维素、木质素与木质纤维素薄膜的制备方法,并采用QCM-D分析酶吸附与水解行为.
目前用于QCM-D研究的薄膜在结构、组成等方面与木质纤维素原始或预处理后的形态存在明显差异,不能真实模拟各组分间相互作用.此外,纤维素酶穿过薄膜表面后会引起薄膜水含量变化,QCM-D不能单独、准确测量因纤维素酶的水解而引起的木质纤维素薄膜质量变化,还需耦合中子反射计等仪器测量木质纤维素薄膜因吸水溶胀而产生的质量变化.
今后,需要进一步利用QCM-D研究化学组成更接近原生木质纤维原料的薄膜,尽量还原自然界中真实存在或预处理后木质纤维素的形态.目前,研究人员构建了单酶、多组分混合酶在纤维素薄膜上的吸附、水解动力学模型,以及单酶在木质素薄膜上的吸附动力学模型,纤维素酶在成分更加复杂的木质纤维素薄膜上的吸附、水解模型的构建仍需要利用QCM-D进行实时、定量、原位分析,发现并阐明纤维素酶解效率变化的演变规律,以指导工业生产中纤维素酶的复配体系设计.
[1] Sheridan C. Big oil turns on biofuels[J].,2013,31(10):870-873.
[2] Liao J C,Mi L,Pontrelli S,et al. Fuelling the future:Microbial engineering for the production of sustainable biofuels[J].,2016,14(5):288-304.
[3] Somerville C,Bauer S,Brininstool G,et al. Toward a systems approach to understanding plant cell walls[J].,2004,306(5705):2206-2211.
[4] Huang R L,Su R X,Qi W,et al. Bioconversion of lignocellulose into bioethanol:Process intensification and mechanism research[J].,2011,4(4):225-245.
[5] Maurer S A,Bedbrook C N,Radke C J. Competitive sorption kinetics of inhibited endo-and exoglucanases on a model cellulose substrate[J].,2012,28(41):14598-14608.
[6] Mohan T,Niegelhell K,Zarth C S P,et al. Triggering protein adsorption on tailored cationic cellulose surfaces [J].,2014,15(11):3931-3941.
[7] Zhang Y X,Rojas O J. Immunosensors for C-reactive protein based on ultrathin films of carboxylated cellulose nanofibrils[J].,2017,18(2):526-534.
[8] Benselfelt T,Cranston E D,Ondaral S,et al. Adsorption of xyloglucan onto cellulose surfaces of different morphologies:An entropy-driven process[J].,2016,17(9):2801-2811.
[9] Salas C,Rojas O J,Lucia L A,et al. On the surface interactions of proteins with lignin[J].,2013,5(1):199-206.
[10] Tham Y Y,Molino P J,Higgins M J,et al. The study of deposition of wood extractives and model compound colloids onto chromium and cellulose surfaces using quartz crystal microbalance with dissipation(QCM-D)[J].:,2016,491:1-11.
[11] Pasquini D,Balogh D T,Oliveira O N,et al. Lignin molecular arrangements in Langmuir and Langmuir-Blodgett films:The influence of extraction processes [J].:,2005,252(2/3):193-200.
[12] Raegen A N,Reiter K,Dion A,et al. Advances in surface plasmon resonance imaging enable quantitative tracking of nanoscale changes in thickness and roughness [J].,2014,86(7):3346-3354.
[13] Quirk A,Lipkowski J,Vandenende C,et al. Direct visualization of the enzymatic digestion of a single fiber of native cellulose in an aqueous environment by atomic force microscopy[J].,2010,26(7):5007-5013.
[14] Maurer S A,Bedbrook C N,Radke C J. Cellulase adsorption and reactivity on a cellulose surface from flow ellipsometry[J].,2012,51(35):11389-11400.
[15] Eriksson J,Malmsten M,Tiberg F,et al. Enzymatic degradation of model cellulose films[J].,2005,284(1):99-106.
[16] Falt S,Wågberg L,Vesterlind E L,et al. Model films of cellulose ID—Improved preparation method and characterization of the cellulose film[J].,2004,11(2):151-162.
[17] Gunnars S,Wågberg L,Stuart M A C. Model films of cellulose:I. Method development and initial results[J].,2002,9(3):239-249.
[18] Cheng G,Liu Z L,Murton J K,et al. Neutron reflectometry and QCM-D study of the interaction of cellulases with films of amorphous cellulose[J].,2011,12(6):2216-2224.
[19] Cheng G,Datta S,Liu Z L,et al. Interactions of endoglucanases with amorphous cellulose films resolved by neutron reflectometry and QCM-D[J].,2012,28(22):8348-8358.
[20] Vuoriluoto M,Orelma H,Zhu B,et al. Control of protein affinity of bioactive nanocellulose and passivation using engineered block and random copolymers[J].,2016,8(8):5668-5678.
[21] Pfeiffer K A,Sorek H,Roche C M,et al. Evaluating endoglucanase Cel7B-lignin interaction mechanisms and kinetics using quartz crystal microgravimetry[J].,2015,112(11):2256-2266.
[22] Ganner T,Rosker S,Eibinger M,et al. Tunable semicrystalline thin film cellulose substrate for high-resolution,in-situ AFM characterization of enzymatic cellulose degradation[J].,2015,7(50):27900-27909.
[23] Qin C R,Clarke K,Li K C. Interactive forces between lignin and cellulase as determined by atomic force microscopy[J].,2014,7(1):65-74.
[24] Chen Q,Xu S M,Liu Q X,et al. QCM-D study of nanoparticle interactions[J].,2016,233:94-114.
[25] Sauerbrey G. Verwendung von schwingquarzen zur wägung dünner schichten und zur mikrowägung[J].,1959,155(2):206-222.
[26] Rodahl M,Jonson M. Viscoelastic acoustic response of layered polymer films at fluid-solid interfaces:Continuum mechanics approach[J].,1999,59(9):391-396.
[27] Zhou S S,Li H F,Garlapalli R,et al. Hydrolysis of model cellulose films by cellulosomes:Extension of quartz crystal microbalance technique to multienzymatic complexes[J].,2017,241:42-49.
[28] Orelma H,Filpponen I,Johansson L S,et al. Modification of cellulose films by adsorption of CMC and chitosan for controlled attachment of biomolecules [J].,2011,12(12):4311-4318.
[29] Lou H M,Wang M X,Lai H R,et al. Reducing non-productive adsorption of cellulase and enhancing enzymatic hydrolysis of lignocelluloses by noncovalent modification of lignin with lignosulfonate[J].,2013,146(10):478-484.
[30] Norgren M,Notley S M,Majtnerova A,et al. Smooth model surfaces from lignin derivatives. I. Preparation and characterization[J].,2006,22(3):1209-1214.
[31] Rahikainen J L,Martin-Sampedro R,Heikkinen H,et al. Inhibitory effect of lignin during cellulose bioconversion:The effect of lignin chemistry on non-productive enzyme adsorption[J].,2013,133(2):270-278.
[32] Fritz C,Ferrer A,Salas C,et al. Interactions between cellulolytic enzymes with native,autohydrolysis,and technical lignins and the effect of a polysorbate amphiphile in reducing nonproductive binding[J].,2015,16(12):3878-3888.
[33] Sammond D W,Yarbrough J M,Mansfield E,et al. Predicting enzyme adsorption to lignin films by calculating enzyme surface hydrophobicity[J].,2014,289(30):20960-20969.
[34] Kumagai A,Lee S H,Endo T. Evaluation of the effect of hot-compressed water treatment on enzymatic hydrolysis of lignocellulosic nanofibrils with different lignin content using a quartz crystal microbalance[J].,2016,113(7):1441-1447.
[35] Kumagai A,Iwamoto S,Lee S H,et al. Quartz crystal microbalance with dissipation monitoring of the enzymatic hydrolysis of steam-treated lignocellulosic nanofibrils[J].,2014,21(4):2433-2444.
[36] Kumagai A,Lee S H,Endo T. Thin film of lignocellulosic nanofibrils with different chemical composition for QCM-D study[J].,2013,14(7):2420-2426.
[37] Strasser S,Niegelhell K,Kaschowitz M,et al. Exploring nonspecific protein adsorption on lignocellulosic amphiphilic bicomponent films[J].,2016,17(3):1083-1092.
[38] Ehmann H M A,Werzer O,Pachmajer S,et al. Surface-sensitive approach to interpreting supramolecular rearrangements in cellulose by synchrotron grazing incidence small-angle X-ray scattering[J].,2015,4(7):713-716.
[39] Hoeger I C,Filpponen I,Martin-Sampedro R,et al. Bicomponent lignocellulose thin films to study the role of surface lignin in cellulolytic reactions[J].,2012,13(10):3228-3240.
[40] Martín-Sampedro R,Rahikainen J L,Johansson L S,et al. Preferential adsorption and activity of monocomponent cellulases on lignocellulose thin films with varying lignin content[J].,2013,14(4):1231-1239.
[41] Huang R L,Guo H,Su R X,et al. Enhanced cellulase recovery without beta-glucosidase supplementation for cellulosic ethanol production using an engineered strain and surfactant[J].,2017,114(3):543-551.
[42] Guo H,Zou S L,Liu B S,et al. Reducing beta-glucosidase supplementation during cellulase recovery using engineered strain for successive lignocellulose bioconversion[J].,2015,187:362-368.
[43] 苏荣欣杨仁俊,齐 崴,等. 聚多巴胺辅助磁微球固定β-葡萄糖苷酶的制备与应用[J]. 天津大学学报:自然科学与工程技术版,2017,50(5):471-476.
Su Rongxin,Yang Renjun,Qi Wei,et al. Polydopamine-assisted preparation and application of magnetic immobilized β-Glucosidase[J].:,2017,50(5):471-476(in Chinese).
[44] Su R X,Yang R J,Yang J F,et al. Oscillating cellulase adsorption and enhanced lignocellulose
hydrolysis upon ultrasound treatment[J].,2016,23(1):11-19.
[45] Maurer S A,Brady N W,Fajardo N P,et al. Surface kinetics for cooperative fungal cellulase digestion of cellulose from quartz crystal microgravimetry[J].,2013,394(1):498-508.
[46] Nakagame S,Chandra R P,Kadla J F,et al. Enhancing the enzymatic hydrolysis of lignocellulosic biomass by increasing the carboxylic acid content of the associated lignin[J].,2011,108(3):538-548.
[47] Li M,Pu Y Q,Ragauskas A J. Current understanding of the correlation of lignin structure with biomass recalcitrance[J].,2016,4:1-8.
[48] Guo F F,Shi W J,Sun W,et al. Differences in the adsorption of enzymes onto lignins from diverse types of lignocellulosic biomass and the underlying mechanism[J].,2014,7(1):1-10.
[49] Rahikainen J L,Evans J D,Mikander S,et al. Cellulase-lignin interactions:The role of carbohydrate-binding module and pH in non-productive binding[J].,2013,53(5):315-321.
[50] Suchy M,Linder M B,Tammelin T,et al. Quantitative assessment of the enzymatic degradation of amorphous cellulose by using a quartz crystal microbalance with dissipation monitoring[J].,2011,27(14):8819-8828.
[51] Palonen H,Tjerneld F,Zacchi G,et al. Adsorption of Trichoderma reesei CBH I and EG II and their catalytic domains on steam pretreated softwood and isolated lignin[J].,2004,107(1):65-72.
(责任编辑:田 军)
QCM-D Analysis of Film Formation and Enzymatic Hydrolysis of Lignocellulose
Su Rongxin1, 2, 3, 4,Chen Mimi1, 2,Huang Renliang1, 2,Qi Wei1, 2, 3, 4,Wang Mengfan1, 2,He Zhimin1, 2
(1.School of Chemical Engineering and Technology,Tianjin University,Tianjin 300350,China;2.State Key Laboratory of Chemical Engineering,Tianjin University,Tianjin 300350,China;3.Collaborative Innovation Center of Chemical Science and Engineering(Tianjin),Tianjin 300350,China;4.Tianjin Key Laboratory of Membrane Science and Desalination Technology,Tianjin 300072,China)
Quartz crystal microbalance with dissipation(QCM-D)is an instrument used to measure the mass change of the electrode surface based on the piezoelectric effect of quartz crystal and has proved to be a highly sensitive online interface process analysis tool.This review summarizes the lignocellulose film preparation and the analysis progress of QCM-D in enzymatic hydrolysis in recent years.Four aspects,which include thin film preparation,cellulase adsorption onto cellulose,lignin,and lignocellulosic substrates,enzymatic hydrolysis analysis and dynamics modeling,are briefly introduced.The above research results help to understand the interaction characteristics between lignocellulose and cellulase,providing foundation and guidance for designing a new compounded enzyme system and a profound understanding of the mechanism of cellulose enzymatic hydrolysis.
lignocellulose;cellulase;QCM-D;film;adsorption;hydrolysis
10.11784/tdxbz201702030
Q64
A
0493-2137(2018)01-0001-08
2017-02-16;
2017-04-27.
苏荣欣(1980— ),男,博士,教授.
苏荣欣,surx@tju.edu.cn.
2017-05-27.
http://kns.cnki.net/kcms/detail/12.1127.N.20170527.0940.006.html.
国家自然科学基金资助项目(51473115,21276192).
the National Natural Science Foundation of China (No.,51473115 and No.,21276192).
