杏鲍菇提取物对小鼠巨噬细胞免疫活性的研究
2018-01-18樊铭聪李文香胡欣蕾孙亚男
樊铭聪 , 李文香 *, 胡欣蕾 , 孙亚男 , 于 戈
(1.青岛农业大学 食品科学与工程学院,山东 青岛 266109;2.山东省应用真菌重点实验室,山东 青岛 266109)
杏鲍菇(Pleurotus eryngii),俗称刺芹侧耳,隶属于真菌门,担子菌纲,伞菌目,侧耳科,侧耳属[1],是一种药食皆宜的珍稀真菌。因其质地脆嫩,肉质肥厚,口感极佳,滑脆爽口,兼具杏仁和鲍鱼的风味而深受广大消费者喜爱,故又有“平菇王”、“雪茸”的美誉[2]。
杏鲍菇不仅是营养价值高的美味食材,还是一种具有众多生物活性物质的保健食品,经常食用杏鲍菇可起到提高免疫力、防癌抗癌[3]、降血压、降血脂[4]、降血糖[5]、保肝、抗氧化[6]等多种功效。近年来,国内外专家学者在研究杏鲍菇生物活性及其活性物质方面已做了大量研究,除了发现具有广谱生物活性的β-葡聚糖[7]外,也发现了一些具有不同保健功能的生物活性物质。Wasser和Weis[8]从杏鲍菇中分离出一种名为Lovastatin的蛋白类降血脂药物。Wang和Ng[9-11]发现了2种小分子多肽Pleureryn和Eryngin,具有良好的抗菌、抗病毒功效;此外,该学者还分离出具有免疫调节、抗病毒功能的热稳定性核糖核酸酶。目前,国内外针对杏鲍菇的活性研究多集中在多糖和活性蛋白质领域,仅有少量研究涉及杏鲍菇有机溶剂萃取物活性。据文献研究报道,杏鲍菇不同极性提取物均具有良好的生物活性,其中,杏鲍菇醇提物能够起到提高小鼠抗炎和免疫机能[12],抗骨质疏松[13]的作用;杏鲍菇氯仿提取物则有良好的抗癌效果[14]。然而,对于系统比较杏鲍菇不同极性提取物活性的研究至今仍未见报道,因此,针对杏鲍菇不同极性提取物的生物活性研究,对探明杏鲍菇生物活性及其作用机理具有重要意义。
本研究利用不同极性溶剂对杏鲍菇中生物活性成分进行广泛萃取,以小鼠巨噬细胞Ana-1为受试细胞,对各提取物(PEs)的体外免疫活性进行研究,试图筛选出一种能够较好地促进免疫细胞增殖、诱导免疫细胞因子分泌、提高吞噬活性的活性成分,并对其最佳作用浓度和最佳作用时间进行了探讨,为杏鲍菇活性成分分析与杏鲍菇功能性食品或药物的开发提供理论依据。
1 材料与方法
1.1 材料、试剂和仪器
1.1.1 主要材料 杏鲍菇,购自青岛市城阳区大润发超市;小鼠巨噬细胞Ana-1,购自中科院上海细胞库。
1.1.2 主要试剂 脂多糖 (LPS),购于美国Sigma公司;胎牛血清(FBS),购于美国Gibco公司;RPMI-1640培养基、青链霉素混合液,购于美国Thermo scientific公司;四甲基噻唑蓝(MTT)、台盼蓝,购于美国Sigma公司;鼠源TNF-α、IL-6 Elisa试剂盒、鼠源TLR2、TLR4试剂盒,购于江苏碧云天生物技术研究所;石油醚、氯仿、乙酸乙酯、甲醇、二甲基亚砜、氯化钠、氯化钾、磷酸二氢钾、磷酸氢二钠,均为国产分析纯,购于国药集团化学试剂有限公司。
1.1.3 主要仪器 MCO-18AICCO2培养箱,购于日本Sanyo公司;CKX-41倒置显微镜,购于日本Olympus公司;Elx808自动酶标仪,购于美国Bio-Tek公司;超净工作台,购于苏州净化设备有限公司;冷冻干燥机,购于德国Christ公司。
1.2 试验方法
1.2.1 杏鲍菇提取物(PEs)制备 杏鲍菇子实体冷冻干燥粉末1.0 kg,用5 000 mL石油醚(30~60℃)50℃回流提取3次,每次12 h,减压浓缩,冷冻干燥得到石油醚浸膏(PEP)13.4 g(白色油脂状);残渣用5 000 mL氯仿,50℃回流提取3次,每次12 h,减压浓缩,冷冻干燥得到氯仿浸膏(PEC)15.5 g(浅黄色油脂状);残渣用5 000 mL乙酸乙酯,50℃回流提取3次,每次12 h,减压浓缩,冷冻干燥得到乙酸乙酯浸膏(PEE)5.8 g(金黄色油脂状);残渣用5 000 mL甲醇,50℃回流提取3次,每次12 h,减压浓缩,冷冻干燥得到甲醇浸膏(PEM)98.1 g(金黄色固体)。
1.2.2 细胞培养 将小鼠巨噬细胞Ana-1接种在RPMI-1640培养基中 (含体积分数10%胎牛血清、100 IU青霉素和l00 μg/mL链霉素),与37℃、体积分数5%CO2的恒温培养箱中孵育,待细胞浓度达到107/mL时,对细胞进行传代培养,保持细胞在指数增生期生长状态。
1.2.3 PE对细胞存活率的影响 参考谷鸿喜[15]的方法,并稍做修改,取对数生长期的Ana-1细胞,以105个/mL细胞浓度接种于96孔细胞培养板中,每孔 100 μL,置于 CO2恒温培养箱(37 ℃、5%),培养24 h后,实验组每孔添加含有PEs不同质量浓度的完全培养基100 μL,使每孔的终质量浓度分别为6.25、12.5、25、50、100、200 μg/mL,空白对照组每孔添加等体积的完全培养基,每组处理设置6个复孔。将培养板置于培养箱中孵育24 h后,每孔加入5 mg/mL MTT 溶液 20 μL,继续培养 4 h,培养结束。取出培养板弃掉上清液,每孔分别加入DMSO 150 μL,振荡 10 min,使沉淀溶解,在酶标仪 490 nm处检测各孔吸光度值,并计算细胞存活率,见公式(1):

其中,A1为试验组吸光度值,A0为对照组吸光度值。
1.2.4 PE对细胞因子分泌量的影响 以105个/mL细胞浓度接种于96孔培养板中,每孔100 μL,置于CO2恒温培养箱(37℃、5%),培养 24 h后,实验组每孔添加含有PEs不同质量浓度的完全培养基100 μL, 使每孔终质量浓度分别为 6.25、12.5、25、50、100 μg/mL,空白对照组每孔添加等体积的完全培养基,每组处理设置6个复孔。将培养板置于培养箱孵育24 h后,培养结束,分别收集各组细胞培养液,1 000 r/min离心10 min,按Elisa试剂盒上说明进行细胞因子TNF-α和IL-6含量的检测。
1.2.5 不同作用时间PEM对细胞因子分泌量的影响 以105个/mL细胞浓度接种于96孔培养板中,每孔 100 μL,置于 CO2恒温培养箱(37 ℃、5%),培养24 h后,实验组每孔添加含有PEM的完全培养基 100 μL,使其终质量浓度为 12.5 μg/mL,于 0、4、8、12、16、20、24 h 收集 6 个复孔细胞培养液,1 000 r/min离心10 min,分别吸取培养液上清液,按Elisa试剂盒上说明进行细胞因子TNF-α和IL-6含量检测的操作。
1.2.6 PEM对细胞吞噬活性的影响 参考张祺[16]的方法,并稍做修改,以105个/mL细胞浓度接种于96孔培养板中,每孔100 μL,置于CO2恒温培养箱(37℃、5%),培养24 h后,实验组每孔添加含有PEM不同质量浓度的完全培养基100 μL,使每孔终质量浓度分别为 6.25、12.5、25、50、100 μg/mL,空白对照组每孔添加等体积的完全培养基,每组处理设置6个复孔。将培养板置于培养箱孵育24 h后培养结束,弃去细胞上清液,每孔加入200 μL 0.1 g/L中性红溶液,置于CO2恒温培养箱(37℃、5%)培养1 h后,吸弃细胞上清液,每孔加200 μL预温的PBS清洗细胞,重复操作3次,加入200 μL 0.1mol/L乙酸-乙醇(体积比1∶1)溶解细胞,酶标仪490 nm处检测吸光值。
1.2.7 PEM对膜表面蛋白表达量的影响 细胞布板情况及培养条件同上,培养结束,分别收集各组细胞培养液,反复冻融,高速离心10 min,得到细胞裂解液,按Elisa试剂盒上说明进行膜表面蛋白TLR2、TLR4含量的检测。
1.2.8 数据分析 采用Origin 8.0绘图及线性回归分析,采用SPSS17.0统计软件,MTT法测量细胞存活率结果采用方差检验,以平均值±标准差(±s)表示,细胞因子数值分析采用重复测量数据的方差分析。当P<0.05为差异显著,P<0.01为差异极显著,具有统计学意义。
2 结果与分析
2.1 不同质量浓度PEs对Ana-1存活率的影响
PEs对小鼠巨噬细胞Ana-1存活率的影响各有不同,如表1所示,LPS为阳性对照。结果表明:PEM、PEE、PEC均表现出了较好的促进Ana-1细胞增殖的作用,而PEP则没有表现出明显的促进Ana-1细胞增殖的作用。其中,PEM对Ana-1细胞的刺激增殖作用最强,但不呈现浓度依赖性,在质量浓度为12.5 μg/mL时有最强的促进增殖作用,Ana-1 细胞的存活率达到(127.83±6.82)%,高浓度时刺激作用不明显。PEE和PEC也表现出了刺激Ana-1细胞增殖的作用,但较PEM组的刺激作用稍弱,这2种提取物均在质量浓度为25 μg/mL时表现出最强的促进增殖作用,Ana-1细胞的存活率分别为(114.93±4.29)%和(110.05±3.78)%,不呈现浓度依赖性,且高浓度时刺激作用均不明显。
表1 不同质量浓度PEs对Ana-1细胞存活率的影响(以±s表示)Table 1 Effect of various concertrations of Pleurotus eryngii extracts on Ana-1 cell survival rate(±s)
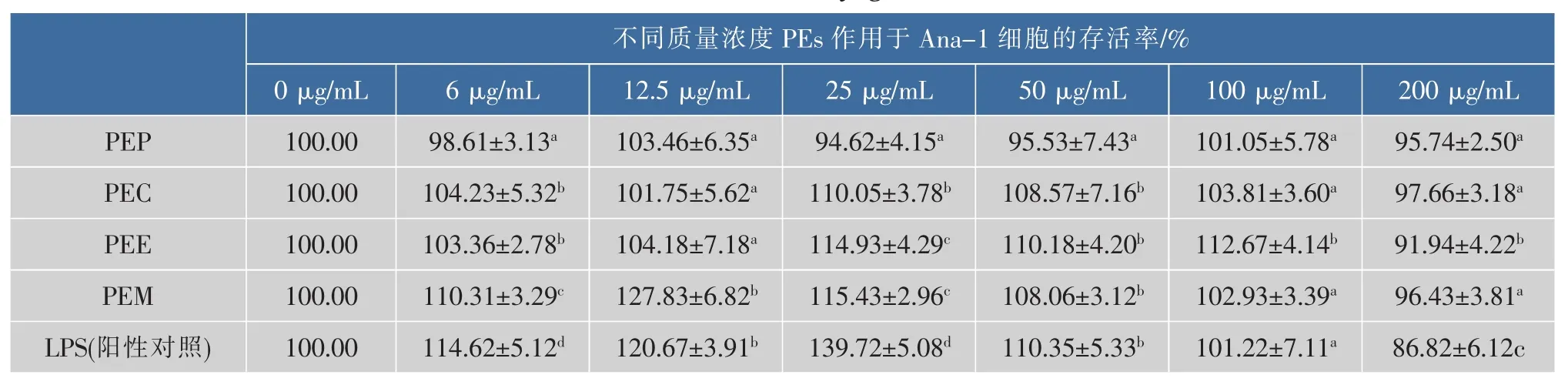
表1 不同质量浓度PEs对Ana-1细胞存活率的影响(以±s表示)Table 1 Effect of various concertrations of Pleurotus eryngii extracts on Ana-1 cell survival rate(±s)
注:每列中相同字母代表无显著性差异,不同字母代表有显著性差异,P<0.05。
不同质量浓度P E s作用于A n a-1细胞的存活率/%6 μ g/m L 0 μ g/m L 1 2.5 μ g/m L 5 0 μ g/m L 1 0 0 μ g/m L P E P 2 5 μ g/m L 1 0 0.0 0 9 8.6 1±3.1 3 a 1 0 3.4 6±6.3 5 a 9 4.6 2±4.1 5 a 9 5.5 3±7.4 3 a 1 0 4.2 3±5.3 2 b 1 0 0.0 0 1 0 8.5 7±7.1 6 b 1 1 0.0 5±3.7 8 b 1 0 1.7 5±5.6 2 a 1 0 3.8 1±3.6 0 a 9 7.6 6±3.1 8 a P E E 1 0 0.0 0 1 1 4.9 3±4.2 9 c 1 0 3.3 6±2.7 8 b 1 0 4.1 8±7.1 8 a P E C 1 1 0.1 8±4.2 0 b 1 1 2.6 7±4.1 4 b 9 1.9 4±4.2 2 b 1 1 0.3 1±3.2 9 c 1 2 7.8 3±6.8 2 b 1 0 0.0 0 1 1 5.4 3±2.9 6 c 1 0 2.9 3±3.3 9 a 1 0 8.0 6±3.1 2 b 9 6.4 3±3.8 1 a L P S(阳性对照)1 0 1.0 5±5.7 8 a 1 1 4.6 2±5.1 2 d P E M 1 0 0.0 0 2 0 0 μ g/m L 1 2 0.6 7±3.9 1 b 1 3 9.7 2±5.0 8 d 1 1 0.3 5±5.3 3 b 1 0 1.2 2±7.1 1 a 9 5.7 4±2.5 0 a 8 6.8 2±6.1 2 c
2.2 不同质量浓度PEs对Ana-1分泌细胞因子TNF-α的影响
不同质量浓度PEs作用于Ana-1细胞后,细胞因子TNF-α分泌的变化情况如图1,LPS为阳性对照。由图中可知,Ana-1细胞接受4种提取物作用后,细胞因子TNF-α分泌的变化均呈现出先上升后下降的趋势,没有浓度依赖性,PEM组的TNF-α分泌量上升趋势最大,其次为PEE、PEC、PEP的变化趋势比较平缓。其中,当PEM质量浓度为12.5 μg/mL时,Ana-1出现了TNF-α的分泌高峰,细胞上清液中的TNF-α质量浓度达到64.16 ng/mL,而在PEE、PEC质量浓度分别为25 μg/mL时,细胞上清液中的TNF-α质量浓度分别为61.20 ng/L和60.31 ng/L,均低于PEM组。

图1 不同质量浓度PEs对TNF-α分泌的影响Fig.1 Effect of various concentrations of Pleurotus eryngii extracts on TNF-α secretion
2.3 不同质量浓度PEs对Ana-1分泌细胞因子IL-6的影响
不同质量浓度PEs作用于Ana-1细胞后,细胞因子IL-6分泌的变化情况如图2,LPS为阳性对照。由图中可知,Ana-1细胞接受4种提取物作用后,细胞因子IL-6分泌的变化均呈现出先上升后下降的趋势,PEM组的IL-6分泌量上升趋势最大,其次为PEC,而PEE、PEP的变化趋势比较平缓。其中,当 PEM、PEC 质量浓度为 12.5 μg/mL时,Ana-1出现了IL-6的分泌高峰,细胞上清液中的IL-6质量浓度分别达到了23.72 ng/L和20.70 ng/L,而在PEE、PEP质量浓度分别为25 μg/mL时,细胞上清液中的IL-6质量浓度分别为19.82 ng/L和19.61 ng/L,均低于PEM组。

图2 不同质量浓度PEs对IL-6分泌的影响Fig.2 Effect of various concentrations of Pleurotus eryngii extracts on IL-6 secretion
2.4 PEM组Ana-1细胞活性与细胞因子分泌量的相关性分析
由表1、图3及图4可以看出,PEM作用于Ana-1细胞后表现出了最高的增殖活性及其细胞因子的分泌高峰,经SPSS软件分析,TNF-α分泌量和IL-6分泌量与PEM作用的细胞存活率成显著正相关(相关系数 r分别为 0.926和 0.986)(见表 2),这说明PEM的刺激作用与Ana-1细胞活性、细胞因子的分泌存在着密切联系,适量质量浓度的PEM能有效促进Ana-1细胞的增殖及细胞因子的释放。

表2 PEM组细胞存活率与TNF-α、IL-6分泌量相关性Table 2 Correlations between the cell survival rate,TNF-α and IL-6 secretion by stimulating with Pleurotus eryngii mathanol extracts
2.5 不同作用时间PEM对细胞因子分泌的影响
PEM (质量浓度为 12.5 μg/mL,在此条件下Ana-1细胞表现出最高的增殖活性)作用于细胞后2种细胞因子的分泌随时间变化情况如图3所示。由图 3(a)可知,Ana-1细胞在加入 PEM 后 TNF-α分泌量显著升高,呈现先升高后下降的趋势,在作用12 h时出现TNF-α分泌高峰,达到67.03 ng/L。随着时间的延长,TNF-α分泌量稍有下降,但均显著高于细胞未接受PEM作用时TNF-α的分泌量。Ana-1细胞在加入PEM后IL-6分泌量变化情况如图3(b),其分泌量也显著升高,但升高趋势与TNF-α的变化不同,IL-6分泌量的变化是呈现逐渐上升的趋势。在作用24 h时出现分泌高峰,细胞上清液中IL-6质量浓度达到23.70 ng/L。

图3 不同作用时间PEM对细胞因子TNF-α和IL-6分泌的影响Fig.3 Effect of Pleurotus eryngii methanol extracts on TNF-α and IL-6 secretion by stimulating with different treament time
2.6 不同质量浓度PEM对细胞吞噬活性的影响
不同质量浓度PEM作用于Ana-1细胞,通过中性红吞噬实验检测细胞的吞噬能力变化,如图4。结果显示:PEM作用于Ana-1细胞后吞噬活性的变化均呈现出先上升后下降的趋势,质量浓度为12.5~100 μg/mL PEM的4个处理组吞噬中性红能力相比空白组均明显升高,其中,PEM质量浓度为25 μg/mL时细胞表现出最高的吞噬活性。

图4 不同质量浓度PEs对细胞吞噬活性的影响Fig.4 Effect of various concentrations of Pleurotus eryngii extracts on macrophage cell phagocytosis activity
2.7 不同质量浓度PEM对细胞膜蛋白表达的影响
不同质量浓度PEM作用于Ana-1细胞后,细胞膜蛋白Toll样受体TLR2和TLR4表达量的变化情况如图5。由图5(a)可知,Ana-1细胞在加入PEM后TLR2的表达量显著升高,呈现先升高后下降的趋势,PEM质量浓度为25 μg/mL时TLR2表达量最高,达到4.36 ng/mL。随着质量浓度的升高,TLR2表达量稍有下降,但均显著高于空白组TLR2的表达量。Ana-1细胞在加入PEM后TLR4表达量变化情况如图5(b),其表达量也显著升高,但升高趋势与TLR2的变化不同,PEM质量浓度在25~100 μg/mL范围内,TLR4表达量显著高于空白组,质量浓度为50 μg/mL时表达量最高,达到5.78 ng/mL。

图5PEM对TLR2和TLR4表达的影响Fig.5 Effect of Pleurotus eryngii methanol extracts on TLR2 and TLR4 expression
3 讨 论
已有研究表明,杏鲍菇水溶性多糖能够通过诱导免疫细胞增殖、提高机体免疫应答能力来达到抗癌效果[17],而对于杏鲍菇脂溶性成分的免疫活性研究则相对较少。众所周知,巨噬细胞在机体固有免疫与适应性免疫中发挥着复杂的功能,尤其在对抗感染和损伤的宿主防御中起到重要作用[18]。增殖是免疫细胞分化成多种功能形态、并在免疫应答中发挥相应作用的前提和基础,巨噬细胞的增殖对于其各种免疫应答功能的实现是必需的[19]。本研究中以杏鲍菇为原料,利用不同极性溶剂对其中的活性成分进行萃取,并将各提取物作用于小鼠巨噬细胞Ana-1,在比较各提取物对Ana-1细胞存活率的影响后发现:4种提取物对该细胞不仅没有细胞毒性,还有不同程度的促进增殖的作用,其中,PEM促进增殖的效果最为显著,在其质量浓度为12.5 μg/mL时有最强的促进增殖作用,Ana-1细胞的存活率达到(127.83±6.82)%。
巨噬细胞来源于骨髓干细胞,是单核吞噬细胞系统中高度分化、成熟的细胞类型,由血液中单核细胞迁入组织后分化而成[20]。它在执行免疫应答或免疫监视功能的过程中,主要有2个方面的作用:1是通过吞噬作用或者细胞毒性作用,2是抗原递呈作用[21]。巨噬细胞可以分泌的各种免疫活性分子,如TNF-α、IL-6、IL-10等,均具有肿瘤细胞和病原菌的直接毒性[22]。巨噬细胞除免疫作用外,还有吞噬作用。巨噬细胞将各类病原微生物、机体衰老死亡的细胞和肿瘤细胞等大颗粒抗原摄入胞内,形成吞噬溶酶体,在多种酶的作用下,杀灭和消化抗原性异物[23]。 本研究中,Ana-1 细胞在 PEM 12.5 μg/mL 质量浓度的刺激作用下,TNF-α和IL-6 2种细胞因子均出现了分泌高峰;此外,在中性红吞噬活性试验结果显示,12.5 μg/mL PEM能明显增强Ana-1的吞噬活性。因此,适量PEM能起到激活巨噬细胞,提高其免疫活性的作用。
在巨噬细胞分泌的诸多细胞因子中,TNF-α备受关注,越来越多的研究表明,其体内水平的高低与疾病严重程度直接相关[24]。在免疫应答和炎症反应中,TNF-α作为早期促炎因子,具有激活中性粒细胞、淋巴细胞的作用,可以刺激诱导其他细胞因子的释放[25]。IL-6是多功能炎性细胞因子,具有致炎和抗炎的双向功能,不仅可以活化B细胞,促使其分泌抗体,也可以抑制巨噬细胞产生IL-1和TNF-α而起到细胞保护和抗炎作用[26]。本研究中,在PEM 12.5 μg/mL的质量浓度刺激作用下,通过检测不同时间对TNF-α和IL-6分泌量影响的结果显示:TNF-α分泌量先升高后下降,在刺激12 h后出现分泌高峰,而IL-6分泌量缓慢上升,在刺激24 h后出现分泌高峰,出现这种现象的原因可能是由于TNF-α诱导IL-6分泌,而IL-6抑制TNF-α过量分泌,从而达到细胞因子之间诱导和拮抗作用的平衡状态。
Toll样受体(Toll-1ike receptors,TLRs)是巨噬细胞、树突状细胞等抗原呈递细胞表面识别多种病原体及内源性物质的跨膜蛋白[27],TLRs可以通过各自不同的配基识别相应的病原相关分子模式(PAMPs),激活一系列的信号通路启动宿主抵抗病原微生物的天然免疫,并对特异性免疫应答进行调控[28]。巨噬细胞在接受外界刺激后,通过TLRs产生激活信号,激活转录因子NF-κB,进而激活一系列免疫反应,如增强吞噬活性、分泌细胞因子等[29]。本研究通过观察PEM作用于巨噬细胞后对TLR2、TLR4 2种膜蛋白表达量的影响,结果显示:PEM能够显著上调TLR2、TLR4的表达量,这说明巨噬细胞免疫应答中的NF-κB通路能够被PEM激活,而在本研究中的观察到的Ana-1细胞的增殖、细胞因子分泌量升高、吞噬活性增加等现象可能与NF-κB通路的激活有关。曾有文献报道,杏鲍菇醇提取物在小鼠肥大细胞的免疫反应和炎症反应中有重要作用,并推测其活性物质为麦角甾醇或其过氧化物[29],本研究中表现出免疫活性的成分可能和其相近,但仍需做进一步详细研究。此外,本研究在探讨PEM免疫调节的可能机制时,仅对其细胞表面介导受体蛋白的表达量进行检测,进一步的调节机制尚需对其相关信号通路控制基因的影响进行探讨。
4 结 语
本文作者利用PEs对小鼠巨噬细胞Ana-1进行了免疫活性研究,结果显示:PEs对小鼠巨噬细胞Ana-1有不同程度上的免疫刺激作用,PEM表现出了最强的促进细胞增殖促进细胞因子分泌的活性,在PEM质量浓度为12.5 μg/mL的条件下,能够促进Ana-1细胞增殖作用最强,细胞因子TNF-α和IL-6均出现分泌高峰;但PEM对细胞因子分泌的作用时间不同,PEM作用于Ana-1细胞后,在12 h时出现TNF-α分泌高峰,而IL-6在24 h时出现分泌高峰。此外,PEM可以激活Ana-1,提高细胞吞噬活性,促进细胞表面膜蛋白受体TLR2、TLR4的表达。本研究结果表明了PEM能够通过促进巨噬细胞增殖、诱导细胞因子分泌和提高吞噬活性的方式实现免疫增强功能,对杏鲍菇功能性食品或相关药物的开发提供理论依据。
[1]CHEN Junchen,YANG Yilong,WENG Minjie,et al.Optimization of combined hot-air and vacuum drying technology for instant Pleurotus eeryngii[J].Transactions of the Chinese Society of Agricultural Engineering,2014,30(14):331-338.(in Chinese)
[2]TIAN Pingping,WANG Jie,QIN Xiaoyi,et al.Effect of postharvest treatment on the storage quality and antioxidant enzyme system of Pleurotus eryngii[J].Scientia Agricultura Sinica,2015,48(5):941-951.(in Chinese)
[3]KUNIYOSHI S,MAIKO Y,MAYUMI G,et al.Estrogen-like activity and prevention effect of bone loss in calcium deficient ovariectomized rats by the extract of Pleurotus eryngii[J].Phytotherapy Research,2006,20(8):659-664.
[4]ASADUZZAMAN K,MOUSUMI T.Nutritional and medicinal importance of pleurotus mushrooms:An overview[J].Food Reviews International,2012,28(3):313-329.
[5]MORI K,KOBAYASHI C,TOMITA T,et al.Antiatherosclerotic effect of the edible mushrooms Pleurotus eryngii(Eringi),Grifola frondosa (Maitake),and Hypsizygus marmoreus (Bunashimeji) in apolipoprotein E-deficient mice[J].Nutrtional Research,2008,28(5):335-342.
[6]KIM J I,KANG M J,IM J,et al.Effect of king oyster mushroom (Pleurotus eryngii) on insulin resistance and dyslipidemia in db/db mice[J].Food Science Biotechnology,2010,19(1):239-242.
[7]MAJTAN J.Pleuran:an effective nutritional supplement against upper respiratory tract infections[J].Nutritional Interventions and Athlete's Health,2013,59:57-61.
[8]WASSER S P,WEIS A L.Medicinal properties of substances occurring in higher Basidiomycetes mushrooms:current perspectives(review)[J].International Journal of Medicinal Mushrooms,1999,1(1):31-62.
[9]WANG H,NG T B.Pleureryn,a novel protease from fresh fruiting bodies of the edible mushroom Pleurotus eryngii[J].Biochemical And Biophysical Research Communications,2001,28(9):750-755.
[10]WANG H,NG T B.Eryngin,a novel antifungal peptide from fruiting bodies of the edible mushroom Pleurotus eryngii[J].Peptides,2004,25(1):1-5.
[11]WANG H,NG T B.Purification of a laccase from fruiting bodies of the mushroom Pleurotus eryngii[J].Applied Microbiology and Biotechnology,2006,69(5):521-525.
[12]MITSUAKI S,KYOJI Y,TSUNETOMO M,et al.Inhibitory effects of edible higher basidiomycetes mushroom extracts on mouse type IV allergy[J].International Journal of Medicinal Mushrooms,2002,4(1):5-11.
[13]KIM S W,KIM H G,LEE B E,et al.Effects of mushroom Pleurotus eryngii extracts on bone metabolism[J].Clinical Nutrition,2006,25(1):166-170.
[14]BAE J S,PARK J W,PARK S H,et al.Apoptotic cell death of human leukaemia U937 cells by ubiquinone-9 purified from Pleurotus eryngii[J].Natural Product Research,2009,23(12):1112-1119.
[15]谷鸿喜,张凤民,凌虹.细胞培养技术[M].北京:北京大学医学出版社,2012:139-140.
[16]ZHANG Qi,LI Xuemin,LI Zhaojie.Immunomodulatory effects of sea cucumber fucoidan on macrophage and the signaling pathways[J].Chinese Pharmacological Bulletin,2015,31(1):87-92.(in Chinese)
[17]YANG Z,XU J,FU Q,et al.Antitumor activity of a polysaccharide from Pleurotus eryngii on mice bearing renal cancer[J].Carbohydrate Polymers,2013,95(2):615-620.
[18]LIU Jing,ZHANG Wei,YANG Feng.Effects of sophoridine pretreating on the expression of c-jun in macrophage RAW264.7 induced by LPS[J].Journal of Ningxia Medical University,2010,32(2):161-165.(in Chinese)
[19]JIA Wei,FAN Hua.Effect of active polysaccharide fraction from agaricus blazei murill on mouse macrophages[J].Food Science,2011,32(11):277-280.(in Chinese)
[20]ZHAO L,DONG Y,CHEN Q et al.Extraction,purification,characterization and antitumor activity of polysaccharides from Ganoderma lucidum[J].Carbohydrate Polymers,2010,80(3):783-789.
[21]REN Yan,ZENG Yanling,LI Pan,et al.Experimental study of Tripterygium wilfordii Hook.f.for inhibiting TNF-α secretion in peritoneal macrophage of endometriosis patients and relevant cell model[J].Modern Journal of Integrated Traditional Chinese and Western Medicine,2012,21(7):702-705.(in Chinese)
[22]WANG Song,WANG Wei,LUO Meng,et al.Regulating effect of compound glycyrrhizin on LPS-induced inflammatory factor release from murine RAW 264.7 cells[J].Progress in Pharmaceutical Sciences,2012,36(10):465-470.(in Chinese)
[23]HUO Desheng,LIU Zhonghui,WANG Shiyao.Activin a enhances phagocytosis of murine macrophage cell line RAW264.7[J].Chinese Journal of Biologicals,2008,21(9):759-763.(in Chinese)
[24]ZHANG M,CUI S W,CHEUNG P C K,et al.Antitumor polysaccharides from mushrooms:a review on their isolation process,structural characteristics and antitumor activity[J].Trends in Food Science and Technology,2007,18(1):4-19.
[25]YUEN J W M,GOHEL M D I.Anticancer effects of Ganoderma lucidum:a review of scientific evidence[J].Nutrition and Cancer,2005,53(1):11-17.
[26]LIN Liyan,ZHANG Huiyun,HE Shaohen.Advance in the research of correlation of IL-6 and its receptors with inflammation disease[J].China Tropical Medicine,2008,8(4):680-682.(in Chinese)
[27]ZENG Xing,LIAN Hui,OU Run-Mei,et al.Effect of injectionwith PPS and BCG on expression of TLRs in mouse peritioneal macropllages[J].Chinese Journal of Immunology,2008,24(9):341-346.(in Chinese)
[28]NOVAK M,VETVICKA V.Beta-glucans,history,and the present:immunomodulatory aspects and mechanisms of action[J].Journal of Immunotoxicology,2008,5(1):47-57.
[29]HAN E H,HWANG Y P,KIM H G.Inhibitory effect of Pleurotus eryngii extracts on the activities of allergic mediators in antigen-stimulated mast cells[J].Food and Chemical Toxicology,2011,49(6):1416-1425.
