松茸口服液的功能特性
2018-01-18佟立君么宏伟付婷婷谢晨阳吴洪军赵凤臣韩书昌张学义
佟立君, 么宏伟, 付婷婷*, 谢晨阳, 吴洪军,赵凤臣, 韩书昌, 张学义, 冯 磊
(1.黑龙江省林业科学院,黑龙江 哈尔滨 150081;2.黑龙江省林副特产研究所 黑龙江省非木质林产品研发重点实验室,黑龙江 牡丹江157011)
松茸[Tricholoma matsutake(S.Ito et Imai) Sing],俗称松口蘑,是一种在温带和寒温带的松林与栎林共同生长的共生菌[1]。健康的野生松茸子实体对生长环境要求苛刻,需要依赖柏树、橡树等阔叶林为其生长发育提供营养支持[2-3]。松茸含有多种氨基酸、维生素和脂肪及丰富的膳食纤维和活性酶,另含有双链松茸多糖、松茸多肽和松茸醇[4-5]。松茸有提高免疫力、抗氧化、抗衰老养颜、抗癌抗肿瘤、心血管疾病及治疗糖尿病和促肠胃保肝脏等多种功效[6-8]。本课题以新鲜松茸为原料,利用超声波辅助水提、弱碱盐溶液提取和醇溶液提取3步提取法提取松茸中的营养物质,并制备成了松茸浓缩口服液。对其免疫调节能力、抗氧化能力和抗疲劳能力进行了功能性验证。为日后松茸浓缩口服液的推广或进一步研究奠定了理论数据基础。
1 材料与方法
1.1 试验材料
松茸浓缩口服液为实验室自制,其制作过程先是利用超声波辅助水提(提取条件:超声功率125 W,超声时间10 s,工作时间4 s,间隔时间1 s,得到含有水溶性多糖、维生素C、黄酮的提取物)、弱碱盐溶液提取(提取条件:碳酸氢钠质量分数0.3%,氯化钠质量分数0.5%,提取时间120 min,提取温度80℃,得到碱溶性蛋白质)和醇溶液提取(提取条件:乙醇体积分数80%,提取时间30 min,提取温度70℃,得到含有多酚、三萜的提取物)。3步提取松茸中的营养物质,提取后滤液按1∶1混合然后过100目筛子过滤。在50℃、60 r/min对上述混合溶液进行蒸馏浓缩,蒸馏浓缩至原混合溶液体积的1/10,混合浓缩得到的产品为无浑浊和沉淀的液体,味甘,相对密度为(1.10±0.05) g/mL,pH 值为(7.50±0.05),每支装量为10 mL,棕色瓶包装,卫生学检测符合标准,具体营养成分见表1和表2。
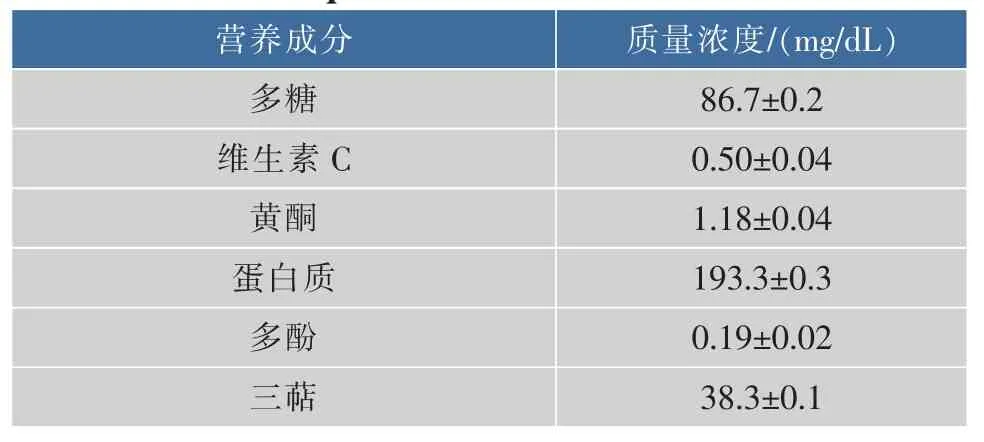
表1 松茸口服液各成分质量浓度Table 1 Allingredientscontent of Tricholoma matsutakeoral liquid

表2 松茸口服液氨基酸质量浓度Table 2 Amino acid content of Tricholoma matsutake oral liquid
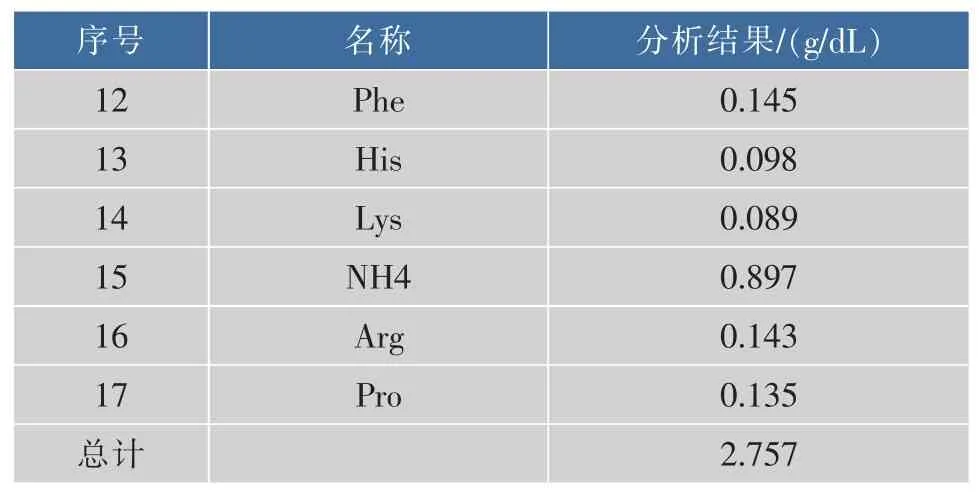
续表2
1.2 试验试剂
血清IgG试剂盒、印度墨汁、丙二醛试剂盒、超氧化物歧化酶试剂盒、血乳酸试剂盒、血清尿素试剂盒,均购于南京建成公司。
1.3 试验动物
昆明小鼠(Mus musculus) 雌性,SPF 级,6~8 周龄,体质量(18±2)g,购于中国农业科学院哈尔滨兽医研究所SPF级动物中心,小鼠饲养于清洁级动物房。小鼠饲养于标准条件下(湿度(50%±10%);12 h白昼/12 h黑夜交替),饲喂经过灭菌的鼠粮及蒸馏水。
1.4 试验仪器与设备
主要试验仪器与设备见表3。
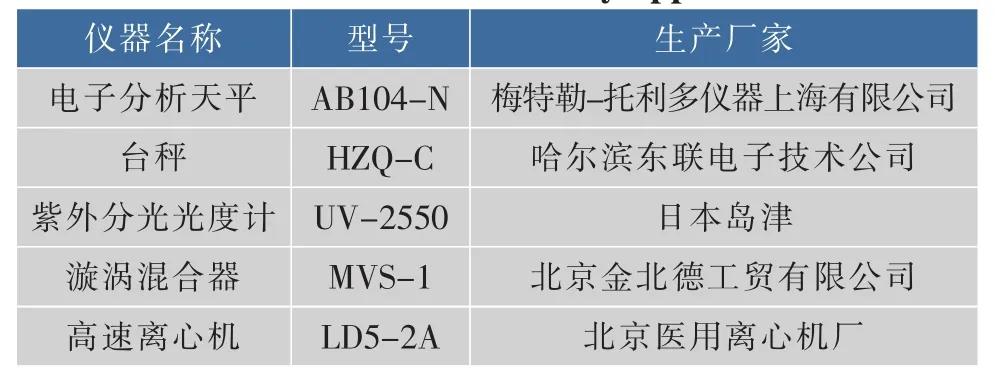
表3 主要试验仪器Table 3 Main laboratory apparatus
1.5 试验方法
1.5.1 试验小鼠分组及处理
48只小鼠经 3天适应性饲养后,平均分为4组,每组12只。每天早晚各添饲料一次,所有小鼠可以自由接触到饲料和水。每次试验开始、结束时都需称体重。2组小鼠灌胃无菌生理盐水,另外2组灌胃松茸浓缩口服液,每只小鼠每天灌胃一次,每次 0.02 mL/g,连续 21 d。
1.5.2 免疫调节能力指标的测定
1)胸腺指数、脾指数测定 分别于试验的第7、14 d和21 d摘眼球放血脱颈椎法处死小鼠,剥掉胸腺(脾),并将其周围组织剥离干净,称重[9]。

式(1)中:I为胸腺(脾)指数;m1为胸腺(脾)重量,mg;m0为体质量,g。
2)血清IgG质量浓度 分别于试验的第7、14和21 d摘眼球放血脱颈椎法处死小鼠,按照IgG试剂盒说明书操作。
3)巨噬细胞吞噬功能
①将印度墨汁按1∶3比例稀释,于试验的第7、14 d和21 d按小白鼠每10 g体质量需0.1 mL稀释墨汁计算,经鼠尾静脉注入体内,待注射完毕立即计时。
②注入稀释墨汁后2、10 min时,分别从眼眶后静脉丛取血20 μL,于2 mL Ca2CO3溶液中摇匀,用紫外分光光度计在600 nm波长下测OD值,以Ca2CO3溶液为空白对照。
根据公式计算碳颗粒廓清指数(CICP)和校正廓清指数(ACICP)。

式(2)中 OD1,OD2分别为,时取血样测得的吸光度值;t1,t2分别为 2 min 和 10 min。
1.5.3 抗氧化活性指标的测定
1)丙二醛浓度测定 分别于试验的第7、14 d和21 d摘眼球放血脱颈椎法处死小鼠,按照MDA试剂盒说明书操作。
按以下公式(4)计算血清MDA浓度(nmol/mL):

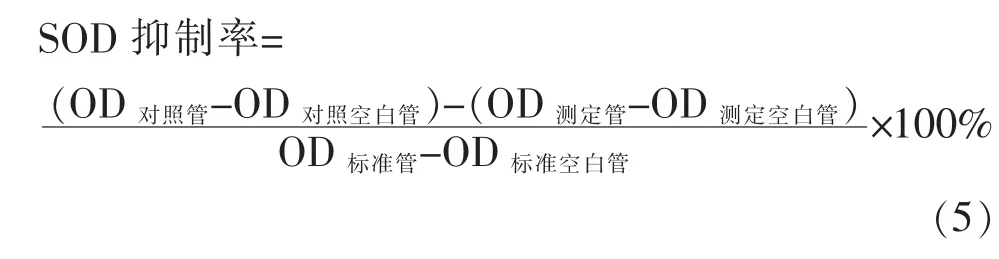
2)超氧化物歧化酶活性测定 分别于试验的第7、14 d和21 d摘眼球放血处死小鼠,按照SOD试剂盒说明书操作。
①按公式(5)计算SOD的抑制率:
②按公式(6)计算SOD的活力:
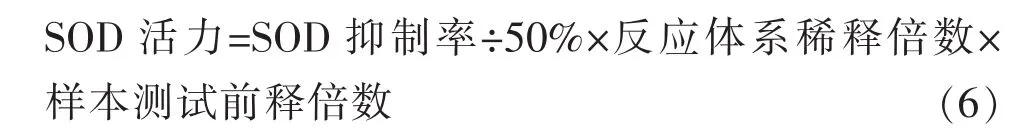
1.5.4 抗疲劳功能指标的测定
1)力竭游泳时间测定 每天灌胃1次,分别连续灌胃7、14 d和21 d。末次灌胃30 min后,在鼠尾根部系上质量分数5%体质量铅丝置于游泳箱中游泳。水深高于30 cm,水温(25±1.0)℃。参照力竭判断标准(即小鼠头部沉入水中,经10 s还不能返回水面视为力竭),记录自游泳开始至力竭的时间,作为游泳时间。数据以均数和标准差(x±SD)表示。
2)血乳酸浓度测定 分别于灌胃后第7、14 d和21 d,将试验组与对照组小鼠尾部负质量分数5%体质量的铅丝放入30℃的游泳箱中游泳 10 min;游泳后即刻取小鼠内眦静脉血20 μL,按照血乳酸含量试剂盒说明书操作。
3)血清尿素氮浓度测定 分别于灌胃后第7、14 d和21 d,将试验组与对照组小鼠同时放入 30℃的游泳箱中游泳60 min,即刻取小鼠眼静脉丛血,离心,取血清,按照血清尿素氮含量试剂盒说明书操作。
计算公式如式(7):

4)统计学方法 实验所得数据以(x±SD)表示,应用T-Test检验处理,P<0.05表示显著差异,P<0.01表示差异极其显著。
2 结果与分析
2.1 松茸浓缩口服液对小鼠免疫调节力的影响
2.1.1 对胸腺指数的影响 胸腺内的巴细胞对 T淋巴细胞的成熟和细胞介导的免疫的发展有重大参与作用。通过试验可以初步认为松茸浓缩口服液能够促进小鼠胸腺的发育,结果如表4。

表4 松茸浓缩口服液对小鼠胸腺指数影响Table 4 Matsutake concentrated oral liquid on thymus index
从表4中可以看出,随着时间的增加,各组胸腺指数呈上升趋势,其中试验组胸腺指数均高于对照组。在灌胃松茸浓缩口服液7、14 d后,试验组胸腺指数高于对照组,分别提高了12%和16%,但是差异不显著。21 d后,试验组的胸腺指数明显高于对照组,提高了 26%,且差异显著(P<0.05)。
2.1.2 对脾脏指数的影响 单核吞噬细胞系统主要由脾脏内吞噬细胞组成。脾脏主要的免疫学功能是通过截流血液里的微生物并与之产生免疫应答来过滤血液。试验发现松茸浓缩口服液可以促进小鼠脾脏的发育。结果如表5。
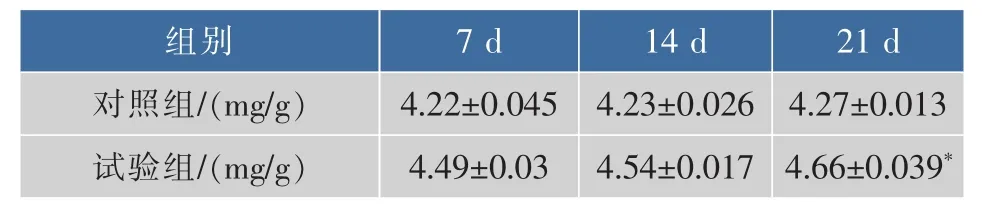
表5 松茸浓缩口服液对小鼠脾脏指数影响Table 5 Matsutake concentrated oral liquid on the spleen index
从表5中可以看出小鼠脾脏指数逐渐增加,且试验组均高于对照组,7、14 d和21 d脾脏指数分别提高了6.4%、7.3%和9.1%,21 d时试验组与对照组相比差异显著(P<0.05)。说明小鼠受到松茸浓缩口服液的作用后,促进了脾脏的发育。
2.1.3 对血清IgG质量浓度的影响 血清中 IgG是体液免疫活性细胞产生的体液免疫分子,其含量是体液免疫系统功能状态的重要指标。试验表明灌胃松茸浓缩口服液的小鼠血清IgG质量浓度较对照组有增加的趋势,说明松茸浓缩口服液有增加血清中 IgG质量浓度的作用,如表6。
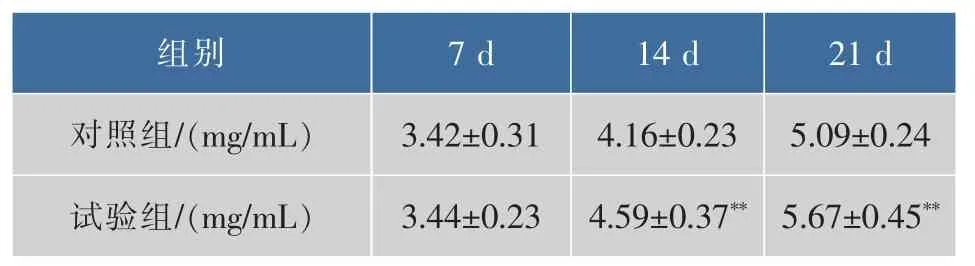
表6 松茸浓缩口服液对小鼠血清IgG质量浓度影响Table 6 Matsutake oral concentrate on serum IgG levels in mice
从表6中不难看出,灌胃口服液7 d后,试验组IgG质量浓度与对照组变化不大,没有显著差异,而灌胃14 d及21 d后,小鼠血清IgG质量浓度分别提高了10%和11%,差异极其显著(P<0.01)。
2.1.4 对巨噬细胞吞噬功能的影响 巨噬细胞可迅速吞噬由静脉注入的特定大小的惰性碳粒,而从血流中廓清。因此可通过测定血清中碳粒的消失速度来反映巨噬细胞吞噬的能力。经过试验后发现,松茸浓缩口服液有提高巨噬细胞的吞噬功能的效果,如表7。
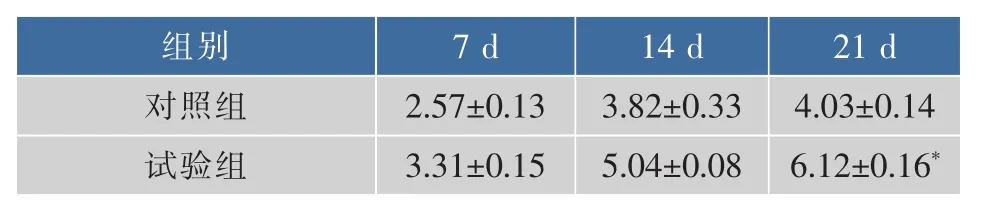
表7 松茸浓缩口服液对小鼠巨噬细胞吞噬指数影响Table 7 Tricholoma matsutake concentrated liquid impact on macrophage phagocytosis of mice
从表7中可以发现,在灌胃松茸浓缩口服液7 d及14 d后,试验组与对照组相比较,吞噬能力分别提高了28%、32%,但没有显著差异。灌胃21 d后,试验组远高于对照组,提高了51%,差异性显著(P<0.05)。
2.2 松茸浓缩口服液对小鼠抗氧化活性的影响
2.2.1 对丙二醛浓度的影响 MDA是一种动物体内多不饱和脂质氧化的终产物,其浓度可以反映体内不饱和脂质的过氧化程度,间接地反映细胞膜的损伤程度。松茸浓缩口服液对小鼠体内MDA浓度的影响见表8。
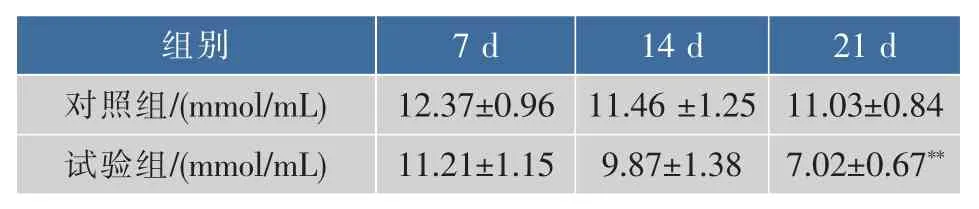
表8 松茸浓缩口服液对小鼠MDA浓度影响Table 8 Tricholoma matsutake concentrated liquid impacton MDA content in mice
由表8可知,试验组MDA浓度均低于空白组,在第7 d和14 d时,MDA浓度分别下降了10%和16%,在灌胃21 d后对照组与试验组相比,降低了57%,差异性极其显著(P<0.01)。说明松茸浓缩口服液可以降低小鼠血清MDA浓度,从而减轻小鼠体内膜脂质氧化。
2.2.2 对超氧化物歧化酶活力的影响 生物体内的SOD是一种重要的自由基清除剂,其具有维持活性氧代谢平衡,保护膜结构的功能。SOD能够清除体内的超氧阴离子自由基。故其活力可反映机体清除自由基能力。本试验测定了血清中SOD活力,结果见表9。
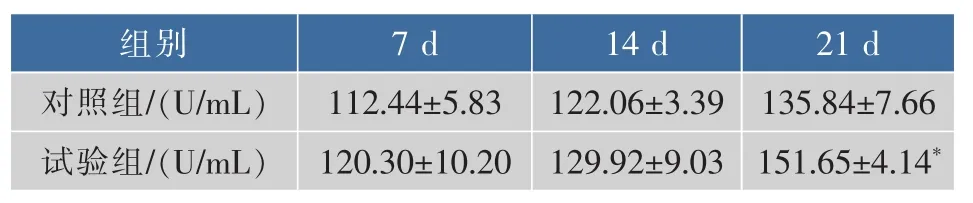
表9 松茸浓缩口服液对小鼠SOD活力影响Table 9 Tricholoma matsutake concentrated liquid impact on SOD content in mice
从表9中可以看出,试验组中小鼠血清的SOD活力均高于空白组,但是在灌胃7 d及14 d时并无显著性差异,分别提高了7%和6%。在灌胃21 d后,试验组小鼠血清内的SOD活力则明显高于对照组,提高了11%,差异显著(P<0.05)。说明试验组的松茸浓缩口服液可以清除小鼠体内过量的O2-,提高小鼠血清的抗氧化能力。
2.3 松茸浓缩口服液对小鼠抗疲劳功能的影响
2.3.1 对小鼠力竭游泳时间的影响 力竭时间是反映运动能力的常用指标,力竭时间的增长是机体抗疲劳能力提升最有力的宏观体现。长时间的剧烈运动,机体会相对缺氧从而导致糖酵解作用加快,进而产生大量的乳酸,乳酸积累过多会影响体内环境的相对稳定和体内的正常代谢过程。
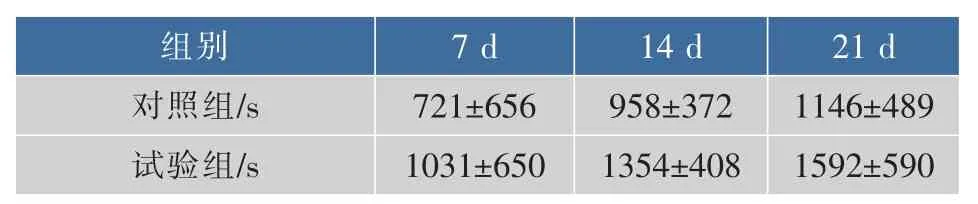
表10 松茸浓缩口服液对小鼠负重游泳时间影响Table 10 Matsutake concentrated liquid impact on weightloading swimming time in mice
由表10可见,灌胃松茸浓缩口服液7、14 d和21 d后,试验组与空白对照组比较,游泳时间有所延长,分别提高了43%、41%和39%,但无显著性差异,可以初步认为松茸浓缩口服液能延长小鼠负重游泳时间,但机制其还需进一步试验验证。
2.3.2 对小鼠血乳酸浓度的影响 乳酸是无氧糖酵解的产物,经过短时间大强度剧烈运动后,乳酸含量迅速增加。所以短时剧烈运动后血乳酸降低的幅度能反映出机体疲劳消除速度、机体恢复程度。

表11 松茸浓缩口服液对血乳酸浓度影响Table 11 Tricholoma matsutake concentrated liquid impact on blood lactic acid content
从表11中可以发现,在灌胃松茸浓缩口服液7 d后,试验组与对照组无明显变化。14 d与21 d后,试验组小鼠血清中血乳酸浓度明显低于对照组,分别降低了 21%和 29%,有显著性差异(P<0.05),随着灌胃时间的增加,血清中血乳酸浓度呈明显的下降趋势。
2.3.3 对小鼠血清尿素氮浓度的影响 血清尿素含量的变化可反应体内含氮物质分解代谢状况,较长时间以及激烈运动或者强体力劳动后会使血尿素含量增高。当打破能量平衡时,含氮物质的分解代谢加强,此时尿素量增加,机体尿素氮含量随劳动或运动负荷成正比,其中机体对负荷适应能力越差,尿素氮增加就越明显。血尿素含量对于机体在负荷时的反应是一个灵敏的指标,因此通过减少蛋白质的分解,降低血清尿素氮水平,可提高对运动负荷的适应能力。
从表12可以发现,在灌胃松茸浓缩口服液7 d后,对照组与试验组血清中尿素氮浓度基本不变,14 d与21 d后,对照组与试验组相比血清尿素氮浓度均明显下降,分别下降了38%和49%,差异极其显著(P<0.01)。
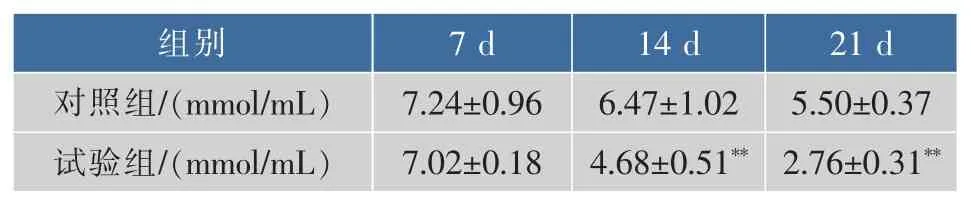
表12 松茸浓缩口服液对血清尿素氮浓度影响Table 12 Tricholoma matsutake concentrated liquidimpact on serum urea nitrogen content
3 结 语
本试验以小鼠的胸腺指数、脾脏指数、血清IgG质量浓度和巨噬细胞吞噬能力为检测指标,研究了松茸浓缩口服液对小鼠免疫能力的影响。结果显示,灌胃松茸浓缩口服液组小鼠与生理盐水组小鼠比较,胸腺指数和脾脏指数呈上升趋势,且当灌胃21 d时试验组小鼠胸腺指数与脾脏指数均显著上升(P<0.05),表明松茸浓缩口服液能有效的促进小鼠胸腺与脾脏的发育。在研究小鼠血清中IgG质量浓度和巨噬细胞吞噬能力时发现,试验组IgG质量浓度均高于对照组,在灌胃14 d及21 d时,差异极其显著(P<0.01)。而巨噬细胞吞噬能力则在灌胃后21 d产生显著性差异(P<0.05)。可以初步说明,松茸浓缩口服液能显著提高小鼠的免疫调节能力,与其他研究结果一致[10-12]。
研究发现,对照组与试验组相比,试验组小鼠血清中MDA浓度均低于对照组,且随着灌胃时间的增加,MDA浓度显著下降,在灌胃21 d后对照组与试验组存在及其显著性差异(P<0.01)。这可能是因为松茸中的营养物质在生物体内直接参与猝灭自由基的途径,并通过参与调动或激活机体的内源性抗氧化剂,使其数量增大和活性增强到机体需要的水平,从而避免或减轻自由基对机体的氧化损伤[13-15]。而试验组中小鼠血清的SOD活力虽然高于对照组,但是在灌胃7 d和14 d时并无明显差异,当灌胃21 d后,试验组小鼠血清内的SOD活力才明显高于对照组,存在明显差异(P<0.05)。这可能是由于松茸浓缩口服液虽然可以提高血清内SOD活力,但是提高SOD活力的能力与修复受损细胞并不能快速的完成,而需要较长时间的累积作用。综上可知,通过较长时间灌胃松茸浓缩口服液,小鼠的抗氧化能力得到了显著性的提高,这与其他研究结果相吻合[16]。
通过小鼠力竭游泳后发现,对照组与试验组相比较,小鼠力竭游泳的时间虽然有提高,但是并没有明显的差异,这可能是由于试验小鼠数量较少,灌胃时间短,个体间的差别不大造成的。而小鼠血清中血乳酸浓度与血清尿素氮浓度均有所下降,在灌胃松茸浓缩口服液14 d后,就开始有显著 (P<0.05)和极其显著(P<0.01)的差异。松茸中含有皂甙、多糖、黄酮、多种氨基及酸、硒、锌、铜等多种微量元素[17-18],其中皂苷可以提高肌糖原对运动所需的能量的储存能力,也可增加LDH活性,加速乳酸代谢,防止乳酸在体内聚集[19];体内主要的供能物质是糖类[20],其供应不足时会通过蛋白质分解供能,进而血液中尿素氮含量增加,糖类供能充足与否的衡量标准是血清尿素氮浓度,血清尿素氮清除效率越高,运动产生的肌肉疲劳效应越不明显;黄酮类物质,能降低蛋白质的分解速度,增强蛋白质的合成能力,以及促使胰岛素水平升高[21]。正是由于松茸浓缩口服液中营养物质丰富,所以松茸浓缩口服液可以增强小鼠抗疲劳性并对小鼠疲劳有一定的缓解作用。
[1]BYEON S E,LEE J,LEE E,et al.Functional activation of macrophages,monocytes and splenic lymphocytes by polysaccharide fraction from Tricholoma matsutake[J].Archives of Pharmacal Research,2009,32(11):1565-1572.
[2]DING X,TANG J,CAO M,et al.Structure elucidation and antioxidant activity of a novel polysaccharide isolated from Tricholoma matsutake[J].International Journal of Biological Macromolecules,2010,47(2):271-275.
[3]KIM S S,LEE J S.Process development formycelial growth and polysaccharide production in Tricholoma matsutake liquidculture[J].Journalof Bioscienceand Bioengineering,2010,3:351-355.
[4]YIN X L,YOU Q H.Immunomodulatory activities of different solvent extracts from Tricholoma matsutake(S.Ito et S.Imai)singer(higherbasidiomycetes) on normal mice[J].International Journal of Medicinal Mushrooms,2012,14:547-554.
[5]YOU Q H,YIN X L.Pulsed counter-current ultrasound-assistedextraction and characterization of polysaccharides from Boletus edulis[J].Carbohydrate Polymers,2014,101:379-385.
[6]YOU Q H,YIN X L.Extraction purificationand antioxidant activities of polysaccharides from Tricholoma mongolicum Imai[J].Carbohydrate Polymers,2014,99:1-10.
[7]YOUQH,YINXL.EnzymeassistedextractionofpolysaccharidesfromthefruitofCornusofficinalis[J].Carbohydrate Polymers,2013,98:607-610.
[8]LIU Peigui,YUAN Mingsheng,WANG Xianghua.Notes on the resources of matsutake group and their reasonable utilization as well as effective conservation in China[J].Journal of Natural Resources,1999,3:245-252.(in Chinese)
[9]胡泽开.猫爪草免疫活性部位的筛选和猫爪草多糖对小鼠免疫功能的影响[D].郑州:河南中医学院,2007.
[10]CHEN Xia,LIU Qin,DING Kan.Research on chemical component,activity and pharmacological action of Tricholoma matsutake[J].China Healthcare Frontiers,2009,12(4):114-116.(in Chinese)
[11]HOSHI H,IIJIMA H,ISHIHARA Y,et al.Absorption and tissue distribution of an immunomodulatory alpha-D-glucan after oral administration of Tricholoma matsutake[J].Journal of Agricultural and Food Chemistry,2008,56(17):7715-7720.
[12]KIM J,BYEON S,LEE Y G,et al.Immunostimulatory activities ofpolysaccharides from liquid culture of pine-mushroom Tricholoma matsutake[J].Journal of Microbiol Biotechnol,2008,18(1):95-103.
[13]LV Xiru,GUO Liang,CHANG Mingchang,et al.Antioxidant Activity of Polysaccharide from agaricus blazei Murill[J].Acta Edulis Fungi,2010,17(1):69-71.(in Chinese)
[14]WANG Weijuan,FENG Cuiping,CHANG Mingchang,et al.Effects of polysaccharides from agaricus blazei murill on the antioxidant activity in lead-poisoning male rats[J].Journal of Chinese Institute of Food Science and Technology,2013,13(6):15-19.(in Chinese)
[15]SUN Juan,ZHANG Zhaohui,LIU Lei,et al.Antioxidant activities of crude polysaccharides from four valuable edible fungi[J].Journal of Anhui Agricultural University,2011,38(3):404-409.(in Chinese)
[16]DANG Lei,HAO Jiaxin,JIANG Haitao.Comparison of antioxidant activity of several edible fungus polysaccharides[J].Anhui Agricultural Science Bulletin,2010,16(5):76-77.(in Chinese)
[17]WEN Yu.Comparison on nutritional components in fruiting bodies of tricholoma-matsutake from Heilongjiang[J].Journal of Anhui Agricultural Science,2010,38(6):2943-2944.(in Chinese)
[18]YIN Xiulian,YOU Qinghong,JIANG Zhonghai,et al.Study on antioxidant activity of different polar solvent extracts and the effective substance of Tricholoma matsutake Sing[J].Food and Fermentation Industries,2011,37(5):194-198.(in Chinese)
[19]LI Pingjing,ZHANG Ting,WANG Xiaoying,et al.The study of anti-fatigue action of pseudo-ginsenoside GQ on exhaustive mouses[J].Chinese Journal of Laboratory Diagnosis,2009,13(7):869-871.(in Chinese)
[20]SUN Yushu,BILifu,SU Xiulan.General research situation ofpolysaccharides and polysaccharides medicine[J].Journal of Inner Mongolia Medical University,2006,28(1):75-78.(in Chinese)
[21]MA Haitian,LIU Xijie.Effect of daidzein and cystamine on the blood concentration of insulin and glucagon in geese[J].Journal of Northeast Agricultural University,2002,33(3):251-255.(in Chinese)
