R9—FOXM1(1—234aa)重组蛋白批量纯化及其抑瘤效应研究
2018-01-17谭拥军余景卫陈燕向勤谭桂湘
谭拥军+余景卫+陈燕+向勤+谭桂湘

摘 要:通过基因工程构建重组表达质粒pET15b-R9-FOXM1(1-234aa),转化大肠杆菌建立构建表达R9-FOXM1(1-234aa)的菌株.采用原核表达系统和His-tag亲和纯化手段,规模化制备纯化穿膜肽R9-FOXM1(1-234aa),获得的蛋白的纯度达到90%以上.用R9-FOXM1(1-234aa)穿膜肽处理不同的肿瘤细胞,通过MTT实验研究其细胞效应.结果显示:当R9-FOXM1(1-234aa)穿膜肽的浓度达到2 mM时,肿瘤细胞的死亡率为50%左右.实验表明穿膜肽R9-FOXM1(1-234aa)抑制不同肿瘤细胞的生长,有可能成为治疗肿瘤的潜在蛋白类药物.
关键词:多聚精氨酸;细胞穿膜肽;FOXM1;肿瘤治疗
中图分类号:Q784 文献标志码:A
Study of Scale Purification and Anti-tumor Efficacy ofR9-FOXM1(1-234aa) Recombinant Protein
TAN Yongjun,YU Jingwei,CHEN Yan,XIANG Qin,TAN Guixiang
(College of Biology, Hunan University, Changsha 410082,China)
Abstract:A recombinant protein expression vector pET15b-R9-FOXM1(1-234aa) was constructed and transformed to E. coli in order to generate a strain expressing R9-FOXM1(1-234aa). The recombinant protein R9-FOXM1 (1-234aa) (R9-FOXM1(1-234aa)) was isolated at a large scale through His-tag affinity chromatography. The purity of the purified protein reached 90%. Moreover, MTT assay was used to test the effect of R9-FOXM1(1-234aa) on cells, and the test results showed that R9-FOXM1(1-234aa) caused the cell death of different types of cancer cells with a half lethal dose around 2 mm。 The results also demonstrated that R9-FOXM1(1-234aa) suppressed the proliferation of cancer cells and may be considered as a potential angent for anti-cancer in the future.
Key words:arginine-rich; cell-penetrating peptides; FOXM1; tumor therapy
Forkhead Box(Fox)基因广泛分布于从酵母到人的各种真核生物,构成一个庞大的转录因子家族[1],在哺乳动物中已拥有超过40个以上的成员,分别参与调节细胞分化、增殖、代谢及细胞凋亡等生理过程[2].该家族的成员FOXM1,首先被发现是一个调控细胞周期和细胞增殖的蛋白[3].在细胞增殖过程中,FOXM1表达水平增高,并参与调节细胞周期相关的多个基因转录,从而控制细胞的DNA复制与有丝分裂过程[4-6],还与DNA损伤修复有关[7-8].通过小鼠肝脏再生模型的研究发现,当从肝细胞中特异性敲除FOXM1基因之后,肝脏再生过程中DNA的复制降低了80%,而有丝分裂被完全抑制[5].在FOXM1被敲除的肝细胞中,细胞核内累积了大量细胞周期蛋白激酶的抑制蛋白p21Cip1和p27Kip1,从而大大降低了DNA的复制水平[5-6,9].同时,FOXM1还上调激活DNA复制所必须的Cdc25A 磷酸酶的表达[5].另一方面,FOXM1的缺失抑制了有丝分裂过程:因为FOXM1控制着许多与有丝分裂相关的基因转录,其中包括cyclin B1,Cdc25B,polo-like kinase 1(PLK1),aurora B kinase,Survivin,着丝粒蛋白A(CENPA)和CENPB基因[5-6,10-11].此外,不同器官中有条件敲除FOXM1还抑制了致癌剂所诱导的肝癌、肺癌、结直肠癌等实体瘤的发生和发展[9,12-13].
FOXM1蛋白氮端能夠通过与碳端结合,干扰FOXM1碳端的磷酸化,抑制FOXM1转录活性、竞争性阻碍FOXM1与其他肿瘤促进因子互作及促瘤信号通路对FOXM1的修饰活化作用等[14].在细胞周期G2阶段,FOXM1的激活依赖cyclin A/cdk的磷酸化,缺失N端的FOXM1不再依赖cyclin A,细胞周期被激活[15].
细胞穿膜肽(cell-penetrating peptides,CPPs)是由氨基酸组成具有穿透细胞膜能力的多肽,最早从人HIV-1的TAT蛋白中发现:该蛋白中包含具有穿膜能力的特殊肽段区域[16];多聚精氨酸作为目前已知最为简单有效的细胞穿膜肽,其中以九聚精氨酸 (R9)效率最高(大约为TAT的20倍),具有极大的研究及应用价值[17].本实验通过构建携带R9的FOXM1-N(1-234aa)原核诱导表达体系,采用His-tag亲和纯化手段进行批量纯化,选用不同肿瘤细胞株,研究重组蛋白对肿瘤细胞的影响.endprint
1 材料与方法
1.1 材 料
乳腺癌细胞MCF-7、肝癌细胞HepG2、肺癌细胞A549来源于(American Type Culture Collection,ATCC),二苯基溴化四氮唑蓝(MTT)由上海生工提供,DMEM培养基和1640培养基均为GIBCO公司产品,HisTrapTMFF.crude,AKTA均由GE公司提供.
1.2 方 法
1.2.1 pHis-FOXM1(1-234aa)-R9的构建
设计NcoI,BamHI限制性内切酶上下游引物,引物序列如下:
引物1(上游引物):GCG CCC ATG GTG CAT CAC CAT CAC CAT CAC ATG AAA ACT AGC CCC CGT CG.
引物2(下游引物):GCG GAT CCC TAC CTT CTC CTT CTC CTT CTC CTT CTC CTA GAC ACA GAG TTC TGC CAG G.
以pcDNA3.1-FOXM1為模板,在引物1和引物2的引导下PCR扩增反应体系为:克隆质粒pcDNA3.1-FOXM1(80 ng/μL)1 μL,10X PCR Buffer for KOD-PLus-Neo5 μL,dNTPs(2 mM each)5 μL,MgSO4溶液(25 mM)4 μL,KOD-PLus-Neo(1.0 U/mL)1 μL,引物1(100 nM)1 μL,引物2(100 nM)1 μL,DMSO2 μL,加去离子水补充至反应体系50 μL.PCR反应条件:先94 ℃ 5 min;再95 ℃ 30 s, 57 ℃ 30 s,68 ℃ 50 s,共30个循环;然后68 ℃ 10 min,4 ℃ 5 min.反应结束后,对PCR扩增产物进行1.5%琼脂糖凝胶电泳,回收并纯化扩增的目的片段,纯化产物溶于40 μLTE缓冲液中,-20 ℃冻存备用.
利用NcoI,BamHI限制性内切酶切出克隆片段的粘性末端.酶切体系:目的片段(150 ng/mL)或pET-15b质粒(150 ng/mL)6.7 μL,NcoI限制性内切酶0.5 μL,BamHI限制性内切酶0.5 μL,10X FastDigest Buffer1 μL,加去离子水至总体积10 μL,37 ℃水浴反应30 min.
将NcoI,BamHI限制性内切酶处理的目的片段和载体进行连接,连接体系及反应条件为:酶切载体5.63 μL,酶切目的片段2.36 μL,T4 DNA Ligase(5 U/mL)1 μL,10X T4 DNA Ligase buffer1 μL,加去离子水至反应体系10 μL.22 ℃反应20 min,-20 ℃冻存备用.
取一管DH5α感受态细胞置于冰上溶解,待感受态完全溶解后,加入1 μL的连接片段,用拇指轻弹混匀,冰上放置30 min.热激过程:42 ℃热激90 s,冰上放置2 min;加入1 mL的LB培养基,37 ℃放置45 min;取200 μL涂布LB平板(氨苄青霉素浓度为25 μg/mL),37 ℃培养过夜(12~16 h);挑取单克隆,接种到5 mL的LB培养液(含25 μg/mL 氨苄青霉素) 37 ℃ 振荡培养过夜(12~16 h).提取质粒,用限制性内切酶NcoI,BamHI进行酶切鉴定,保种并分装测序.pHis-FOXM1(1-234aa)-R9原核表达质粒结构示意图(图1(a)).
1.2.2 重组蛋白的规模化制备及检测
将表达载体pHis-FOXM1(1-234aa)-R9转化大肠杆菌Rostta DE3感受态细胞,37 ℃培养过夜(12~16 h),随机挑选一个单克隆,接种到5 mL的LB培养基(含25 μg/mL 氨苄青霉素和25 μg/mL 氯霉素),37 ℃振荡培养4~6 h.将菌液加到100 mL的LB培养液(含25 μg/mL 氨苄青霉素和25 μg/mL 氯霉素)37 ℃振荡培养过夜(12~16 h),取菌液检测OD600值,调整OD600值至0.8~1,加入IPTG诱导剂(终浓度0.8 mM),30 ℃诱导振荡培养6 h.4 000 r/min离心20 min收集菌体,用15 mL Binding Buffer(20 mM Na3PO4, 500 mM NaCl, 20 mM imidazole, pH 7.4)重悬菌体,超声40 min(超3 s,停2 s)破碎菌体.细菌裂解液采用原核表达系统和His-tag亲和纯化手段,纯化后蛋白利用SDS-PAGE凝胶电泳方法检测蛋白.
根据上述确认的菌液进行扩大培养,在8瓶500 mL的摇瓶进行培养,37 ℃振荡培养过夜,取菌液检测OD600值,调整OD600值至0.8~1,加入IPTG诱导剂,30 ℃诱导振荡培养6 h.4 000 r/min离心20 min收集菌体,用15 mL Binding Buffer重悬菌体,超声40 min破碎菌体.裂解液用HisTrapTMFF.crude亲和层析方法,通过GE AKTA蛋白纯化系统,用不同强度的离子浓素洗脱,收集吸收峰出现的样品,然后利用SDS-PAGE凝胶电泳方法检测蛋白.
1.2.3 MTT法检测细胞活性
取对数期细胞,以每孔20 000个细胞接种到96孔板,每孔100 μL培养基,置于37 ℃、5% CO2培养箱中培养24 h.吸出培养基,加入纯化的蛋白,蛋白按照5个浓度梯度,5个平行样处理细胞,置于培养箱中培养24 h.每孔加入20 μL MTT培养4 h,小心吸出上清,每孔加100 μL DMSO,用酶标仪测定492 nm的吸光度OD值.利用Origin 9.0软件系统绘制曲线.
2 实验结果endprint
2.1 pHis-FOXM1(1-234aa)-R9的构建
PCR扩增R9-FOXM1(1-234aa)目的基因,1.5%琼脂糖凝胶电泳分析,条带位于700bp位置,如图1(b)所示.构建的重组表达质粒pHis-FOXM1(1-234aa)-R9经NcoI,BamHI限制性内切酶处理,结果如图1(c)所示,1号样品符合结果,测序结果比对,与理论序列一致.
2.2 重组蛋白R9-FOXM1(1-234aa)的批量纯化及鉴定
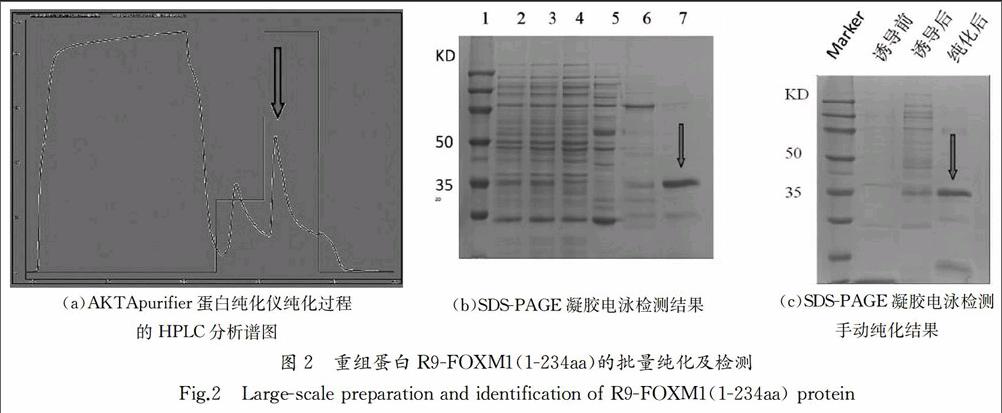
裂解液采用原核表达系统和His-tag亲和纯化手段,采用不同洗脱强度收集纯化蛋白,实现规模化制备纯化穿膜肽融合人FOXM1蛋白氮端(1-234aa)的重组蛋白,并获得纯化过程的HPLC分析谱图图2(a),横坐标表示洗脱体积,纵坐标表示吸收峰UV280.吸收峰曲线代表整个过程中UV280检测结果,阶梯状曲线代表洗脱液的离子强度(实验过程中采用梯度洗脱),箭头为重组蛋白吸收峰.SDS-PAGE凝胶电泳方法检测蛋白制备不同阶段的蛋白样品,上样量均为10 μg(图2(b),AKTApurifier蛋白纯化仪纯化过程中不同时间段纯化蛋白的纯度,100%洗脱时目的蛋白的纯度高,箭头为目的蛋白的位置.Lane1:Marker Lane2:sample Lane3:filtered sample Lane4:No binding sample Lane5:0% elutionB Lane6:30% elutionB Lane7:100% elutionB).
2.3 重组蛋白R9-FOXM1(1-234aa)对肿瘤细胞的抑制效应
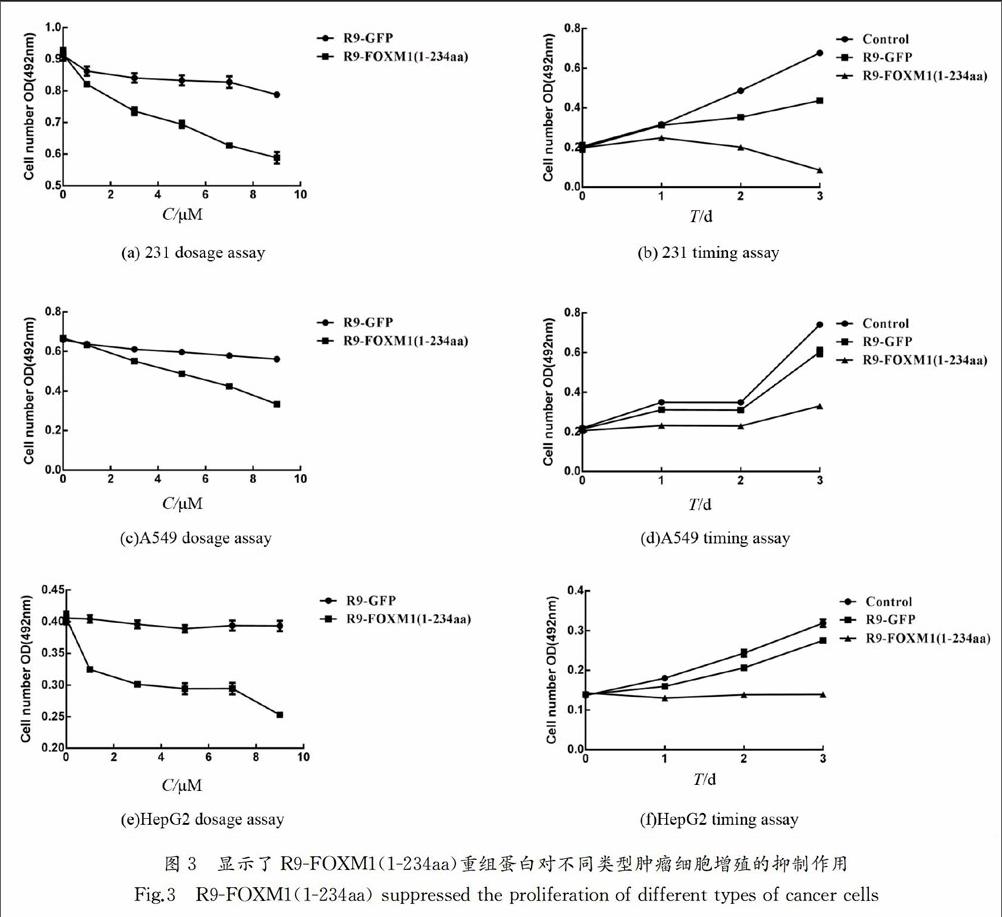
MTT实验验证重组蛋白对肿瘤细胞增殖表型的影响:选择乳腺癌MDA-MB-231、肺癌A549、肝癌HepG2细胞,用不同浓度的重组蛋白(1 μmol/L,3 μmol/L,5 μmol/L,7 μmol/L,9 μmol/L)进行处理,24 h时后检测细胞的活性,R9-GFP处理作为对照,获得剂量依赖曲线,如图3(a)不同浓度重组蛋白处理231细胞,24h后细胞的影响,图3(c)不同浓度重组蛋白处理A549细胞,24h后细胞的影响,图3(e)不同浓度重组蛋白处理HepG2细胞,24h后细胞的影响.针对所选细胞,固定重组蛋白处理浓度(1 μmol/L),在处理后不同时间点(1 d,2 d,3 d)检测细胞活性,获得相关细胞的生长曲线,图3(b)1 μmol/L重組蛋白处理231细胞,3d内细胞活性变化,图3(d)1 μmol/L重组蛋白处理A549细胞,3d内细胞活性变化,图3(f)1 μmol/L重组蛋白处理HepG2细胞,3d内细胞活性变化.实验结果表明,R9-FOXM1(1-234aa)对不同的肿瘤细胞都具有一定的抑制作用.
3 结 论
转录因子FOXM1能刺激细胞增殖、增强DNA损伤修复能力、维持细胞干性、促进细胞迁移,并被作为肿瘤治疗的分子靶标,抑制FOXM1有效抑制肿瘤的发生和发展.FOXM1蛋白氮端抑制FOXM1转录活性、竞争性阻碍FOXM1与其他肿瘤促进因子互作及促瘤信号通路对FOXM1的修饰活化作用等.本实验研究结合多聚精氨酸R9穿膜肽,构建了穿膜肽融合人FOXM1蛋白氮端(1-234aa)的原核表达质粒;采用原核表达系统和His-tag亲和纯化手段,规模化制备穿膜肽R9-FOXM1(1-234aa).相对手动纯化,实验纯化手段具有蛋白纯度高,产量高,时间短等明显优势.为进一步的活体实验提供充足的材料.细胞水平上选择了不同类型的肿瘤细胞(乳腺癌MDA-MB-231、肺癌A549、肝癌HepG2)开展实验,证实了R9-FOXM1(1-234aa)对肿瘤细胞的抑制作用,R9-FOXM1(1-234aa)具体的作用机制还需要进一步的研究.本研究为R9-FOXM1(1-234aa)成为新型抗肿瘤蛋白类药物提供了初步理论基础.
参考文献
[1] KAESTNER K H,KNOCHEL W,MARTINEZ D E. Unified nomenclature for the winged helix/forkhead transcription factors [J]. Genes Development,2000,14(2):142-146.
[2] HANNENHALLI S,KAESTNER K H. The evolution of Fox genes and their role in development and disease[J]. Nature Review Genetics,2009,10(4):233-240.
[3] YE H,KELLY T F,SAMADANI U,et al. Hepatocyte nuclear factor 3/fork head homolog 11 is expressed in proliferating epithelial and mesenchymal cells of embryonic and adult tissues[J]. Molecular Cell Biology,1997,17(3):1626-1641.
[4] YE H,HOLTERMAN A X,YOO K W,et al. Premature expression of the winged helix transcription factor HFH-11B in regenerating mouse liver accelerates hepatocyte entry into S phase[J]. Molecular Cell Biology,1999,19(12):8570-8580.
[5] WANG X,KIYOKAWA H,DENNEWITZ M B,et al. The Forkhead Box m1b transcription factor is essential for hepatocyte DNA replication and mitosis during mouse liver regeneration[J]. Proceeding of the National Academy of Science USA,2002,99(26):16881-16886.endprint
[6] WANG I C,CHEN Y J,HUGHES T,et al. Forkhead box M1 regulates the transcriptional network of genes essential for mitotic progression and genes encoding the SCF (Skp2-Cks1) ubiquitin ligase [J]. Molecular Cell Biology,2005,25(24):10875-10894.
[7] TAN Y,RAYCHAUDHURI P,COSTA R H. Chk2 mediates stabilization of the FoxM1 transcription factor to stimulate expression of DNA repair genes[J]. Molecular Cell Biology,2007,27(3):1007-1016.
[8] TAN Y,CHEN Y,YU L,et al. Two-fold elevation of expression of FoxM1 transcription factor in mouse embryonic fibroblasts enhances cell cycle checkpoint activity by stimulating p21 and Chk1 transcription [J]. Cell Proliferation,2010,43(5):494-504.
[9] KALINICHENKO V V,MAJOR M L,WANG X M B,et al. Foxm1b transcription factor is essential for development of hepatocellular carcinomas and is negatively regulated by the p19ARF tumor suppressor [J]. Genes Development,2004,18(7):830-850.
[10]KRUPCZAK-HOLLIS K,WANG X,KALINICHENKO V V,et al. The mouse Forkhead Box m1 transcription factor is essential for hepatoblast mitosis and development of intrahepatic bile ducts and vessels during liver morphogenesis [J]. Developmental Biology,2004,276(1):74-88.
[11]WANG X,QUAIL E,HUNG N J,et al. Increased levels of forkhead box M1B transcription factor in transgenic mouse hepatocytes prevent age-related proliferation defects in regenerating liver [J]. Proceeding of the National Academy of Science USA,2001,98(20):11468-11473.
[12]KIM I M,ACKERSON T,RAMAKRISHNA S,et al. The Forkhead Box m1 transcription factor stimulates the proliferation of tumor cells during development of lung cancer[J]. Cancer Research,2006,66(4):2153-2161.
[13]YOSHIDA Y,WANG I C,YODER H M,et al. The forkhead box M1 transcription factor contributes to the development and growth of mouse colorectal cancer [J]. Gastroenterology,2007,132(4):1420-1431.
[14]PARK H J,WANG Z,COSTA R H,et al. An N-terminal inhibitory domain modulates activity of FoxM1 during cell cycle [J]. Oncogene,2008,27(12):1696-1704.
[15]LAOUKILI J,ALVAREZ M,MEIJER L A,et al. Activation of FoxM1 during G2 requires cyclin A/Cdk-dependent relief of autorepression by the FoxM1 N-terminal domain [J]. Molecular and Cellular Biology,2008,28(9):3076-3087.
[16]REGBERG J,SRIMANEE A,LANGEL U,et al. Applications of cell-penetrating peptides for tumor targeting and future cancer therapies [J]. Pharmaceuticals (Basel),2012,5(9):991-1007.
[17]SCHMIDT N,MISHRA A,LAI G H,et al. Arginine-rich cell-penetrating peptides [J]. FEBS Letters,2010,584(9):1806-1813.endprint
