葛仙米藻胆蛋白的提取工艺优化及其纯化研究
2018-01-17余佳赵岚张瑞华王玉兰
余佳,赵岚,张瑞华,*,王玉兰,*
(1.湖南省微藻生物工程技术研究中心湖南炎帝生物工程有限公司,湖南株洲412007;2.中国科学院过程工程研究所,北京100190)
葛仙米(Nostoc sphaeroids Kutzing),学名拟球状念珠藻,属蓝藻门[1](Nostocaceae)念珠藻属(Nostoc.)[2-6],与发菜同属[4-5],古称天仙米,又名水木耳(Nostoc com mune vauch)[5],是我国传统出口的珍贵药食两用固氮[7-8]蓝藻。《药性考》中称葛仙米具有“清神解热,痰火能疗”的作用,《纲目拾遗》中则记载葛仙米具有“解热,清膈,利肠胃”的作用,《陕西中草药》称其在“清热收敛,益气明目,治烫火伤,夜盲症”有很好的功效[9]。葛仙米的蛋白质、多糖及氨基酸的含量极高,且组成合理,配比均衡,氨基酸种类多达16种以上,多糖含量高达37.9 g/100 g,蛋白质含量为30.8 g/100 g,氨基酸总含量为31.06 g/100 g,甚至超过FAO的标准。另外,葛仙米还含有较多的矿物质,其中Ca、Mg、Na的含量较多,Ca含量达1 920 mg/100 g,烟酸、烟酰胺和维生素K1的含量较高,是配比均衡的营养品。
藻胆蛋白是广泛存在于红藻、蓝绿藻和隐藻的藻胆体[10]中的捕光色素蛋白,能把捕获的光能高效的传递给叶绿素,从而进行光合作用。藻胆蛋白包括藻蓝蛋白、藻红蛋白、藻红蓝蛋白(Phycoerythrocyanin,PEC)和别藻胆蛋白(Allphycocyanin,APC)四类[11]。藻胆蛋白可以是一种重要的抗辐射、抗氧化活性物质,可制成食品、保健食品及化妆品,用于医疗保健[12]。国内外学者对藻胆蛋白进行了大量研究,一方面,藻胆蛋白主要的提取技术有:化学试剂处理法、反复冻融法[13]、溶胀法、超声波法和组织捣碎法等[14]。不同方法对藻胆蛋白的提取率不同。另一方面,藻蓝蛋白[15]或者藻红蛋白[16]的纯化通常需要经过几步纯化,首先经过盐析法、等电点法或者结晶法初步分离提取后,再通过柱层析法纯化,包括羟基石灰石吸附层析法、纤维素系列离子交换层析法[17]、亲和层析和分子排阻层析法[18],得到单一的藻蓝蛋白或者藻红蛋白。
本文探讨了影响葛仙米藻胆蛋白提取率的主要因素,并对提取的藻胆蛋白纯化做了前期研究,超声波辅助纯水提取葛仙米藻胆蛋白以及一步阴离子交换法纯化藻胆蛋白均尚无人研究,为葛仙米藻胆蛋白日后的深加工应用提供了一定前期基础。
1 材料与方法
1.1 材料与试剂
葛仙米:常德炎帝生物科技有限公司。
考马斯亮蓝G250:上海阿拉丁生化科技股份有限公司;牛血清蛋白(纯度96%):上海晶纯生化科技股份有限公司;其他试剂均为国产分析纯。
1.2 仪器与设备
ME155DU电子天平:梅特勒-托利多仪器(上海)有限公司;TG16-WS台式高速离心机:湖南湘仪实验室仪器开发有限公司;Cary60紫外分光光度计:安捷伦科技(中国)有限公司;Kq5200de超声清洗仪:深圳市旗美世纪科技有限公司;SCIENTZ-50FN冻干机:宁波新芝生物科技股份有限公司;AKTA purifier 100、AKTA purifier 10蛋白纯化仪:通用电气医疗系统(中国)有限公司;UV-2501PC紫外可见吸收光谱仪、EDS-700HS荧光光谱仪:日本岛津公司。
1.3 方法
1.3.1 葛仙米基本成分的测定
蛋白质含量:凯氏定氮法,依照GB 5009.5-2010《食品安全国家标准食品中蛋白质的测定》[19]进行测定;水分含量:直接干燥法,依照GB 5009.3-2010《食品安全国家标准食品中水的测定》进行[20]测定;脂肪含量:索氏抽提法,依照GB/T 5009.6-2003《食品中脂肪的测定》[21]进行测定;多糖(以葡萄糖计)含量:苯酚-硫酸法,依照《功能性食品活性成分测定》[22]测定;灰分含量:马弗炉高温灼烧法,依照GB 5009.4-2010《食品安全国家标准食品中灰分的测定》[23]进行测定;藻蓝蛋白含量:分光光度法,依照SN/T 1113-2002《进出口螺旋藻粉中藻蓝蛋白、叶绿素含量的测定方法》[24]进行测定。
1.3.2 葛仙米蛋白质提取率的测定
参照李合生《植物生理生化实验原理和技术》[25]中考马斯亮蓝G-250染色法测定。将葛仙米粉加入提取液处理后,4 000 r/min离心10 min,取上层0.1 mL,加入0.9 mL纯水和5 mL考马斯亮蓝G250蛋白试剂,混匀静置10 min,于595 nm波长处测定吸光度(A595nm)。以上试验重复3次。
蛋白质提取率/%=测得的0.1 mL蛋白质含量×提取液体积(mL)×10/葛仙米样品中蛋白质的总含量×100
1.4 葛仙米藻胆蛋白的提取工艺
葛仙米干品→机械粉碎→过筛→纯水提取→过滤→超滤除杂→超滤浓缩→冷冻干燥→藻胆蛋白粗品
1.4.1 样品粉碎
取葛仙米干品,用粉碎机粉碎,依次过10、24、65、80、120、200目筛,将不同截留样品装样,标记留用。超微粉(约6 000目左右,下同)是由秦皇岛太极环纳米制品有限公司提供。
1.4.2 葛仙米藻胆蛋白提取工艺单因素试验
选择葛仙米粉粒径数、超声功率、处理方法、液料比、提取时间、提取温度作为考察的6个因素。各因素条件分别为葛仙米粉粒径数:10目~24目、24目~65目、65目~80目、80目~120目、120目~200目、200目以上、超微粉;超声功率:400、500、600、700、800、900 W;处理方法:反复冻融法、直接水提法、超声波辅助提取法;液料比:30 ∶1、40 ∶1、50 ∶1、60 ∶1、70 ∶1、80 ∶1、90 ∶1(mL/g);提取时间:0、0.5、1、2、3、4、5、6 h;提取温度:15、30、45、60 ℃。每个因素重复试验 3 次,结果取平均值。
1.4.3 葛仙米藻胆蛋白提取工艺条件响应面优化
通过单因素试验,选取葛仙米粉粒径数、液料比、提取时间进行响应面试验设计。以葛仙米藻胆蛋白提取率为响应值,确定葛仙米藻胆蛋白提取的最优条件(其他因素水平以超声波功率为700 W、超声波辅助提取法、提取时间为6 h为准)。按照表1进行试验。

表1 响应面分析试验因素和水平Table 1 Factors and levels used for response surface analysis
1.5 藻蓝蛋白和藻红蛋白的分离纯化及其纯度分析
1.5.1 藻蓝蛋白和藻红蛋白的分离纯化
将葛仙米藻胆蛋白粗提粉末用50 mmol/L的Tris-HCl缓冲液 Buffer A(pH 值为 7.3、电导率为 3.9 μs/cm)溶解,离心(10 000 r/min,45 min),弃沉淀。取出上层清夜加入饱和硫酸铵溶液使之达到60%的饱和度,在上述离心条件下离心45 min,取出沉淀,用缓冲液BufferA复溶后,4℃条件下透析24 h,去除硫酸铵,用于后续DEAE层析。
用缓冲液Buffer A平衡DEAE-52离子交换柱(1.6 cm×40 cm),用50 mmol/L的Tris-HCl-NaCl缓冲液Buffer B(pH 值为 7.3、电导率为 4.0 μs/cm)的梯度洗脱,0~100%收集洗脱液。分别收集红色和蓝色的组分。3 000 D的超滤膜超滤浓缩,透析,水溶液4℃保存。
1.5.2 藻蓝蛋白和藻红蛋白的纯度、初步分子量检测
应用十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)、凝胶过滤色谱、紫外可见吸收光谱和荧光光谱对纯化后的葛仙米藻蓝蛋白和藻红蛋白进行纯度测定。
电泳分离胶浓度(以体积分数表示)为13.5%,浓缩胶浓度(以体积分数表示)为4.5%,以考马斯亮蓝R-250染色。
凝胶过滤色谱:采用Superdex 75凝胶色谱柱,流动相为50 mmol/L Tris-HCl缓冲液+0.15 mol/L NaCl(PH=7.0),流速为 0.5 mL/min,检测波长为 280 nm,进样量为0.1 mL(浓度均在1 mmL/g左右)。
紫外吸收的检测波长为200 nm~800 nm,与标准品对照,分析产物纯度。
1.6 数据分析
数据分析处理采用OrignPro 8.0和Design Expert 8.06软件。每次设置3个平行试验。
2 结果与分析
2.1 葛仙米的化学成分组成
葛仙米的化学成分见表2。
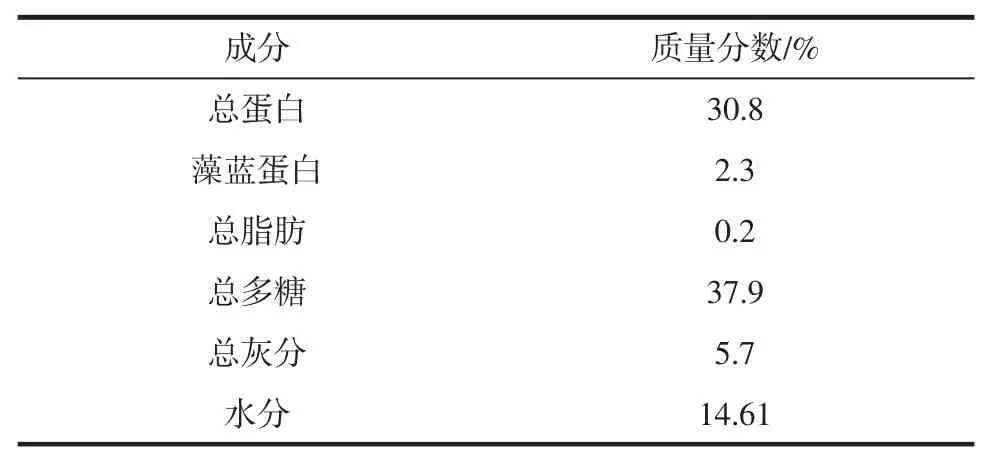
表2 葛仙米的化学成分Table 2 Chemical composition of nostoc sphaeroids kutz
由表2可以看出,葛仙米的总蛋白质含量为30.8%,其中藻蓝蛋白含量2.3%,占总蛋白的7.5%。说明葛仙米含有丰富的蛋白质,是很好的藻蓝蛋白来源。另外,葛仙米干品的含水量为14.61%,蛋白质提取试验数据计算是仅考虑无水干品的重量。
2.2 藻胆蛋白提取工艺单因素试验结果
2.2.1 葛仙米粉粒径数对蛋白质提取率的影响
组织破坏葛仙米结构可以促进藻胆蛋白的溶出。葛仙米粉粒径数对葛仙米藻胆蛋白提取率的影响见图1。

图1 葛仙米粉粒径数对葛仙米藻胆蛋白提取率的影响Fig.1 Effect of dry nostoc sphaeroids kutz powder size on the extraction yield of nostoc sphaeroids kutz phycobiliprotein
由图1可知,随着葛仙米粉粒径数越高,葛仙米粉越细,水溶蛋白的提取率呈先增长后降低的趋势。在120目~200目区间的葛仙米粉提取率最高。葛仙米粉太粗,细胞内的蛋白质很难溶出,葛仙米粉太细,会对溶出的蛋白质有吸附作用,阻碍水溶性藻胆蛋白的释放。因此,最佳葛仙米粉粒径数为120目~200目,选择80目~120目、120目~200目、200目以上3个水平进行响应面分析试验。
2.2.2 超声波功率对藻胆蛋白提取率的影响
超声波功率对葛仙米藻胆蛋白提取率的影响见图2。
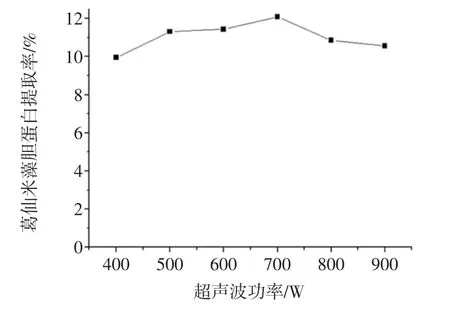
图2 超声波功率对葛仙米藻胆蛋白提取率的影响Fig.2 Effect of ultrasonic irradiation power on the extraction yield of nostoc sphaeroids kutz phycobiliprotein
由图2可知,葛仙米藻胆蛋白提取率随着超声波功率的增大而先增加后减小,在超声波功率700 W时,藻胆蛋白提取率达到最大,继续增大超声波功率,提取率逐渐减小。主要原因是增加超声波功率可以有效促进细胞破碎,藻胆蛋白溶出增加;继续增加超声波功率,可能使藻胆蛋白降解,多糖等杂质溶出增加,使得藻胆蛋白提取率下降。因此,最佳的超声波功率为700 W。由于超声波功率对提取率的影响不大,不选择其作为响应面的分析因素。
2.2.3 处理方法对藻胆蛋白提取率的影响
不同的处理方法对葛仙米藻胆蛋白的提取不同。处理方法对葛仙米藻胆蛋白提取率的影响见图3。

图3 处理方法对葛仙米藻胆蛋白提取率的影响Fig.3 Effect of treatment process on the extraction yield of nostoc sphaeroids kutz phycobiliprotein
由图3可知,超声波辅助提取法提取率最高,原因是超声波破碎葛仙米细胞壁,使藻胆蛋白溶出,提取率提高。因此,最佳处理方法为超声波辅助提取法,不选择其作为响应面的分析因素。
2.2.4 液料比对藻胆蛋白提取率的影响
细胞溶胀作用使得液料比也成为影响藻胆蛋白提取的一个关键因素。液料比对葛仙米藻胆蛋白提取率的影响见图4。

图4 液料比对葛仙米藻胆蛋白提取率的影响Fig.4 Effect of liquid-to-solid ratio on the extraction yield of nostoc sphaeroids kutz phycobiliprotein
由图4可知,开始随提取液用量的增大,葛仙米藻胆蛋白提取率逐渐增大,在液料比为60∶1(mL/g)时,藻胆蛋白的提取率达到最大;而后,随着提取液用量的增大,藻胆蛋白的提取率反而下降。出现这种趋势可能因为,溶剂用量的增加可以增加质量浓度差和固液接触面积,提高扩散速度,但随着溶剂用量的增大,大量杂质溶出,藻胆蛋白提取率反而下降。因此,最佳液料比为 60 ∶1(mL/g),选择 50 ∶1、60 ∶1、70 ∶1(mL/g)3个水平进行响应面分析试验。
2.2.5 提取时间对藻胆蛋白提取率的影响
提取时间对葛仙米藻胆蛋白提取率的影响见图5。
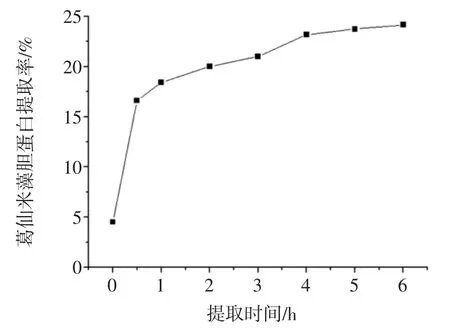
图5 提取时间对葛仙米藻胆蛋白提取率的影响Fig.5 Effect of extraction time on the extraction yield of nostoc sphaeroids kutz phycobiliprotein
由图5可知,随着提取时间的延长,葛仙米藻胆蛋白提取率逐渐增高,开始增长速率很快,随后渐渐平缓,在6 h左右已达24.15%。继续延长提取时间虽会少量提高藻胆蛋白的提取率,但是也增加了提取的复杂性,综合考虑,最佳提取时间为6 h,由于时间一定后提取率趋于稳定,故不选择其作为响应面的分析因素。
2.2.6 提取温度对蛋白质提取率的影响
温度是影响藻胆蛋白溶出的另一个关键因素,而温度过高又会影响蛋白质性质。提取温度对葛仙米藻胆蛋白提取率的影响见图6。
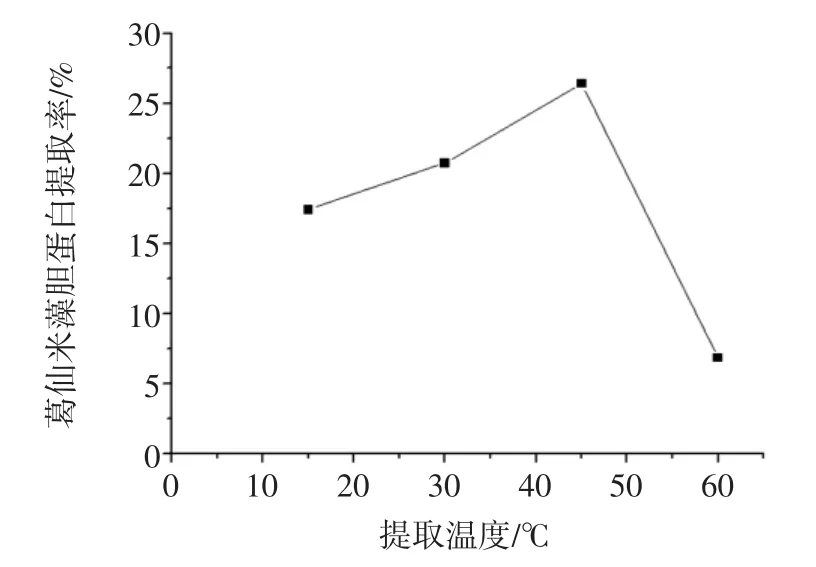
图6 提取温度对葛仙米藻胆蛋白提取率的影响Fig.6 Effect of extration temperature on the extraction yield of nostoc sphaeroids kutz phycobiliprotein
由图6可知,随着提取温度的提高,藻胆蛋白提取率不断上升,在45℃时达到最大,继续升高温度,提取率骤降。原因是葛仙米蛋白质变性,液体变得粘稠,提取率降低。因此,最佳提取温度为45℃,由于提取率随温度变化很大,故选择30、45、60℃3个水平进行响应面分析试验。
2.3 响应面分析法优化葛仙米藻胆蛋白提取的最优条件
2.3.1 Box-Behnken试验设计及结果
根据单因素试验结果,选择葛仙米粉粒径数、液料比、提取温度为Box-Behnken设计的3个因素,优化葛仙米藻胆蛋白的响应面试验设计及结果如表3,回归模型方差分析见表4。

表3 Box-Behnken试验分析及结果Table 3 Box-Behnken design with experimental results

表4 回归模型方差分析Table 4 Analysis of various for regression model

续表4 回归模型方差分析Continue table 4 Analysis of various for regression model
所得响应值回归模型函数表达式如下:
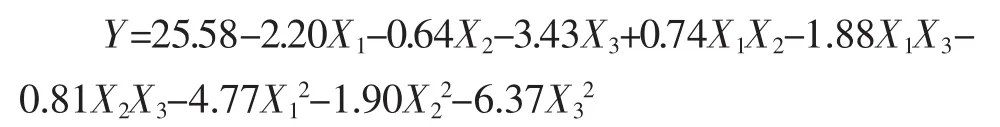
由表4方差分析得出,模型极显著,模型的失拟项不显著,回归决定系数R2=0.985 1,修正决定系数R2Adj=0.965 9,说明方程拟合性好,可靠性高。根据结果进行分析,一次项 X1、X3极显著,二次项 X1X3、X12、X22、X32极显著。说明该模型拟合程度良好,用该模型对葛仙米藻胆蛋白提取工艺进行优化是可行的。提取条件各因素交互作用的响应面及等高线见图7。

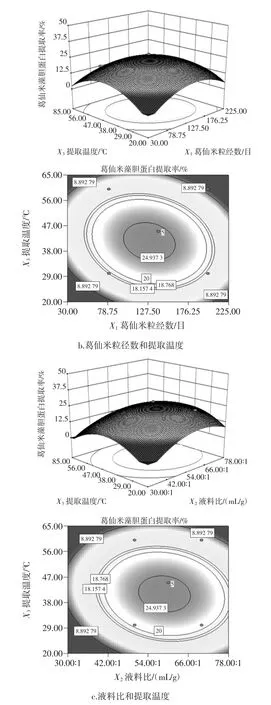
图7 各因素交互作用对葛仙米藻胆蛋白提取率影响的响应面及等高线图Fig.7 3D-surface and corresponding contour plots for the effect of extraction conditions on the extraction yield of nostoc sphaeroids kutz phycobiliprotein
从图7可以看出葛仙米粉粒径数与提取温度交互作用图接近于椭圆形,说明二者的交互作用均显著;液料比和提取温度、葛仙米粒径数和液料比的交互作用图接近圆形,交互作用不显著。
2.3.2 葛仙米藻胆蛋白提取工艺条件的确定及验证
从模型的方差分析显示,回归模型存在最大值,提取工艺的最佳条件为:葛仙米粒径数120目~200目、液料比58.44∶1(mL/g)、提取温度41.55℃。在此条件下葛仙米藻胆蛋白的提取率为26.25%,为方便操作,选择葛仙米粒径数120目~200目、液料比58∶1(mL/g)、提取温度42℃进行试验,结果表明,在此条件下的藻胆蛋白提取率为26.13%,达到预测值的99.54%。
2.4 藻蓝蛋白的纯化
2.4.1 十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDSPAGE)
将藻胆蛋白粗品和DEAE分离纯化得到的藻红蛋白和藻蓝蛋白样品进行SGS-PAGE,电泳图谱见图8。

图8 三组分SGS-PAGE分析图Fig.8 SGS-PAGE analysis of the three substance
SGS-PAGE中蛋白质的迁移仅与其相对分子量有关。经过纯化后的藻蓝蛋白有3条蛋白质带,说明藻蓝蛋白含有3种亚基,分子量分别约为18、19、20 kD。经过纯化后的藻红蛋白电泳只显示一条蛋白质带,说明该藻红蛋白的亚基的相对分子量均一,分子量约为14kD。
2.4.2 凝胶过滤色谱分析
藻红蛋白和藻蓝蛋白的凝胶过滤色谱图见图9。

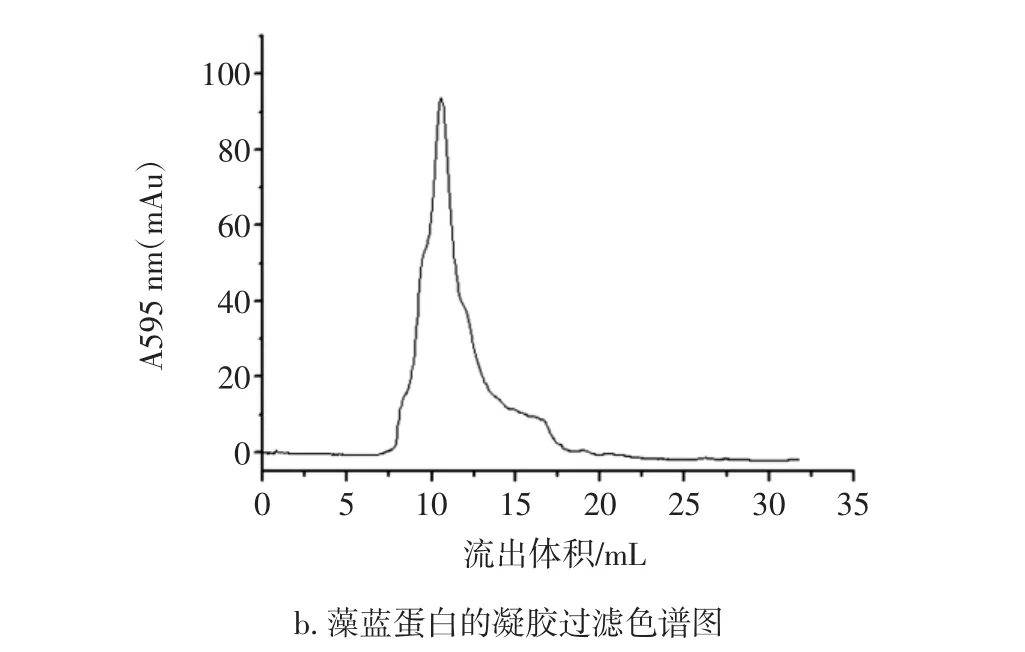
图9 藻红蛋白和藻蓝蛋白的凝胶过滤色谱图Fig.9 Gel filtration chromatography of phycocyanin and phycoerythrim
由图9可知,藻红蛋白主要出峰位置在7.7 mL和12.71 mL处(电泳证实是一条带,纯品),由积分图计算藻红蛋白纯度为83.5%。藻蓝蛋白的主要出峰位置在10.5 mL,对应分子量约为40 KD,与文献[15]的报道藻蓝蛋白的分子量为38.245 KD相近,由积分图计算藻蓝蛋白纯度为93%。
2.4.3 紫外光谱分析
藻红蛋白和藻红蛋白标准品的紫外光谱见图10,藻蓝蛋白和藻蓝蛋白标准品的紫外光谱见图11。

图10 藻红蛋白和藻红蛋白标准品的紫外光谱Fig.10 UV spectra of phycoerythrim and phycoerythrim standards
由图10可知,藻红蛋白的紫外吸收峰分别为542 nm和565 nm。由图11可知,藻蓝蛋白的紫外吸收峰为610 nm。
3 结论
通过单因素试验和响应面分析,得到微波辅助提取葛仙米藻胆蛋白的最优工艺组合为:处理方法为超声波辅助提取法,超声波功率为700 W、葛仙米粒径数120目~200目、液料比 58∶1(mL/g)、提取温度 42℃、提取时间6 h,在此条件下,葛仙米藻胆蛋白的提取率达到最大,为26.13%,达到预测值的99.54%。
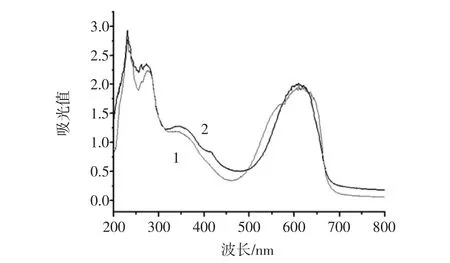
图11 藻蓝蛋白和藻蓝蛋白标准品的紫外光谱Fig.11 UV spectra of phycocyanin and phycocyanin standards
通过一步离子交换层析法,用50 mmol/L的Tris-HCl缓冲液 Buffer A(pH 值为 7.3、电导率为 3.9 μs/cm)溶解藻胆蛋白粗提粉,用50 mmol/L的Tris-HCl-NaCl缓冲液 Buffer B(pH 值为 7.3、电导率为 4.0 μs/cm)洗脱得到高纯度的藻蓝蛋白和藻红蛋白,经过凝胶过滤色谱、紫外光谱分析,该藻红蛋白纯度达到83.5%,藻蓝蛋白纯度达到93%。
超声波辅助提取葛仙米藻胆蛋白条件温和、提取率高、用时短;一步离子交换层析提纯藻蓝蛋白和藻红蛋白,试验方法简单,纯度高,为葛仙米藻蓝蛋白和藻红蛋白的工业化生产提供条件。而葛仙米藻胆蛋白、藻蓝蛋白及藻红蛋白的功效试验尚需进一步研究。
[1]ZHONGYANG D,QIANG H,FAN L,et al.Colony development and physiological characterization of the edible blue-green alga,Nostoc sphaeroides(Nostocaceae,Cyanophyta)[J].Progress in Natural Science,2008(18):1475-1483
[2]朱浩然.中国淡水藻志(第二卷)[M].北京:科学出版社,1991:1-10
[3]杨春澍.药用植物学[M].上海:上海科技出版社,2001:130-131
[4]杨世杰.植物生物学[M].北京:科学出版社,2000:294-296
[5]丁广奇,王学文.植物学名解释[M].北京:科学出版社,1986:1-463
[6]Li D H,Liu Y D,Song L R.Hormogonia mass differentiation from Nostoc sphaeroies Kutz.(cyanobacterium)and comparison of structural characteristics between hormogonia and vegetative filaments[J].Phycological Research,2001,49(2):81-87
[7]WEI Z,YUJIE F.Characterization of nitrogen-fixing moderate halophilic cyanobacteria isolated from saline soils of Songnen Plain in China[J].Progress in Natural Science,2008(18):769-773
[8]ROMAIN D,XINNING Z,DARCY L M,et al.Biological nitrogen fixation by alternative nitrogenases in boreal cyanolichens:importance of molybdenum availability and implications for current biological nitrogen fixation estimates[J].New Phytol,2017,213(2):680-689
[9]谭学儒.葛仙米[J].土特产,2000(3):30
[10]DUNHAI L,LANZHOU C,GENBAO L,et al.Photoregulated or energy dependent process of hormogonia differentiation in Nostoc sphaeroides Kutzing(cyanobacterium)[J].Journal of Integrative Plant Biology Formerly Acta Botanica Sinica,2005,47(6):709-716
[11]JUNJIE Y,DI X,XIAONAN Z,et al.Lyase activities of heterologous CpcS and CpcT for phycocyanin holo-β-subunit from Arthrospira platensis in Escherichia coli[J].J Ocean Univ China,2014,13(3):497-502
[12]彭卫民,唐莉.螺旋藻与藻胆蛋白[J].资源开发与市场,2000,16(4):206-207
[13]MINGQIU L,XIANQING Y,BO Q,et al.Study of Ultrasonic-Freeze-Thaw-Cycle Assisted Extraction of Polysaccharide and Phycobiliprotein from Gracilaria lemaneiformis[J].Advanced Materials Research,2013,6:1818-1824
[14]郑江.藻胆蛋白的提取纯化研究进展[J].食品科学,2002,23(11):159-161
[15]汪兴平.葛仙米藻蓝蛋白的一级结构、构象及抗氧化活性研究[D].武汉:华中农业大学,2006
[16]陈德文.葛仙米藻红蛋白的分离、纯化和结构及生物活性研究[D].武汉:华中农业大学,2005
[17]赵静.藻蓝蛋白分离纯化技术及其影响因素分析[J].食品与发酵工业,2014,40(10):168-175
[18]CARMEN S S,TERESA P N.Extraction and purification of phycocyanin from Calothrix sp[J].Process Biochemistry,2004,39(11):2047-2052
[19]中华人民共和国卫生部.GB 5009.5-2010食品安全国家标准食品中蛋白质的测定[S].北京:中国标准出版社,2010
[20]中华人民共和国卫生部GB 5009.3-2010食品安全国家标准食品中水的测定[S].北京:中国标准出版社,2010
[21]中华人民共和国卫生部.GB/T 5009.6-2003食品中脂肪的测定[S].北京:中国标准出版社,2003
[22]白鸿.功能性食品活性成分测定[M].北京:中国中医药出版社,2012:73-76
[23]中华人民共和国卫生部.GB 5009.4-2010食品安全国家标准食品中灰分的测定[S].北京:中国标准出版社,2010
[24]国家质量监督检验检疫总局.SN/T 1113-2002进出口螺旋藻粉中藻蓝蛋白、叶绿素含量的测定方法[S].北京:中国标准出版社,2002
[25]李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000:184-186
