藻类富集水体重金属的机理及应用
2018-01-17郑蒙蒙邵鲁泽管幼青周思齐李非里
郑蒙蒙, 邵鲁泽, 管幼青, 周思齐, 李非里
(浙江工业大学环境学院, 浙江 杭州 310014)
0 引言
重金属污染在淡水生态系统日趋严重。由于重金属物质不能被降解,在人类的生产生活过程中释放并迁移,在环境中经过一系列转变、吸附,最终通过食物链的生物放大作用对人体健康造成极大危害,破坏生态系统、使生态环境恶化。因此,重金属污染的防治刻不容缓。
藻类作为水生生态环境中的重要组成部分,对重金属的富集行为特征,受到诸多因素的影响,包括藻的生长状态、种类,比如活体藻与非活体藻,海水藻与淡水藻;还受到环境因素的影响,比如温度、pH值、离子强度、溶解性有机质等的影响[1];除此之外,接触时间与藻的粒径等也是影响吸附量的重要因素。本文综述了常用藻类生物吸附剂用于微生物富集重金属的行为、机理及其影响因素,为正确评价和开发藻类重金属富集剂等的研究提供参考依据。
1 藻类生物吸附剂种类
常用作去除重金属的生物吸附剂的藻类为褐藻、红藻和绿藻。本文统计了活体3门藻类在重金属污染修复的综合应用中所含重金属富集情况,见表1。
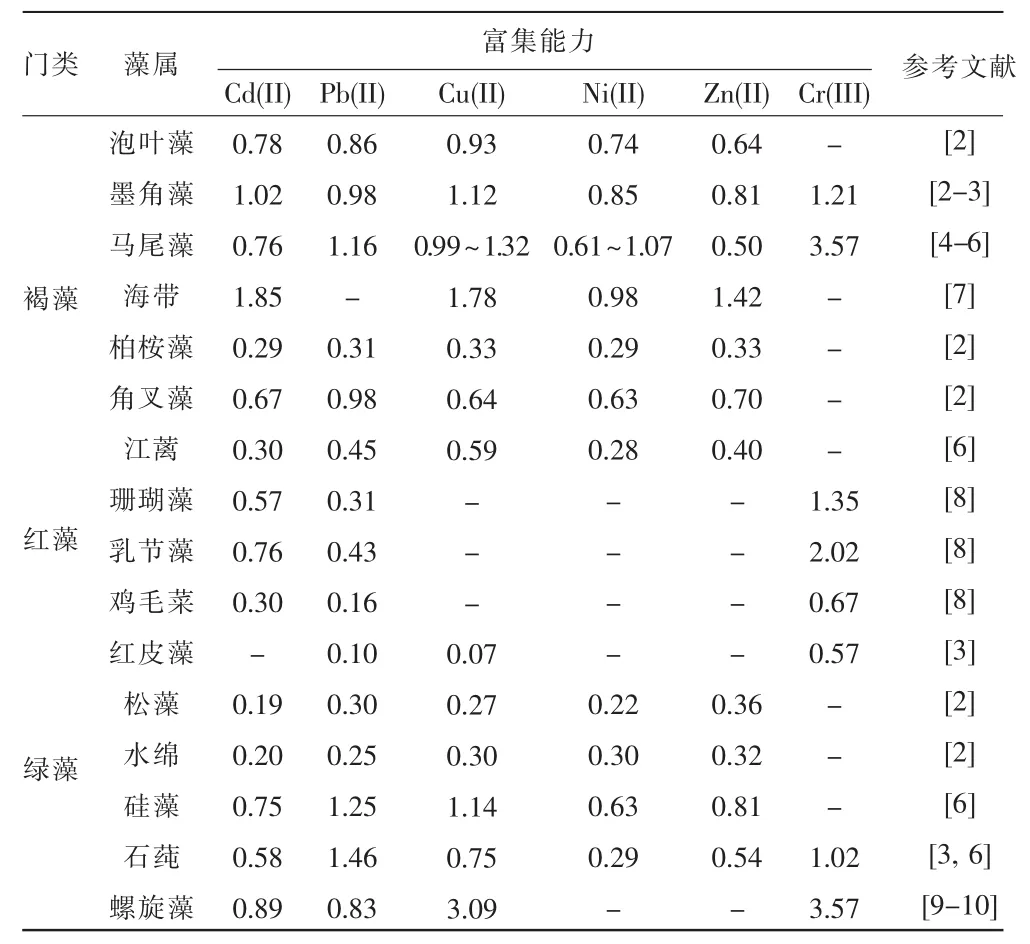
表1 不同门类的藻对重金属的富集能力mmoL·g-1
1.1 褐藻生物吸附剂
褐藻是研究最为广泛的藻类生物,对重金属的生物吸附量很高。褐藻(泡叶藻、墨角藻、马尾藻和海带)对Cd(II),Cu(II)和Pb(II)等有毒有害重金属的生物吸附量相当高,其中墨角藻和海带对Cd(II)的吸附量超过1 mmol/g,高出其他种类生物吸附剂3~5倍[2,4,6-7]。还可以成功地去除贫铀UO2(II),最大吸附能力高于1.59 mmol/g[11]。然而,不同种类褐藻的生物去除能力也具有差异,扇藻和囊链藻相比于喇叭藻和马尾藻具有更高吸附重金属能力[12]。
1.2 红藻生物吸附剂
红藻类生物吸附剂对重金属的吸附能力相对于褐藻生物吸附剂来说,则逊色不少,在去除Cd(II),Zn(II),Ni(II)和 Cu(II)重金属离子的能力较弱[2,6,8](表1)。掌状红皮藻对Pb(II)和Cu(II)的吸附量更弱,仅为其他红藻的10%~25%[3]。乳节藻对重金属的吸附能力则较强,对Cr(III)吸附重金属能力高于珊瑚藻,叉珊瑚和鸡毛菜,甚至比绿藻生物吸附剂高出2倍[8]。此外,红藻类对Co(II)表现出较高生物吸附能力,如珊瑚藻的最大生物吸附量达到1.29 mmol/g[8]。
1.3 绿藻生物吸附剂
通常,绿藻生物吸附剂对于重金属离子的生物吸附能力远低于褐藻类生物吸附剂。但在近年来逐渐开展对绿藻的研究中显示,个别绿藻比如螺旋藻的吸附 Cr(III),Cu(II),Ni(II)和 Cr(VI)的能力表现出极大的潜力,不管是活体藻还是非活体藻,去除能力都很强[10,13-14]。石莼对Pb(II)的去除能力强于大部分绿藻和红藻[6]。
由于绿藻的体积小、生长速度快、培养成本低等优点,在生物修复法中越来越受到重视。特别是在低浓度重金属吸附实验中,有几种绿藻显示出较强吸附能力。如斜生栅藻对质量浓度为11 mg/L的Cd(II)有高达97%的吸附率[15];小球藻在对质量浓度为0.008mg/LCu(II)的去除率达到95.4%;而集胞藻6 803在质量浓度为0.12mg/L对Pb(II)的去除可达到98.78%[16]等。
2 藻类修复重金属污染水体的特点
用于生物修复法处理重金属污染废水的藻类应具有以下特点:对重金属有较强耐受性;较强富集能力;足够生物量;易吸附-解吸等。国内外研究者发现藻类吸附去除污染水体中重金属具有不可比拟的优势:原料来源丰富、廉价易得;不产生二次污染;相比高等植物具有更快生长速度;吸附量大且灵敏度高;比表面积大,吸附能力高;可净化含多种重金属污染;投资成本低廉;适合于低浓度重金属污染;可应用条件较宽松(温度范围4~90℃),更重要的是被藻类吸附的重金属易于洗脱,有利于藻类的重复利用和重金属回收,不但减轻了对环境的污染,而且可对藻类和重金属循环使用,即可节约资源又可节省开支[17]。
2.1 藻类富集重金属的机理
藻类对金属离子的生物富集不同于一般简单的吸附、沉积或离子交换,而是一个复杂的物化与生化过程。藻类生物富集重金属的机制包括:生物吸附和生物富集这2个类型。包括:络合、离子交换、氧化还原;胞外聚合物、胞内聚合物和液泡区室化,见图1。
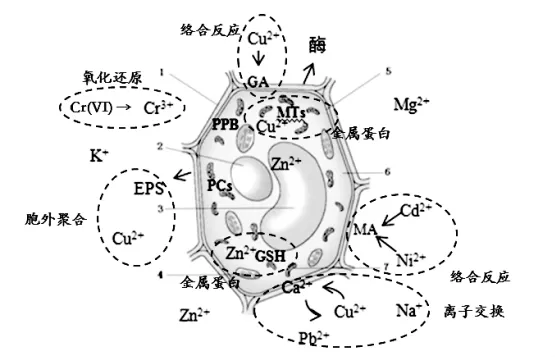
图1 藻类生物富集机制
2.1.1 生物吸附作用
生物吸附作用在生物吸收总量中占80%~90%,由于藻类细胞壁上的多糖、蛋白质、磷脂等多聚复合体提供了大量官能团(氨基、羧基、羟基等),一部分官能团失去质子而带负电荷,依靠静电引力吸附金属离子;一部分官能团自身带弧对电子,与金属离子形成配位键。除此之外,藻类细胞壁带一定电荷和粘性,增加金属离子的吸附。这种生物吸附过程包括表面络合、离子交换、氧化还原和酶促机理作用,这种金属离子的吸附过程可在数分钟或数小时完成。
典型的络合反应发生在褐藻细胞壁中独特成分褐藻酸和藻酸盐上。藻酸盐主要由2种酸性单糖无序排列的线性缩合高聚物组成:1,4-β-D-甘露糖醛酸(Mannuronic acid,MA)及α-L古罗糖醛酸(Guluronic acid,GA)(图1),它们分别提供单基配位和多基配位体。不同褐藻中MA和GA单元的排列及比例不同,若GA单元比例高,则对二价重金属离子的吸附能力更强[18]。MA和GA单元的独特性,使得褐藻吸附重金属能力优于其他藻类。
离子交换作用在藻类吸附重金属离子过程中也起到了至关重要的作用。溶液中的重金属阳离子与藻类细胞壁所含酸性功能基团上的轻金属离子(Na+,K+,Ca2+等)相交换,重金属离子结合到细胞表面,轻金属离子进入水溶液;且随着吸附时间延长,溶液中轻金属离子浓度增加,与重金属吸附动力学曲线一致[19]。
在藻类吸附重金属过程中存在氧化还原作用,主要跟藻类所分泌的酶有关。例如,在用马尾藻吸附强致癌物Cr(VI)时,在细胞表面部分发现被还原成Cr(III)(图1)[20],还发现在小球藻吸附稀有金属Au(III)后,可在细胞表面氧化成金色颗粒Au(0)[21]。氧化还原作用在去除Cr(VI)的研究中体现了极大的研究价值。
2.1.2 生物富集作用
生物富集作用主要是由于长时间处于金属离子污染环境中的藻类进行细胞代谢过程,金属离子通过主动转运、膜孔过滤等方式被运送至细胞膜内部,与胞内官能团结合。生物富集的途径有胞外聚合物、胞内聚合物(金属结合蛋白与多肽、多磷酸体)和液泡作用这4种。
2.1.2.1 细胞外聚合物
胞外聚合物(Extracellular polymeric substances,EPS)是藻类的分泌物质,是一种很好的天然阳离子螯合剂,可与重金属离子形成络合物附着在细胞表面,在胁迫环境下对藻类起到保护作用。研究发现绿藻在共存体系Cu(II)和Zn(II)中(图1),能刺激绿藻分泌EPS形成生物膜,且分泌EPS增加量与增金属浓度呈线性关系[22]。胞外聚合物是藻类长期受重金属胁迫下生长代谢的复杂过程中,建立起来的一系列适应和解毒机制。
2.1.2.2 细胞内聚合物
藻类细胞在重金属存在下可合成金属结合蛋白,如植物络合素(phytochelatins,PCs)、金属硫蛋白(metallothioneins,MTs)、谷胱甘肽(glutathione,GSH)等。在重金属污染物种起到稳定、转运、富集、降低毒性的作用。
PCs是一类酶促合成小分子多肽,结构式为(γ-Glu-Cys)n-Gly,相对分子质量约 2 000 ~ 10 000,是由植物络合素酶以GSH为底物催化合成,被金属离子所激活[23]。其中,诱导PCs合成效应最强的重金属为Cd(II)。MTs是一类基因编码的低分子量金属结合蛋白,由 Cys-Cys,Cys-X-Cys,Cys-X-X-Cys(X-表示任何种类氨基酸)结构单元构成,其中Cys残基可通过巯基与金属离子结合,使之降低重金属毒性[23]。如,小球藻在Zn(II)和Cd(II)的胁迫下合成MTs,但在重金属Cu(II)的胁迫下却合成PCs。由此可见,不同重金属的诱导下藻类可合成植物络合素或金属硫蛋白,但机制尚不明确。
GSH是机体内非蛋白硫醇的主要来源,不仅作为合成PCs的原料,也可以与重金属直接结合。如褐藻在Cd(II)的胁迫下能使得50%GSH转化成PCs[24]。
多磷酸体(polyphosphate bodies,PPB)是由正磷酸盐脱水缩合形成的阴离子线性聚合物,不仅是藻类细胞内储存磷的物质,也是细胞内最主要的金属离子螯合剂,是绿藻、红藻和蓝藻富集重金属能力的重要贡献。
2.1.2.3 液泡区室化
藻细胞也可能通过液泡区室化作用使得重金属在液泡中富集。大多数研究者认为,重金属在细胞体内以离子或植物络合素、蛋白和多肽以及多磷酸体等结合的方式通过液泡(或叶绿体或线粒体)储存、细胞外排作用将有害物质清除[25]。但液泡中重金属的进入方式和解毒机制尚不明确。
2.2 藻类生物吸附重金属的影响因素
大量研究表明影响藻类去除重金属的因素主要分为藻种类、形态、大小;水溶液中的环境条件;重金属种类。其中人为可控对藻类吸附重金属能力影响最大的是水溶液的环境条件。已有大量研究对温度、pH值和离子强度对藻类吸附重金属能力进行考察,在其他条件如吸附时间;是否为活体藻;藻粒径大小以及DOM存在下的研究较少。
2.2.1 吸附时间
吸附时间是藻类吸附重金属最重要的影响因素。不管活藻、死藻都属于快速吸附的过程,一般在30 min~2 h可以达到吸附平衡。藻类的吸附量随着时间的增加而增加的过程中并不呈线性关系,在小球藻吸附Cd(II),在100 mg/L的初始质量浓度下,活藻和死藻在5 min可吸附95.2%和96.8%,105 min达到吸附平衡,吸附效率达到96%和98.1%[26]。
2.2.2 活体藻类或非活体藻类
活体藻类具有旺盛的生物代谢能力,在吸附重金属过程中可促进化学吸附,提高重金属的富集量,一些研究者认为活体藻对重金属的富集能力比非活体藻要好,因为活体藻不止通过生物吸附来富集重金属,还能分泌一些聚合物、糖类和多肽等物质来与重金属离子结合,除此之外还可通过主动运输富集一定量重金属;但大部分研究者认为非活体藻具有更强吸附能力,是由于活体藻的细胞膜具有高度选择性,一般只允许中性分子通过,而非活体藻细胞破碎,更多的内部功能性基团暴露出来可与金属离子相结合,且细胞膜失去选择透过性,更容易让金属离子通过,总富集量能比活体藻类多。但毫无疑问,在活体非活体吸附Cu(II)对比试验中发现,2者的总吸附量相同情况下,非活体藻类对Cu(II)的吸附速率要大于活体细胞[27]。
2.2.3 藻粒径
研究证明,孔石莼的大粒径(40~60mm)对Cd(II)的吸附率为55.7%,但小粒径(0.5~2 mm)的吸附率可达到79.9%,表明小粒径孔石莼粒径的吸附量越高。这可能是由于小粒径可增加细胞表面积,暴露更多的吸附官能团,从而增加其吸附量[28]。但粒径过小则不利于吸附剂与溶液分离。吸附剂粒径对重金属吸附的影响研究大部分还处于非活体藻体阶段,对于活体藻类的粒径还有待更进一步研究。
2.2.4 溶解性有机质
DOM可作为藻类营养物质,还具有较强的络合、螯合、吸附和氧化还原能力,对环境污染物如重金属、持久性有机物(POPs)等在环境迁移、转化过程中起着重要作用[29]。将HA,FA和HyI这3种DOM与 Cu(II),Cd(II)反应,发现HyI能迅速的与Cu(II)和Cd(II)发生反应,HA和FA更容易与Cu(II)发生络合,而Cd(II)则只与FA发生络合反应[30]。低分子的有机酸如苹果酸、柠檬酸可增加Cu(II)生物吸附量,而高分子量HA则降低吸附能力[31]。由于DOM-重金属化学性质的不确定性,因此研究并整理其反应机制尤为重要。
3 存在问题及展望
目前在研究藻类吸附重金属机理上也取得了一定进展,但大规模工业应用方面基本处于起步阶段。
(1)藻类在条件恶劣的废水的生存问题:受活体藻类所处的生长条件限制,在废水中的重金属去除效果可能达不到预期结果。
(2)复合重金属污染条件下藻种如何选择:现今研究重点仍处于单一重金属的研究,但在自然水体中往往是多种重金属共存,其相互作用对藻类影响着对不同重金属的富集行为和能力。
(3)对重金属的资源回收是藻类吸附的另一目的,虽然现今在解吸方面有一定进展,但是还未达到推广的要求,包括解吸条件、影响因素以及环境风险还不能明确。
[1]刘亚子,高占启.腐殖质提取与表征研究进展[J].环境科技,2011,24(S1):76-80.
[2]ROMERA E,GONZ LEZ F,BALLESTER A,et al.Comparative study of biosorption of heavy metals using different types of algae[J].Bioresource technology,2007,98(17):3 344-3 353.
[3]MURPHY V,HUGHES H,MCLOUGHLIN P.Comparative study of chromium biosorption by red,green and brown seaweed biomass[J].Chemosphere,2008,70(6):1 128-1 134.
[4]KLEIN S J,SILVA E A D,SILVA M G C D,et al.Equilibrium of Cu(II)and Ni(II)biosorption by marine alga sargassum filipendulainadynamicsystem:competitivenessandselectivity[J].Bioresource technology,2011,102(7):4 610-4 617.
[5]BERM DEZ Y G,RICO I L R,GUIBAL E,et al.Biosorption of hexavalent chromium from aqueous solution by sargassum muticum brown alga.application of statistical design for processoptimization[J].Chemicalengineeringjournal,2012,183(8):68-76.
[6]SHENG P X,TING Y P,CHEN J P,et al.Sorption of lead,copper,cadmium,zinc,and nickel by marine algal biomass:characterization of biosorptive capacity and investigation of mechanisms[J].Journal of colloid&interface science,2004,275(1):131-141.
[7]LIU Y,CAO Q,FANG L,et al.Biosorption of Cd2+,Cu2+,Ni2+and Zn2+ions from aqueous solutions by pretreated biomass of brown algae[J].Journal of hazardous materials,2009,163(2):931-938.
[8]IBRAHIM W M.Biosorption of heavy metal ions from aqueous solution by red macroalgae[J].Journal of hazardous materials,2011,192(3):1 827-1 835.
[9]HERN NDEZ E,OLGU N E J.Biosorption of heavy metals influenced by the chemical composition of spirulina sp.(arthrospira)biomass[J].Environmental technology,2002,23(12):1 369-1 377.
[10]CHOJNACKA K,CHOJNACKI A,G RECKA H.Biosorption of Cr3+,Cd2+and Cu2+ions by blue-green algae spirulina sp.:kinetics,equilibrium and the mechanism of the process[J].Chemosphere,2005,59(1):75-84.
[11]YANG J,VOLESKY B.Biosorption of uranium on sargassum biomass[J].Water research,1999,33(15):3 357-3 363.
[12]ALI A Y A,IDRIS A M,EBRAHIM A M,et al.Brown algae(phaeophyta)for monitoring heavy metals at the sudanese red sea coast[J].Applied water science,2017,7(7):3 817-3 824.
[13]DOSHI H,RAY A,KOTHARI I L.Bioremediation potential of live and dead spirulina:spectroscopic,kinetics and SEM studies[J].Biotechnology&bioengineering,2007,96(6):1 051-1 063.
[14]DOSHI H,SETH C,RAY A,et al.Bioaccumulation of heavy metals by green algae[J].Current microbiology,2008,56(3):246-255.
[15]段晨雪.斜生栅藻对重金属的吸附及其产油条件的优化[D].天津:天津科技大学,2015.
[16]施定基,蒋雨新,张江伟,等.蓝藻和绿藻去除重金属能力的比较[C]//中国藻类学会第八次会员代表大会暨第十六次学术讨论会论文摘要集.青岛:中国海洋大学出版社,2011.
[17]潘进芬,林荣根.海洋微藻吸附重金属的机理研究[J].海洋科学,2000,24(2):31-34.
[18]DAVIS T A,VOLESKY B,MUCCI A.A review of the biochemistry of heavy metal biosorption by brown algae[J].Water research,2003,37(18):4 311-4 330.
[19]MATAYN,BLZQUEZML,BALLESTERA,etal.Biosorption of cadmium,lead and copper with calcium alginate xerogels and immobilized fucus vesiculosus[J].Journal of hazardous materials,2008,163(2):555-562.
[20]YANG L,CHEN J P.Biosorption of hexavalent chromium ontorawandchemicallymodifiedsargassumsp[J].Bioresource technology,2008,99(2):297-307.
[21]TING Y P,TEO W K,SOH C Y.Gold uptake by chlorella vulgaris[J].Journal of applied phycology,1995,7(1):97-100.
[22]GARC A-MEZA J V,BARRANGUE C,ADMIRAAL W.Biofilm formation by algae as a mechanism for surviving on minetailings[J].Environmentaltoxicology&chemistry,2005,24(3):573-581.
[23]COBBETT C,GOLDSBROUGH P.Phytochelatins and metallothioneins:roles in heavy metal detoxification and homeostasis[J].Annual review of plant biology,2002,53(1):159-182.
[24]MORELLI E,SCARANO G.Synthesis and stability of phytochelatins induced by cadmium and lead in the marine diatom phaeodactylum tricornutum[J].Marine environmental research,2001,52(4):383-395.
[25]NISHIKAWAK,YAMAKOSHIY,UEMURAI,etal.ultrastructu ral changes in chlamydomonas acidophila(Chlorophyta)induced by heavy metals and polyphosphate metabolism[J].Fems microbiology ecology,2003,44(2):253-259.
[26]尹文珂.小球藻对重金属镉的耐受性及吸附研究[D].陕西:西北农林科技大学,2015.
[27]HASSEN A,SAIDI N,CHERIF M,et al.Effects of heavy metals on pseudomonas aeruginosa and bacillus thuringiensis[J].Bioresource technology,1998,65(1):73-82.
[28]常秀莲,冯咏梅,王文华,等.孔石莼吸附重金属镉离子的影响因素及机理[J].江南大学学报:自然科学版,2003,2(1):72-75.
[29]方小满,施 雯,李非里,等.溶解性有机质对水中重金属生物有效性的影响研究[J].环境科技,2016,29(2):59-63.
[30]WU J,ZHANG H,HE PJ,et al.Insight into the heavy metal binding potential of dissolved organic matter in MSW leachate using EEM quenching combined with PARAFAC analysis[J].Water research,2011,45(4):1 711-1 719.
[31]INABA S,TAKENAKA C.Effects of dissolved organic matter on toxicity and bioavailability of copper for lettuce sprouts[J].Environment international,2005,31(4):603-608.
