铝暴露对大鼠血糖、胰岛功能及胰腺组织形态的影响
2018-01-16何明杰吴标良韦喜杨大伟
何明杰+吴标良+韦喜+杨大伟
【摘要】目的观察铝暴露大鼠的血糖、胰岛素水平对胰腺组织病理形态的影响,探讨铝暴露导致糖代谢异常的机制。方法选取健康成年SD清洁级大鼠20只,按体重随机分为两组:对照组(生理盐水)和铝暴露组(AlCl3 8 mg·kg-1·d-1),腹腔注射,1次/日,全程共4周。第4周末测定两组空腹血糖(FBG)、空腹胰岛素(Fins),计算稳态模型胰岛素分泌指数(HOMA-β);取胰腺组织切片行HE染色,观察胰腺组织的改变。结果铝暴露组FPG高于对照组,Fins、HOMA-β低于对照组,差异有统计学意义(P<0.01);对照组胰腺组织正常,铝暴露组胰腺组织坏死明显,可见部分胰岛细胞坏死。结论铝暴露可能通过破坏胰岛细胞导致胰岛素减少,从而引发大鼠血糖升高。
【关键词】铝暴露;血糖;胰岛素;胰腺组织
中图分类号:R595.2文献标识码:ADOI:10.3969/j.issn.1003-1383.2017.06.002
【Abstract】ObjectiveTo observe the effect of aluminum exposure on blood glucose and insulin levels in rats,and to investigate the mechanism of impaired glucose metabolism induced by aluminum exposure.Methods20 healthy adult SD clean rats were selected and randomly divided into two groups according to their body weight: control group(saline)and aluminum exposed group(AlCl3 8 mg·kg-1·d-1)by intraperitoneal injection 1 times per day for 4 weeks.Then fasting blood glucose(FBG)and fasting insulin(Fins) were measured at the end of the fourth week in the two groups,and the Home-insulin secretion index(HOMA-β)were calculated.Pancreatic tissue sections were stained with HE to observe the changes of pancreatic tissue.ResultsFBG of the aluminum exposed group was higher than that of the control group,but Fins and HOMA-β were lower than those of the control group,difference was statistically significant(P<0.01).In the control group,the pancreatic tissue was normal,and the pancreatic tissue necrosis in the aluminum exposed group was obvious,and some islet cell necrosis could be found.ConclusionAluminum exposure may cause insulin depletion by disrupting islet cells,leading to elevated blood glucose in rats.
【Key words】aluminum exposure;blood glucose;insulin;pancreatic tissue
国内学者对居住在铝污染环境的人群进行健康调查发现,1/3的受检者患有糖脂代谢紊乱、高血压、冠心病等慢性疾病,揭示长期铝暴露严重影响人体的健康[1]。近几年越来越多的研究发现,长期铝暴露可能导致人体糖代谢紊乱。本研究拟通过连续腹腔注射三氯化铝(AlCl3)的方法,建立铝暴露大鼠模型,观察大鼠血糖、胰岛素及胰腺形态的变化,并探讨其内在机制。1材料与方法1.1动物由右江民族医学院实验动物中心提供20只活动能力相近、体重220~250 g的健康成年SD清洁级大鼠,将实验大鼠适应喂养1周后,随机分为对照组、实验组,每组10只,分笼饲养,自由进食及饮水。
1.2试剂结晶氯化铝分析纯(AlCl3·6H2O,相对分子质量241.43),西安化学试剂厂产品。
1.3动物模型的建立及给药方法将AlCl3溶液用蒸馏水配制,浓度为10 g/L。AlCl3水溶液高压灭菌后,以8 mg·kg-1·d-1的剂量对铝暴露组大鼠进行腹腔注射,对照组腹腔注射等量(2 ml/只)灭菌生理盐水,1次/日,全程共4周。
1.4样本采集及制备
1.4.1血糖及胰岛素的检测造模第4周末取大鼠尾静脉血液约3 ml,分离血清,采用己糖激酶法检测空腹血糖(FBG),化学发光法测定空腹胰岛素(Fins),計算稳态模型胰岛素分泌指数(HOMA-β)=20×空腹胰岛素/(FBG-3.5)[2]。
1.4.2胰腺组织病理学观察取第4周末处死的大鼠胰腺组织标本,用福尔马林固定,4~5 μm石蜡切片,HE染色,用光学显微镜观察病理学改变。
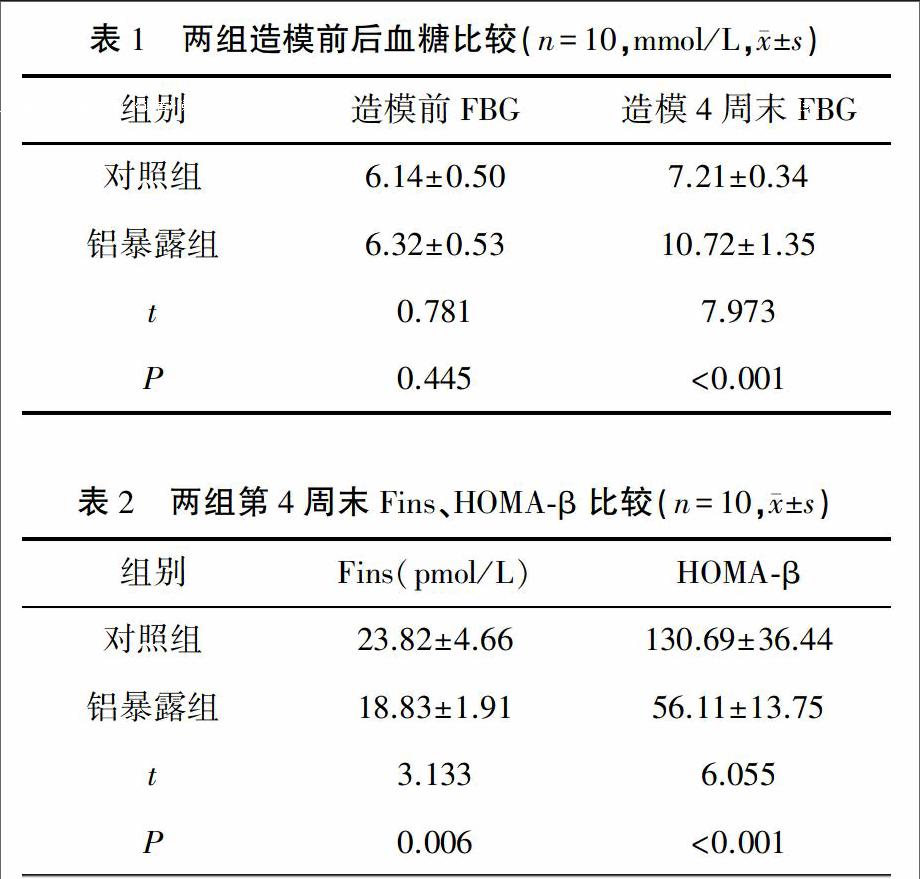
1.5统计学方法计量资料数据均以(±s)表示,采用SPSS 17.0统计软件进行t检验,检验水准:α=0.05,双侧检验。2结果2.1铝暴露对血糖及胰岛素的影响 由表 1、2可见第4周末铝暴露组大鼠FBG高于对照组,而Fins、HOMA-β则明显低于对照组,差异有统计学意义(P<0.01)。endprint
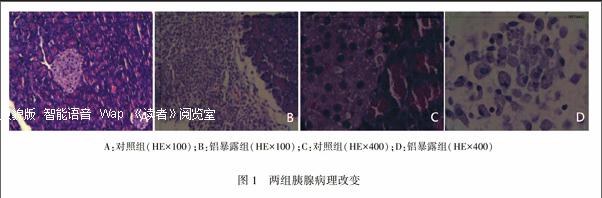
2.2铝暴露大鼠胰腺组织病理学的影响对照组:胰腺小叶内腺泡均匀、紧密,可见胰岛分布在腺泡间,胰岛细胞数量较多,与外分泌腺界限清楚,排列规整,胞质丰富浅染,胞核清晰呈卵圆形。见图1-A、C。铝暴露组:部分胰腺组织中有多处片状坏死,部分胰岛细胞结构破坏,胰岛细胞数量明显减少,排列紊乱,胰岛内胞浆较少,细胞轮廓消失,部分细胞核碎裂、溶解,部分伴有钙化灶形成及炎症细胞浸润。见图1-B、D。
3讨论铝是地壳中常见的金属元素,越来越多的研究证实,长期铝暴露对神经系统、血液、肝肾、免疫系统等都有不同程度的毒性作用[3],导致相应器官功能及结构变化。近年来不断有研究发现铝暴露可干扰血糖代谢,引起血糖升高[4]。本研究结果显示,铝暴露组大鼠血糖较对照组显著升高,证实铝的过度摄入可导致糖代谢异常。目前研究认为铝暴露导致血糖升高的主要机制有氧化应激、促进炎症发生、抑制ATPase活性等[5]。根据国内一项研究发现,长期居住在铝工业区的人群胰岛素抵抗发生率较非铝区的居民明显升高,且IL-6、CRP较其他非铝区的居民显著升高,提示长期铝暴露后可促进炎症反应,进而导致胰岛素抵抗的发生[6]。由此我们推断胰岛素抵抗是铝暴露引起血糖升高的其中原因之一。郭湘云等[7]的研究发现,铝作业工人血糖升高可能是因为铝摄入超标导致细胞膜上的Na+-K+-ATPase活性下降,进而影响葡萄糖代谢。Na+-K+-ATPase作为葡萄糖转运中介,其活性降低可导致β细胞的胰岛素胞泌作用受到抑制,阻碍正常糖代谢,导致机体血糖水平升高[8]。本研究显示铝暴露组大鼠血清空腹胰岛素、HOMA-β较对照组显著减少,揭示铝暴露通过抑制胰岛素分泌进而导致血糖升高,其结果与上述研究结果吻合。故可认为胰岛素分泌减少是铝暴露大鼠血糖升高的另一原因。
通过对胰腺组织进行观察,本研究还发现铝暴露组胰腺组织及胰岛细胞部分坏死,且炎症细胞浸润,故笔者推断铝可能直接造成胰腺组织损伤,引起胰岛细胞数量减少,胰岛素分泌下降,进而导致血糖升高。通常认为重金属进入人体后,主要在肝脏和肾脏积蓄,直接破坏胰腺组织的可能性极小。目前铝导致胰腺损伤相关的研究及报道并不多,但雷立健[9]对长期接触重金属的职业工人研究发现,受检者血清胰岛素水平、血清淀粉酶水平随着血镉、尿镉水平的增加而降低,说明一些重金属可能导致胰腺损伤引起组织结构和功能改变。另一方面,铝负荷可诱导机体氧化应激,动物实验发现在脑组织与免疫系统均发现活性氧自由基(ROS)增多或超氧化物歧化酶(SOD)活性下降[10~11],而胰腺组织抗氧化应激能力较差,可能造成组织细胞损害进而引起胰岛素分泌减少。故推断铝损伤胰腺组织导致胰岛素分泌减少的可能性是存在的。但国内外对铝暴露与胰腺相关性研究较少,且本研究样本量小,今后可以通过增加动物样本量、胰腺组织铝含量的测定等方面深入研究,希望找到更多的证据,为铝暴露与糖代谢紊乱的理论研究提供新思路。
参考文献
[1] 阎飞.1337名氧化铝退休工人健康状况调查分析[J].医学信息(中旬刊),2011,24(7):2901.
[2] 杜任生,庾永基,肖伟明.2型糖尿病患者血清锌、硒、铬、铜与血糖水平的相关性研究[J].国际检验医学杂志,2017,38(8):1059-1063.
[3] 孙中蕾,陈瑶,白静.铝中毒研究进展[J].医学综述,2013,19 (15):2741-2743.
[4] 韦华,王民登,蒙连新,等.桂西铝工业基地居民血清微量元素含量及其与糖代谢异常关系研究[J].现代预防医学,2012,39(4):946-950.
[5] 韦喜,韦华.铝与糖尿病关系的研究进展[J].微量元素与健康研究,2017,34(1):81-83.
[6] 覃晓洁,吴标良,王民登.长期高铝暴露人群糖代谢变化及机制[J].山东医药,2015,55(28):71-72.
[7] 郭湘云,余霞,魏周邦.铝作业工人血糖水平的观测[J].中国工业医学杂志,2002,15(4):246.
[8] Zadhoush F,Sadeghi M,Pourfarzam M.Biochemical changes in blood of type 2 diabetes with and without metabolic syndrome and their association with metabolic syndrome components[J].J Res Med Sci,2015,20(8):763-770.
[9] 雷立建.镉对胰脏的毒性作用[D].上海:复旦大学,2004.
[10] Abdel Moneim,Ahmed E.Evaluating the potential role of pomegranate peel in aluminum-induced oxidative stress and histopathological alterations in brain of female rats[J].Biol Trace Elem Res,2012,150(1-3):328-336.
[11] Luo X,Jia S,Zhang Y.Suppressive effects of subchronic aluminum overload on the splenic immune function may be related to oxidative stress in mice[J].Biol Trace Elem Res,2014,157(3):249-255.
(收稿日期:2017-08-15修回日期:2017-10-09)
(編辑:潘明志)endprint
