肺腺癌中MMP-9、MMP-13、HIF-1α表达与临床病理特征、EGFR突变及预后的关系
2018-01-15刘月平刘俊英郭瑞霞贺宇彤单保恩
刘月平,刘俊英,郭瑞霞, 丁 妍,贺宇彤,单保恩
基质金属蛋白酶(matrix metalloproteinases, MMPs)是由肿瘤细胞或间质细胞分泌的、活化后可以降解细胞外基质(extracellular matrix, ECM)的锌离子依赖内肽酶家族,MMP-9和MMP-13属于MMPs家族,在MMPs激活过程中起重要作用;主要参与肿瘤的发生、侵袭和转移[1-3]。缺氧诱导因子-1α(hypoxia-inducible factor 1α, HIF-1α)属于氧依赖的转录激活因子,在缺氧条件下HIF-1α的转录水平升高,参与肿瘤的生长及侵袭过程[4]。肺腺癌的靶向治疗目前已取得突破性进展,但仍有部分患者不能采用靶向治疗,对于这部分患者我们需要探索新的方法。本文应用免疫组化SP法染色检测MMP-9、MMP-13、HIF-1α的表达,采用实时荧光PCR法检测患者EGFR突变情况,探讨肺腺癌中MMP-9、MMP-13、HIF-1α的表达与临床病理特征、EGFR突变及预后的相关性,以期为肺腺癌患者的个体治疗提供依据。
1 材料与方法
1.1临床资料选取河北医科大学第四医院病理科2011年3月~2015年3月所有行EGFR基因检测的肺腺癌手术患者存档资料629例,另选取原切口下癌旁正常组织及肺炎性假瘤样增生组织各50例作为对照。629例肺腺癌患者中男性317例,女性312例;年龄20~80岁,平均59岁。所有标本均为手术标本,术前未进行放、化疗。患者均已行EGFR 18~21外显子基因检测;切片均经两位有经验的病理医师复诊,按WHO(2015)肺腺癌分型标准分类,伏壁状腺癌54例、腺泡状腺癌372例、乳头状腺癌76例、实性腺癌93例、黏液腺癌23例、微乳头状腺癌11例。
1.2方法10%中性福尔马林固定,石蜡包埋,每个蜡块行4 μm厚连续切片4张,分别用于常规HE染色及免疫组化染色。免疫组化染色采用SP法,蜡块行4 μm厚切片后,置于60 ℃烤箱干燥,贴附120 min。免疫组化采用罗氏Benchmark XT全自动免疫组化仪。MMP-9(浓缩液)及MMP-13(浓缩液)一抗稀释浓度为1 ∶100,HIF-1α(浓缩液)一抗稀释浓度为1 ∶50,抗原修复采用柠檬酸缓冲液高温高压热修复。阳性对照采用已知的阳性切片,以PBS代替一抗做阴性对照,鼠抗人MMP-9单克隆抗体购自福州迈新公司,兔抗人MMP-13多克隆抗体、鼠抗人HIF-1α单克隆抗体均购自Abcam公司,DAB显色试剂盒购自福州迈新公司。
EGFR基因检测采用实时荧光PCR法检测EGFR 18~21外显子基因突变情况,采用罗氏Cobas DNA样品制备及EGFR突变检测试剂盒,具体操作步骤按试剂盒说明书进行,并采用罗氏Cobas Z480进行PCR分析,直接输出结果。
1.3结果判定MMP-9和MMP-13均以胞质内呈棕黄色颗粒为阳性;HIF-1α阳性染色主要位于细胞质或细胞核。由两名经验丰富的病理医师分别进行独立阅片,对结果进行评定。按染色强度计分:无阳性着色为0分,黄色为1分,棕黄色为2分,棕褐色为3分。400倍光镜下随机选择5个高倍视野,每视野计数100个癌细胞,按阳性细胞的百分率计分:无阳性细胞为0分,阳性细胞数≤10%为1分,11%~50%为2分,51%~75%为3分,≥75%为4分。将两项结果相乘:<4分为阴性,≥4分为阳性。
1.4随访通过电话随访,截止日期为2016年4月,随访的终点为随访截止日期或患者的死亡日期。电话随访的主要内容包括患者目前的身体状况、治疗情况等。若无法联系到该患者或其家属,则视为失访。本组随访600例,29例失访,失访率为4.6%。
1.5统计学方法采用SPSS 19.0软件进行统计学处理。多组率的比较用χ2检验,多组之间两两比较采用P值修正法,生存曲线采用Kaplan-Meier法,生存率的比较采用Log-rank法,用COX风险比例回归模型进行单因素和多因素生存分析。以P<0.05为差异有统计学意义。
2 结果
2.1MMP-9、MMP-13、HIF-1α在肺腺癌组和对照组中的表达629例肺腺癌组中MMP-9、MMP-13、HIF-1α阳性率分别为67.57%、74.88%、60.25%,均明显高于癌旁正常组(22.00%、16.00%、18.00%)及肺炎性假瘤样增生组(46.00%、42.00%、38.00%),差异均具有统计学意义(P<0.001,表1,图1~3)。经两两比较,肺腺癌与癌旁组织、肺腺癌与炎性假瘤样增生组织、癌旁组织与炎性假瘤样增生组织中MMP-9、MMP-13的表达差异均有统计学意义(P<0.017)。HIF-1α在肺腺癌与癌旁组织、肺腺癌与炎性假瘤样增生组织中差异有统计学意义(P<0.017);在癌旁组织与炎性假瘤样增生组织中表达差异无统计学意义(P>0.017)。

①②③
图1MMP-9在肺腺癌中的表达,SP法图2MMP-13在肺腺癌中的表达,SP法图3HIF-1α在肺腺癌中的表达,SP法

表1 MMP-9、MMP-13、HIF-1α在肺腺癌和对照组中的表达
*P<0.05
2.2MMP-9、MMP-13、HIF-1α表达与肺腺癌临床病理特征的关系MMP-9在肺腺癌组织中有淋巴结转移者(72.77%)阳性率高于无淋巴结转移者(64.90%);肿瘤直径>3 cm者(73.37%)高于肿瘤直径≤3 cm者(64.88%),差异具有统计学意义(P均<0.05)。MMP-9与患者性别、年龄、吸烟史、肿瘤分期、病理分型、EGFR突变及是否胸膜受侵无关,差异无统计学意义(P>0.05)。
MMP-13在肺腺癌Ⅰ~Ⅲa期患者中的阳性率分别为68.56%、83.88%、83.33%;有淋巴结转移者(82.16%)阳性率高于无淋巴结转移者(71.15%);肿瘤直径>3 cm者(79.90%)高于肿瘤直径≤3 cm者(72.56%);有吸烟史者(79.73%)高于无吸烟史者(72.13%);差异有统计学意义(P均<0.05)。MMP-13与患者性别、年龄、病理分型、EGFR突变及胸膜受侵均无关,差异无统计学意义(P>0.05)。
HIF-1α在肺腺癌组织中有淋巴结转移者(65.73%)阳性率高于无淋巴结转移者(57.45%);有吸烟史者(65.64%)高于无吸烟史者(57.21%);差异有统计学意义(P均<0.05)。HIF-1α的表达与患者性别、年龄、肿瘤分期、分型、肿瘤大小、EGFR突变及胸膜受侵无关,差异无统计学意义(P>0.05,表2)。
2.3生存分析本组629例肺腺癌患者中,生存时间0.4~59.9个月,中位生存时间42.4个月。MMP-9阳性组和阴性组12、24、36个月的累积生存率分别为92.8%、78.6%、53.2%和98.5%、91.3%、89.9%,Log-rank法比较两组生存率差异有显著统计学意义(χ2=24.312,P<0.001,图4)。MMP-13阳性组和阴性组12、24、36个月的累积生存率分别为93.1%、79.3%、60.3%和99.4%、93.6%、88.0%,Log-rank法比较两组生存率差异有显著统计学意义(χ2=14.832,P<0.001,图5)。HIF-1α阳性组和阴性组12、24、36个月的累积生存率分别为94.1%、79.3%、58.4%和95.5%、88.6%、79.7%,Log-rank法比较两组生存率差异有显著统计学意义(χ2=9.706,P<0.05,图6)。EGFR突变组和无突变组12、24、36个月的累积生存率分别为97.5%、96.6%、96.3%和95.6%、94.4%、92.9%,Log-rank法比较两组生存率差异有显著统计学意义(χ2=15.634,P<0.001,图7)。

表2 MMP-9、MMP-13、HIF-1α表达与肺腺癌临床病理特征的关系
*P<0.05

图4 MMP-9阳性与阴性组生存曲线

图5 MMP-13阳性与阴性组生存曲线
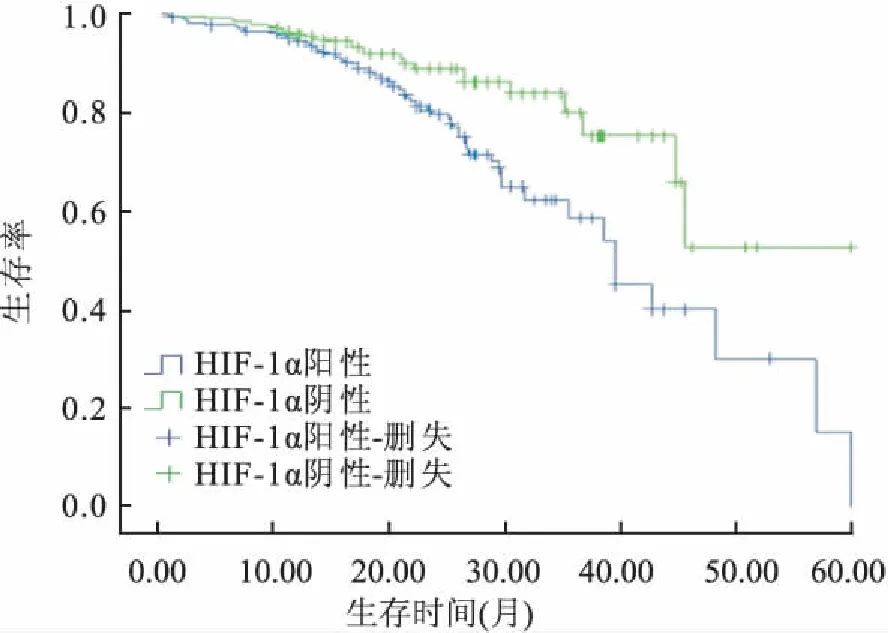
图6 HIF-1α阳性与阴性组生存曲线

图7 EGFR突变组与无突变组生存曲线
2.4COX回归模型对各种可能影响生存的预后因素进行单因素分析,结果显示:患者男性、淋巴结转移、肿瘤较大、胸膜受侵、有吸烟史、肿瘤分期晚、EGFR突变、MMP-9阳性、MMP-13阳性、HIF-1α 阳性均为肺腺癌患者生存的影响因素,差异有统计学意义(P均<0.05)。将单因素分析有意义的变量纳入COX多因素回归模型,结果显示:肿瘤较大、肿瘤分期晚、EGFR突变、MMP-9阳性、MMP-13阳性、HIF-1α阳性均为肺腺癌患者生存状况的独立危险因素,差异均具有统计学意义(P<0.05,表3)。

表3 肺腺癌患者术后生存的单因素及多因素分析
3 讨论
MMPs在胚胎发育、分化、肿瘤血管发生、肿瘤侵袭和转移等过程中发挥重要作用[5]。MMP-9是MMPs中明胶酶的一种,能够降解ECM中的Ⅳ型胶原[6],从而参与肿瘤的侵袭和转移[7]。MMP-13基因位于MMPs级联反应的中心位置,其能激活MMP-9、MMP-2等多种MMPs,也能被MMP-2、MMP-3和MT-MMP等活化,在肿瘤的浸润转移过程中具有重要意义。恶性肿瘤在生长过程中,由于组织增生过快会造成局部组织的严重缺氧,肿瘤细胞的缺氧适应主要由缺氧诱导因子介导,HIF-1α是HIF的主要氧调节亚基,可引起基质MMPs的表达增加,进而促进恶性肿瘤的转移。
徐晓艳等[1]报道MMP-9与MMP-13在非小细胞肺癌中的表达呈正相关,但两者表达与肺癌患者肿瘤大小及吸烟情况均无关。Kuo等[11]认为,HIF-1α的表达与患者吸烟史有相关性。本实验结果显示,MMP-13、HIF-1α与肺腺癌患者吸烟史有关,有吸烟史者阳性率高(P<0.05),但MMP-9与肺腺癌患者吸烟史无关(P>0.05);MMP-9、MMP-13均与肿瘤大小有关,肿瘤大者阳性率高(P<0.05);MMP-13与患者肿瘤分期有关(P<0.05);三者均在有淋巴结转移者阳性率高(P<0.05)。在肺癌患者吸烟史上多项研究结果不同,有待增加样本进一步分析。本实验结果提示肿瘤恶性程度越高,生长越快,直径较大肿瘤内部不能得到足够的血液供应,局部组织、细胞缺氧显著,促进HIF-1α过表达。同时HIF-1α上调其下游靶基因MMP-9的表达,从而降解肿瘤周围基膜与ECM,为肿瘤侵袭创造条件,以适应肿瘤的生长需要。
肺癌尤其是肺腺癌的个体化靶向治疗是当今研究的热点,个体化靶向治疗方案的制定关键在于鉴别、筛选出能明确预测患者可获益于某种靶向治疗的分子标志物[12]。目前,肺腺癌患者最突出的靶向治疗方案为基于EGFR基因检测基础上的EGFR-TKI治疗。Mulloy等[13]提出:EGFR基因突变导致EGFR有更强的激酶活性和催化效率,使胞外的活化信号更加强烈和持久的向胞内表达,导致肿瘤细胞持续异常增殖。本实验结果表明MMP-9、MMP-13和HIF-1α的表达均与患者EGFR突变情况无关(P>0.05),故有待进一步扩大样本、改进方法进行深入分析。
Kaplan-Meier生存曲线分析显示,MMP-9、MMP-13和HIF-1α阳性组12、24、36个月的累积生存率均明显低于阴性组(P<0.05)。经COX回归模型单因素分析,结果显示患者性别、淋巴结转移、肿瘤大小、胸膜受侵、吸烟史、肿瘤TNM分期、EGFR突变、MMP-9、MMP-13、HIF-1α的表达均为肺腺癌患者生存的影响因素(P<0.05)。将单因素分析有意义的变量纳入COX多因素回归模型,结果显示:EGFR突变、MMP-9阳性、MMP-13阳性、HIF-1α 阳性均为肺腺癌患者生存状况的独立危险因素(P<0.05)。因此,MMP-9、MMP-13和HIF-1α在肺腺癌中的阳性及EGFR基因突变对患者预后评估有重要意义。
综上所述,MMP-9、MMP-13和HIF-1α在肺腺癌组织中均存在过表达,且三者在肺腺癌浸润、转移和预后中均发挥重要作用,三者的表达与肺腺癌EGFR突变情况无关,但均是肺腺癌患者生存状况的独立危险因素,因此三者存在独立或联合EGFR突变情况作为肺腺癌患者评估预后及制定治疗方案的可能性。
[1] 徐晓艳,裴陆田,李秀霞. 非小细胞肺癌中MMP-9和MMP-13的表达及意义[J]. 临床与实验病理学杂志, 2014,30(12):1358-1363.
[2] Herszényi L, Hritz I, Lakatos G,etal. The behavior of matrix metalloproteinases and their inhibitors in colorectal cancer[J]. Int J Mol Sci, 2012,13(10):13240-13263.
[3] 廖渝蓉,胡兴胜,邹心怡,等. MMP-13在肺鳞癌和肺腺癌组织中的表达及预后价值[J]. 肿瘤防治研究, 2013,40(3):257-260.
[4] Park S, Ha S Y, Cho H Y,etal. Prognostic implications of hypoxia-inducible factor-1α in epidermal growth factor receptor-negative non-small cell lung cancer[J]. Lung Cancer, 2011,72(1):100-107.
[5] Sun H Z. Clinicopathological significance of stromal variables angiogenesis, lymphangiogenesis, inflammatory infiltration, MMP and PINCH in colorectal carcinomas[J]. Mol Cancer, 2006,5(43):1-20.
[6] Qiao Z K, Li Y L, Lu H T,etal. Expression of tissue levels of matrix metalloproteinases and tissue inhibitors of metalloproteinases in renal cell carcinoma[J]. World J Surg Oncol, 2013,11:1.
[7] Herszényi L, Hritz I, Lakatos G,etal. The behavior of matrix metalloproteinases and their inhibitors in colorectal cancer[J]. Int J Mol Sci, 2012,13(10):13240-13263.
[9] Choi J Y, Jang Y S, Min S Y,etal. Overexpression of MMP-9 and HIF-1α in breast cancer cells under hypoxic conditions[J]. J Breast Cancer, 2011,14(2):88-95.
[10] 何 斐,祁 琪,李 旭,等. 室内空气污染、HIF-1α基因单核苷酸多态性与福建汉族肺癌易感性的关系[J]. 中国肺癌杂志, 2017,20(3):149-156.
[11] Kuo W H, Shih C M, Lin C W,etal. Association of hypoxia inducible factor-1α polymorphisms with susceptibility to non-small-cell lung cancer[J]. Transl Res, 2012,159(1):42-50.
[12] Bunnell C A, Shulman L N. Will we be able to care for cancer patients in the future? [J]. Oncology (Williston Park), 2010,14:1343-1348.
[13] Mulloy R, Ferrand A, Kim Y,etal. Epidermal growth factor receptor mutants from human lung cancers exhibit enhanced catalytic activity and increased sensitivity to gefitinib[J]. Cancer Res, 2007,67:2325-2330.
