还原型谷胱甘肽应用于局部晚期肺癌放疗中对放射性肺损伤及炎症介质的影响
2018-01-15王玉娟薛亚妮常晓红
王玉娟,王 莉,康 睿,薛亚妮,常晓红
(延安大学附属医院呼吸内科,陕西延安 716000)
放射性治疗(简称放疗)是晚期肺癌患者局部治疗的重要手段,但放疗过程中正常肺部组织不可避免地受到一定照射剂量,而发生不同程度的放射性肺损伤。相关研究显示,由于放射性损伤使得在一定程度上限制有效照射剂量,严重影响到肺癌局部控制率[1]。临床上通常表现形式为早期急性无菌性间质性肺炎和后期肺纤维化。常见临床症状有呼吸困难、高热、急促咳嗽,病情呈进行式发展且难以逆转,严重者发展为呼吸衰竭,甚至危及患者的生命安全,直接影响到患者放疗效果及生存质量[2]。随着放疗广泛用于肿瘤的治疗,如何减轻放射性肺损伤就显得十分重要。临床研究发现,白细胞介素-6(IL-6)、白细胞介素-10(IL-10)、肿瘤坏死因子-ɑ(TNF-α)、转化生长因子-β(TGF-β)、血管紧张素转换酶(ACE)水平变化可反映放射性肺损伤的危险程度[3]。还原型谷胱甘肽(GSH)是一种具有巯基调节代谢与抗氧化的还原剂,参与机体内氧化还原,保护细胞膜中巯基酶和蛋白质。近年来临床上被应用于肾损害、肝损害、肺炎及慢性阻塞性肺疾病的辅助治疗。鉴于此,本研究通过将GSH用于局部晚期肺癌患者放射性损伤辅助治疗,探讨其对肺组织的保护作用及对炎性细胞因子的影响,现报道如下。
1 资料与方法
1.1一般资料 本研究采取随机、对照、开放、前瞻性试验方案,经医院伦理委员会审核批准。选取2014年11月至2015年11月住院进行放疗的86例局部晚期肺癌患者作为研究对象,分为观察组和对照组,每组43例。观察组中男25例,女18例;年龄36.7~74.2岁,平均(53.8±12.7)岁;病理类型:腺癌29例,鳞癌14例;卡氏功能状态评分(KPS)[4]76~88分,平均(82.6±4.8)分;按照国际抗癌联盟TMN肿瘤分期标准[5]:Ⅱ期10例,Ⅲ期19例,Ⅳ期14例;按照美国肿瘤放疗协会组织(RTOG)分级标准[6]:2级15例,3级12例,4级16例;放疗形式:适形21例,调强22例。对照组男27例,女16例;年龄37.3~75.1岁,平均(54.3±12.2)岁;病理类型:腺癌26例,鳞癌17例;KPS评分75~86分,平均(83.2±4.58)分;TMN肿瘤分期标准:Ⅱ期11例,Ⅲ期21例,Ⅳ期11例;RTOG分级标准:2级10例,3级16例,4级17例;放疗形式:适形24例,调强19例。两组患者在性别、年龄、病理类型、肿瘤分期、RTOG分级及放疗形式等方面比较,差异无统计学意义(P>0.05),具有可比性。
1.2纳入及排除标准[7]纳入标准:(1)经纤维支气管镜活检、穿刺细胞学等病理组织学检查确诊为肺癌;(2)预生存期>6个月,KPS评分>70分,未行全肺切除手术;(3)放疗前经充分评估,均为初次放疗;(4)无放疗禁忌证,未出现远端转移者;(5)患者及家属知晓治疗过程风险,并签署知情同意书。排除标准:(1)合并高血压、细菌感染、糖尿病者;(2)严重慢性支气管炎、肺源性心脏病、肺气肿者;(3)放疗及激素应用禁忌者;(4)凝血功能异常、自身免疫性功能疾病或身体状况无法耐受者。
1.3方法
1.3.1治疗方法 两组患者入院后均行常规检查,包括胸部CT、肝功能、肾功能、肺功能、免疫功能、心电图、血糖、电解质等检查。参照RTOG标准对放疗前呼吸道症状进行评分,放疗采用三维适形放疗与调强放疗。对照组对靶区、食管、心脏、肺、脊髓等重要器官进行勾画,确定肿瘤靶区(GTV)、临床靶区(CTV)、计划靶区(PTV)。结合肺功能状态、危及器官受量,采用剂量体积直方图(DVH)与等剂量曲线进行综合评价,以确定治疗计划。适形、调强放疗采用3~5照射野治疗,放疗剂量45~70 Gy,其中小细胞癌剂量45~60 Gy,非小细胞肺癌95%CTV剂量60~70 Gy,每天每次2.0 Gy,每天5次。双肺接受20 Gy剂量照射的肺体积占全肺总体积的百分比(V20)<30%,双肺接受30 Gy剂量照射的肺体积占全肺总体积的百分比(V30)<20%,双肺接受5 Gy剂量照射的肺体积占全肺总体积的百分比(V5)<48%,心脏接受40 Gy照射的心脏体积占心脏总体积百分比(心脏V40)<50%,脊髓受量≤45 Gy。于放疗前、中给予铂类为基础两联化疗方案4个周期。观察组在对照组基础上给予注射用GSH(上海复旦复华药业有限公司,规格每支0.6 g,生产批号20141007)2支/次,每天1次,溶于0.9%氯化钠溶液100 mL,15 min静脉滴注。两组患者4周为1个疗程,连续治疗4个周期。
1.3.2观察指标 (1)比较两组患者近期临床疗效。(2)比较两组患者放射性肺炎及肺纤维化发生情况。(3)两组患者分别于放疗前、放疗45 Gy后采集空腹静脉血3 mL,静置30 min,采用湘仪离心机仪器有限公司生产台式L400离心机,以3 000 r/min离心10 min,将红细胞与血清分离,静析上清液置于-70 ℃冰箱内保存,待检;采用酶联免疫吸附试验检测IL-6、IL-10、TNF-α、TGF-β、ACE水平,试剂盒购自上海酶联生物科技有限公司,相关操作均严格按照说明书流程执行。
1.3.3疗效判定 根据WHO制定的相关标准[8]判定疗效。完全缓解(CR):所有靶病灶完全消失,未出现新病灶,维持>4周;部分缓解(PR):靶病灶最大径之和减少≥30%,维持>4周;稳定(SD):靶病灶最大径之和减少小于PR,或增大小于PD;进展(PD):靶病灶最大径之和至少增加≥20%,或出现新病灶。总有效率(RR)=CR+PR。
2 结 果
2.1两组患者近期临床疗效比较 观察组近期总有效率(76.7%)明显高于对照组(51.2%),差异有统计学意义(χ2=6.103,P<0.05),见表1。

表1 两组患者近期临床疗效比较[n(%)]
注:与对照组比较,*P<0.05
2.2两组患者放疗后放射性肺炎及肺纤维化发生情况比较 放疗后,观察组放射性肺炎发生率为20.9%,肺纤维化发生率为11.6%,明显低于对照组,差异有统计学意义(P<0.05),见表2。
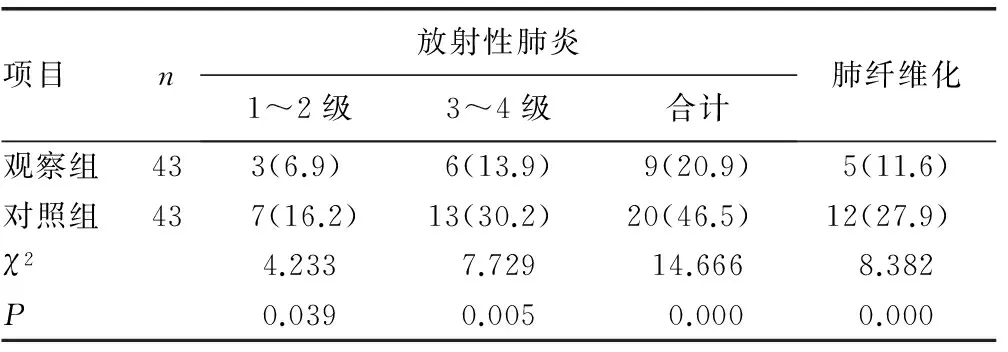
表2 两组患者放疗后放射性肺炎及肺纤维化发生情况比较[n(%)]
2.3两组患者放疗前后炎症介质水平变化情况 放疗后,两组患者IL-6、TNF-α、TGF-β水平明显降低,IL-10、ACE水平明显升高(P<0.05);两组间比较,观察组IL-6、TNF-α、TGF-β明显低于对照组,IL-10、ACE明显高于对照组,差异有统计学意义(P<0.05)。见表3。

表3 两组患者放疗前后炎症介质水平变化情况
注:与组内放疗前比较,aP<0.05;与对照组比较,bP<0.05
3 讨 论
肺癌是临床常见的恶性肿瘤之一,将近70%肺癌患者就诊时已进入中晚期,往往丧失最佳手术时机,病死率高,居恶性肿瘤首位[9]。临床上放化疗成为主要的治疗手段,其中放射性治疗最严重的并发症为放射性肺损伤,分为急性放射性肺炎与慢性肺纤维化,成为临床最常见的并发症之一,严重影响患者生存质量。放射性肺损伤主要以肺组织间质性无菌性炎症为主要特征,直接或间接产生细胞因子的病理过程,一旦发生往往难以逆转,因此如何有效预防显得尤为重要[10]。当肺部组织受到一定剂量的照射即发生靶细胞损伤,诱发一系列细胞因子合成增加,炎症介质在细胞内相互传递,导致肺组织损伤。张文珏等[11]研究显示,放射性肺损伤是由多种细胞因子共同存在,相互作用调节的复杂病理过程。有研究显示,放射性肺损伤发生与IL-6、TNF-α、TGF-β、IL-10、ACE等细胞因子级联反应密切相关[12]。
临床研究显示,IL-6是重要的促炎性因子,参与放射性肺损伤进展,主要由肺泡巨噬细胞、肺泡Ⅱ型上皮细胞、T细胞和肺成纤维细胞产生[13]。TNF-α是炎性反应的重要细胞因子,在放射性肺损伤的发生与进展中起到重要作用。一项动物实验在大鼠放射性肺损伤模型中进行放射性治疗,结果显示TNF-α表达随着放疗时间延长呈增加趋势,于12 h后达到峰值,以后逐渐降低,放疗4~8周后再次上升,16周后逐渐降低[14]。TGF-β对细胞生长、分化及免疫功能具有重要的调节作用。王玉祥等[15]研究亦表明,肺癌患者进行放疗后,TGF-β表达于48 h至24周呈逐步增加趋势。GSH是人类细胞中自然合成的三肽,广泛分布于人体各器官,具有保护细胞膜,减轻细胞损伤,起到修复与维持细胞生物功能的作用。临床常用于减轻放疗所引起的放射性黏膜炎、神经毒性或心肌毒性。本研究结果证实,对照组接受放疗治疗后IL-6、TNF-α、TGF-β水平明显升高,而观察组在此基础上应用GSH可有效降低IL-6、TNF-α、TGF-β水平,提示GSH可降低放射性肺损伤的发生。IL-10为一种重要的多功能负性调节因子,由活化B细胞、Th2细胞、巨噬细胞及单核细胞所产生,是机体最重要的抗炎性细胞因子,在放射性损伤中具有负反馈作用,起到抑制放射性肺损伤发生的作用。ACE水平可反映血管内皮细胞功能,属于血管内皮细胞的一种外肽酶。相关研究发现,肺癌治疗过程中肺组织ACE表达与放射性肺损伤相关,ACE活性表达降低,肺部损伤越严重,治愈率就越低,死亡风险越大[16]。本研究结果亦证实,观察组在对照组基础上应用GSH可明显提高IL-10、ACE表达水平,提示GSH能调节IL-10释放,提高ACE水平表达,减轻炎症介质损伤。
在放射性肺炎及肺纤维化发生率方面,本研究结果发现,观察组明显低于对照组,提示GSH能够降低放射性肺损伤发生率,与其调节IL-6、TNF-α、TGF-β、IL-10、ACE等细胞因子的表现相一致。另外值得注意的是,本次研究结果亦显示出观察组患者的近期总有效率(76.7%)明显高于对照组(51.2%),究其原因可能与GSH的细胞膜保护功能有关,能够有效减轻细胞损伤,降低炎性反应,对于肺癌的治疗也有一定的促进作用,但其具体机制尚需进一步研究。
综上所述,GSH用于局部晚期肺癌患者放疗辅助治疗中,能降低放射性肺损伤的发生,减轻炎性反应,提高肿瘤局部控制率,具有良好的临床应用价值。
[1]WU G,LI H,JI Z,et al.Inhibition of autophagy by autophagic inhibitors enhances apoptosis induced by bortezomib in non-small cell lung cancer cells[J].Biotechnol Lett,2014,36(6):1171-1178.
[2]CHANG S H,MIRABOLFATHINEJAD S G,KATTA H,et al.T helper 17 cells play a critical pathogenic role in lung cancer[J].Proc Natl Acad Sci USA,2014,111(15):5664-5669.
[3]PALMA D A,SENAN S,OBERIJE C,et al.Predicting radiation pneumonitis after chemoradiation therapy for lung cancer:an international individual patient data meta-analysis[J].Int J Radiat Oncol Biol Phys,2013,85(2):444-450.
[4]麻宏亮,张洪涛.化疗联合中药对中晚期非小细胞肺癌患者免疫功能和KPS评分的影响[J].海南医学,2014,25(15):2271-2272.
[5]张用,毕建平,皮国良,等.国际肺癌研究协会第八版国际肺癌TNM分期修订稿解读[J].肿瘤防治研究,2016,43(4):313-318.
[6]Verhoven B,Yan Y,Ritter M,et al.Ki-67 is an Independent Predictor of Metastasis and Cause-Specific Mortality for Prostate Cancer Patients Treated on Radiation Therapy Oncology Group(RTOG) 94-08[J].Int J Radiat Oncol Biol Phys,2013,86(2):317-323.
[7]王刚,张茜,张延京,等.肿瘤标志物的联合检测在肺癌诊断中的价值[J].中华实验和临床病毒学杂志,2015,29(6):537-539.
[8]杨欣,林冬梅.2015版WHO肺癌组织学分类变化及其临床意义[J].中国肺癌杂志,2016,19(6):332-336.
[9]姚晓军,刘伦旭.肺癌的流行病学及治疗现状[J].现代肿瘤医学,2014,22(8):1982-1986.
[10]王丽军,王朝娟,宋润珞,等.个性化护理对放化疗肺癌患者生活质量的影响[J].实用医学杂志,2013,29(1):135-137.
[11]张文珏,周宗玫,陈东福,等.广泛期小细胞肺癌化疗后脑预防照射及颅外病变放疗的Ⅱ期临床研究[J].中华放射肿瘤学杂志,2013,22(5):365-368.
[12]李超,陈桂明,彭冰,等.还原型谷胱甘肽对肺癌放疗患者急性放射性肺炎及相关细胞因子水平的影响[J].广东医学,2016,37(17):2597-2600.
[13]王谨,包勇,庄婷婷,等.非小细胞肺癌同期放化疗后重度急性放射性肺炎的预测模型研究[J].中华放射肿瘤学杂志,2013,22(6):455-459.
[14]孙万良,魏丽,张晶,等.EGCG对大鼠放射性肺损伤的防治作用及机制探索[J].生物技术通讯,2013,24(4):504-509.
[15]王玉祥,田丹丹,邱嵘,等.Ⅲ期非小细胞肺癌三维适形放疗所致放射性肺炎的影响因素[J].肿瘤防治研究,2014,41(12):1307-1312.
[16]沙莎,王茂玉,邹卫卫,等.血浆TNF-α、IL-6水平及 DVH 参数与局部晚期非小细胞肺癌放射性肺损伤相关性分析[J].现代中西医结合杂志,2014,23(33):3670-3674.
