乙型肝炎病毒感染者疾病进展程度与宿主CYP3A5和MDR1基因多态性研究*
2018-01-15杨旭洁卢永杰吴晓娟苏真珍
杨旭洁,卢永杰,陈 捷,吴晓娟,苏真珍,蔡 蓓
(四川大学华西医院实验医学科,成都 610041)
据世界卫生组织(WHO) 统计,全世界大约有20亿以上的人感染了乙型肝炎(乙肝)病毒(HBV),其中约有3.6亿为慢性乙肝,10%~20%可发展为肝硬化,1%~5%可发展为肝癌[1]。肝脏是人体的代谢器官,一些与药物代谢及转运有关的物质,比如细胞色素氧化酶P450(CYP450)和P-糖蛋白(P-gp)如果出现异常,将影响外源性和内源性有害物质的代谢,进而可能影响疾病的发展。CYP450主要有CYP1、CYP2、CYP3家族,其中CYP3A5是CYP家族中活性最强的酶之一[2]。P-gp由多药耐药基因(MDR1)编码,其生理作用是保护细胞免受毒物及代谢产物损害[3]。宿主遗传背景不同,这些与药物代谢和转运有关的物质也会有差异,这可能会导致宿主的疾病进展不同。本文探讨宿主遗传背景即CYP3A5和MDR1基因型与乙肝患者病程进展的关系,现报道如下。
1 资料与方法
1.1一般资料 收集本院2016年1-11月就诊的HBV感染患者共524例,其中慢性乙肝187例(慢性乙肝组),乙肝性肝硬化163例(乙肝肝硬化组),乙肝性肝癌174例(乙肝肝癌组)。诊断根据《慢性乙型肝炎防治指南》2015年制订的标准、《乙肝相关肝硬化诊疗规范专家共识2014》及《美国肝病研究学会指南》在乙肝相关肝癌诊断中的验证及诊断标准[4]。慢性乙肝组男女比例17∶9,年龄24~63岁、中位年龄43岁;乙肝肝硬化组男女比例17∶10,年龄37~70岁、中位年龄52岁;乙肝肝癌组男女比例27∶8,年龄27~68岁、中位年龄48岁。纳入的研究对象在年龄、性别比方面比较,差异无统计学意义(P>0.05),具有可比性。临床资料及标本的获取经华西伦理委员会审议通过。
1.2方法
1.2.1DNA提取 采用北京百泰克生物技术有限公司提供的全血基因组DNA快速提取试剂盒(离心柱型)提取标本DNA。收集上述患者外周血标本,取200 μL放入1.5 mL离心管;加入20 μL蛋白酶K(20 mg/mL)溶液,室温放置15 min(期间颠倒混匀几次);加入200 μL 结合液CB,立刻剧烈颠倒轻摇,充分混匀,70 ℃放置10 min;加入100 μL异丙醇(陈旧血加200 μL异丙醇),剧烈颠倒轻摇,充分混匀;将上一步所得溶液和絮状沉淀都加入一个吸附柱Ⅵ中(吸附柱放入收集管中),10 000 r/min离心30 s,弃废液;加入500 μL抑制物去除液IR,12 000 r/min 离心30 s,弃废液;加入500 μL漂洗液WB(已加入无水乙醇的WB),12 000 r/min离心30 s,弃废液;加入500 μL漂洗液WB,12 000 r/min离心30 s,弃掉废液;将吸附柱Ⅵ放回空收集管中,13 000 r/min离心2 min。取出吸附柱Ⅵ,放入一个干净的离心管中,在吸附膜的中间部位加100 μL洗脱缓冲液EB(洗脱缓冲液事先在 65~70 ℃水浴中预热),室温放置3~5 min,12 000 r/min离心1 min;将得到的溶液重新加入离心吸附柱中,室温放置2 min,12 000 r/min离心1 min;DNA分装并放置在-80 ℃。
1.2.2聚合酶链反应(PCR)反应和基因型检测 采用罗氏MIX试剂和Lightcycler480进行PCR扩增和产物的基因型检测。引物序列如下,CYP3A5(6986A>G) 正向:ACC ACC CAG CTT AAC GAA TG,CYP3A5(6986A>G)反向:TTG TAC GAC ACA CAG CAA CCT;MDR-1(3435C>T)正向:GCT GAG AAC ATT GCC TAT GGA,MDR-1(3435C>T)反向:GCA TGT ATG TTG GCC TCC TT。反应体系组成:1 μL DNA标本,0.5 μL正向引物,0.5 μL反向引物,1.4 μL荧光染料(EVA-GREEN),0.5 μL底物,0.2 μL Taq酶,2 μL缓冲液,1 μL 50 mmol/L MgCl2。反应条件及过程:先95 ℃孵育15 min,接着完成95 ℃×10 s,60 ℃×15 s,72 ℃×20 s,共计50个循环,接着95 ℃孵育1 min,40 ℃孵育1 min,65 ℃孵育1 s,最后以0.01 ℃/s加热到95 ℃。
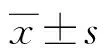
2 结 果
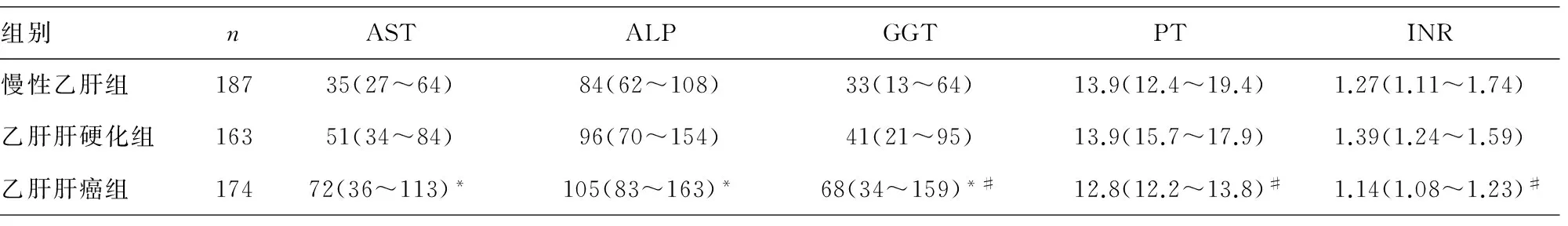
2.1各组肝功能及凝血指标检测结果 慢性乙肝组与乙肝肝硬化组的丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)、碱性磷酸酶(ALP)、γ-谷氨酰转移酶(GGT)、凝血酶原时间(PT)、国际标准化比值(INR)、活化部分凝血活酶时间(APTT)、纤维蛋白原(FIB)、甲胎蛋白(AFP)水平差异无统计学意义(P>0.05),总蛋白(TP)、清蛋白(ALB)、总胆红素(TB)、直接胆红素(DB)、HBV脱氧核糖核酸(HBV-DNA)水平差异有统计学意义(P<0.05);慢性乙肝组与乙肝肝癌组的TB、ALT、PT、INR、APTT水平差异无统计学意义(P>0.05),TP、ALB、DB、AST、ALP、GGT、FIB、AFP、HBV-DNA水平差异有统计学意义(P<0.05);乙肝肝硬化组与乙肝肝癌组的AST、ALP、HBV-DNA水平差异无统计学意义(P>0.05),ALB、TB、DB、ALT、GGT、PT、INR、APTT、FIB、AFP水平差异有统计学意义(P<0.05)。见表1。

表1 各组肝功能及凝血指标检测结果[M(P25~P75)]
组别nASTALPGGTPTINR慢性乙肝组18735(27~64)84(62~108)33(13~64)13.9(12.4~19.4)1.27(1.11~1.74)乙肝肝硬化组16351(34~84)96(70~154)41(21~95)13.9(15.7~17.9)1.39(1.24~1.59)乙肝肝癌组17472(36~113)*105(83~163)*68(34~159)*#12.8(12.2~13.8)#1.14(1.08~1.23)#

组别nAPTTFIBAFPHBV-DNA慢性乙肝组18732.5(30.5~32.7)1.67(1.55~1.79)7.88(3.20~15.1)1.21E+5(2.92E+4~1.21E+6)乙肝肝硬化组16337.5(32.1~43.0)1.72(1.2~2.3)3.83(1.99~8.09)1.04E+3(1.00E+3~5.80E+4)*乙肝肝癌组17429.7(27.0~33.7)#3.09(2.42~3.92)*#64.60(4.67~738.35)*#1.01E+3(1.00E+3~9.9E+3)*
注:与慢性乙肝组比较,*P<0.05;与乙肝肝硬化组比较,#P<0.05
2.2各组间CYP3A5基因分布频率 CYP3A5等位基因GG、AG、AA的分布频率分别在慢性乙肝组和乙肝肝硬化组、慢性乙肝组和乙肝肝癌组间的差异有统计学意义(P<0.05),而乙肝肝硬化组和乙肝肝癌组的等位基因分布频率差异无统计学意义(P>0.05)。见表2。
2.3各组间MDR1 C3435T基因分布频率 MDR1 C3435T的等位基因CT、CC分布频率在慢性乙肝组和乙肝肝硬化组、乙肝肝硬化组和乙肝肝癌组间的差异有统计学意义(P<0.05),而在慢性乙肝组和乙肝肝癌组间差异无统计学意义(P>0.05)。见表3。

表2 各组间CYP3A5基因分布频率比较[n(%)]
注:与慢性乙肝组比较,△P<0.05

表3 各组间MDR1 C3435T基因分布频率比较[n(%)]
注:与乙肝肝硬化组相比,*P<0.05
3 讨 论
慢性乙肝在我国发病率较高,HBV感染后部分患者发展为慢性肝炎,并可发展成肝硬化和肝癌,进程不一,药物治疗的反应个体差异亦很大[5]。已知HBV感染后的疾病进展与黄曲霉素、生活方式、环境和遗传等因素有关[6]。一些与药物代谢及转运有关的物质(如CYP450和P-gp)如果出现异常,将影响外源性和内源性有害物质的代谢,进而影响疾病的发展。环境因素特别是接触黄曲霉素与肝癌的发生密切相关,研究显示,CYP3A5可代谢黄曲毒素B1成为致突变物黄曲毒素B1-外-8,9-环氧化物[7],后者是肝细胞癌的主要危险因子。
CYP450广泛分布于人体各器官组织中,在肝脏中水平最丰富。编码CYP3A的基因位于人类第7号染色体q21.3-22.1。人类共有18个CYP450基因家族和43个亚家族,涉及多数药物代谢的酶系主要有CYP1、CYP2、CYP3家族。其中CYP3A 亚家族成员作用尤为突出,水平最多、底物谱大,是药物代谢反应中最主要的限速酶[8]。在CYP3A家族主要有4种基因亚型参与药物代谢:CYP3A4、CYP3A5、CYP3A7 及CYP3A43。其中CYP3A5是CYP4503 A家族中活性最强的酶之一。CYPs主要负责内源性底物、外源性物质和许多其他合成化学物质的代谢[9]。
近年来,大量文献报道CYP3A5基因多态性与肿瘤发生有相关性。CYP3A5催化许多前致癌物转化成终致癌物,被认为在各种癌症易感性中起重要作用。前已述及,CYP3A5可代谢黄曲毒素成为一种致突变物,这种物质是肝细胞癌的主要危险因子,故CYP3A5的遗传多态性可影响个体患肝细胞癌的风险[10]。
本试验通过比较慢性乙肝组与乙肝肝硬化组以及乙肝肝癌组的CYP3A5基因分布频率,发现慢性乙肝与乙肝肝硬化、乙肝肝癌组基因分布频率不同,慢性乙肝组的A基因分布频率明显低于乙肝肝硬化组和乙肝肝癌组,而G基因频率明显高于乙肝肝硬化组和乙肝肝癌组。由于CYP3A5与黄曲霉菌代谢有关,同样是感染HBV后,含有CYP3A5 G基因的人体内的CYP3A5不能将黄曲霉菌转化为代谢物形式,进展为肿瘤的危险性相对较小,所以突变型G成为保护性基因,而含A基因的个体进展为肝硬化或肝癌的危险性较高。
人类MDR1位于第7号染色体长臂上,含有28个外显子,全长为4.5 kb,含有一个开放读框,编码1 280个氨基酸多肽,经糖基化后形成170×103的膜糖蛋白(P-gp)。研究报道MDR1 C3435T与MDR1基因的蛋白产物P-gp功能密切相关[11]。近年来研究发现,MDR1 多态性不仅是影响肿瘤患者对化疗药物反应的重要遗传因素,也与患者对疾病的易感性及临床表现有关[12]。MDR1 C3435T 基因多态性与白血病、结直肠癌、肾细胞癌、乳腺癌、神经胶质瘤、鼻咽癌、胃癌等恶性肿瘤易感性的相关性研究已有报道[13],在肝癌方面的研究尚少见报道。
本试验通过比较慢性乙肝组与乙肝肝硬化组、乙肝肝癌组的MDR1 C3435T基因分布频率,发现MDR1 C3435T的等位基因CT、CC分布频率在慢性乙肝组和乙肝肝硬化组、乙肝肝硬化组和乙肝肝癌组间的差异有统计学意义(P<0.05),而在慢性乙肝组和乙肝肝癌组间差异无统计学意义(P>0.05)。提示药物代谢相关的基因突变可能与HBV感染后进展至肝癌的风险有关,而药物转运相关的基因突变虽然与疾病进展有相关性,但本试验未发现MDR1 C3435T与肝癌风险有相关性,也不排除由于其他因素(比如性别、年龄等)导致试验结果的不准确,所以尚需做进一步研究。
[1]XU W,YU J,WONG V W.Mechanism and prediction of HCC development in HBV infection[J].Best Pract Res Clin Gastroenterol,2017,31(3):291-298.
[2]ZHOU J,WEN Q,LI S F,et al.Significant change of cytochrome P450s activities in patients with hepatocellular carcinoma[J].Oncotarget,2016,7(31):50612-50623.
[3]BRAMBILA-TAPIA A J.MDR1(ABCB1) polymorphisms:functional effects and clinical implications[J].Rev Invest Clin,2013,65(5):445-454.
[4]王贵强,王福生,成军,等.慢性乙型肝炎防治指南:2015年更新版[J].临床肝胆病杂志,2015,31(12):1941-1960.
[5]NOSRATABADI R,ALAVIAN S M,ZARE-BIDAKI M,et al.Innate immunity related pathogen recognition receptors and chronic hepatitis B infection[J].Mol Immunol,2017,90:64-73.
[6]RAPISARDAV,LORETOC,MALAGUARNERAM,etal.Hepatocellularcarcinomaandtheriskofoccupationalexposure[J].WorldJHepatol,2016,8(13):
573-590.
[7]BAHARI A,MEHRZAD J,MAHMOUDI M,et al.Cytochrome P450 isoforms are differently up-regulated in aflatoxin B1-exposed human lymphocytes and monocytes[J].Immunopharmacol Immunotoxicol,2014,36(1):1-10.
[8]CHEN H,SHEN Z Y,XU W,et al.Expression of P450 and nuclear receptors in normal and end-stage Chinese livers[J].World J Gastroenterol,2014,20(26):8681-8690.
[9]DALY A K.Polymorphic variants of cytochrome P450:relevance to cancer and other diseases[J].Adv Pharmacol,2015,74:85-111.
[10]NIU Y,WU Z,SHEN Q,et al.Hepatitis B virus X protein co-activates pregnane X receptor to induce the cytochrome P450 3A4 enzyme,a potential implication in hepatocarcinogenesis[J].Dig Liver Dis,2013,45(12):1041-1048.
[11]STANKO G,KAMINSKI M,BOGACZ A,et al.The importance of G2677T/A and C3435T polymorphisms of the MDR1 gene in the aetiology of colorectal cancer[J].Prz Gastroenterol,2016,11(1):35-40.
[12]LI H,WANG B,CHANG C,et al.The roles of variants in human multidrug resistance(MDR1) gene and their haplotypes on antiepileptic drugs response:a meta-analysis of 57 studies[J].PLoS One,2015,10(3):e0122043.
[13]WU D D,ZHANG J X,LI J,et al.Lack of association of the MDR1 C3435T polymorphism with susceptibility to gastric cancer and peptic ulcer:a systemic review and meta-analysis[J].Asian Pac J Cancer Prev,2014,15(7):3021-3027.
