HIV在人体免疫网络中传播的动力学研究
2018-01-13黄颖,娄洁
黄 颖,娄 洁
获得性免疫缺陷综合症(acquired immvne def i ciency syndrome,AIDS),也称艾滋病,是由人类免疫缺陷病毒(human immunodef i ciency virus,HIV)引起的恶性传染病.目前,AIDS已是一个全球性的公共卫生问题.研究发现,接受高效联合抗逆转录病毒疗法(highly active antire trorival therapy,HAART)的HIV患者的共同特征是持续低水平的病毒血症[1].这就提出了一个重要的问题:是否某些组织具有某种特殊生理结构,如大脑中的血脑屏障或睾丸中的血睾屏障,使得大部分的药物无法穿透屏障,从而导致它们成为患者在接受治疗期间病毒持续产生的储存库,或称HIV病毒的避难所[1].
HIV病毒的靶细胞是淋巴细胞,而淋巴细胞能够在淋巴组织和非淋巴组织之间再循环.再循环是一个复杂的过程.简言之,淋巴细胞从血液进入淋巴结或粘膜淋巴组织,然后再次回到血液,穿过隔离系统形成免疫监视和免疫功能的基础.当遇到抗原,静息的淋巴细胞被激活,并大量复制.激活的淋巴细胞从脾脏和淋巴结进入血液,然后再从血液进入其他的淋巴组织和非淋巴组织,对抗原实施杀伤作用.
在淋巴组织和血液中,感染的细胞会产生大量的HIV感染性病毒颗粒[2-3].一旦个体被感染,HIV病毒就会通过血液循环进入到身体各处.由于血液中病毒易于检测,通常卫生部门会通过血液中的HIV浓度来量化感染者体内的病毒载量情况.由于大部分组织中的病毒载量难以检测,血液中的病毒载量能否准确地说明其他组织中的病毒载量尚无定论.研究发现,接受抗病毒治疗时,血浆病毒水平较低或几乎检测不到[4-5],而通过细胞培养或聚合酶链式反应(polymerase chain reaction,PCR)技术仍然在精液中发现了病毒的存在.这表明,一些药物无法穿透血睪屏障并降低感染者传播HIV的能力[6-7].因此,许多感染个体的外周血自由病毒的水平并不能正确地反映身体内正在发生的状况[6].
本工作旨在探讨大脑等器官是否为HIV病毒的储存库,以及血液中HIV的浓度能否代表身体其他组织的病毒水平.
1 模型
Callaway等[8]提出了HIV病毒动力学模型,考虑了两个组织间的病毒传播问题.但考虑到淋巴细胞再循环,尤其是体内不同的淋巴组织、血液和大脑(或睾丸)等组织构成的网络,本工作建立了一个改进的HIV病毒动力学模型,描述了各淋巴细胞以及HIV病毒在体内网络中的分布情况.模型假设如下:对于第i个器官(组织、血液、睾丸或大脑),Ti表示易感的CD4+T细胞,表示已经被HIV感染的T细胞,表示慢性感染T细胞,Vi表示HIV病毒载量,则在HAART下各类细胞和病毒的动力学方程为
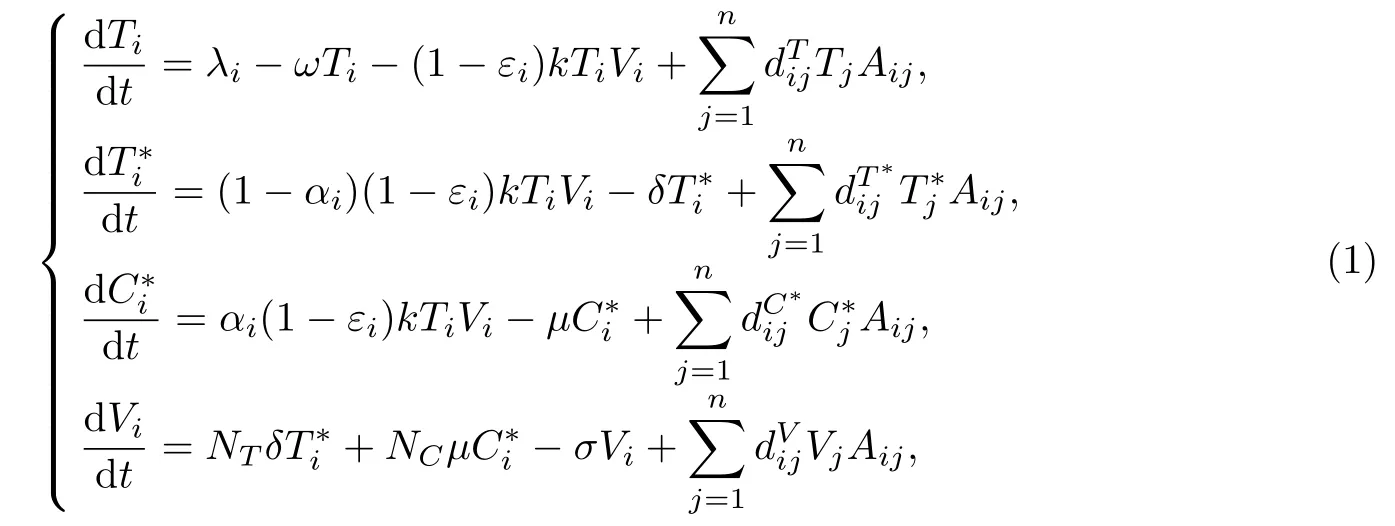
式中:i=1,2,···,n,n=200,并约定i=1表示血液系统,i=200表示大脑系统,其他表示组织,如淋巴结、脾脏等;常数λi表示易感细胞的来源,ω为死亡率,常数k为感染率,αi为感染细胞变为记忆感染细胞的比例;常数µ为记忆感染细胞死亡率,δ为感染细胞的死亡率;NT,NC分别为T∗和C∗产生病毒颗粒的平均数量;σ是病毒清除率,εi表示药物效果,0≤εi≤1;分别表示T,T∗,C∗和V细胞从i到j的传播率,为了方便起见,简写为dT,dT∗,dC∗,dV.细胞和病毒在血液、组织和大脑之间的传播受常数dT,dT∗,dC∗和dV以及矩阵A影响.A=G−M表示允许传播交换,其中G是传播网络的邻接矩阵,如果细胞或病毒被允许从j到i,则定义Gij=1,对角矩阵M为移出矩阵,忽略传播过程中病毒或细胞的出生率和死亡率,矩阵G和M分别为
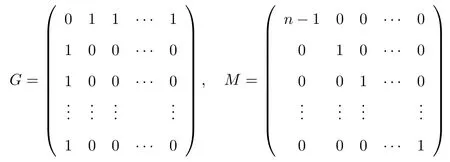
2 理论结果
为了找到模型(1)的无病平衡点,考虑
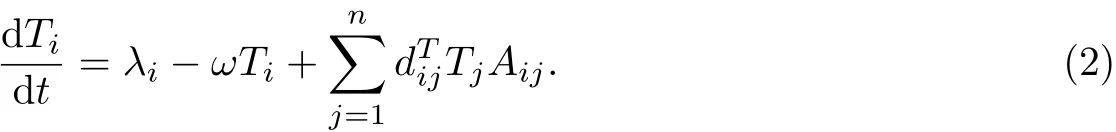
式(2)可改写为

式中,T=(T1,T2,···,Tn)T,λ =(λ1,λ2,···,λn)T,矩阵Θ 为
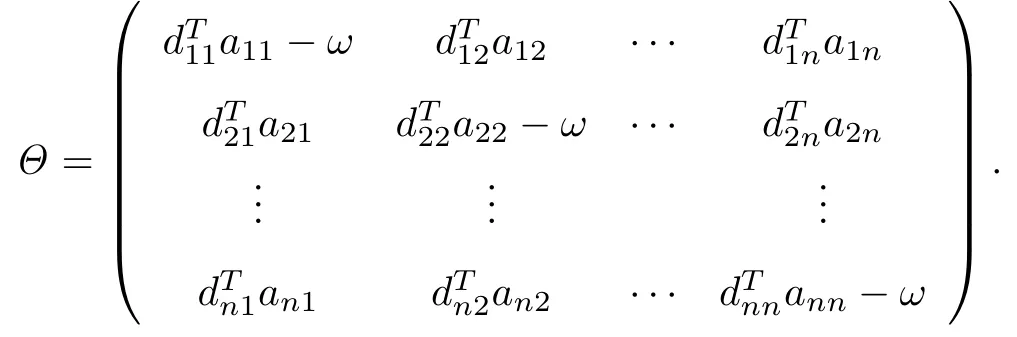
显然,模型(2)存在正平衡点~T,且有
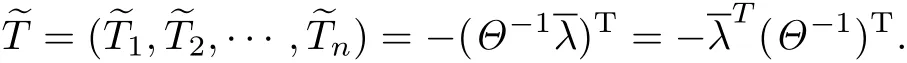
如果矩阵Θ的所有特征值均具有负实部,则容易证明正平衡点~T是局部渐近稳定的,即有
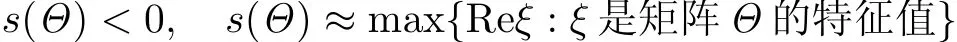
成立.
模型(1)有唯一的无病平衡点E0=(~T,0,0,0),这里0表示n维零向量.
对于无病状态E0,线性化模型(1)中的感染类T∗,C∗,V可表示为
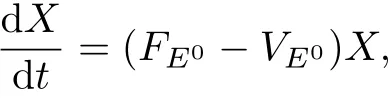
式中:
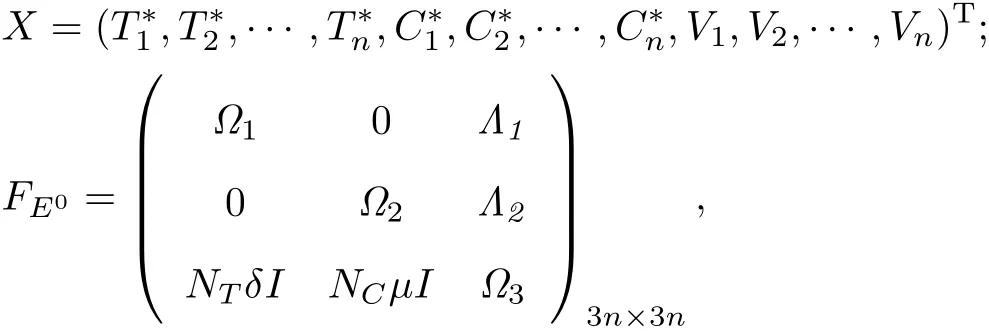
其中I是n×n的单位矩阵,且有

利用“再生矩阵”方法[9],可求得基本再生数R0,
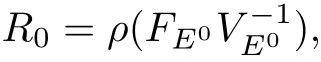
定理1 当s(Θ)<0时,若R0<1,则无病平衡点E0是局部渐近稳定的;若R0>1,则E0是不稳定的.
定理1表明:当R0<1时,个体内的HIV-1不会持续存在;反之,感染将持续存在.
3 数值模拟
由于不同个体内的参数值不确定,需对每一个参数使用拉丁超立方体(Latin hypercube)抽样[10],给定每个不确定参数的概率密度函数.本工作共模拟500次Latin hypercube抽样.
表1为改进的HIV病毒动力学模型的参数.按照表1给出的参数范围,500次Latin hypercube抽样下的基本再生数R0的均值为2.28(标准差:1.85;95%置信区间:2.04∼2.51;四分位区间:1.11∼2.78),表明即使感染个体接受有效的抗逆转录病毒疗法(antiretroviral therapy,ART),基本再生数R0也不可能小于1,即病毒无法从该个体内彻底清除.
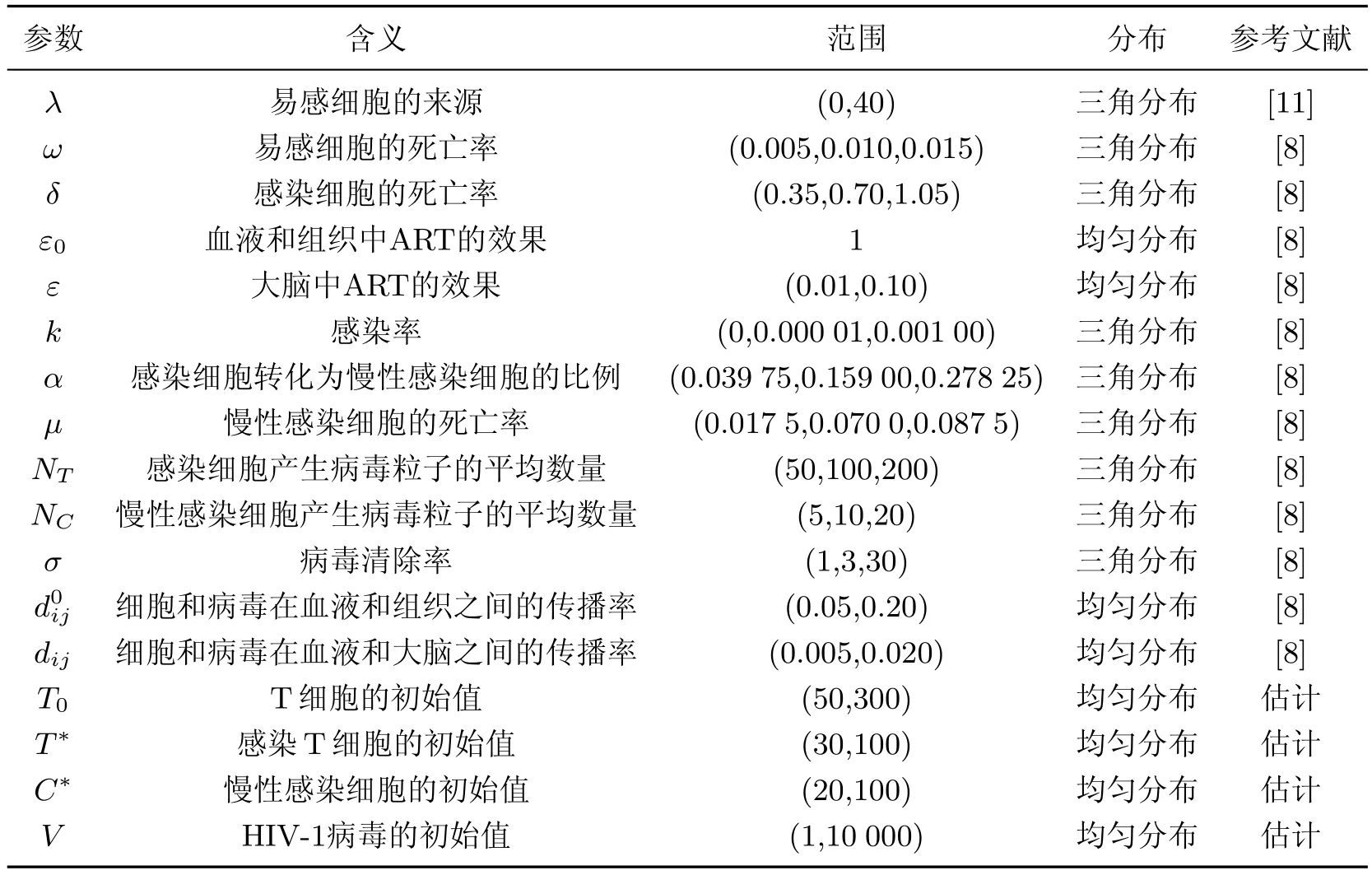
表1 改进的HIV病毒动力学模型的参数Table 1 Parameters of improved HIV virus dynamic model
假设在血液和组织中ε0=1,即药物疗效为100%,病毒复制被完全抑制.考虑到血脑屏障的存在,大脑中的ε在(0.01,0.10)内取值,其他参数取值见表1,则感染个体接受治疗后血液和大脑中健康T细胞和病毒载量的浓度变化分别如图1∼2所示.
由图1可以看出:ART治疗后,血液中健康CD4+T细胞的平均浓度减少,但随时间增加,浓度逐渐增大,两个月后达到480.0 Cells/mL;大脑中T细胞的平均值变化与CD4+T细胞类似,但是比血液低很多,最终为345.0 Cells/mL.淋巴组织中健康CD4+T细胞的平均浓度随时间增大,最终达到546 Cells/mL,比血液中高很多.因此,血液中淋巴细胞状况并不能体现它们在其他组织或器官中的状况.
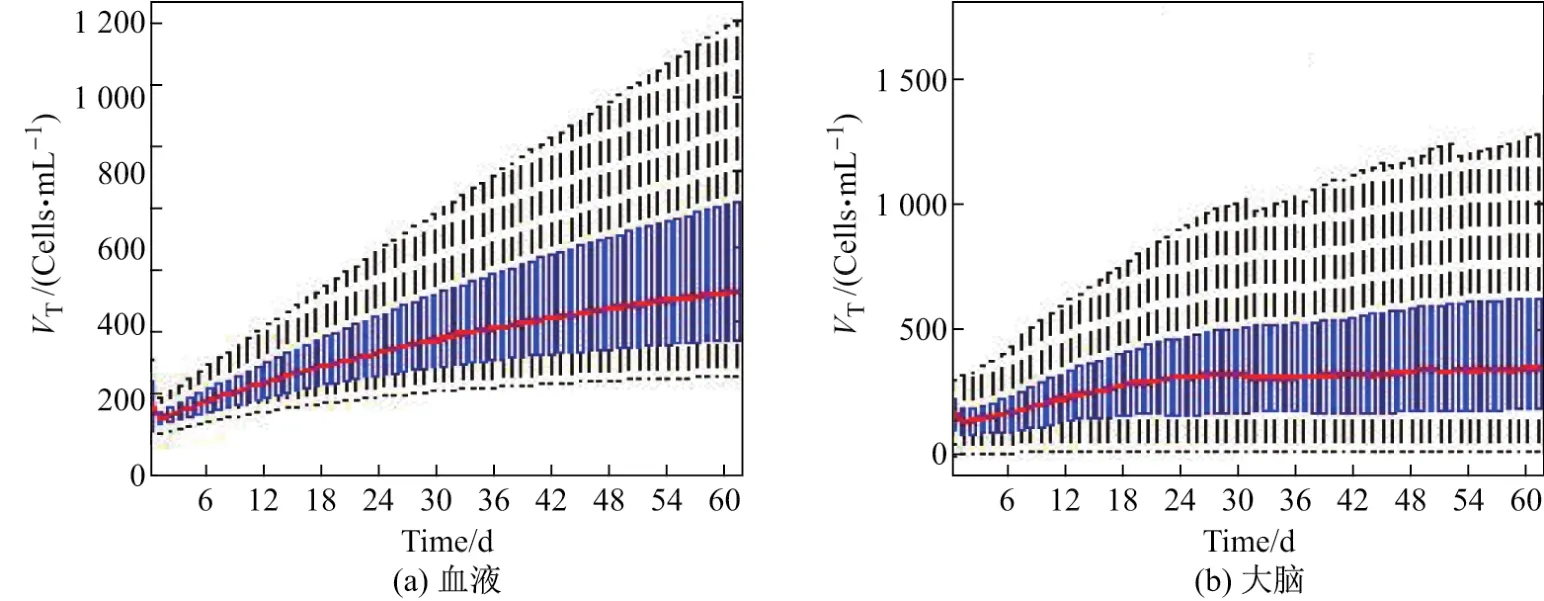
图1 感染个体治疗后血液和大脑中健康T细胞的浓度变化Fig.1 Concentraion of healthy T cells of HIV patients after ART in blood and in brain respectively
由图2可以看出,血液中病毒载量的平均浓度在治疗的初期按指数规律衰减,随着时间的增加,衰减的速度减慢,组织中病毒载量的平均浓度呈现类似的趋势.但是大脑内病毒载量的平均浓度的变化趋势与血液和其他组织不同,在初始的3周内病毒载量的平均浓度逐渐减小,随后却呈现增大态势,且最终稳定在一个较高的水平,平均约为84.3Cells/mL,比血液和组织中的HIV载量高得多.上述结果表明,外周血自由病毒水平并不能正确反映身体内其他组织中的状况[1].
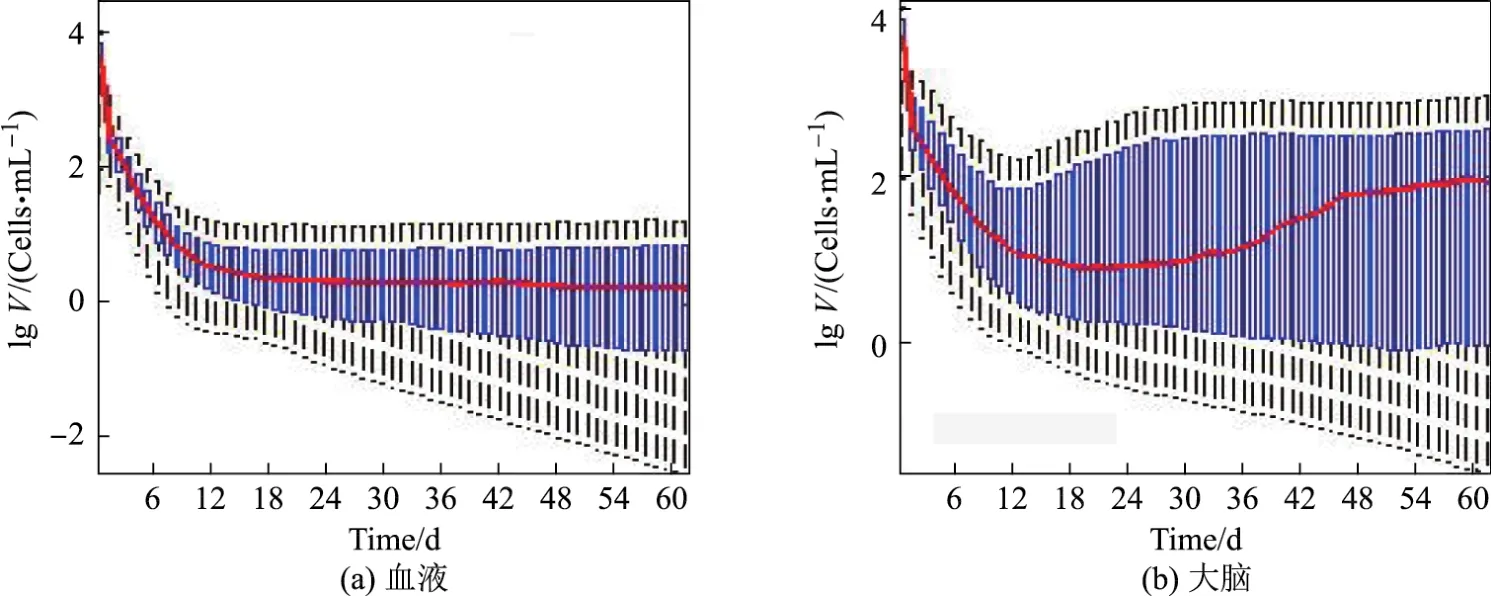
图2 感染个体治疗后血液和大脑中病毒载量的浓度变化Fig.2 Concentraion of of HIV virus of HIV patients after ART in blood and in brain respectively
4 讨论
Perelson等[12]研究了8个接受ART治疗的HIV感染者,研究结果发现,患者呈现的病毒衰变模式如下:治疗初期,病毒呈现快速指数衰减态势;接下来则呈现较慢的指数衰减.本工作发现了与之类似的规律.显然,在血液和组织中,接受2周治疗的患者的血浆病毒血症低于标准检测阈值50拷贝/mL,但大脑内的病毒载量最终会维持在一个较高的水平.这表明在常规检查中,即使外周血中的病毒水平已经检测不出,也不能随意停止HAART的治疗,以免个人免病毒载量发生反弹,导致耐药株产生并在宏观人群中传播.
[1]SHEN L,SILICIANO R F.Viral reservoirs,residual viremia,and the potential of highly active antiretroviral therapy to eradicate HIV infection[J].Journal of Allergy and Clinical Immunol,2008,122(1):22-28.
[2]PERELSON A S,ESSUNGER P,CAO Y,et al.Decay characteristics of HIV-1-infected compartments during combination therapy[J].Nature,1997,387(6629):188-191.
[3]HAASE A T,HENRY K,ZUPANCIC M,et al.Quantitative image analysis of HIV-1 infection in lymphoid tissue[J].Science,1996,274(5289):985-989.
[4]HAMED K A,WINTERS M A,HOLODNIY M.et al.Detection of human immunodef i ciency virus type 1 in semen:eあects of disease stage and nucleoside therapy[J].Journal of Infectious Diseases,1993,167(4):798-802.
[5]VERNAZZA P L,ERON J J,COHEN M S,et al.Detection and biologic characterization of infectious HIV-1 in semen of seropositive men[J].AIDS,1994,8(9):1325-1329.
[6]LEVY J A.HIV and the pathogenesis of AIDS[M].3rd ed.Washington:ASM Press,2007.
[7]BARkER C F,BILLINGHAM R E.Immunologically privileged sites[J].Advances in Immunology,1978,25:1-54.
[8]CALLAWAY D S,PERELSON A S.HIV-1 infection and low steady state viral loads[J].Bulletin of Mathematical Biology,2002,64(1):29-64.
[9]Van Den DRIESSCHE P,WATMOUGH J.Reproduction numbers and sub-threshold endemic equilibrium for compartmental models of disease transmission[J].Mathematical Biosciences,2002,180(1/2):29-48.
[10]BLOWER S M,GERSHENGORN H B,GRANT R M.A tale of two futures:HIV and antiretroviral therapy in San Francisco[J].Science,2000,287(5453):650-654.
[11]LOU J,LOU Y J,WU J H.Threshold virus dynamics with impulsive antiretroviral drug eあects[J].Journal of Mathematical Biology,2012,65(4):623-652.
[12]PERELSON A S,ESSVNGER P,CAO Y,et al.Decay characteristics of HIV-infected compartments during combination therapy[J].Nature,1997,387(6629):188-191.
