复方硝酸咪康唑氢化可的松软膏的体外透皮吸收研究
2018-01-12张明淋谢晓燕王雪敏卞君醒张自强何淑旺
张明淋,谢晓燕,王雪敏,卞君醒,张自强 ,何淑旺
(1.江苏省省级机关医院,南京 210024;2.南京泽恒医药技术开发有限公司,南京 210042;3.南京师范大学生命科学院,南京 210042;4.山东达因海洋生物制药股份有限公司,北京 100102)
皮炎湿疹合并感染,尤其是条件致病性真菌感染发病率很高,使得抗真菌药与皮质激素联合应用有极大的优势[1]。复方硝酸咪康唑氢化可的松软膏既具有抗真菌作用,也能使炎症症状快速消退,方便患者使用[2-4]。本研究建立了同时检测氢化可的松和硝酸咪康唑累计释药量的HPLC法,并通过Franz扩散池检测复方药物体外透皮情况,通过与参比制剂F2的计算,最终确定处方制剂[5-9]。
1 仪器与材料
1.1仪器 SPD-M20A高效液相色谱系统(包括LC-20A泵、SPD-M20A检测器,日本岛津公司);Agilent C18色谱柱 (150 mm×4.6 mm,5m);TK-12A透皮吸收仪(上海偕凯科技贸易有限公司)。
1.2试药 氢化可的松对照品(批号100152-200206),硝酸咪康唑对照品(批号100213-200706),均购自中国食品药品检定研究院;复方硝酸咪康唑氢化可的松软膏(自制,批号:160218-1,160218-3,160218-4,160218-5);参比制剂(Daktacort®ointment,Janssen-Cilag Ltd, BGB0Z0006-2014);乙腈为色谱纯;水为纯化水;其他化学试剂均为分析纯。
1.3动物 雄性小鼠,体质量20±2 g,由中国药科大学提供,合格证号:SYXK(苏):2012-0035。
2 方法与结果
2.1HPLC法验证
2.1.1色谱条件 参照英国药典BP-2013[10]“Miconazole and Hydrocortisone Ointment”,建立复方硝酸咪康唑氢化可的松软膏透皮释放度含量测定方法:色谱柱为Agilent C18色谱柱(150 mm×4.6 mm,5m);以0.01 mol·L-1的磷酸二氢铵溶液(用稀氨水调节pH值为6.0)为流动相A,乙腈为流动相B;以1.5 mL·min-1流速进行梯度洗脱;检测波长为235 nm;柱温为25 ℃;进样量为20L。洗脱程序见表1。
表1梯度洗脱程序
Tab.1 Gradient elution program

时间/min流动相A/%流动相B/%08020202080252080278020328020
2.1.2溶液的制备 对照品溶液:取硝酸咪康唑对照品25 mg,氢化可的松对照品12.5 mg,精密称定,置于50 mL量瓶中,加甲醇40 mL超声溶解,加水稀释定容至刻度,精密移取4 mL,置于100 mL量瓶中,加体积分数为20%的无水乙醇生理盐水定容至刻度,作为对照品溶液。
供试品溶液:取本品适量(含硝酸咪康唑25 mg,氢化可的松12.5 mg),精密称定,按照上述对照品溶液的配制方法进行配制,作为供试品溶液。
阴性供试品溶液:取空白辅料适量,按照上述对照品溶液的配置方法进行配制,作为阴性供试品溶液。
2.1.3专属性 取2.1.2项下制备的对照品溶液、阴性供试品溶液及空白透皮介质,按照2.1.1项下的色谱条件进行检测,记录色谱图。结果表明,空白溶剂和空白辅料均无干扰,此方法专属性良好,见图1。
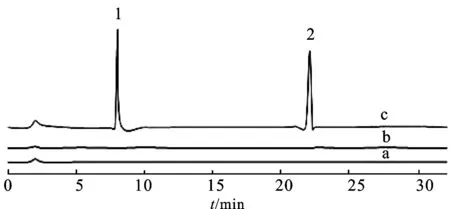
图1方法学专属性实验叠图
A.空白透皮介质;b.阴性供试品溶液;c.供试品溶液;1.氢化可的松;2.硝酸咪康唑。
Fig.1 The overlay of specific test in methodology
A.transdermal medium;b.negative sample solution;c.sample solution;1.hydrocortisone;2.miconazole nitrate.
2.1.4标准曲线 精密称取硝酸咪康唑25.12 mg,氢化可的松12.51 mg,按照2.1.2项下方法配制对照品储备液,分别取40 μL及0.4,2,4和5 mL,分别置于100 mL量瓶中,用体积分数为20%的乙醇生理盐水稀释至刻度,摇匀,各取20 μL进样,记录色谱图,以峰面积y对质量浓度x(mg·L-1)进行线性回归,绘制标准曲线,氢化可的松的线性方程为y=27 723x+1 712.3(r=0.999 5,n=5),表明氢化可的松质量浓度在0.10~12.51 mg·L-1范围内线性关系良好;硝酸咪康唑的线性方程为y=19 441x+798.52(r=0.999 6,n=5),表明硝酸咪康唑质量浓度在0.20~25.12 mg·L-1范围内线性关系良好。
2.1.5稳定性 精密移取对照品储备液适量,定量稀释制成含氢化可的松和硝酸咪康唑质量浓度分别为10和20 mg·L-1(完全释药率的10%)的溶液,室温放置,分别于0,6,12,24,48和72 h精密量取20 μL,注入液相色谱仪,记录色谱图,结果表明,72 h内氢化可的松与硝酸咪康唑的峰面积RSD值均小于2.0%,结果表明,供试品溶液室温放置72 h内稳定。
2.1.6重复性 取同一批号的复方咪康唑氢化可的松软膏,按照2.1.2项下方法分别平行配制6份供试品溶液进行测定。结果显示,复方硝酸咪康唑氢化可的松软膏中的硝酸咪康唑峰面积RSD值为1.25%,氢化可的松峰面积RSD值为1.27%,结果表明,该方法重复性良好。
2.1.7精密度 分别称取按处方比例制备的空白辅料混合物各12份,精密称定,3份1组,释药率在0.1%~10%范围内,分别向每组加入低、中、高质量浓度的对照品溶液,按照2.1.2项下方法配制供试品溶液,分别进样,记录色谱图,计算回收率,结果见表2,该方法精密度较好。
表2硝酸咪康唑和氢化可的松的加样回收率结果
Tab.2 The results of addition recoveries for hydrocortisone and miconazole nitrate
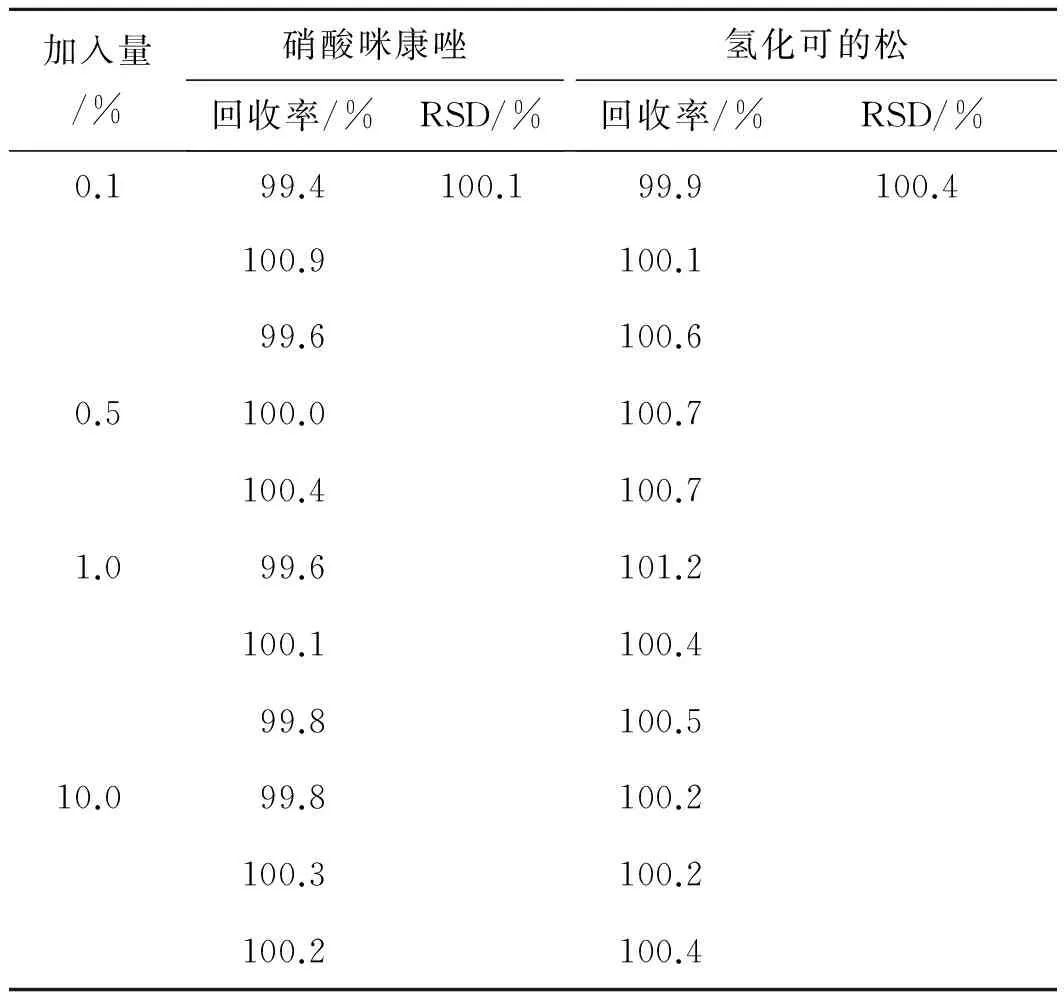
加入量/%硝酸咪康唑回收率/%RSD/%氢化可的松回收率/%RSD/%0.199.4100.199.9100.4100.9100.199.6100.60.5100.0100.7100.4100.71.099.6101.2100.1100.499.8100.510.099.8100.2100.3100.2100.2100.4
2.2溶解度考察 分别考察原料硝酸咪康唑和氢化可的松在质量浓度为9 g·L-1氯化钠、pH值为6.8的缓冲盐和体积分数为20%的乙醇生理盐水中的溶解情况,结果显示,氢化可的松在质量浓度为9 g·L-1氯化钠与pH值为6.8的缓冲盐中极微溶,在体积分数为20%的乙醇生理盐水中微溶,硝酸咪康唑在质量浓度为9 g·L-1氯化钠与体积分数为20%的乙醇生理盐水中极微溶,在pH值为6.8缓冲盐中几乎不溶,用HPLC法检测,结果显示,氢化可的松和硝酸咪康唑在17 mL(为立式扩散池,体积为17 mL)含体积分数为20%的乙醇生理盐水中能满足漏槽条件,故初步选择其为透皮介质。
2.3漏槽实验 取复方硝酸咪康唑氢化可的松软膏0.2 g,置于立式扩散池中,分别以质量浓度为9 g·L-1氯化钠、pH值为6.8缓冲盐和含体积分数为20%的乙醇生理盐水6 mL为透皮释放介质(n=6),转速为300 r·min-1,温度为37±0.5 ℃,30 h后,取样过滤,按照2.1.1项下色谱条件进行检测。结果表明,复方硝酸咪康唑氢化可的松软膏中的氢化可的松和硝酸咪康唑在体积分数为20%的乙醇生理盐水6 mL中能完全溶解,满足漏槽实验条件,在质量浓度为9 g·L-1的氯化钠、pH值为6.8的缓冲盐中不能完全溶解。因此,选择体积分数为20%的乙醇生理盐水作为透皮介质。
2.4透皮吸收实验 采用立式扩散池[11-16],以体积分数为20%的乙醇生理盐水为透皮介质,以离体小鼠皮为载体,转速为300 r·min-1,依法操作,经32 h,取适量溶液滤过,作为透皮吸收供试品溶液。
2.5计算方法 氢化可的松透皮释放度(%)=(A氢样×M氢×r氢×V样)÷(V对×A氢对×m×1%)×100%
硝酸咪康唑透皮释放度(%)=(A硝样×M硝×r硝×V样)÷(V对×A硝对×m×2%)×100%
注:A氢样:供试品溶液中氢化可的松的峰面积;A硝样:供试品溶液中硝酸咪康唑的峰面积;A氢对:对照品溶液中氢化可的松的峰面积;A硝对:对照品溶液中硝酸咪康唑的峰面积;M氢:氢化可的松对照品称样量;r氢:氢化可的松对照品含量;M硝:硝酸咪康唑对照品称样量;r硝:硝酸咪康唑对照品含量;V样:释放介质体积;V对:对照品溶液稀释体积;m:样品称样量。
2.6参比透皮通过率实验 取参比制剂Daktacort®cream适量,分别采用半透膜、小鼠皮(雄性小鼠,体质量为22±2 g,由江苏省实验动物中心提供)进行透皮通过率测定,取样时间为2,4,6,24和36 h,结果见图2。
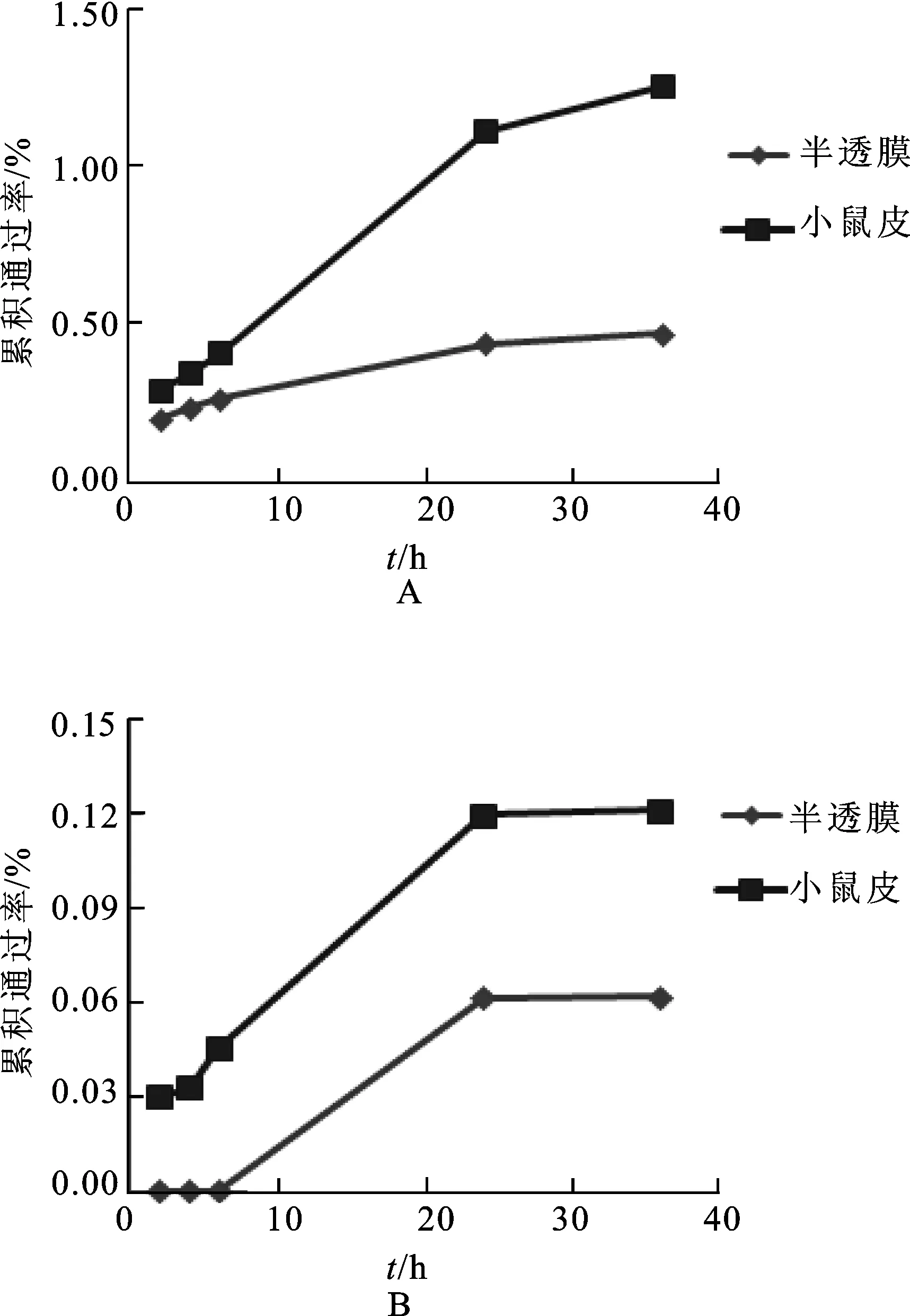
图2参比Daktacort®onimentde中氢化可的松和硝酸咪康唑的透皮通过率曲线
A.氢化可的松;B.硝酸咪康唑。
Fig.2 Transdermal curve of hydrocortisone and miconazole nitrate in Daktacort®onimentde
A.hydrocortisone;B.miconazole nitrate.
参比制剂采用半透膜和小鼠皮进行透皮通过率实验时,36 h内取样硝酸咪康唑和氢化可的松透皮通过率均小于2%,其中离体小鼠皮药物通过率高于半透膜,故选用其为透皮实验膜。
2.7处方研究 分别测定批号160218-1,160218-3,160218-4和160218-5的处方(处方160218-3,160218-4和160218-5分别为轻质液体石蜡的量从25%升至50%,白凡士林的量从70%降至35%,硬脂酸的量从5%升至15%),采用离体小鼠皮肤通过Franz扩散池进行药物渗透量测定,取样时间为2,4,6,24和36 h,计算各时间点累积通过率,并绘制曲线,与参比测定结果进行比较,筛选出与参比透皮通过率基本一致的处方[17-19]。实验结果见图3。
由实验结果可知,批号为160218-3的处方各时间点累积通过率与参比制剂基本一致,再结合处方开发的其他考察指标和参比制剂释放度进行F2一致性比较,因此选择批号为160218-3的处方为最佳处方。
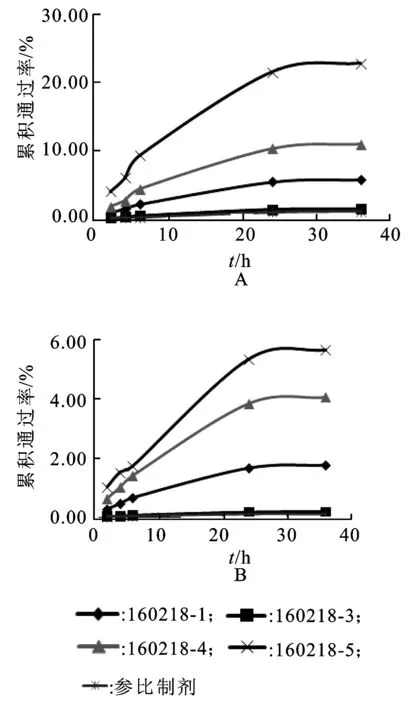
图3处方筛选中氢化可的松和硝酸咪康唑透皮累积通过率曲线
A.氢化可的松;B.硝酸咪康唑。
Fig.2 Transdermal curve of hydrocortisone and miconazole nitrate by formula optimization
A.hydrocortisone;B.miconazole nitrate.
3 讨论
复方硝酸咪康唑氢化可的松软膏作为仅在给药局部发挥作用的剂型,主要考察外用药物透过皮肤进入体内循环的渗透量,同时关注药物的局部安全性问题。本次实验考察了不同处方及参比制剂累积渗透量,由结果可知,该药物仅发挥局部作用,32 h皮肤通过率均小于2%,表明本供试品无全身吸收作用。
本文引入了口服固体释放F2因子比较法,比较不同处方和原研制剂的累积通过率,通过F2因子的比较很容易确定最佳释放的处方。
[1] Van Cutsem J M,Thienpont D.Miconazole,a broad-spectrum antimycotic agent with antibacterial activity[J].Chemotherapy, 1972, 17(6):392-404.
[2] 曹文冰, 肖爱英, 潘西海.复方硝酸咪康唑乳膏的制备工艺与质量标准研究[J].齐鲁药事, 2005, 24(2):114-115.
[3] El-Bagary R I,Elkady E F,Tammam M H,et al.Simultaneous determination of miconazole and hydrocortisone or mometasone using reversed phase liquid chromatography [J].Eur J Chem, 2012, 3(4):421-425.
[4] Salama I, Gomaa M S.Comparative determination of miconazole, nystatin, hydrocortisone and neomycin by HPTLC/HPLC-DAD[J].Eur J Chem, 2013, 63(1):29-34.
[5] Barr M.Percutaneous absorption[J].J Pharmaceut Sci, 1962, 51(5):395-409.
[6] Bronaugh R L, Stewart R F.Methods forinvitropercutaneous absorption studies.VI:Preparation of the barrier layer[J].J Pharm Sci, 1986, 75(5):487-491.
[7] Shadomy S, Paxton L, Espinel-Ingroff A,et al.Invitrostudies with miconazole and miconazole nitrate[J].J Antimicrob Chemother, 1977,3(2):147-152.
[8] Ahmed T A, El-Say K M, Mahmoud M F, et al.Miconazole nitrate oral disintegrating tablets:invivoperformance and stability study[J].AAPS Pharm Sci Tech, 2012, 13(3):760-771.
[9] Nafee N A, Ismail F A, Boraie N A, et al.Mucoadhesive buccal patches of miconazole nitrate:invitro/invivoperformance and effect of ageing[J].Int J Pharm,2003, 264(1/2):1-14.
[10]British Pharmacopoeia Commission.British Pharmacopoeia:2013[S].London:The Stationery Office, 2013:5729.
[11]陈铁锋, 余细勇, 林曙光,等.复方酮康唑的透皮吸收[J].中国现代应用药学, 2003, 20(2):134-137.
[12]渠莉.复方甲氨蝶呤软膏中甲氨蝶呤的体外透皮吸收研究[J].中国药师, 2005,8(12):990-992.
[13]付秀娟,于倩,张弗盈,等.复方利巴韦林软膏剂的研制及体外释药研究[J].白求恩医科大学学报, 1998, 24(4):374-375.
[14]Ueda C T,Shah V P,Derdzinski K,et al.Topical and transdermal Drug Products[J].Pharmacopeial Forum, 2009, 35 (3):750-764.
[15]袁小红,袁雪妹,范瑞强.香莲软膏剂体外透皮试验[J].中国实验方剂学杂志,2012, 18(11):10-12.
[16]Fini A, Bergamante V, Ceschel G C,et al.Control of transdermal permeation of hydrocortisone acetate from hydrophilic and lipophilic formulations[J].AAPS Pharm Sci Tech,2008,9(3):762-768.
[17]薛强.溶出度的测定和评价方法[J].中外医疗,2008,(35):73-74.
[18]王悦,王永禄, 李学明,等.非诺贝特纳米混悬剂溶出度测定与体内吸收的相关性评价[J].中国现代应用药学, 2010, 27 (11):1013-1018.
[19]孙晓阳,王彬杰,张瑜,等.HPLC法测定阿那曲唑片溶出度及与原研产品的一致性评价[J].沈阳药科大学学报,2016,33(8):643-646.
