大黄素通过自噬抑制血管平滑肌细胞的增殖和迁移
2018-01-12李小蓉赵忠孝刘靖丽
权 彦,李小蓉,赵忠孝,刘靖丽,张 朋
(陕西中医药大学,咸阳 712046)
动脉粥样硬化是引起心脑血管疾病死亡的主要原因。血管平滑肌细胞(VSMC)增殖与迁移在动脉粥样硬化形成中起着关键作用[1]。研究发现,白藜芦醇、丹参和黄芪甲苷等[2]均可抑制血管平滑肌细胞的增殖迁移。
大黄素(emodin)是存在于大黄属、蓼属、鼠李属植物和番泻叶中的游离型蒽醌类成分,具有多种药理作用[3-4]。研究发现,大黄素具有抑制肿瘤细胞增殖和迁移的作用[5]。郭丹杰等[6]首次提出中药纯品大黄素剂量依赖性抑制兔髂动脉血管平滑肌细胞增殖。文献证实大黄素对家兔离体主动脉平滑肌细胞和人脐动脉血管平滑肌细胞增殖的抑制作用存在明显质量浓度依赖性[7-8]。然而,大黄素对大鼠胸主动脉VSMC增殖迁移作用还未被阐明。
细胞自噬(autophagy) 是一种维持细胞内环境稳态的机制[9]。近年来较多研究集中在自噬与增殖迁移调控的关系上[10]。目前发现自噬激活对肝癌HepG2细胞和舌鳞癌细胞的增殖迁移均具有抑制作用[11]。雷帕霉素抑制SD大鼠的腹主动脉离体血管平滑肌细胞增殖与自噬激活有关[12]。目前,关于自噬在大黄素对细胞增殖迁移抑制过程中的作用报道较少。
本实验以大鼠胸主动脉血管平滑肌细胞为研究对象,研究大黄素对大鼠胸主动脉血管平滑肌细胞增殖迁移的抑制作用并初步探讨其作用机制。
1 仪器与材料
1.1仪器 超净工作台(苏州安泰空气技术有限公司);CO2培养箱(美国Thermo公司);倒置显微镜(重庆光学仪器厂);全波段酶标仪,SDSPAGE微型凝胶电泳仪,化学发光成像仪,Quantity One Software图像分析系统(均购自伯乐生命医学产品(上海)有限公司)。
1.2试药 大黄素由陕西赛德高科技生物股份公司提供,经HPLC鉴定质量分数>95%;DMEM培养基、新生牛血清(美国Gibco公司);3-甲基腺嘌呤(3-MA) (德国Sigma 公司);LC3,Beclin1,PCNA和β-actin抗体 (美国Cell Signaling Technology公司);CCK8试剂盒(日本同仁会社);HRP(美国 Santa Cruz公司)。
1.3动物 健康雄性 SD大鼠,体质量为150~200 g,购于西安交通大学医学部实验动物中心,合格证号:SYXK(陕)2014-003。
2 方法
2.1细胞培养 选取体质量为150~200 g的健康雄性SD大鼠,腹腔注射麻醉药。取大鼠胸腹主动脉,剔除外周结缔组织,用预冷的PBS冲洗3次后,剥离血管中膜层,剪碎,贴块法培养VSMC,整个操作过程保持无菌。细胞在含100 mL·L-1胎牛血清(fetal bovine serum,FBS)、100 U·mL-1青霉素和100 [μg·mL-1]链霉素的DMEM培养基中,于体积分数为5%的CO2和37 ℃条件下培养,取3~7代进行实验[13]。
2.2CCK8法 取对数生长期大鼠主动脉血管平滑肌细胞,制成单细胞混合液,调整密度为1×104个·mL-1,接种于96孔板,每孔含200 μL细胞混悬液,设置6个复孔,常规培养。待细胞密度生长至60%~80%时,分别加入含不同质量浓度大黄素(0,5,10,20,40和80 μg·mL-1)的DMEM(含10 mL·L-1FBS) 200 μL刺激细胞,同时设空白调零组(不加细胞仅加入等量的DMEM)及TGF-β1(5[ng·mL-1)]刺激的阳性药物组。药物处理24 h后每孔加入CCK8溶液,在37 ℃培养箱中孵育 2 h。用酶标仪于450 nm波长条件下测定吸光度值A,计算细胞抑制率,实验重复3次。
细胞增殖抑制率(%)=[1-(实验组A450值-空白调零组A450值)/(对照组A450值-空白调零组A450值)]×100%
2.3划痕实验法 将对数生长期的VSMC消化混匀为1×104个·mL-1细胞混悬液,接种1 mL于24孔板,在含10 mL·L-1FBS的 DMEM中培养细胞至90%~95%混合。用200 μL无菌枪头在孔中划出直径为3 mm的平直划痕,PBS 冲洗后换含不同质量浓度大黄素(0,5,10,20,40和80 μg·mL-1)的DMEM及TGF-β1(5 ng·mL-1)刺激的阳性药物,继续培养24 h。在倒置显微镜下观察划痕情况,拍照,每个孔至少拍照3个点,每组实验至少重复3次。
2.4蛋白印迹法 各组细胞经相应给药处理后,预冷PBS漂洗2次,每孔加入150 μL RIPA 和 1 μL PMSF,冰上裂解20 min,以12 000 r·min-1离心15 min,吸取上清液。采用BCA法进行蛋白定量检测。热变性后,取30 μg总蛋白在聚丙烯酰胺梯度凝胶电泳分离,电转至PVDF膜上,0.5 g·L-1脱脂奶粉室温封闭4 h。一抗(LC3II/I,Beclin-1,PCNA和β-actin)4 ℃孵育过夜。TBST缓冲液洗膜3次,每次10 min,加入辣根过氧化物酶标记的相应 IgG二抗(工作液质量浓度为1∶5 000)室温孵育1~2 h。最后将漂洗后的PVDF膜上加发光底物显影液曝光显影,置于凝胶成像系统进行图像采集。用Quantity One 4.31凝胶蛋白分析软件对条带进行灰度分析。

3 结果
3.1不同质量浓度大黄素对VSMC增殖的影响 CCK8法和免疫印迹法检测不同质量浓度大黄素对VSMC增殖的影响,应用不同质量浓度(5,10,20,40和80 μg·mL-1)大黄素刺激VSMC 24 h。CCK8法结果显示,与空白对照组比较,TGF-β1(5 ng·mL-1)可明显促进VSMC增殖,而大黄素可抑制VSMC增殖,随着质量浓度增加抑制率显著增加,在质量浓度为40 μg·mL-1时抑制作用最明显,抑制率达50.9%~60.6%。同时,采用免疫印迹法检测增殖蛋白PCNA的表达变化,结果发现,大黄素呈质量浓度依赖性抑制VSMC中增殖蛋白PCNA的表达,且在质量浓度为40 μg·mL-1时抑制效果最强,质量浓度为80 μg·mL-1时抑制率有所下降,可能与其高质量浓度导致细胞死亡有关。见图1。

图1不同质量浓度大黄素对VSMC增殖的影响
A.CCK8法检测细胞抑制率;B.免疫印迹法检测PCNA蛋白表达水平。与对照组比较*P<0.05,**P<0.01。
Fig.1 The effect of emodin on the proliferation of VSMC
1.the cell viability determined by CCK8 assay;B.the protein expression of PCNA determined by Western Blotting.*P<0.05,**P<0.01 vs the control group.
3.2不同质量浓度大黄素对VSMC迁移的影响 采用划痕实验法检测不同质量浓度大黄素对VSMC迁移的影响。结果见图2。由图2可知,TGF-β1(5 ng·mL-1)可明显促进VSMC迁移,而随着大黄素质量浓度依次增加,划痕愈合程度明显减弱,各质量浓度组细胞迁移率差异均具有统计学意义。结果表明,大黄素可质量浓度依赖性地抑制VSMC的迁移,且质量浓度为40 μg·mL-1时细胞抑制率最低。
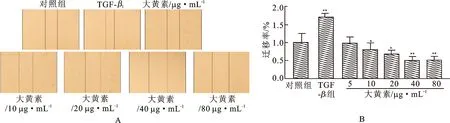
图2不同质量浓度大黄素对VSMC迁移的影响
A.各组24 h细胞划痕实验图片;B.各组24 h细胞划痕实验迁移率。划痕实验法检测细胞迁移。与对照组比较*P<0.05,**P<0.01。
Fig.2 The effect of emodin on the migration of VSMC
A.24 h cell scratch test pictures in each group; B.Migration rate of scratch test of 24 h cells in each group.The migration determined by wound healing assay.*P<0.05,**P<0.01 vs the control group.
3.3不同质量浓度大黄素对VSMC自噬的影响 为初步探讨细胞自噬是否参与大黄素对VSMC细胞增殖迁移的调控过程,应用不同质量浓度大黄素刺激VSMC细胞24 h后,提取细胞总蛋白,免疫印迹法检测自噬相关蛋白LC3和Beclin1的表达。与对照组比较,TGF-β1可明显促进VSMC自噬蛋白LC3和Beclin1的表达,且随着大黄素质量浓度增加,LC3和Beclin1蛋白表达水平明显增强,结果表明,大黄素抑制VSMC增殖迁移过程中,可质量浓度依赖性地上调细胞自噬。见图3。

图3不同质量浓度大黄素对VSMC细胞自噬的影响
A.免疫印迹法检测LC3蛋白表达水平;B.免疫印迹法检测Beclin1蛋白表达水平。与对照组比较*P<0.05,**P<0.01。
Fig.3 The effect of emodin on the autophagy of VSMC
A.the protein expression of LC3 determined by Western Blotting;B.the protein expression of Beclin1determined by Western Blotting.*P<0.05,**P<0.01 vs the control group.
3.4大黄素通过细胞自噬抑制VSMC的增殖 为进一步研究大黄素是否通过细胞自噬抑制VSMC的增殖迁移。我们采用自噬抑制剂3-MA(5 mM)预处理细胞1 h,40 μg·mL-1大黄素刺激细胞24 h。见图4。CCK8法结果显示,与对照组比较,40 μg·mL-1大黄素明显抑制VSMC增殖;而与40 μg·mL-1大黄素处理组比较,3-MA预处理后,大黄素对VSMC的抑制作用明显减弱,差异均具有统计学意义(P<0.05)。免疫印迹法检测增殖蛋白PCNA的表达水平,其变化与CCK8法检测结果一致。
3.5大黄素通过细胞自噬抑制VSMC的迁移 研究采用自噬抑制剂3-MA(5 mM)预处理细胞1 h,40 μg·mL-1大黄素刺激细胞24 h。见图5。与单独40 μg·mL-1大黄素处理组比较,抑制细胞自噬后,大黄素对VSMC的迁移抑制作用明显减弱。综上所述,大黄素抑制VSMC的增殖迁移作用是通过细胞自噬实现的。

图4大黄素通过细胞自噬抑制VSMC的增殖
A.CCK8法检测细胞抑制率;B.免疫印迹法检测PCNA蛋白表达水平。与对照组比较*P<0.05,**P<0.01;与大黄素组比较#P<0.05。
Fig.4 Emodin inhibits the proliferation of VSMC through autophagy
A.the cell viability determined by CCK8 assay;B.the protein expression of PCNA determined by Western Blotting.*P<0.05,**P<0.01 vs the control group;#P<0.05 vs the emodin group.

图5大黄素通过细胞自噬抑制VSMC的迁移
A.各组24 h细胞划痕实验图片;B.各组24 h细胞划痕实验迁移率。划痕实验法检测细胞迁移。与对照组比较*P<0.05,**P<0.01;与大黄素组比较#P<0.05。
Fig.5 Emodin inhibits the proliferation of VSMC through autophagy
A.24 h cell scratch test pictures in each group; B.Migration rate of scratch test of 24 h cells in each group.The migration determined by wound healing assay.*P<0.05,**P<0.01 vs the control group;#P<0.05 vs the emodin group.
4 讨论
VSMC的增殖迁移可能是造成动脉粥样硬化性疾病的病理学基础。研究发现,多酚类化合物原花青素能够显著抑制VSMC的增殖与迁移。据报道,大黄素对某些以细胞增殖、迁移及凋亡为主要病理改变的疾病具有潜在的治疗作用[14]。大黄素可有效抑制大鼠胶质细胞瘤、乳腺癌、人胰腺癌Panc-1细胞等生长及高糖诱导的大鼠 GMC增殖等。据此,我们首次采用原代培养的大鼠胸主动脉VSMC对大黄素增殖迁移的作用进行研究。实验结果显示,随着大黄素给药质量浓度的增加,其对VSMC的增殖和迁移的抑制作用逐渐增强。表明大黄素呈质量浓度依赖性抑制VSMC的增殖迁移,其机制有待进一步探讨。
基础水平的血管平滑肌细胞自噬[15]延缓动脉粥样硬化病变的进程,提示细胞自噬可能参与调控血管平滑肌细胞增殖与迁移[16]。观察不同质量浓度大黄素抑制VSMC增殖迁移作用的过程中,细胞自噬水平上调。此结果与张佩佩等提出的雷帕霉素的抑制VSMC增殖作用与自噬激活有关结论一致。研究再采用自噬特异性抑制剂3-MA抑制自噬。结果显示,单独40 μg·mL-1大黄素可抑制细胞增殖[17-18],3-MA预处理VSMC后大黄素对VSMC增殖迁移的抑制作用明显减弱,说明大黄素抑制VSMC的增殖迁移是通过细胞自噬完成。
综上所述,我们发现大黄素可通过细胞自噬抑制VSMC的增殖迁移。由此可知,大黄素对防治动脉粥样硬化性及血管狭窄等血管病变的发生发展具有临床价值,本研究对于研究自噬在细胞增殖迁移中的调控也具有重要意义。
[1] Ballantyne M D,Pinel K,Dakin R,et al.Smooth muscle enriched long noncoding RNA (SMILR) regulates cell proliferation[J].Circulation,2016,133(21):2050-2065.
[2] Heiss E H,Liu R,Waltenberger B,et al.Plumericin inhibits proliferation of vascular smooth muscle cells by blocking STAT3 signaling via S-glutathionylation[J].Sci Rep,2016,(6):20771.
[3] Zhu T,Zhang W,Feng S J,et al.Emodin suppresses LPS-induced inflammation in RAW264.7 cells through a PPARγ-dependent pathway[J].Int Immunopharmacol,2016,(34):16-24.
[4] Li X,Liu W,Wang Q,et al.Emodin suppresses cell proliferation and fibronectin expression via p38MAPK pathway in rat mesangial cells cultured under high glucose[J].Mol Cell Endocrinol,2009,307(1/2):157-162.
[5] Heo S K,Yun H J,Park W H,et al.Emodin inhibits TNF-alpha-induced human aortic smooth-muscle cell proliferation via caspase and mitochondrial-dependent apoptosis[J].J Cell Biochem,2008,105(1):70-80.
[6] 郭丹杰,徐成斌,陈源源.大黄素对血管平滑肌细胞增殖影响的实验研究[J].中华内科杂志,1996,35(3):157-159.
[7] 刘晗,高云.大黄素药理作用的分子机制研究进展[J].中国药理学通报,2009,25(12):1552-1555.
[8] 潘浩,刘学波,张红旗,等.大黄素对人血管平滑肌细胞增殖的影响[J].解剖学研究,2004,26(2):121-123.
[9] Lim W,Jeong M,Bazer F W,et al.Curcumin suppresses proliferation and migration and induces apoptosis on human placental choriocarcinoma cells via ERK1/2 and SAPK/JNK MAPK signaling pathways[J].Biol Reprod,2016,95(4):83.
[10]Sun Y,Liu J H,Sui Y X,et al.Beclin1 overexpression inhibitis proliferation,invasion and migration of CaSki cervical cancer cells[J].Asian Pac J Cancer Prev,2011,12(5):1269-1273.
[11]王雅雯,唐海阔,汪淼,等.雷帕霉素诱导自噬抑制舌鳞癌细胞增殖和迁移[J].中华口腔医学研究杂志:电子版,2011,5(6):568-572.
[12]金龙,杨宏宇,杨辉俊,等.NOD2上调自噬抑制舌鳞癌细胞增殖和迁移[J].实用口腔医学杂志,2015,31(3):352-356.
[13]张鹏,林福玉,张迎梅,等.小鼠主动脉血管平滑肌原代细胞的分离培养及鉴定[J].生物技术通讯,2010,21(1):54-57.
[14]Wang X F,San A J,Xu D L,et al.Emodin inhibits the migration and proliferation of vascular smooth muscle cells independent of metabolism [J].J Am Coll,2006,97(8):39.
[15]杨雨民,王世君,金丹丹,等.大黄素对血管紧张素Ⅱ诱导血管平滑肌细胞增殖的影响[J].中国中药杂志,2008,33(1):63-67.
[16]Liu S,Xie F,Wang H,et al.Ubenimex inhibits cell proliferation,migration and invasion in renal cell carcinoma:The effect is autophagy-associated[J].Oncol Rep,2015,33(3):1372-1380.
[17]Heo S,Yun H,Park W,et al.Emodin inhibits TNF-alpha-induced human aortic smooth-muscle cell proliferation via caspase-and mitochondrial-dependent apoptosis[J].J Cell Biochem,2008,105(1):70-80.
[18]Gao R,Chen R,Cao Y,et al.Emodin suppresses TGF-beta1-induced epithelial-mesenchymal transition in alveolar epithelial cells through notch signaling pathway [J].Toxicol Appl Pharm,2017,(318):1-7.
