内聚能密度结合响应面法优化酿后葡萄皮渣中原花青素的提取工艺
2018-01-12张玉君杨晓君丁泽人赵圆圆王秋平余壮壮
张玉君,杨晓君,丁泽人,赵圆圆,王秋平,余壮壮
(新疆农业大学,乌鲁木齐 830000)
我国为葡萄生产大国。酿后葡萄皮渣是葡萄酒产业的副产品,占酿酒葡萄总质量的20%~30%[1],多被企业丢弃或作为饲料,不仅污染环境,而且造成功能性成分和资源的浪费[2]。研究表明,葡萄的多酚类化合物主要分布于葡萄籽和皮中[3],有花色苷类、白藜芦醇、单宁和原花青素等。这些多酚类物质具有清除自由基、抗氧化、抗癌、预防动脉硬化和降血脂等保健作用[4-6]。因此,研究葡萄皮和籽的深加工方法具有重要的科学意义和产业应用前景。
原花青素为低聚黄烷化合物的总称,该类物质能在热酸作用下产生花青素[7]。随着对原花青素研究的深入,其提取成为研究热点。目前,原花青素的提取方法主要有:传统的有机溶剂提取法、新兴技术超临界二氧化碳提取法、微波辅助提取法、超声波辅助提取法和酶解提取法等[8]。对于提取溶剂的选择主要依靠参考文献及实验,结合生产实际,开发高效、能定量选择以及符合原花青素品质要求的溶剂提取工艺。
内聚能密度法[9]是一种依据物质化学结构计算出微观分子间非价键相互作用力大小来确定具有相近微观分子间非价键相互作用力的溶剂对物质进行溶解的定量计算方法,逆向思考则为在满足渗透条件、知道被提取物质的化学结构,用该法来预先通过计算定量确定提取剂。具体方法:先根据相似相溶和亲核亲电原理确定溶剂的选择范围,再用摩尔吸引常数,定量计算被提取物的内聚能密度和溶剂的内聚能密度,以两者的内聚能密度数据定量配置混合提取溶剂[10]。传统溶剂提取法一般采用相似相溶原理选择提取溶剂,内聚能密度法确定提取溶剂能降低开发成本,缩短研究时间。本文即采用内聚能密度法对酿后葡萄皮渣中的原花青素进行提取。
1 仪器与试药
1.1仪器 UV-2550紫外-可见分光光度计(日本岛津公司);AB204-S电子分析天平(d=0.01 mg)(梅特勒-托利多国际贸易上海有限公司);LabTechVB50真空泵(莱伯泰科有限公司)。
1.2试药 甲醇、无水乙醇、盐酸,均为分析纯(北京化工厂);去离子水(实验室自制);原花青素对照品(大连美仑生物制剂有限公司,批号MB2168,质量分数>95%);酿后葡萄皮渣,由新疆新天酒厂提供。
2 实验方法
2.1内聚能密度法确定提取溶剂
2.1.1内聚能密度公式如下:

(1)
2.1.2原花青素的溶解度参数的计算
溶解度参数公式如下:
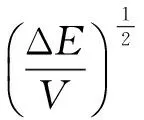
(2)
根据Small提出的基团贡献法中的公式[11]如下:
E=Fd+Fp+Eh(Fd为色散力,Fp为极性力,Eh为氢键力)
(3)
对应的溶解参数方程为
δ2=δd2+δp2+δh2
(4)

(5)
原花青素分子式见图1。由图1可知,分子式可拆解为:羟基10个,四取代苯1个,五取代苯1个,三取代苯2个,羰基2个,亚甲基1个和次甲基1个。
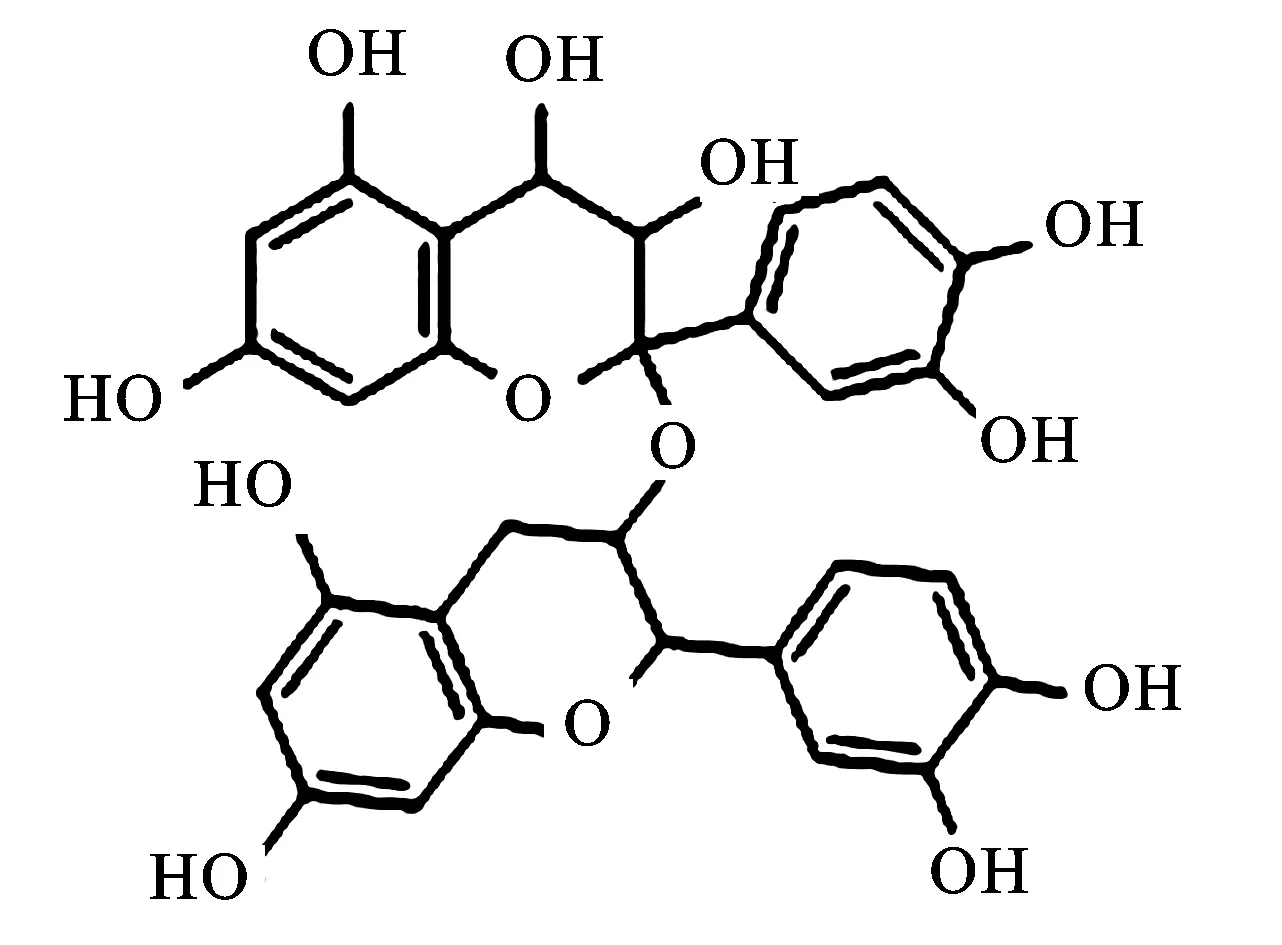
图1原花青素结构式
Fig.1 Structural formula of procyanidins

2.1.3葡萄皮渣中原花青素提取溶剂的确定
2.1.3.1提取溶剂种类的确定 根据亲核亲电原理和相似相溶原理,先选择出上述各物质的提取溶剂范围,再根据内聚能密度法越接近越易溶的原则及混合溶剂内聚能密度计算原则计算出相应的混合溶剂比例。依据相似相溶原则,原花青素提取可选择醇类小分子溶剂和水;进一步考虑原花青素的亲核亲电性,提取溶剂应适度酸化;同时考虑到提取所得原花青素的使用安全及提取溶剂去除的方便性,选择乙醇、盐酸和水进行复配作为葡萄皮渣中原花青素的提取溶剂。具体复配的比例依照内聚能密度相近原则和溶剂混合的内聚能计算规则进行计算。
2.1.3.2提取溶剂混合比例的确定 内聚能密度相近原则是在满足相似相溶、亲核亲电性相近的条件下,聚合物与溶剂的内聚能密度相近则能相互溶解,一般认为聚合物与溶剂内聚能密度差的绝对值小于1.7~2时,聚合物易溶于溶剂中。逆向思考,能使被提取物溶解分散于其中的溶剂,即可作为被提取物的提取溶剂。参考高分子物理方面的文献[14]:

由溶剂混合的内聚能计算规则:
δ混=δV1×φ1+δV2×φ2+…+δVn×φn(φ:组分比)
(6)
则10 mL·L-1盐酸δ=47.3×0.99+0.01×29.89=47.13;无水乙醇∶10 mL·L-1盐酸(95∶5)δ=47.13×0.05+22.99×0.95=24.20;内聚能密度相近性判断:∣24.20-25.73∣=1.53<1.7。
经过上述计算和混合溶剂与葡萄皮渣中原花青素内聚能密度的相近性判断,将葡萄皮渣中原花青素的提取剂比例确定为无水乙醇∶10 mL·L-1盐酸(95∶5)。
2.2葡萄皮渣中原花青素的提取与含量测定
2.2.1葡萄皮渣中原花青素的提取 粉碎酿后葡萄皮渣样品,精密称定,置于圆底烧瓶中。根据单因素实验设计料液比,精密量取提取溶剂无水乙醇∶10 mL·L-1盐酸(95∶5),不同温度下水浴加热回流一定时间,提取若干次,将提取液倒出,过滤,置于室温中,倒入100 mL量瓶中,用无水乙醇定容至刻度。精密吸取1 mL提取液,置于25 mL棕色量瓶中,用无水乙醇定容至刻度,得到原花青素提取液,用于紫外检测。
2.2.2葡萄皮渣中原花青素的含量测定
2.2.2.1原花青素标准曲线的制备 准确称取干燥至恒质量的原花青素对照品20 mg,置于25 mL棕色量瓶中,加入甲醇15 mL,超声溶解,定容,摇匀,即得质量浓度为0.8 mg·mL-1的原花青素标准储备液。精密量取标准储备液0,0.5,1.0,2.0,3.0,4.0和5.0 mL,分别置于10 mL棕色量瓶中,加甲醇定容,摇匀,即得质量浓度分别为0.00,0.04,0.08,0.16,0.24,0.32和0.40 mg·mL-1的标准溶液。在最大吸收波长280 nm处测定吸光度值,绘制葡萄皮渣中原花青素标准曲线,得回归方程。
2.2.2.2样品含量的测定 吸取葡萄皮渣中的原花青素提取液,用0.25 μm有机滤膜过滤,取滤液,甲醇作为对照品,在280 nm波长处测定吸光度值。依照回归方程,得原花青素含量。

式中:C为原花青素提取液吸光度值带入回归方程中所得原花青素的质量浓度(mg·mL-1),M为酿后葡萄皮渣样品质量(mg),V为原花青素提取液定容体积(mL),N为稀释倍数。
2.3单因素实验 以酿后葡萄皮渣为原料回流提取。考察料液比、提取温度、提取时间和提取次数对酿后葡萄皮渣中原花青素含量的影响。
2.4响应面法优化酿后葡萄皮渣中原花青素的提取条件 在单因素实验的基础上,以其较优条件为响应面优化法的起始条件,根据Box-Benhnken组合实验设计原理,以料液比、提取温度和提取时间为考察因素,对酿后葡萄皮渣中原花青素的提取条件进行优化。
3 结果
3.1酿后葡萄皮渣中原花青素标准曲线的制备 以吸光度值A280为纵坐标、原花青素含量(C)为横坐标,绘制标准曲线,得回归方程:A280=16.026C+0.049,r=0.995 2。原花青素对照质量浓度在0~55 mg·mL-1范围内有良好的线性关系。
3.2单因素实验结果与分析
3.2.1料液比对酿后葡萄皮渣中原花青素含量的影响 提取温度为45 ℃,提取时间为60 min,提取1次,设定料液比为1∶5,1∶10,1∶15,1∶20和1∶25(g·mL-1),考察酿后葡萄皮渣中原花青素含量的变化。实验结果表明,随着料液比的增加,原花青素含量总体呈上升趋势,不同的料液比对原花青素含量的影响并不大,当料液比为1∶20时,原花青素的含量最高为17.39 mg·g-1。
3.2.2提取时间对酿后葡萄皮渣中原花青素含量的影响 提取温度为45 ℃,料液比为1∶20,提取1次,设定提取时间为55,70,85,100和115 min,考察不同提取时间对酿后葡萄皮渣中原花青素含量的影响。实验表明,随着提取时间的升高,含量不断增加,在提取时间为100 min时,原花青素提取效果最好,超过100 min后,原花青素含量下降。可能是随着提取时间的增加,原花青素挥发或分解所致[15]。因此,提取时间选择100 min进行下一步实验。
3.2.3提取温度对酿后葡萄皮渣中原花青素含量的影响 提取时间为100 min,料液比为1∶20,提取1次,分别设定提取温度为45,50,55,60和65 ℃,考察不同提取温度对酿后葡萄皮渣中原花青素含量的影响。实验表明,提取温度为60 ℃时,原花青素含量最高,超过60 ℃含量开始下降,可能是由于原花青素随着提取温度的升高而产生挥发或分解。因此,选择60 ℃为提取温度,进行下一步实验。
3.2.4提取次数对酿后葡萄皮渣中原花青素含量的影响 提取时间为100 min,料液比为1∶20,提取温度为60 ℃,分别设定提取次数为1,2,3和4次,考察不同提取次数对酿后葡萄皮渣中原花青素含量的影响。实验表明,随着提取次数的增加,原花青素含量也随之增加。提取2次后含量增加不显著,从节约提取成本考虑,选择提取次数为2次。
3.3酿后葡萄皮渣中原花青素提取工艺的优化
3.3.1响应面实验结果 在单因素实验的基础上,以料液比(A)、提取时间(B)和提取温度(C)3个因素为自变量,原花青素含量(Y)为响应值,设计3因素3水平的实验。实验设计和结果见表1~2。
表1Box-Benhnken实验设计因素和水平
Tab.1 Factors and levels in response surface design

水平因素A,料液比B,提取时间/minC,提取温度/℃-11∶15705501∶201006011∶2513065
表2响应面分析方案及实验结果
Tab.2 Response surface design arrangement and experimental results

实验号ABCY/mg·g-11234567891011121314151617181920-11-11-11-11-110000000000-1-111-1-11100-1100000000-1-1-1-111110000-1100000034.5528.6429.4331.6838.7227.5337.1232.6042.8135.3245.3439.7245.4643.0146.1448.5849.5250.7051.7049.40
3.3.2模型的建立和方差分析 根据Box-Benhnken中心组合设计原理,利用Expert 8.0.6软件,对表2中的实验数据进行多元回归拟合,可得料液比、提取时间和提取温度与酿后葡萄皮渣中原花青素含量的二次多元回归方程为:
y=242.82-13.42A-2.12B+4.61C+9.27AB-7.53AC+3.47BC-41.60A2-24.27B2-15.75C2
式中A、B、C在设计中均经过量纲线性编码处理,各项系数的绝对值大小直接体现出各因素对响应值的影响程度大小,系数的正负反映了影响的方向。对表2的实验结果进行统计分析,得到的方差分析结果见表3,等高线及其曲面图见图2~4。
表3回归模型的方差分析结果
Tab.3 Variance analysis results of the constructed regression model

变异来源平方和自由度均方FP显著性 模型ABCABACBCA2B2C2回归模型失拟纯误差总和28419.341802.0444.82212.61686.91453.4696.264760.081619.78682.131496.251039.17457.0729915.5891111111111055193157.701802.0444.82212.61686.91453.4696.264760.081619.78682.13149.62207.8391.4121.1012.040.301.424.593.030.6431.8110.834.56 2.27≤0.00010.00600.59620.26080.05780.11230.44120.00020.00810.0585 0.1942**** **** 不显著

由表3和图2~4可知,以原花青素提取量为响应值时,P=0.006 0<0.01,表明该二次方程模型极显著,同时失拟项P=0.194 2>0.100 0,表明正交实验结果和数学模型拟合良好,即可用该数学模型推测实验结果。3种因素的P值大小排序为B>C>A,即提取温度的影响>料液比的影响>提取时间的影响。r2为0.950 0,表明模型的置信度高。各因素两两交互对葡萄皮渣原花青素含量的影响大小为AC>BC>AB,即料液比与提取温度交互的影响>提取温度与提取时间交互的影响>料液比与提取时间交互的影响。

图2料液比和提取时间对酿后葡萄皮渣原花青素含量的交互影响
Fig.2 The reciprocal effect of solid-liquid rate and extraction time on the procyanidins content from brewed grape skin residue

图3料液比和提取温度对酿后葡萄皮渣原花青素含量的交互影响
Fig.3 The reciprocal effect of solid-liquid rate and extraction temperature on the procyanidins content from brewed grape skin residue

图4提取时间和提取温度对酿后葡萄皮渣原花青素含量的交互影响
Fig.4 The reciprocal effect of extraction time and extraction temperature on the procyanidins content from brewed grape skin residue
在内聚能密度法计算葡萄皮渣原花青素提取溶剂的基础上,通过Expert 8.0.6软件进行响应面工艺优化,得到葡萄皮渣中原花青素提取的优化工艺为:提取温度为60 ℃,提取时间为100 min,料液比为1∶20。
3.4葡萄皮渣中原花青素提取优化工艺的验证 取酿后葡萄皮渣样品,粉碎,精密称定5 g,置于圆底烧瓶中,精密量取提取溶剂无水乙醇∶10 mL·L-1盐酸(95∶5)100 mL,60 ℃水浴加热100 min,平行提取2次,倒出酿后葡萄皮渣提取液,过滤,放冷至室温,倒入100 mL量瓶中,用提取溶剂定容,得到酿后葡萄皮渣中原花青素提取液。按照2.2.2项下方法进行葡萄皮渣中原花青素含量测定,得原花青素平均含量为49.39 mg·g-1(n=3,RSD=1.7%)。
4 讨论
目前,原花青素提取溶剂主要有:甲醇、乙醇、丙酮和乙酸乙酯[16]。溶剂的选择及配比都是根据参考文献或均匀实验选取,耗时长、成本高、效率低。本实验依据相似相溶和亲核亲电原理,同时考虑食用药用安全性,确定溶剂的选择范围,再根据内聚能密度法,用摩尔吸引常数定量计算出原花青素的内聚能密度和提取溶剂的内聚能密度,筛选得提取溶剂无水乙醇和10 mL·L-1盐酸溶液,以两者的内聚能密度数据定量配制混合提取溶剂,得两者配比为无水乙醇∶10 mL·L-1盐酸(95∶5)。克服了提取溶剂选择的经验性和不确定性。本实验采用的内聚能密度法提取的原花青素平均含量为49.39 mg·g-1,高于文献方法提取的含量,如陈月英等[17]采用微波辅助提取法的原花青素含量为9.12 mg·g-1,采用酶法提取工艺提取的原花青素含量为11.08 mg·g-1[18];王竹清等[19]采用乙醇浸提法提取的原花青素含量为2.67 mg·g-1。此法比酶解法、微波辅助提取法更经济,相对于一般的溶剂提取法,能更快地找到合适的提取试剂。因此,该方法也为其他天然产物成分的溶剂提取提供了有力的理论依据。
本文在单因素实验的基础上,将响应面法应用于酿后葡萄皮渣中原花青素的提取。实验结果表明,提取温度、料液比和提取时间的平方项对原花青素含量有显著影响,说明提取温度、料液比、提取时间与原花青素含量的影响不是简单的线性关系。
[1] 李双石,李晓燕,苑函,等.葡萄酒渣提取多酚化合物研究进展[J].酿酒科技,2012,(12):17-22.
[2] 李春阳.葡萄籽中原花青素的提取纯化及其结构和功能研究[D].无锡:江南大学,2006:2-3.
[3] 齐岩,檀昕,程安玮,等.葡萄皮和籽中游离酚和结合酚组成及抗氧化活性比较[J].核农学报,2017,31(1):104-109.
[4] 向阳.葡萄中保健性功效成分及其降血脂作用的研究[D].乌鲁木齐:新疆医科大学,2003:12-17.
[5] 吴嘉慧,袁春龙,宋洋波.葡萄籽功能性成分及其应用[J].日用化学工业,2011,41(3):216-221,228.
[6] 张慧文,张玉,马超美.原花青素的研究进展[J].食品科学,2015,36(5):296-304.
[7] Ross Julie A,Kasum Christine M.Dietary flavonoids:bioavailability,metabolic effects,and safety[J].Annu Rev Nutr,2002,22(10):19-34.
[8] 李超,王卫东.原花青素提取方法的研究进展[J].粮油加工,2009,(9):145-148.
[9] 何平笙.高聚物的结构与性能[M].北京:科学出版社,2011:485-489.
[10]Grazia M,Maurizio V.The influence of ethylene oninvitrorooting of GF 677 (Prunuspersica×Prunusamygdalus) hybrid peach rootstock[J].InVitroCell Dev Biol-Plant,1997,(33):26-29.
[11]王本力,付洪瑞,史程飞,等.溶解度参数理论在润滑剂基础油调合中的应用[J].润滑与密封,2013,38(10):69-72.
[12]范克雷维伦.聚合物的性质[M].北京:科学出版社,2010:36.
[13]金日光,华幼卿.高分子物理[M].北京:化学工业出版社,2012:34-36.
[14]殷敬华,莫志深.现代高分子物理学[M].北京:科学出版社,2003:127.
[15]李超,王卫东,郑义,等.响应曲面法优化原花青素的超声波协同微波提取工艺[J].食品与发酵工业,2009,35(10):167-171.
[16]王佳宁,郜玉钢,臧埔,等.原花青素的提取方法与药理作用研究进展[J].上海中医药杂志,2015,49(10):94-97.
[17]陈月英,王彦平,孙瑞琳,等.葡萄皮渣原花青素微波辅助提取工艺的优化及其抗氧化活性研究[J].北方园艺,2016,(11):123-126.
[18]陈月英,王彦平,孙瑞琳,等.葡萄皮渣原花青素酶法提取工艺优化及抗氧化性研究[J].北方园艺,2016,(16):129-132.
[19]王竹清,王军.“赤霞珠”葡萄皮渣中原花青素的提取工艺研究[J].食品科学,2009,30(12):101-106.
