氧化铈和氧化钪掺杂对氧化锆材料中点缺陷的影响
2018-01-11陶景超
陶景超
(上海交通大学 材料科学与工程学院,上海 200240)
氧化铈和氧化钪掺杂对氧化锆材料中点缺陷的影响
陶景超
(上海交通大学 材料科学与工程学院,上海 200240)
介绍了两种稀土元素掺杂的氧化锆(ZrO2)材料:氧化铈(CeO2)掺杂ZrO2和氧化钪(Sc2O3)掺杂ZrO2.CeO2掺杂ZrO2材料的研究重点是温度和氧分压对其氧空位形成的影响,以及由此带来的其热力学参数的变化.Sc2O3掺杂ZrO2材料的研究重点在ZrO2的掺杂含量对其氧空位数量的影响,以及氧空位作为离子导通的载体在晶体和晶界上的变化对材料导电性能的作用.
氧化锆; 点缺陷; 氧空位
0 引 言
氧化锆(ZrO2)是一种十分重要的结构和功能材料,它具有非常优异的物理和化学性能[1].纯 ZrO2在室温下是单斜相(空间群P21/c)[2-3];随着温度的升高,ZrO2材料在1 400 K的时转变为四方相(空间群P42/nmc);继续升温达到2 650 K时,它会转变成立方萤石结构(空间群fm3m)[4-6].立方ZrO2萤石结构由Zr4+构成的面心立方点阵占据1/2的八面体空隙组成,O2-占据面心立方点阵所有的4个四面体空隙.四方ZrO2相当于萤石结构沿着c轴拉长而变形的晶体结构.单斜相ZrO2晶体则可以看作四方ZrO2沿着β角偏转一个角度而构成.由硬球理论可以得出,为了形成稳定的八面体配位结构,晶体中的阳离子与阴离子的半径比(r+/r-)应大于0.732,当r+/r-<0.732且离子的配位数为8时,静电吸引力小而排斥力大,体系变的很不稳定[7].对于萤石结构的ZrO2来说,rZr4+/rO2-≈0.564.这种结构导致晶体内部氧间隙太小,尽管氧的八面体空隙只有一半被锆占据,但相邻氧原子之间的库仑排斥力使结构变得很不稳定,所以低温下Zr4+趋向于形成配位数小于8的结构,即单斜相,而具有8配位结构的立方相和四方相只能在高温下借助于晶格振动平衡才能稳定存在[8-9].
正是由于ZrO2的多相体系,其在相变时晶格参数也随之变化.升温时,由于吸收热量,ZrO2存在明显的体积收缩;而降温时,其体积膨胀,这是造成陶瓷龟裂的原因.这种现象造成了纯ZrO2在应用上的局限性.一些稀土氧化物(如氧化钇Y2O3、 氧化钪Sc2O3、 氧化镁MgO或氧化铈CeO2)的添加可以将ZrO2在高温的晶体结构在室温下保留,称为稳定作用.同时也可以改善ZrO2热机械性能,使得材料具备高强度、高韧性,以及优良的抗热震性能,称为增韧作用[10-11].增韧ZrO2陶瓷应用广泛,在发动机、内燃机领域可以用作汽缸内衬、活塞顶、气门导管、进气和排气阀座、轴承、挺杆、凸轮、凸轮随动件和活塞环等零件;在结构陶瓷领域可以用作光纤接插件及套管、ZrO2磨介、刀具、纺织及烟草机械承板等[12-14].
稀土氧化物对ZrO2高温相的稳定机理一直是科研工作者的热门研究课题.Garvie等[15]认为ZrO2粉体的尺寸对ZrO2的相变有很大的影响,他认为存在一定的临界晶粒尺寸,超过这个晶粒尺寸,四方相ZrO2就会转变为单斜相.Shukla等[16]做了大量的计算工作,最终得出10 nm是ZrO2从四方相向单斜相转变的临界尺寸.Tsunekawa[17]通过第一原理计算出立方ZrO2向四方ZrO2转变的临界尺寸是2 nm.除了晶粒尺寸效应的解释外,目前比较流行的也是被普遍接受的掺杂稳定机理是通过氧空位和Zr-O共价键能量变化来解释[18].该理论认为,纯ZrO2是稳定的7配位的单斜结构,当低价态的阳离子(如Y3+,Sc3+)加入时,为了达到电荷平衡,晶体内部就产生了相应数量的氧空位.Zr4+和氧空位组合会减小Zr4+的配位数,使其配位数倾向于小于7.为了维持有效配位数,Zr-O共价键主导的晶体结构就会形成一个虚拟的8配位的晶体结构(大于7),同时吸收产生的氧空位与相邻的Zr4+形成新的晶格.因此,8配位的四方相和立方相晶体结构中的氧空位和Zr4+的组合有减少配位数小于8的倾向[19-20].
稀土掺杂ZrO2能够将其高温相稳定在室温下,形成复合多相材料.此种材料在能源领域有特殊应用,长期以来一直是研究者关注的热点.例如Y2O3稳定ZrO2(YSZ)[2-4,21-22]和氧化钪稳定的ZrO2(ScSZ)[23-26]立方晶体结构具有良好和稳定的离子电导性能,可以用作固体氧化物燃料电池(SOFC)的电介质材料;ZrO2掺杂CeO2(ZDC)材料不仅可以用做汽车尾气催化剂[27-29],而且最新的研究发现它可以利用太阳能来分解水,从而产生清洁能源氢气(H2)[30-33].
综上所述,稀土氧化物掺杂改进了ZrO2材料的性能,其本质是在ZrO2内部产生了不同类型和机制的点缺陷,这些点缺陷主要以氧空位的形式存在.这些氧空位的存在使ZrO2材料显示出不同的物理、化学性能(如Y2O3稳定ZrO2,在其晶格内部形成的固定氧空位,可以使氧离子在一定温度下自由导通,显现出良好的离子导电性能;又比如掺杂同价CeO2的ZrO2材料,在氧化还原的气氛下,晶体内部的氧原子和外界气氛中的氧气O2,由于需要达到某种热力学平衡,使得晶格中的氧原子和外部的O2进行不断交换,使得这种材料显现出不同寻常的热力学性能).这些性能使得ZrO2材料可以作为很好的新能源材料.
1 ZrO2中的点缺陷
在考虑固体中点缺陷行为时,最重要的两点是点缺陷的类型和点缺陷的浓度.但是这两个重要参数并不是独立的,它们依赖于一些特定的参数,如晶体结构、化学组分、粒子间作用力以及温度等.在研究过程中发现材料的物理性能如密度、熔点、电导率、扩散系数和吸光性也都是研究点缺陷的重要线索[34-41].
1.1 Kroger-Vink 表示法

图1 Kroger-Vink 表示法示意图
要描述点缺陷,就需要用点缺陷的化学反应公式.标准的描述固态离子点缺陷的方法称为Kroger-Vink 表示法.这种表示法将点缺陷分为三个部分(图1):一、缺陷主体,如果是空位就用“V”表示,如果是元素,就用该元素的分子式表示,例如金属锆就用“Zr”表示;二、符号的下标代表缺陷所占据的是晶格中的正常点位还是间隙位置,如果是正常点位就用该点位的化学元素符号表示,如果是间隙位置就用“i”表示;三、符号的上标表示有效电荷,一点(·)代表正电荷,一撇(′)代表负电荷,(x)表示中性.
1.2 ZrO2中点缺陷的分类
ZrO2中的点缺陷主要分为本征缺陷和外因引起的缺陷.本征缺陷主要是由于晶格内部的原子在温度升高的情况下得到了能量,使原子发生振动,最终导致原子偏离自己本来在晶格中的位置,形成点缺陷.ZrO2中的主要本征点缺陷有肖特基、弗伦克尔阴离子、弗伦克尔阳离子以及反肖特基这几种.它们的缺陷化学反应公式见式(1)~(4).可以看出肖特基缺陷中的空位是成对出现的,并且最终正常点位上的原子大多数都逃离到材料的表面或者晶界上.而弗伦克尔型缺陷中通常只出现一个空位,这个位置上的原子逃离到了晶格中原子的间隙处.由于本征缺陷通常要在很高的温度下(一般认为熔点的一半温度)才能形成足以影响材料性能的浓度.即使达到了这个温度,通常缺陷浓度也在10-6的数量级.因此,本征点缺陷对ZrO2材料的影响一般情况下不做讨论.
(1)
(2)
(3)
(4)
外因作用引起的点缺陷通常可分为掺杂引起的点缺陷,以及由于元素本身的多种价态在不同的氧分压下引起的氧化还原反应,从而形成的点缺陷.掺杂又分为同价掺杂和异价掺杂,同价掺杂是指掺杂的元素和锆是同价的,这样不会由于价态的变化引起电荷补偿,从而形成点缺陷(通常是氧空位),如CeO2和ZrO2的掺杂(阳离子都是4价的).异价掺杂是指掺杂的元素和锆不同价,由于要达到晶格内的电中性,从而形成了氧空位,如Y2O3和Sc2O3掺杂的ZrO2.由式(5)可以得出,每2 mol的Sc2O3替代ZrO2就会伴随1 mol的氧空位的产生.因此这种异价掺杂引起的缺陷的浓度是由掺杂元素的掺杂比例所决定的,并且是一个定值.
(5)
另一种由外因作用引起的点缺陷是由元素本身的多价态引起的,如ZrO2掺杂CeO2中,铈和锆同为4价,所以不存在电荷补偿引起的氧空位点缺陷.但是,由于铈是多价态化合物,因此在温度和外界氧分压的作用下就会形成式(6)式的反应.从(6)式的反应方程式中可以分析出,稳定的正4价铈在一定条件下从正常点位的氧离子中得到电子,被还原成正3价铈,氧离子失去电子后产生氧空位,并释放出O2.其实质可以改写成式(7).简单地说,就是晶格中的游离态的氧和气态的氧发生氧化还原反应,并在一定条件下达到平衡状态,这样的反应就会形成氧空位,而氧空位的比例显然是和外部的氧分压有关的.由于铈的多价态性,CeO2就有两个分子式:CeO2和CeO1.5.在发生氧化还原反应的整个过程中氧的化学定量比是非定量的,称之为非化学定量比,对CeO2来说,氧的非化学定量比的值是在0~0.5之间的,这个值取决于温度和氧分压.
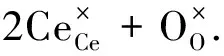
(6)
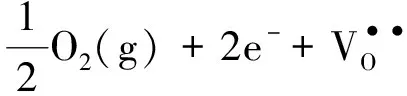
(7)
1.3 ZrO2中的点缺陷组合
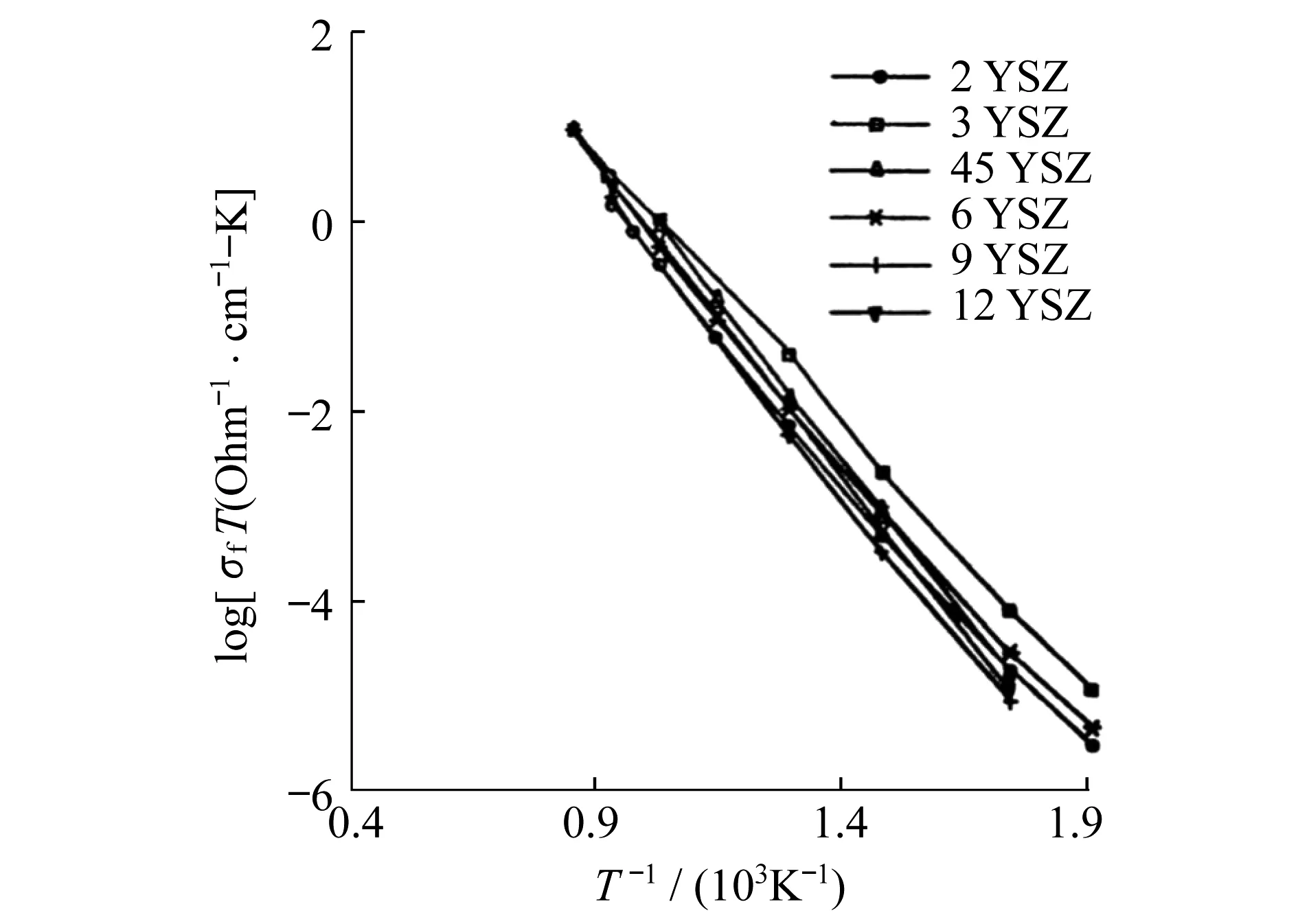
图2 不同比例Y2O3掺杂ZrO2的导电性能[42]
Ramamoorthy等[42]发现,在Y2O3掺杂的ZrO2(YSZ)中,添加的Y2O3的比例和材料的导电性能并不完全成正比.如图2所示,添加氧化钇比例最多的12 %(物质的量分数)的YSZ材料的导电性能小于添加Y2O33%、6%和9%(物质的量分数)的YSZ材料,正如1.2节中讨论的那样,YSZ中的氧空位的浓度是由加入的Y2O3的比例所决定的,而且是一个定值,也就是说Y2O3加入的越多,氧空位的浓度就越高.
材料的导电性能和其导电离子的浓度是成正比的,所以YSZ材料的导电性能应该和它晶格中的氧空位的浓度成正比,也就是和添加的Y2O3的比例成正比的,但事实却正好相反.同样的现象也出现在Sc2O3掺杂的ZrO2体系中[43].这说明缺陷和缺陷之间会发生关联,从而形成缺陷组合.
σi=(zie)2CiDi/KT,
(8)
式中σi为离子导电率,zi为电荷数,e为电子质量,Ci为离子浓度,μi为离子流动性,K为玻尔兹曼常数.
缺陷组合一般分为捕获式和捆绑式.由式(7)可知,氧化还原反应引起的缺陷氧空位和2个自由电子.当晶格体系处于极端还原的气氛下,会出现如式(9)的反应,氧空位被还原成带一价负电的空位.这个过程也可以看成是氧空位捕获了一个自由电子.因此,实际就是缺陷和缺陷在反应,形成了缺陷组合的一种.另一种缺陷组合是如式(10)所示,为了达到晶格内的电中性,每2 mol的钇离子占据锆离子的点位会带来1 mol的氧空位,但是也存在如式(11)的情况,两种缺陷会捆绑在一起,形成一个捆绑式的缺陷,这样无形中减少了氧空位的单独存在,从而影响了离子导电性能.
(9)
(10)
(11)
2 ZDC材料中的点缺陷和应用
如前文所介绍的那样,ZDC材料中出现的点缺陷主要是由于CeO2材料的两种价态间互相转换,形成氧化还原反应,从而形成了氧空位.这种氧空位产生的数量和氧的非化学定量比以及外界的状态有关.外界的状态通常指的是外界的氧分压和温度的变化.氧空位产生的位置是完全随机的,也就是说其结构熵(ΔS)可以达到最大.因此在一定外界氧分压和温度的状态下,氧空位的非化学定量比以及整个系统的热力学参数的变化就成为众多学者研究的焦点.
Chueh等[44]利用纯CeO2的氧化还原的特点,将其应用在两步法分解水产生清洁能源的研究上.高温时(1 300~1 500 ℃)的反应如式(6)所示,CeO2的内部会形成一定的氧空位,并释放出相应数量的O2.在低温时(800~1 000 ℃)通入水(式(12))或者二氧化碳CO2(式(13)),由于CeO2中的氧空位有吸回O2的趋势,最终导致了水和CO2中的氧被夺走,填补了CeO2晶格中的氧空位,并伴随放出H2和一氧化碳CO.H2和CO都是很好的清洁能源.Grigoriev等[45]和Abanades[46]等也对此进行了研究,并得到了相似的结果.Chueh等[47]又进一步利用太阳能中的热来进行类似实验并取得了成功.因此,这项研究工作对未来新能源的研究有着重要意义.
(12)
(13)

图3 多孔CeO2的扫描电子显微镜(SEM)照片.(a) 循环实验开始时(1 773 K煅烧3 h)的晶粒尺寸;(b) 500次热循环后的晶粒尺寸(循环温度在1 073~1 773 K之间)[51]
然而研究者发现纯CeO2材料在上述的热循环过程中的稳定性不好,晶粒会不断长大,这样会减缓H2和O2的释放.如图3所示,纯CeO2的晶粒在经历热循环后有了明显的长大,说明了这种材料的不稳定性.因此寻找一种更好的材料是目前研究的当务之急.ZDC材料长期以来一直因为它的氧化还原作用而被用作汽车尾气的三效催化剂[23-24,48-51].在尾气催化剂的应用上ZDC的使用远远多于纯CeO2,主要原因是ZDC有更好的被还原的能力,也就是说在相同的氧分压和温度下,ZDC材料释放O2和储存O2的能力要强于纯CeO2.这是因为锆的原子半径大于铈,锆的加入增加了锆氧间原子的距离,使阳离子对氧离子的束缚减小,导致氧离子更容易逃离晶格,形成氧空位[52].
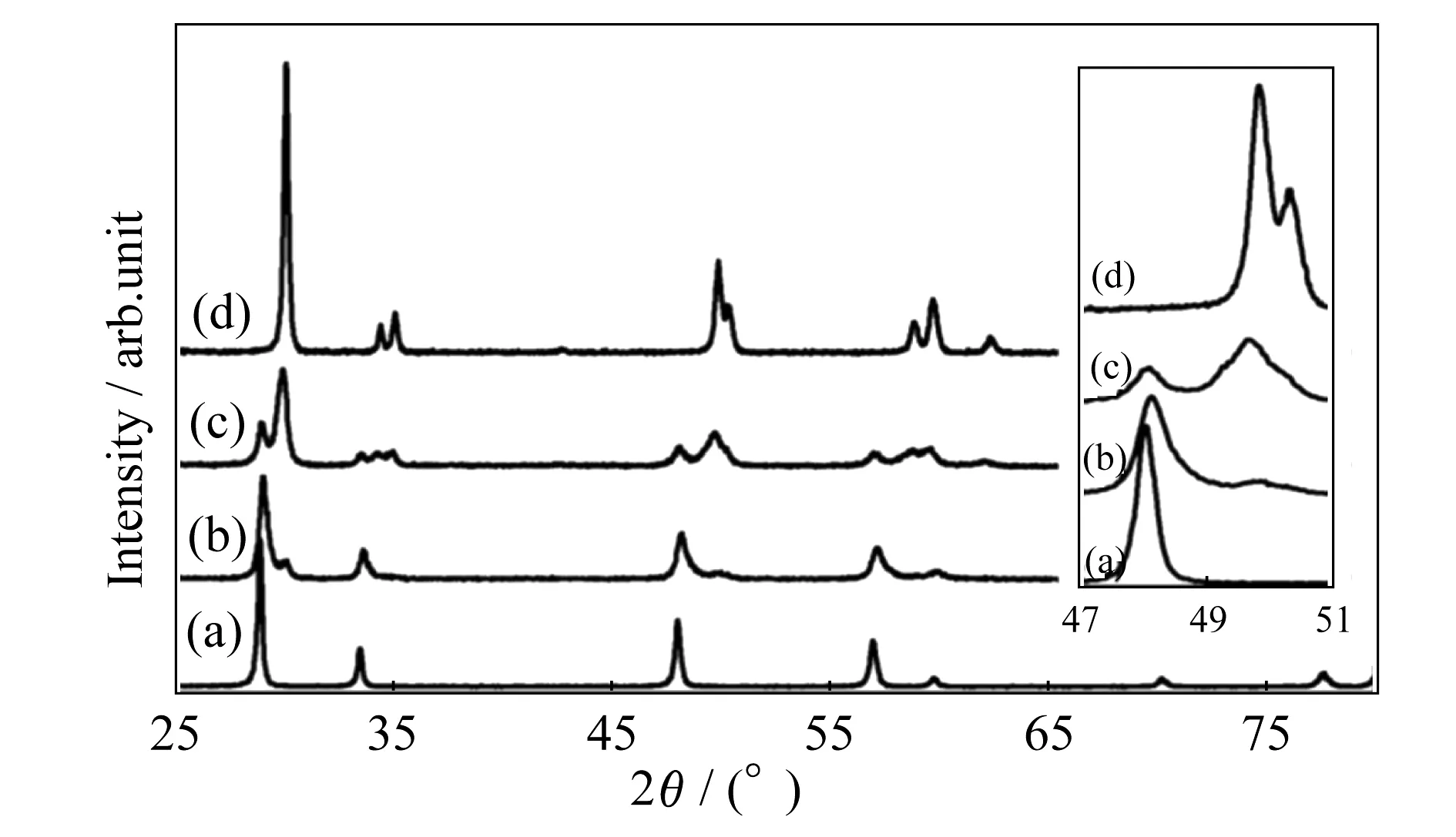
图4 CeyZr1-yO2 样品在1 323 K煅烧 4 h后的X射线衍射(XRD)图谱.(a) y=0.81;(b) y=0.59;(c) y=0.33;(d) y=0.14.插图显示了放大的立方相的主峰(2 2 0)[65]
影响ZDC体系点缺陷的因素最主要的是晶体结构和热力学参数.ZDC体系中随着锆的加入,ZDC的晶体结构会发生明显的变化.如图4所示,ZrO2含量在20% (物质的量分数)的时候,材料是立方相的晶体结构,而当ZrO2的含量增加到41%和67%(物质的量分数)时,原来单一的立方相就分解为两相.因此,在选取ZDC材料进行研究的时候,一般ZrO2的添加量最多到20%(物质的量分数).因为立方相的晶体结构无论在离子导通还是离子扩散方面都有优良的性能.在热力学参数的研究方面,Gong等[52]认为ZDC材料中氧的焓变是和ZrO2的加入量无关的,并且是长程无序,但是短程有序的.然而,氧的熵变和ZrO2的添加量有密切关系的.
由于ZDC材料的这些热力学性能以及其在汽车尾气催化剂上的应用,此种材料作为太阳能驱动的两步法分解水的主要材料,从而代替纯CeO2.
3 ScSZ材料中的点缺陷和应用
ScSZ材料中的点缺陷主要是由正3价钪和正4价锆掺杂后引起的电荷补偿所产生的氧空位.如式(5)所示,每2 mol的Sc2O3替代ZrO2就会伴随1 mol的氧空位产生,因此ScSZ材料中的点缺陷浓度是随着Sc2O3材料含量而确定的一个定值.因此,此类材料的点缺陷是很少受外界条件的影响而改变,它只和材料合成时掺杂物的含量有关.正是由于这一特性,ScSZ材料是很好的、稳定的离子导体,被普遍应用于SOFC的电介质材料[53-57].
ScSZ作为SOFC的电介质材料的研究主要集中在3个方面:晶体结构的研究、导电性能的研究和晶界上的空间电势的研究.
ScSZ的晶体结构大概有4种,其中,单斜、四方和立方是ZrO2材料的3种主要晶体结构,通过不同的Sc2O3的掺杂可以得到这3种结构,或者是某2种结构的混合结构.这些研究结果和YSZ是一致的[58-61].但是ScSZ在Sc2O3的添加超过一定比例后,会出现棱方的结构,这种结构研究者认为是立方结构的分解而得到的[53,55].晶体结构的变化直接影响了材料的离子导电性能,式(8)也被称作Nernst-Einstein方程,其中Di是离子在晶格中的扩散系数,K是玻尔兹曼常数.扩散系数在不同的晶体结构中是不同的,这就是不同ScSZ晶体结构导致离子电导率的巨大差异的本质原因[34].目前的研究认为,立方相的ScSZ晶体结构具有最好的氧离子扩散系数,因此立方相的ScSZ具有最好的离子电导率.研究者也通过添加其他稀土元素来保持ScSZ材料的立方结构,但同时又能保证其氧空位的浓度不变.Weller[40]和Son等[61]添加Y2O3来保持ScSZ中的立方相结构;Yamamoto等[55]研究了将氧化镱(Yb2O3)加入ScSZ材料后的晶体结构的变化和导电性能的变化.Liu等[62]将CeO2添加到ScSZ材料中后,增加了其导电性能.
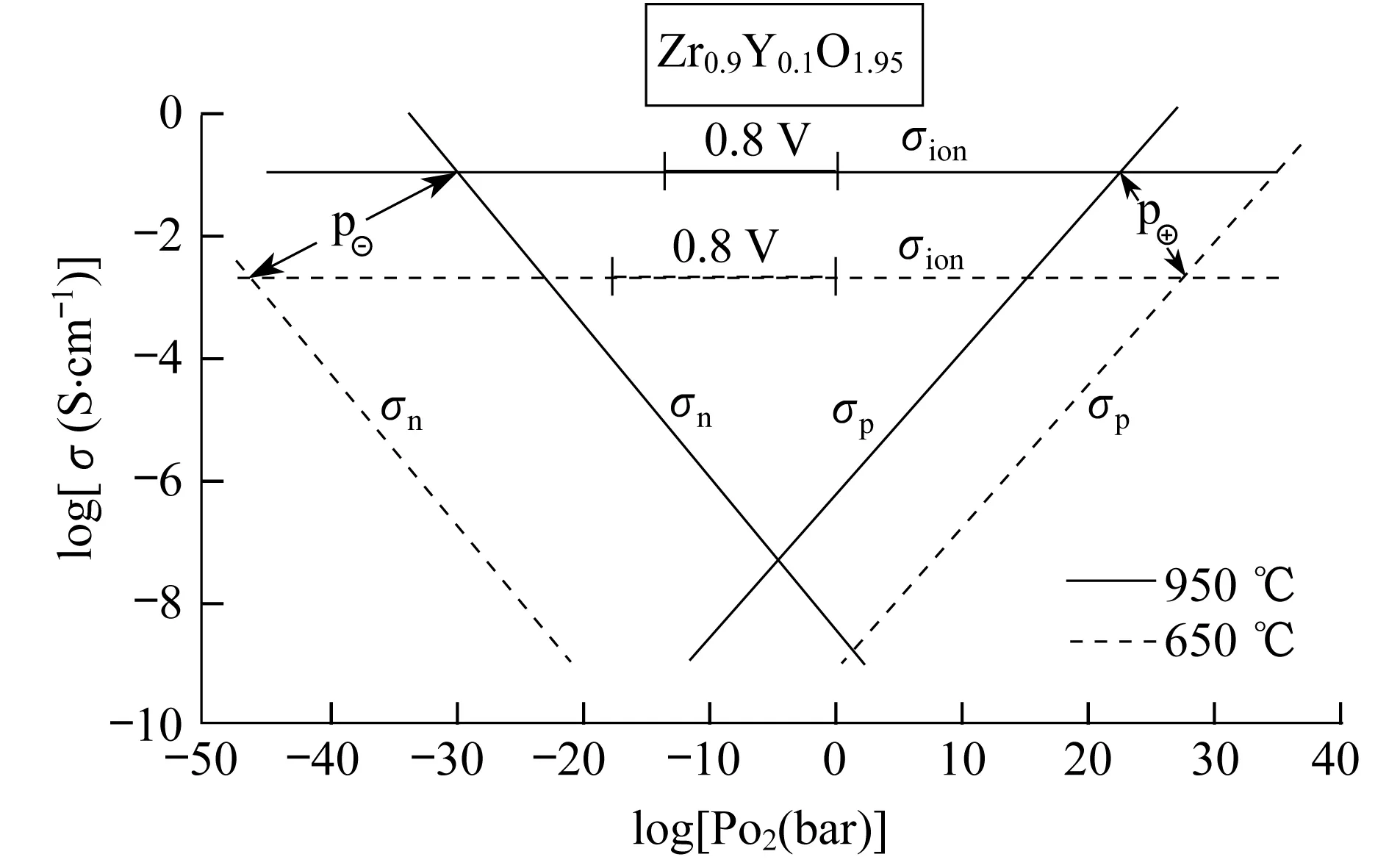
图5 Zr0.9Y0.101,95作为电介质材料的离子和电子电导率及氧分压的函数关系[63]
导电性能的研究的前提条件就是ScSZ材料必须是良好的离子导体,而不能有电子导通.Steele等[63]对YSZ材料进行了不同氧分压下的导电性能的测试,如图5所示,10% (物质的量分数)Y2O3含量的YSZ材料中,离子电导率在950 ℃时,在10-28~1025Pa大气压力的范围内都是常数,也就是说都是离子导通的.所以,YSZ材料是一种非常好的离子导体材料.有了这个前提条件,研究者就可以确保所研究的电性能是百分之百的离子电导率.通常研究电导率的方法是用交流阻抗谱的方法来研究,用这种方法,不仅可以得到材料在一定温度下的电阻和电容还可以将材料的晶体和晶界的电性能区分开.
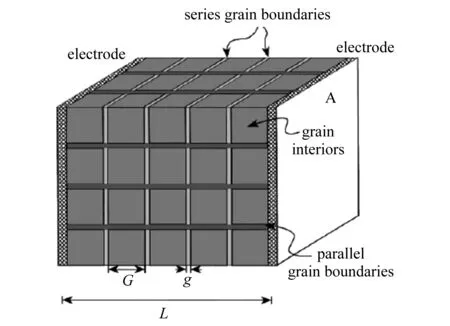
图6 多晶材料的“砖层结构”模型(晶粒被假设为正方形,晶界是平面状存在的)[64]
由于交流阻抗谱可以将被测材料的晶体和晶界的导电性能区分,所以就给研究者研究材料的晶界的特性带来极大的方便.晶界的研究一直是材料研究的热点问题,这是因为晶界上往往富集了杂质,并且呈现出完全不同的性能.对于ScSZ而言,在晶界上的电势以及导电机理和晶体内部是完全不同的.Haile等[64]应用砖层结构模型研究氧化物材料的质子导电性能.如图6所示,所谓砖层结构模型就是将被测样品的晶粒和晶界假设为正方型的结构,便于计算每个晶粒的尺寸,而晶界是以平面的状态存在的.经过Haile等[64]的计算和推导,证明电流不会从平行于电流方向的晶界中穿过,因此在计算晶界电阻时,只需要计算垂直于电流方向的晶界电阻即可.
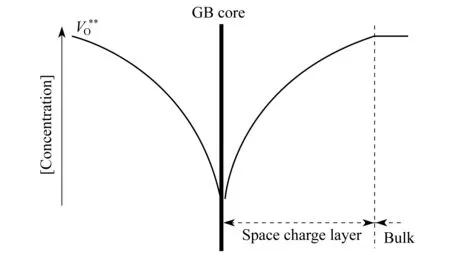
图7 晶界中导电离子形成的空间电势示意图
通过“砖层结构”模型,研究者就可以将材料的晶界层单独拿出来研究.Haile等[64]对YSZ材料的晶界做了研究.他们发现,YSZ材料经过烧结后,在晶界上会形成正电势,这样就造成了带正电的氧空位在晶界上被排斥,而且排斥的范围是1/2的晶界厚度.如图7所示,氧空位的浓度会随着与晶粒的距离变大而变小,直到达到1/2晶界厚度的时候达到最小.由于氧空位是YSZ材料中的导电离子的实际载体,所以氧空位浓度减小就会造成晶界上的离子电导率下降,直接导致了材料电导率的下降.
4 小 结
主要介绍了稀土掺杂ZrO2材料中的点缺陷(主要是氧空位)的形成原因、特点和相关的理论、机理,并且分析了这些材料在工业上特别是能源领域的应用前景,着重介绍了2种ZDC和ScSZ稀土元素掺杂的ZrO2材料.
ZDC的研究重点是温度和氧分压对其氧空位形成的影响,以及由此带来的热力学参数的变化.研究的目的是通过对这些基本原理的研究,使得此种材料可以被应用在太阳能驱动分解水,从而产生清洁能源的问题上.因此,这种材料是非常具有发展前景的新型能源材料,并可能成为我国未来的新能源储备材料.
ScSZ的研究重点是Sc2O3的掺杂含量对其氧空位数量的影响,以及氧空位作为离子导通的载体在晶体和晶界上的变化对材料导电性能的作用.研究的目的是使得此种材料可以作为一种潜在的优良固体燃料电池的电介质材料.固体燃料电池是一种有效的新型能源,并且已经在一些领域得到了应用.
[1] Heuer A H,Hobbs L W.Advances in Ceramics,Science and Technology of Zirconia [M].Columbus:The American Ceramic Society,1981.
[2] McCullough J D,Trueblood K N.Magnetism of sputtered Co/Cu multilayers and the annealing effects [J].Acta crystallogram,1959,12(7):507-509;
[3] Smith D K,Newkirk H K.Crystal structure of baddeleyite (monoclinic ZrO2) and its relation to polymorphism of ZrO2[J].Acta Crystallogram,1965,18:983-991.
[4] Howard C J,Hill R J,Reichert B E.Crystal structure of baddeleyite (monoclinic ZrO2) and its relation to polymorphism of ZrO2[J].Acta Crystallographica Section B,1988,44(2):116-120.
[5] Aldebert P,Traverse J P.Structure and ionic mobility of zirconia at high temperature [J].Journal of the American Ceramic Society,1985,68(1):34-40.
[6] Ackermann O R J,Garg S P,Rauh E G.High-temperature phase diagram for the system Zr [J].Journal of the American Ceramic Society,1977,60(7-8):341-345.
[7] 周玉.陶瓷材料学 [M].哈尔滨:哈尔滨工业大学出版社,1995.
Zhou Y.Ceramic Materials [M].Harbin:Harbin Institute of Technology Press,1995.
[8] 路新瀛,梁开明,顾守仁,等.氧空位对ZrO2相结构稳定性及相变过程的影响 [J].硅酸盐学报,1996,24(6):670-674.
Lu X Y,Liang K M,Gu S R,et al.Influence of oxygen vacancy on phase structure and transformation of zirconia [J].Journal of the Chinese Ceramic Society,1996,24(6):670-674.
[9] Bogicevic A,Wolverton C,Crosbie G M,et al.Defect ordering in aliovalently doped cubic zirconia from first principles [J].Physical Review B,2001,64(1):014106.
[10] Chiba R,Ishii T,Yoshimura F.Temperature dependence of ionic conductivity in (1-x)ZrO2-(x-y)Sc2O3-yYb2O3electrolyte material [J].Solid State Ionics,1996,91(3-4):249-256.
[11] Huang W,Shuk P,Greenblatt M,et al.Structural and electrical characterization of a novel mixed couductor:CeO2-Sm2O3-ZrO2solid solution [J].Journal of the Electrochemical Society,2000,147(11):4196-4202.
[12] Drennan J,Auchterlonie G.Microstructural aspects of oxygen ion conduction in solids [J].Solid State Ionics,2000,134(1-2):75-87.
[13] McEvoy A J.Thin SOFC electrolytes and their interfaces:A near-term research strategy [J].Solid State Ionics,2000,132(3-4):159-165.
[14] Minh N Q,Takahashi T.Science and Technology of Ceramic Fuel Cells [M/OL].Amsterdam:Elsevier,1995.http://xueshu.baidu.com/s?wd=paperuri%29&filter=sc_long_sign&tn=SE_xueshusource_2kduw22v&sc_vurl=http%3A%2F%2Fwww.sciencedirect.com%2Fscience%2Fbook%2F9780444895684&ie=utf-8&sc_us=17780966391681613573.
[15] Garvie R C.The occurrence of metastable tetragonal zirconia as a crystallite size effect [J].The Journal of Physical Chemistry,1965,69(4):1238-1243.
[16] Shukla S,Seal S,Rahman Z,et al.Effect of nanocrystallite morphology on the metastable tetragonal phase stabilization in Zirconia [J].Nano Letters,2002,2(9):989-993.
[17] Tsunekawa S,Ito S,Kawazoe Y,et al.Critical size of the phase transition form cubic to tetragonal in pure zirconia nanoparticles [J].Nano Letters,2003,3(7):871-875.
[18] Shukla S,Seal S,Vij R,et al.Reduced activation energy for grain growth in nanocrystalline Yttria-stabilized zirconia [J].Nano Letters,2003,3(3):397-401.
[19] Li P,Chen I W,Penner-Hahn J E.Effect of dopants on zirconia stabilization-an x-ray absorption study:I,trivalent dopants [J].Journal of the American Ceramic Society,1994,77(1):118-128.
[20] Ho S M.On the structural chemistry of zirconium oxide [J].Materials Science Engineering,1982,54(1):23-29.
[21] Badwal S P S.Effect of dopant concentration on electrical conductivity in the Sc2O3-ZrO2system [J].Journal of Materials Science,1987,22(11):4125-4132.
[22] Spiridonov F M,Popova L N,Popil′Skii R Y.On the phase relations and the electrical conductivity in the system ZrO2-Sc2O3[J].Journal of Solid State Chemistry,1970,2(3):430-438.
[23] Sugiura M,Ozawa M,Kanazawa T,et al.Development of innovative three-way catalysts containing ceria-zirconia solid solutions with high oxygen storage/relwase capacity [J].Bulletin of the Chemistry Society Japan,2005,78(5):752-767.
[24] Kaspar J,Fornasiero P,Hickey N.Automotive catalytic converters:current status and some [J].Catalysis Today,2003,77(4):419-449.
[25] Shelef M,Graham.G W,McCabe R W.Ceria and other oxygen storage components in automotive catalysts [M].London:Imperial College Press,2002:343-375.
[26] Ghenciu A F.Review of fuel processing catalysts for hydrogen production in PEM fuel cell systems [J].Current Opinion in Solid State and Materials Science,2002,6(5):389-399.
[27] Choung S Y,Ferrandon M,Krause T.Pt-Re bimetallic supported on CeO2-ZrO2mixed oxides as water-gas shift catalysts [J].Catalysis Today,2005,99(3-4):257-262.
[28] Liu X S,Ruettinger W,Farrauto R,et al.Deactivation of Pt/CeO2water-gas shift catalyst due to shutdown/startup modes for fuel cell applications [J].Applied Catalysis B:Enviromental,2005,56(1-2):69-75.
[29] Fu Q,Saltsburg H,Flytzani-Stephanopoulos M.Active nonmetallic Au and Pt species on ceria-based water-gas shift catalysts [J].Science,2003,301:935-938.
[30] Swartz D S L,Seabaugh M M,Dawson W J,et al.Fuel processing catalysts based on nanoscale ceria [J].Fuel Cells Bulletin,2004,4(30):7-10.
[31] Fletcher E A,Moen R L.Hydrogen-and oxygen from water [J].Science,1977,197(4308):1050-1056.
[32] Kogan A.Direct solar thermal splitting of water and on-site separation of the products-II [J]//Experimental feasibility study.International Journal of Hydrogen Energy,1998,23(2):89-98.
[33] Ihara S.Feasibility of hydrogen production by direct water splitting at high temperature [J].International Journal of Hydrogen Energy,1978,3(3):287-296.
[34] Chiang Y M,Birnie D P,Kingery W D.Physical Ceramics:Principles for Ceramic Science and Engineering(Mit Series in Materials Science & Engineering) [M].New York:Wiley,1996.
[35] Allnatt A R,Lidiard A B.Atomic Transport in Solids [M].Cambridge:Cambridge University Press,1993.
[36] Wellen M.2.Point Defect Relaxations [J].Materials Science Forum,2001,366-368:95-140.
[37] Weller M,Damson B,Lakki A.Mechanical loss of cubic zirconia [J].Journal of Alloys and Compounds,2000,310(1-2):47-53.
[38] Lakki A,Herzog R,Borchardt G.Mechanical loss,creep,diffusion and ionic conductivity of ZrO2-8mol%Y2O3polycrystals [J].Journal of European Ceramic Society,2005,20(3):285-296.
[39] Solier J D,Cachadia I,Dominguez-Rodriguez A.Ionic conductivity of ZrO2-12mol%Y2O3single crystals [J].Physical Review B,1993,48(6):3704-3712.
[40] Weller M,Herzog R,Scherrer S.Defects and phase transition in yttria-and Scandia-doped zirconia [J].Solid State Ionics,2004,175(1-4):329-333.
[41] Shannon R D.Revised effective ionic raii and systematic studies of interatomic distances in halides and chalcogenides [J].Acta Crystallographica Section A,1976,32(5):751-767.
[42] Ramamoorthy R,Sundararaman D,Ramasamy S.Ionic conductivity studies of ultrafine-grained yttria stabilized zirconia polymorphs [J].Solid State Ionics,1999,123(1-4):271-278.
[43] Politova T I,Irvine J T S.Investigation of scandia-yttria-zirconia system as an electrolyte material for intermediate temperature fuel cells—influence of yttria content in system (Y2O3)x(Sc2O3)(11-x)(ZrO2)89[J].Solid State Ionics,2004,168(1-2):153-165.
[44] Chueh C W,Haile M S.A thermochemical study of ceria:exploiting an old material for new modes of energy conversion and CO2mitigation [J].Philosophical Transactions of the Royal Society A,2010,368:3269-3294.
[45] Grigoriev S,Lyutikova E,Martemianov S,et al.Palladium-based electrocatalysts for PEM applications [C].The World Hydrogen Energy Conference (16th),Lyon France,June,2000:13-16.
[46] Abanades S,Legal A,Cordier A,et al.Investigation of reactive cerium-based oxides for H2production by thermochemical two-step water-splitting [J].Journal of Material Science,2010,45(15):4163-4173.
[47] Chueh W C,Falter C,Abbott M,et al.High-flux sola-driven thermochemical dissociation of CO2and H2O using nonstoichiometric ceria [J].Science,2010,330:1797-1801.
[48] Trovarelli A.Catalysis by Ceria and Related Materials [M].London:Imperial College Press,2002.
[49] Shinjoh H.Rare earth metals for automotive exhaust catalysts [J].Journal of Alloys and compounds,2006,408(18):1061-1064.
[50] Masui T,Ozaki T,Adachi G-Y,et al.Preparation of ceria-zirconia sub-catalysts for automotive exhaust cleaning [J].Journal of Alloys andcompounds,2000,303(9):49-55.
[51] Ozawa M,Kimura M,Isogai A.The application of Ce-Zr oxide solid solution to oxygen storage promoters in automotive catalysts [J].Journal of Alloys and Compounds,1993,193(1-2):73-75.
[52] Gong Z,Parag R S,Raymond J G et al.Oxidation enteropies and enthapies of ceria-zirconia solid solutions [J].Catalysis Today,2007,123(1-4):86-93.
[53] Mizutani Y,Hisada K,Yamamoto O,et al.From rare earth doped zirconia to 1kW solid oxide fuel cell system [J].Journal of Alloys and Compounds,2006,408:518-524.
[54] Kosacki I,Anderson H U,Ukai K,et al.Nonstoichiometry and electrical transport in Sc-doped zirconia [J].Solid State Ionics,2002,152(02):431-438.
[55] Yamamoto O,Arati Y,Imanishi N,et al.Electrical conductivity of stabilized zirconia with ytterbia and Scandia [J].Solid State Ionics,1995,79:137-142.
[56] Badwal S P S,Drennan J.Microstructure/conductivity relationship in the Scandia-zirconia system [J].Solid State lonics,1992,53-56:769-776.
[57] Dixon J M,Lagrange L D,Porter J T,et al.Electrical Resistivity of stabilized zirconia at elevated temperature [J].Journal of Electrochemistry Society,1963,110(4):276-280.
[58] Yutaka S.Phase transition temperature of ZrO2-Y2O3solid solutions (2.4~6 mol% Y2O3) [J].Solid State Ionics,1997,95(3-4):227-230.
[59] Wang J,Ong C L,Ng S C.Crystallization in seeded zirconia precipitates [J].Materials Letters,1996,27(4-5):239-246.
[60] Wang C M,Cargillll G S,Harmer M P,et al.Atomic structural environment of grain boundary segregated Y and Zr in creep resistant alumina from EXAFS [J].Acta materials,1999,47(12):3411-3422.
[61] Son H J,Lim T,Kim S H.Investigation of Scandia stabilized zirconia(ScSZ)-Yttria stabilized zirconia(YSZ) composite electrolyte for intermediate temperature fuel cells [J].Solid State Phenomena,2007,124-126:795-798.
[62] Liu M,He C,Wang Z W,et al.Investigation of (CeO2)x(Sc2O3)(0.11-x)(ZrO2)0.89(x=0.01-0.10) electrolyte materials for intermediate-temperature solid oxide fuel cell [J].Journal of Alloys and Compounds,2010,502(2):319-323.
[63] Steele B C H.Oxygen transport and exchange in oxide ceramics [J].Journal of Power Sources,1994,49:1-14.
[64] Haile M,West D L,Campbell J.The role of microstructure and processing on the proton conducting properties of gadolinium-doped barium cerate [J].Journal of Materials Research,1998,13(6):1576-1595.
Influenceofdopingofceriaandscandiaonthepointdefectsofzirconiabasedmaterial
TaoJingchao
(School of Materials Science and Engineering,Shanghai Jiao Tong University,Shanghai 200240,China)
The advanced properties of rare-earth oxide doped zirconia materials are closely related to the different types of point defects which exist in zirconia crystals.These point defects are mainly in the form of oxygen vacancies.The research sample is zirconia doped ceria (ZDC).This kind of doping doesn′t result the appearance of oxygen vacancy.But cerium is not a single valence element.It has two possible valences+4 and+3 which results the reducing or oxidizing of Ceria.The reducing and oxidizing of Ceria could result the dissociating of oxygen atom from internal crystal with the variation of oxygen partial pressure and temperature.The second type is hetero-valence doping.The research sample is Scandia stabilized Zirconia (ScSZ).The doping leads to the charge compensation which results the appearance of oxygen vacancy.The concentration of this kind of oxygen vacancy is a constant with the doping ratio of Scandia but not the function of oxygen partial pressure.
zirconia; point defect; oxygen vacancy
10.3969/J.ISSN.1000-5137.2017.06.008
2017-09-29
陶景超(1977-),男,博士,助理研究员,主要从事稀土掺杂氧化物陶瓷晶体结构、力学性能、电学性能等方面的研究.E-mail:taojingchao@sjtu.edu.cn
陶景超.氧化铈和氧化钪掺杂对氧化锆材料中点缺陷的影响 [J].上海师范大学学报(自然科学版),2017,46(6):835-844.
formatTao J C.Influence of doping of ceria and scandia on the point defects of zirconia based material [J].Journal of Shanghai Normal University(Natural Sciences),2017,46(6):835-844.
O 611.62
A
1000-5137(2017)06-0835-10
郁 慧)
