SAHA-CTSB对三阴乳腺癌MDA-MB-231细胞凋亡的诱导作用
2018-01-11孙玮璐韩翰
孙玮璐,韩翰
(1.沈阳医学院基础医学院临床医学专业2015级12班,辽宁 沈阳 110034;2.基础医学院生物化学与分子生物学教研室)
SAHA-CTSB对三阴乳腺癌MDA-MB-231细胞凋亡的诱导作用
孙玮璐1,韩翰2*
(1.沈阳医学院基础医学院临床医学专业2015级12班,辽宁 沈阳 110034;2.基础医学院生物化学与分子生物学教研室)
目的:探讨辛二酰苯胺异羟肟酸(SAHA)是否经由组织蛋白酶B(CTSB)的有效调控诱导人乳腺癌细胞株MDA-MB-231细胞凋亡的发生。方法:采用Western blot及ELISA法检测SAHA、CTSB抑制剂(Cystain C)对乳腺癌细胞中CTSB表达的影响;采用Muse自动分析仪检测SAHA、Cystain C对乳腺癌MDA-MB-231细胞活力及凋亡的影响。结果:Cystatin C对乳腺癌细胞中CTSB的有效抑制浓度为100 ng/ml;Cystain C和SAHA共同作用乳腺癌细胞后,乳腺癌细胞活力及凋亡细胞比率较单独SAHA处理组相比恢复明显,差异均有统计学意义。结论:SAHA对乳腺癌的生长抑制作用需要CTSB的参与。
活乳腺癌;SAHA;CTSB;凋亡
乳腺癌是全球女性最常见的恶性肿瘤[1-2]。据统计,在过去的20年中,全球乳腺癌绝对数量上升了1.4倍,我国每年新发女性乳腺癌病例约27.9万,位居女性发病首位,且三阴乳腺癌发病比例越来越大[3-4]。目前,乳腺癌的治疗仍以手术为主,辅助放疗和化疗,虽然有一定的疗效,但仍存在严重的不良反应和普遍的耐药现象[5-6]。
组蛋白去乙酰化酶抑制剂(histone deacetylase inhibitor,HDACi)作为抗肿瘤药物为探索女性恶性肿瘤治疗提供了新方向[7-9]。辛二酰苯胺异羟肟酸(suberoylanilide hydroxamic acid,SAHA)是目前已知最经典的HDACi之一,研究表明,SAHA对乳腺癌、神经胶质瘤、非小细胞肺癌、结肠癌、卵巢癌等均有高效杀伤作用,并且不良反应较少[10-12]。
组织蛋白酶B(Cathepsin B,CTSB)是溶酶体内半胱氨酸组织蛋白酶,属于木瓜蛋白酶家族,其广泛地参与蛋白质的降解,并在各种生理和病理过程中发挥重要作用[13-14],随着研究的深入,发现其与细胞凋亡有着密切的联系[15-16]。
研究表明,SAHA可通过影响乳腺癌细胞周期来抑制细胞增殖[17-19],但其全部作用靶点并没有阐明,因此,有针对性地筛选出SAHA作用的新效应靶点是十分必要的。本文选取三阴乳腺癌细胞株MDA-MB-231,探讨SAHA是否经由CTSB的有效调控,启动细胞凋亡反应,从而抑制乳腺癌细胞的生长增殖。
1 材料与方法
1.1 材料 人乳腺癌细胞株MDA-MB-231购自美国ATCC细胞库;Leibovitz′s L-15培养基、胎牛血清、青霉素以及链霉素购自美国Thermo公司;SAHA、CTSB抑制剂(Cystain C)购自美国Sigma-Aldrich 公司;Muse Annexin V&Dead Cell、Muse Count&Viability试剂盒购自德国Merck Millipore公司;Human Pro-Cathepsin B ELISA试剂盒购自美国R&D公司;其他的化学试剂购自美国Sigma-Aldrich公司。
1.2 方法
1.2.1 细胞培养 将人乳腺癌细胞株MDA-MB-231培养于含15%胎牛血清的Leibovitz′s L-15培养基(含100 U/ml的青霉素、100 μg/ml的链霉素),37℃、5%CO2的条件下传代培养。
1.2.2 Western blot法检测SAHA、Cystain C对乳腺癌细胞中CTSB的影响 将5×105个/ml的MDAMB-231细胞接种于6孔板各孔内,待细胞铺满率>75%进行L-15无血清同步化处理后,加入5 μmol/L的SAHA与不同浓度的CTSB抑制剂Cystain C(0、20、40、60、80、100 ng/ml)共同培养48 h,收集细胞后,采用RIPA蛋白裂解液提取出的蛋白应用BCA蛋白分析试剂盒测定,调整蛋白浓度。蛋白煮沸变性后,SDS-PAGE凝胶电泳分离蛋白并转移至PVDF膜上。封闭液封闭1 h,一抗4℃过夜。TBST冲洗10 min,3次,将膜放入辣根过氧化物酶标记的山羊抗兔二抗中,室温中摇床振荡60 min,用TBST洗膜10 min,3次,将等体积混合的ECL化学发光底物A、B液均匀加在PVDF膜上,显色5 min。化学发光成像系统曝光后,计算膜上各抗体标记点的灰度值。
1.2.3 ELISA检测SAHA、Cystain C对乳腺癌细胞中CTSB表达量的影响 将5×105个/ml的MDAMB-231细胞接种于6孔板各孔内,待细胞铺满率>75%进行L-15无血清同步化处理后,加入5 μmol/L的SAHA与不同浓度的CTSB抑制剂Cystain C(0、20、40、60、80、100 ng/ml)共同培养48 h,加入裂解液进行裂解后,经酶标抗体孵育、底物显色处理,在450 nm处用酶标仪测定SAHA和Cystain C各处理组对MDA-MB-231细胞中CTSB蛋白表达的影响。
1.2.4 细胞活力检测 将5×105个/ml乳腺癌MDAMB-231细胞分别接种于6孔板各孔中,待细胞铺满率>75%进行无血清同步化处理。MDA-MB-231细胞加入5 μmol/L SAHA和100 ng/ml Cystain C共同孵育。取2×105个乳腺癌MDA-MB-231细胞和450 μl Count&Viability试剂共同孵育5 min。通过Muse自动细胞分析仪(德国MerckMillipore公司)Cell Count&Viability software module分析各处理因素诱导MDA-MB-231细胞活力发生的情况。1.2.5 细胞凋亡检测 将5×105个/ml乳腺癌MDAMB-231细胞分别接种于6孔板各孔中,待细胞铺满率>75%进行无血清同步化处理。MDA-MB-231细胞加入5 μmol/L SAHA和100 ng/ml Cystain C共同孵育。取2×105个乳腺癌MDA-MB-231细胞和100 μl Muse Annexin V&Dead Cell试剂室温孵育20 min。应用自动细胞分析仪Muse Cell Analyzer检测各处理因素诱导MDA-MB-231细胞凋亡发生的情况。
1.3 统计学方法 采用SPSS 20.0软件进行统计学分析,结果以均值±标准差表示,多组数据比较采用单因素方差分析,2组比较采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 SAHA、Cystain C对乳腺癌细胞中CTSB的影响 Western blot检测结果显示:与空白对照组相比,SAHA能够显著增加乳腺癌细胞中CTSB的蛋白含量,当加入CTSB特异性抑制剂Cystain C后,发现Cystain C对SAHA引起的CTSB表达升高具有不同抑制作用,仅Cystain C浓度达到100 ng/ml抑制作用达到最强,与SAHA+0 ng/ml Cystatin C组比较,差异有统计学意义,见图1。
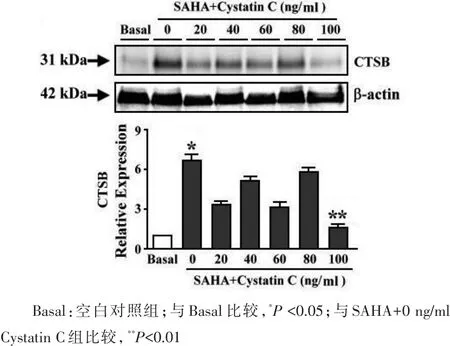
图1 Western blot检测SAHA、Cystain C对乳腺癌细胞MDA-MB-231中CTSB表达的影响
ELISA结果也验证了上述实验结果,与空白对照组相比,SAHA可显著升高乳腺癌MDA-MB-231细胞中CTSB的相对表达量。低浓度的Cystatin C不能有效地抑制SAHA引起的CTSB相对表达量的升高,只有浓度达到100 ng/ml时,CTSB的相对表达量才有所下降,且与SAHA+0 ng/ml Cystatin C组比较,差异有统计学意义,见图2。
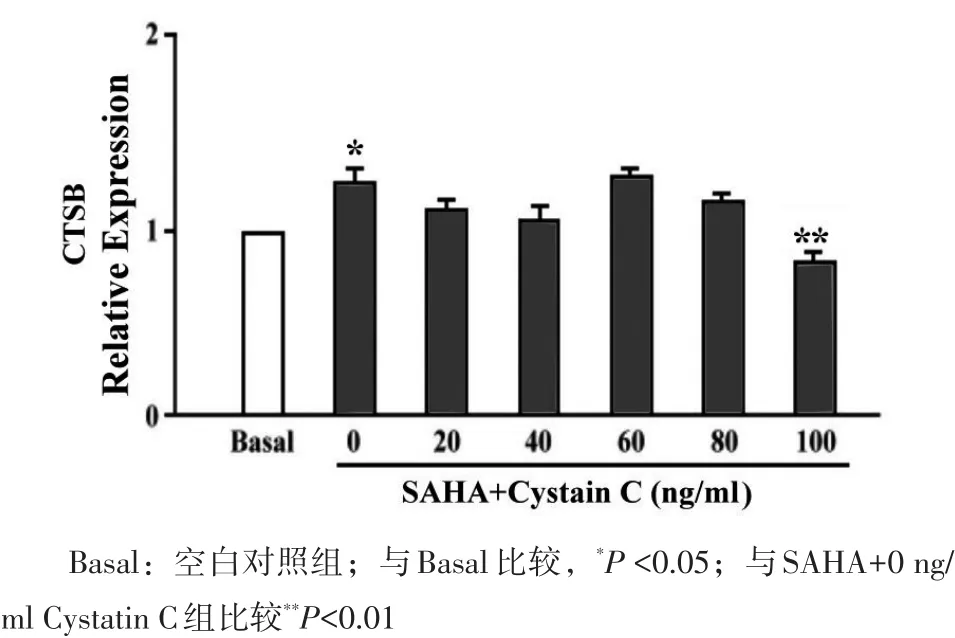
图2 ELISA检测SAHA、Cystain C对乳腺癌细胞MDAMB-231中CTSB表达的影响
2.2 SAHA、Cystain C对乳腺癌细胞活力的影响 为明确CTSB在SAHA抑制乳腺癌细胞生长过程中的作用,将100 ng/ml Cystain C作用于MDAMB-231细胞中以抑制CTSB的表达,分析SAHA对乳腺癌细胞活力的影响。结果发现,单独SAHA能够显著抑制乳腺癌细胞的增殖,活细胞比率下降(P<0.05);单独Cystain C对乳腺癌细胞影响不大,细胞活力无明显的变化;而Cystain C和SAHA共同作用乳腺癌细胞后,乳腺癌细胞活力较单独SAHA处理组相比恢复明显,MDA-MB-231活细胞比率高于单独SAHA处理组(P<0.05),见图3。
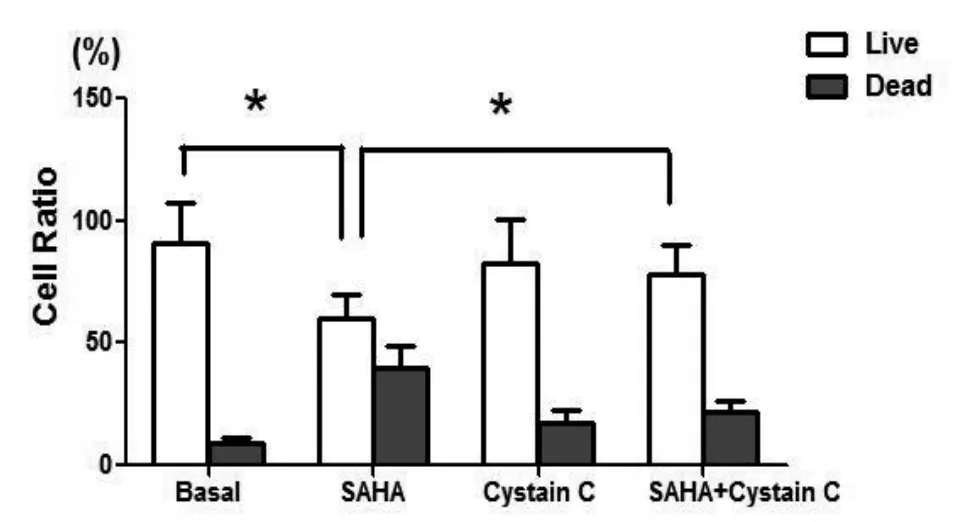
图3 Muse自动细胞分析仪分析SAHA、Cystain C对乳腺癌细胞活力的影响(*P<0.05)
2.3 SAHA、Cystain C对乳腺癌细胞凋亡的影响 细胞凋亡结果显示:单独SAHA能够显著诱导乳腺癌细胞的凋亡,凋亡细胞(含早、晚期凋亡)和死细胞比率升高(P<0.05);单独Cystain C作用于乳腺癌MDA-MB-231细胞后凋亡细胞(含早、晚期凋亡)和死细胞比率与空白对照组相比相差不大;而Cystain C和SAHA共同作用乳腺癌细胞后,乳腺癌MDA-MB-231凋亡细胞(含早、晚期凋亡)和死细胞比率较SAHA组下降(P<0.05),见图4。
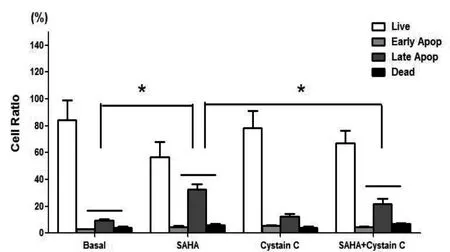
图4 Muse自动细胞细胞仪分析SAHA、Cystain C对乳腺癌细胞凋亡的影响(*P<0.05)
3 讨论
细胞凋亡是一个高度程序化的主动过程,由一系列相关基因进行调控[20]。在机体发育过程中,细胞凋亡在组织和器官的构建中起着重要的作用,是通过启动细胞自身的内部死亡机制而产生的一种细胞死亡方式,诱导肿瘤细胞凋亡是许多抗肿瘤药物的作用机制之一[21]。
前期研究确定了5 μmol/L SAHA作用三阴乳腺癌MDA-MB-231细胞48 h后可明显抑制乳腺癌细胞的生长[11],本研究进一步发现,5 μmol/L的SAHA可导致乳腺癌细胞活力下降,诱导乳腺癌细胞凋亡。Western blot和ELISA等实验结果显示,SAHA作用乳腺癌细胞过程中伴随着CTSB蛋白表达量的增高。CTSB可以调节细胞凋亡,调节其他蛋白酶的表达,与细胞凋亡存在密切关系[15-16]。SAHA是否通过调控细胞中CTSB的表达从而诱导细胞凋亡的产生目前还无法确定。我们利用CTSB特异性抑制剂Cystain C阻断乳腺癌MDAMB-231细胞中CTSB的表达,检测CTSB在SAHA抑制乳腺癌细胞生长中的调控作用。
本研究Western blot实验结果显示,当Cystatin C浓度达到100 ng/ml时,能够显著抑制SAHA引起的乳腺癌细胞中CTSB的升高,ELISA证实了上述实验结果。接下来,我们将筛选出的Cystain C、SAHA作用于MDA-MB-231细胞中,分别分析了乳腺癌细胞活力和细胞凋亡的变化情况。发现当利用Cystain C抑制乳腺癌细胞中CTSB的表达时,对乳腺癌细胞影响不大,细胞活力及凋亡无明显的变化,说明CTSB功能失活对乳腺癌细胞的生长增殖没有明显调控作用,同时也表明Cystain C不会产生细胞毒性,可以作为本实验中独立因素抑制MDA-MB-231细胞中CTSB的表达;而单独SAHA处理显著抑制了乳腺癌细胞的生长,表现为细胞活力下降,细胞凋亡细胞(含早、晚期凋亡)和死细胞比率明显上升;用Cystain C抑制CTSB的表达后,SAHA处理的乳腺癌MDA-MB-231细胞的活细胞比率较SAHA单独处理组升高,而凋亡细胞(含早、晚期凋亡)和死细胞比率较SAHA单独处理组降低。实验结果表明抑制细胞中CTSB的表达能够明显阻抑SAHA对乳腺癌细胞的生长抑制效应,因此,SAHA对乳腺癌细胞的凋亡诱导作用需要CTSB的调控。
综上所述,SAHA的抗肿瘤作用虽已被证实,但其全部作用靶点并未完全阐明。而本研究初步阐明了SAHA经CTSB介导产生细胞凋亡,从而抑制了乳腺癌细胞的生长增殖。
[1] Parkin DM,Bray F,Ferlay J,et al.Global cancer statistics,2002[J].CA Cancer J Clin,2005,55(2):74-108.
[2] Jemal A,Bray F,Center MM,et al.Global cancer statistics[J].CA Cancer J Clin,2011,61(2):69-90.
[3]陈万青,郑荣寿,张思维,等.2012年中国恶性肿瘤发病和死亡分析[J].中国肿瘤,2016,25(1):1-8.
[4] Al-Hajj M,Wicha MS,Benito-Hernandez A,et al.Prospective identification of tumorigenic breast cancer cells[J].Proc Natl Acad Sci U S A,2003,100(7):3983-3988.
[5] Poncet B,Bachelot T,Colin C,et al.Use of the monoclonal antibody anti-HER2 trastuzumab in the treatment of metastatic breast cancer: a cost-effectiveness analysis[J].Am J Clin Oncol,2008,31(4): 363-368.
[6] Müller A,Homey B,Soto H,et al.Involvement of chemokine receptors in breast cancer metastasis[J].Nature, 2001,410(6824):50-56.
[7] Marks PA,Xu WS.Histone deacetylase inhibitors:Potential in cancer therapy[J].J3 Cell Biochem,2009,107(4):600-608.
[8] Bolden JE,Peart MJ,Johnstone RW.Anticancer activities of histone deacetylase inhibitors[J].Nat Rev Drug Discov,2006,5(9):769-784.
[9] Kleer CG,Cao Q,Varambally S,et al.EZH2 is a marker of a ggressive breast cancer and promotes neoplastic transformation of breast epithelial cells[J].Proc Natl Acad Sci U S A,2003,100(20):11606-11611.
[10] Li GC,Zhang X,Pan TJ,et al.Histone deacetylase inhibitor trichostatin A inhibits the growth of bladder cancer cells through induction of p21WAF1 and G1 cell cycle arrest[J].Int J Urol,2006,13(5): 581-586.
[11] Feng X,Han H,Zou D,et al.Suberoylanilide hydroxamic acid-induced specific epigenetic regulation controls Leptininduced proliferation of breast cancer cell lines[J].Oncotarget,2017,8(2):3364-3379.
[12] Kelly WK, Richon VM,O′Connor O,et al.Phase I clinical trial of histone deacetylase inhibitor: suberoylanilide hydroxamic acid administered intravenously[J].Clin Cancer Res, 2003, 9(10 Pt 1): 3578-3588.
[13] Guicciardi ME,Leist M,Gores GJ.Lysosomes in cell death[J].Oncogene,2004,23(16): 2881-2890.
[14] Hook GR, Yu J, Sipes N, et al.The cysteine protease cathepsin B is a key drug target and cysteine protease inhibitors are potential therapeutics for traumatic brain injury [J].J Neurotrauma,2014,31(5):515-529.
[15] Yang C, Wu C, Xu D, et al.AstragalosideII inhibits autophagic flux and enhance chemosensitivity of cisplatin in human cancer cells[J].Biomed Pharmacother, 2016, 81:166-175.
[16] Wootz H,Weber E,Korhonen L,et al.Altered distribution and levels of cathepsinD and cystatins in amyotrophic lateral sclerosis transgenic mice:possible roles in motor neuron survival[J].Neuroscience,2006,143(2):419-430.
[17]聂建云,刘馨,金从国,等.组蛋白去乙酰化酶抑制剂对乳腺癌细胞株MCF-7增殖周期的影响[J].中国综合临床,2009,25(12):1238-1240.
[18]聂建云,陈杨萍,黄云超.辛二酰苯胺异羟肟酸(SAHA)对乳腺癌细胞增殖影响的动物实验研究[J].实用癌症杂志,2011,26(3):221-225.
[19]周伟强.SAHA抑制瘦素诱导的乳腺癌MDA-MB-231细胞增殖的分子机制[J].沈阳医学院学报,2017,19(2):84-86,90.
[20] Green DR,Reed JC.Mitochondria and apoptosis[J].Science,1998,281(5381):1309-1312.
[21] Hengartner MO.The biochemistry of apoptosis[J].Nature,2000,407(6805):770-776.
SAHA Induces Apoptosis in Triple-negative Breast Cancer Cell MDA-MB-231 via the Regulation of CathepsinB
SUN Weilu1,HAN Han2*
(1.Class 12 Grade 2015,Shenyang Medical College Shenyang 110034,China;2.Department of Biochemistry)
Objective:To clarify the regulation role of cathepsin B (CTSB) in cell apoptosis induced by SAHA in triplenegative breast cancer cell MDA-MB-231.Methods:MDA-MB-231 cells were incubated with SAHA and/or Cystain C,the expression of CTSB was determined by Western blot and ELISA,the cell viability and apoptosis of MDA-MB-231 cells were detected by Muse cell analyzer.Results:The optimal concentration of Cystain C was 100 ng/ml.The cell viability and apoptosis test demonstrated that the combination treatment of Cystatin C and SAHA significantly resumed the inhibitory effect caused by SAHA alone.Conclusion:CTSB plays an important role in apoptosis induced by SAHA in triple-negative breast cancer cell MDA-MB-231.
breast cancer;SAHA;CTSB;apoptosis
R725
A
1008-2344(2017)06-0530-04
10.16753/j.cnki.1008-2344.2017.06.021
沈阳医学院科研基金项目(No.20141004);沈阳医学院大学生科研课题(No.20179002)
韩翰(1982—),女(汉),讲师,研究方向:肿瘤分子机制研究.E-mail:hanhan82831@163.com
2017-07-07
(文敏编辑)
