高效液相色谱-串联质谱法测定荔枝花粉和花蜜中腈菌唑和苯醚甲环唑残留
2018-01-11王思威刘艳萍孙海滨杜兰娟徐能莉
王思威, 刘艳萍, 孙海滨, 杜兰娟, 徐能莉
(广东省农业科学院植物保护研究所, 广东省植物保护新技术重点实验室, 广东 广州 510640)
荔枝(LitchichinensisSonn.)为亚热带常绿果树,世界上荔枝栽培面积最广和产量最大的国家是中国,主要集中在广东、海南等地[1]。南方高温高湿的气候环境极易导致荔枝发生病害,尤其在花期、果实发育及成熟期。腈菌唑(myclobutanil)和苯醚甲环唑(difenoconazole)均属于三唑类杀菌剂,具有内吸性强、持效期长的特点,是用于荔枝树炭疽病防治的主要药剂。荔枝花为雌雄同株异花异熟,需要蜜蜂等昆虫媒介才能较好地完成授粉。蜜汁和花粉是蜜蜂访花的主要诱物,通过其授粉可使荔枝坐果率提高248% ~290%[2]。近年来,化学农药投入量巨大,蜜蜂在花期采集含有残留农药(尤其是强内吸性、长持效期的农药)的花蜜和花粉,对其生理行为构成巨大影响。一般认为,杀菌剂对非靶标生物低毒,故在实际使用过程中极少关注杀菌剂的毒性。其实不然,许多杀菌剂对昆虫有直接杀伤作用,且随着杀菌剂使用量的逐年增多,杀菌剂对包括蜜蜂在内的非靶标生物存在潜在的和未知的风险[3,4]。腈菌唑对蜜蜂毒性为中毒,且对蜜蜂具有中等风险性[4];苯醚甲环唑虽对蜜蜂毒性为低毒,但对蜜蜂具有中等风险性[5],在蜜源作物花期时应慎重使用。因此,通过建立分析方法检测杀菌剂在蜜蜂直接接触的花粉、花蜜中的残留水平,评估杀菌剂对蜜蜂等有益生物的安全性十分必要。
国内外有关腈菌唑和苯醚甲环唑的分析方法主要有气相色谱法(GC)[6-11]、高效液相色谱法(HPLC)[12,13]、气相色谱- 质谱法(GC- MS)[14-19]和液相色谱- 串联质谱法(LC- MS/MS)[20-27]等。主要的前处理方法有液液分配萃取+填充柱净化、固相萃取(SPE)和QuEChERS净化等。液液分配萃取法需要消耗大量溶剂且不环保;填充柱净化耗时耗
力,步骤繁琐,不适于大批量样品的分析;SPE净化过程也较复杂且价格偏高;QuEChERS方法快速、操作简单,是目前较为通用的前处理方法。目前有关腈菌唑和苯醚甲环唑分析的基质主要有蔬菜、谷物和果树,暂未见分析花粉和花蜜基质的相关报道。
本研究应用改良的QuEChERS结合高效液相色谱- 串联质谱技术,建立了测定荔枝花粉和花蜜中腈菌唑和苯醚甲环唑的分析方法。该法简便快速,极大地提高了分析效率。
1 实验部分
1.1 仪器、试剂与材料
Agilent LC- 1200高效液相色谱- 串联AB SCIEX 4000Q TRAP质谱仪,配电喷雾电离(ESI)源;Milli- Q超纯水机(美国Millipore公司); LD5- 2A离心机(北京雷勃尔医药公司); OA- SYS氮吹仪(美国Organomation Associates公司); XW- 80A涡旋仪(上海精科有限公司)。
乙腈(色谱纯,美国Fisher公司);甲酸(色谱纯,美国Fluka公司);无水硫酸镁、氯化钠(国药集团化学试剂有限公司);十八烷基键合硅胶吸附剂(C18)、N- 丙基乙二胺吸附剂(PSA)(上海安谱实验科技股份有限公司)。标准品:腈菌唑纯度为99.8% (美国Chem Service公司)、苯醚甲环唑纯度为99.9% (美国AccuStandard公司)。
1.2 标准溶液的配制
准确称取适量腈菌唑和苯醚甲环唑标准品,用乙腈稀释成1 000 mg/L的标准储备液;分别准确吸取1 mL腈菌唑和苯醚甲环唑标准储备液,用含0.1%(v/v)甲酸的乙腈溶液定容至10 mL,配制100 mg/L混合标准溶液,于-20 ℃避光保存。
1.3 样品前处理
1.3.1花粉
准确称取荔枝花粉样品2.0 g,置于50 mL离心管中,加入10 mL乙腈、8 mL超纯水和3 mL正己烷进行提取,然后加入1 g氯化钠,立即用手剧烈振荡,再涡旋1 min,然后以5 000 r/min离心2 min。取5 mL乙腈层溶液,置于加有0.9 g无水硫酸镁、0.15 g PSA和0.15 g C18的离心管中,立即用手剧烈振荡,然后涡旋10 s,再以5 000 r/min离心2 min。取2 mL上清液,置于5 mL锥形管中,用氮吹仪吹至约50 μL,用含0.1%(v/v)甲酸的乙腈溶液定容至2 mL,过0.22 μm有机滤膜,待HPLC- MS/MS测定。
1.3.2花蜜
准确称取荔枝花蜜样品5.0 g,置入50 mL离心管中,加入10 mL超纯水,混匀,加入10 mL乙腈提取,再加入1 g氯化钠,立即用手剧烈振荡,涡旋1 min,然后以5 000 r/min离心2 min。取4 mL乙腈层溶液,置于加有0.9 g无水硫酸镁和0.15 g PSA的离心管中,立即用手剧烈振荡,然后涡旋10 s,再以5 000 r/min离心2 min。取1 mL上清液,置于5 mL锥形管中,用氮吹仪吹至约50 μL,用含0.1%(v/v)甲酸的乙腈溶液定容至2 mL,过0.22 μm有机滤膜,待HPLC- MS/MS测定。
1.4 色谱-质谱条件
色谱柱:Poroshell- 120 EC- C18柱(150 mm×3.0 mm, 2.7 μm);柱温:35 ℃;流动相:0.1%(v/v)甲酸水溶液- 乙腈(25∶75, v/v),等度洗脱;分析时间:7 min;流速:0.4 mL/min;进样量:5 μL。
离子源:ESI源,正离子扫描;扫描模式:选择离子监测(SIM)模式;离子源温度:550 ℃;气帘气压力:0.2 MPa;毛细管电压:5 500 V;雾化气压力:0.3 MPa;辅助气压力:0.3 MPa。其他质谱参数见表1。

表 1 腈菌唑和苯醚甲环唑的保留时间、母离子、子离子、去簇电压和碰撞能量
* Quantitative ion.
2 结果与讨论
2.1 前处理条件的优化
2.1.1提取剂的选择
实验考察了乙酸乙酯、丙酮和乙腈作为提取剂时目标农药的回收率。结果显示,由于乙酸乙酯微溶于水,导致其不能将强极性的苯醚甲环唑从基质中全部提取,回收率较低;丙酮易溶于水,对目标农药的回收率较高,但其提取过程中共萃取物较多(花粉中的脂类、色素等),导致基质的净化效果较差,增加了后续净化的难度,且分层效果不显著,不易于后续净化步骤的进行;乙腈与水互溶,通过氯化钠的盐析作用,可以达到水相- 有机相界面的良好分层,提高了目标农药的回收率,且基质较干净,是优良的提取溶剂,故选为实验所用。
由于花粉中含有较多的脂类物质,因此在提取过程中加入正己烷以达到去除脂类物质干扰的目的,增强净化效果。除脂前后腈菌唑和苯醚甲环唑混合标准溶液(100 μg/L)在选择离子监测模式下的总离子流色谱图见图1。

图 1 加入正己烷(a)前、(b)后腈菌唑和苯醚甲环唑混合标准 溶液(100 μg/L)在SIM模式下的总离子流色谱图Fig. 1 Total ion chromatograms of myclobutanil and difenoconazole in a mixed standard (100 μg/L) under selected ion monitoring (SIM) mode (a) before and (b) after adding n- hexane
2.1.2吸附剂的选择
花粉中含有大量脂类、黄酮类和糖类等成分,花蜜中主要含有糖类物质,针对不同基质的特点,选择不同吸附剂进行净化来降低基质效应的影响,以达到准确定量的目的。无水硫酸镁是干燥剂,主要用于除去花粉和花蜜中多余的水分,避免目标农药溶解于水中而不易被提取到乙腈中,导致回收率不足;PSA是弱阴离子交换填料,可有效去除样品中的脂肪酸、色素、糖类等物质;C18吸附剂是硅胶基质键合十八烷基填料,比表面积大,具有较强的吸附能力,能够去除脂肪、脂类等非极性干扰物。花粉中含有脂肪酸和脂肪酸酯类化合物,通过PSA+C18联合应用能够明显去除脂类物质的干扰,改善花粉的净化效果。相较于花粉,花蜜中的杂质较少,大部分是糖类物质,通过无水硫酸镁和PSA填料的加入,能够将糖类物质吸附,且基质较为干净,目标物的添加回收率满足分析要求。

图 2 腈菌唑和苯醚甲环唑在二级质谱模式下的质谱图和裂解机理Fig. 2 Mass spectra and pyrolysis mechanisms of myclobutanil and difenoconazole under MS/MS mode
2.1.3吸附剂加入量的选择
实验考察了加入0.05、0.10、0.15和0.20 g PSA对花粉中2种目标农药回收率的影响。结果表明,当PSA加入量为0.05 g和0.10 g时,目标农药的回收率分别为83.1% ~86.7%和85.9% ~92.0% ; 加入量为0.15 g与0.20 g时,目标农药的回收率相近,分别为88.7% ~94.6%和82.8% ~92.7% ,随着PSA用量的增加,基质中的色素越少,颜色越淡。综合节约成本和保证回收率的需要,选择加入0.15 g的PSA。由于花蜜的基质相对花粉简单,直接采用0.15 g PSA用于花蜜的净化,回收率为84.7% ~95.8% ,满足分析要求。
比较了加入0.05、0.10、0.15和0.20 g C18吸附剂对花粉中2种目标农药回收率的影响。结果显示,C18加入量为0.15 g时,花粉中2种目标农药的回收率为83.4% ~92.9% 。C18加入量过少,不能达到去除脂类物质的明显效果;加入量过多,影响目标物的添加回收率。因此,花粉净化时选择C18加入量为0.15 g。
2.2 流动相的选择
实验考察了甲醇- 水和乙腈- 水对腈菌唑和苯醚甲环唑色谱分离度和响应强度的影响。结果显示,甲醇的黏度较大,容易引起柱压升高[28],不利于色谱柱及相关仪器配件的长久使用,且2种目标农药的色谱峰对称性较差;乙腈- 水对目标农药的分离程度和响应强度均较好,是ESI+模式下优先选择的流动相组成。水相中加入0.1%(v/v)的甲酸可以促成[M+H]+离子峰的形成,以[M+H]+作为母离子能够获取高强度的离子碎片,增强目标农药的响应值,进而提高仪器检测的灵敏度。
2.3 质谱条件的优化
采用单针自动进样分析腈菌唑和苯醚甲环唑标准溶液(100 μg/L),优化质谱参数。通过一级质谱扫描获取目标农药的准分子离子峰,优化去簇电压;准分子离子进入二级质谱后发生断裂或重排等裂解反应,产生不同m/z的离子碎片,从而优化碰撞能量、明确定量和定性离子。二级离子质谱图及可能的裂解机理见图2。
2.4 基质效应
基质效应能够影响目标农药的准确定量,通过基质匹配标准溶液能够有效消除基质效应的影响。基质效应表现为对目标化合物信号的增强或抑制作用,通常采用基质匹配标准溶液与溶剂标准溶液斜率的比值进行评价,比值大于1,表现为基质增强效应,相反则为基质抑制效应。实验结果表明,腈菌唑在花粉和花蜜基质中斜率的比值均小于1,表明存在基质抑制效应;苯醚甲环唑在花粉和花蜜基质中斜率的比值均大于1,存在基质增强效应(见表2)。本实验采用基质匹配标准溶液校正基质效应的方法,以确保实验结果的准确性。
2.5 方法学评价
2.5.1线性范围和检出限
在1~100 μg/L范围内,腈菌唑和苯醚甲环唑在花粉和花蜜基质匹配标准溶液中的峰面积(y)与对应的质量浓度(x, μg/L)呈良好的线性关系,相关系数(r2)均大于0.999 0(见表2)。以3倍和10倍信噪比(S/N)确定方法的检出限(LOD)和定量限(LOQ),腈菌唑和苯醚甲环唑的LOD分别为0.25 μg/kg和0.50 μg/kg, LOQ分别为0.83 μg/kg和1.7 μg/kg。

表 2 腈菌唑和苯醚甲环唑在溶剂和基质匹配标准溶液中的线性方程、相关系数和基质效应
y: peak area;x: mass concentration, μg/L.
2.5.2回收率和精密度
在10、50和100 μg/kg的添加水平下,腈菌唑和苯醚甲环唑在荔枝花粉和花蜜中的平均加标回收率分别为87.0% ~95.2%和90.1% ~96.4% ,相对标准偏差(RSD)分别为1.2% ~3.6%和0.7% ~4.1%(见表3),符合残留分析检测要求。
2.6 实际样品检测
对某地区5个示范园的荔枝花粉和花蜜样品进行检测,花粉和花蜜样品中腈菌唑的含量均低于检出限;花粉样品中苯醚甲环唑的含量为0.6~0.9 μg/kg,花蜜样品中苯醚甲环唑的含量低于检出限。花粉和花蜜样品在SIM模式下的总离子流色谱图见图3。
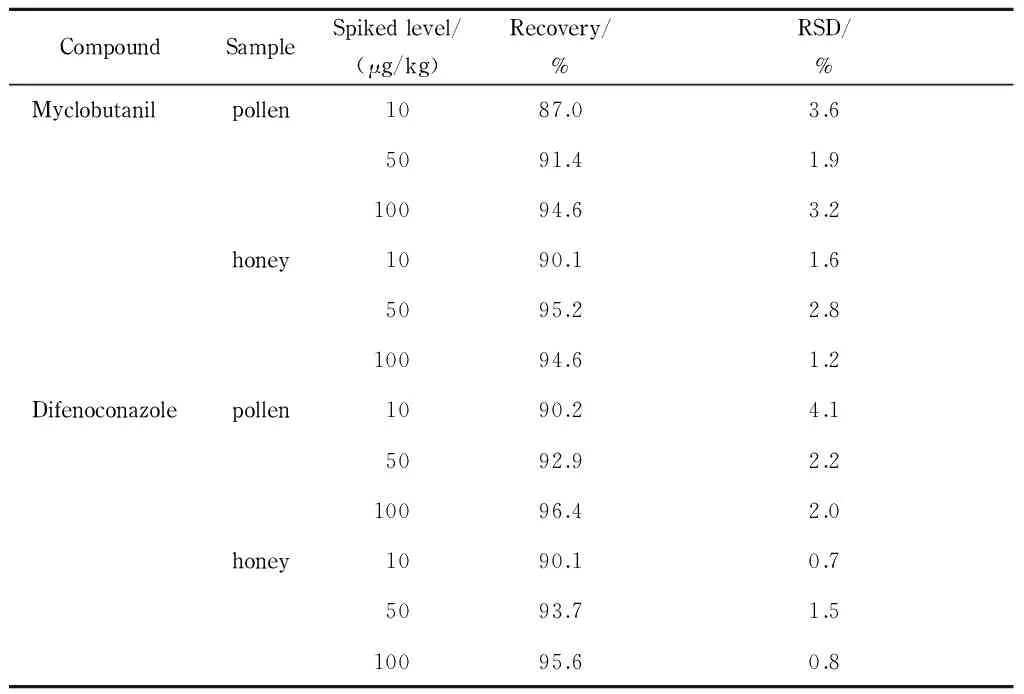
表 3 腈菌唑和苯醚甲环唑在荔枝花粉和花蜜中的加标回收率和相对标准偏差(n=5)

图 3 (a)花粉和(b)花蜜样品在SIM模式下的总离子流色谱图Fig. 3 Total ion chromatograms of (a) pollen and (b) honey samples under SIM mode
3 结论
本文建立了改良的QuEChERS- 高效液相色谱- 串联质谱方法分析荔枝花粉和花蜜中痕量腈菌唑和苯醚甲环唑的残留水平。方法简便、可靠,可用于荔枝树上花粉和花蜜样品的快速准确定量,符合对蜜蜂安全评价指标的要求。该方法可为监测农药对蜜蜂等授粉生物的风险性提供基础,为评价有益生物的安全性提供技术支持。
[1] Bai H Q, Wu J G, Pan X B. Journal of Fruit Science, 2016, 33(4): 436
白慧卿, 吴建国, 潘学标. 果树学报, 2016, 33(4): 436
[2] Huang C X, Wu D Y, Jiang D G, et al. Journal of South China Normal University Natural (Science Edition), 1984(1): 49
黄昌贤, 吴定尧, 江杜规, 等. 华南师范大学学报(自然科学版), 1984(1): 49
[3] Zhang N, Zhang C Q, Zhu G N, et al. Chinese Journal of Pesticide Science, 2016, 18(3): 387
张宁, 张传清, 朱国念, 等. 农药学学报, 2016, 18(3): 387
[4] Wang Y J, Gao J L, Han W S, et al. Journal of Environmental Entomology, 2017, 39(1): 126
王雅珺, 高景林, 韩文素, 等. 环境昆虫学报, 2017, 39(1): 126
[5] Cang T, Zhao X P, Zhang Z H, et al. Zhejiang Agricultural Science, 2009(4): 785
苍涛, 赵学平, 张志恒, 等. 浙江农业科学, 2009(4): 785
[6] Deng Z B, Hu J Y, Qin D M, et al. Chromatographia, 2010, 71(7/8): 679
[7] Zhang X Y, Dai X F, Mao J, et al. Chinese Journal of Pesticide Science, 2013, 15(1): 91
张雪燕, 代雪芳, 毛佳, 等. 农药学学报, 2013, 15(1): 91
[8] Mohapatra S. Environ Sci Pollut R, 2016, 23(6): 5795
[9] Xue J Y, Chen X C, Jiang W Q, et al. J Chromatogr B, 2015, 975: 9
[10] Zhao F F, Zheng X H, Lv D Z, et al. Journal of Henan Agricultural University, 2017, 51(1): 115
赵方方, 郑雪红, 吕岱竹, 等. 河南农业大学学报, 2017, 51(1): 115
[11] Szpyrka E, Walorczyk S. J Environ Sci Heal B, 2017, 52(2): 131
[12] Zhao C J, Pang J, Gao W H. Journal of Chinese Institute of Food Science and Technology, 2015, 15(3): 175
赵春娟, 庞军, 高文惠. 中国食品学报, 2015, 15(3): 175
[13] Ferreira J A, Santos L F S, Souza N R S, et al. Bull Environ Contam Toxicol, 2013, 91(2): 160
[14] Raeppel C, Nief M, Fabritius M, et al. J Chromatogr A, 2011, 1218(44): 8123
[15] Xie J J, Chen J, Li J, et al. Journal of Food Safety and Quality, 2013, 4(1): 82
谢建军, 陈捷, 李菊, 等. 食品安全质量检测学报, 2013, 4(1): 82
[16] Liu Y N, Li W Z, Wei P, et al. Journal of Ecology and Rural Environment, 2016, 32(5): 832
刘雅楠, 李文卓, 魏鹏, 等. 生态与农村环境学报, 2016, 32(5): 832
[17] Guo Y Y, Shi H M, Han X M, et al. Chinese Journal of Analysis Laboratory, 2017, 36(7): 811
郭亚芸, 史红梅, 韩晓梅, 等. 分析试验室, 2017, 36(7): 811
[18] Xue X H, Dai S H, Zhang L S, et al. Chinese Journal of Pesticide Science, 2010, 12(3): 309
薛晓航, 戴守辉, 张璐珊, 等. 农药学学报, 2010, 12(3): 309
[19] Yao F, Song Z Y, Nie J, et al. Physical Testing and Chemical Analysis Part B: Chemical Analysis, 2017, 53(6): 650
姚芳, 宋志宇, 聂晶, 等. 理化检验- 化学分册, 2017, 53(6): 650
[20] Su S F, Xue X, Wang J, et al. Chemical Research and Application, 2014, 26(3): 460
宿书芳, 薛霞, 王骏, 等. 化学研究与应用, 2014, 26(3): 460
[21] Chen J H, Wang H L, Guo B Y, et al. Int J Environ An Ch, 2014, 94(8): 791
[22] Zhang X Z, Zhao Y C, Luo F J, et al. Journal of Instrumental Analysis, 2016, 35(11): 1376
张新忠, 赵悦臣, 罗逢健, 等. 分析测试学报, 2016, 35(11): 1376
[23] Wang Y, Wang C W, Gao J, et al. China Journal of Chinese Materia Medica, 2014, 39(13): 2464
王燕, 王春伟, 高洁, 等. 中国中药杂志, 2014, 39(13): 2464
[24] Montagner C C, Vidal C, Acayaba R D, et al. Anal Methods, 2014, 6(17): 6668
[25] Yang A, EI- Aty A M A, Park J H, et al. Biomed Chromatogr, 2014, 28(6): 735
[26] Zhang X Z, Luo F J, Chen Z M, et al. Chinese Journal of Analytical Chemistry, 2013, 41(2): 215
张新忠, 罗逢健, 陈宗懋, 等. 分析化学, 2013, 41(2): 215
[27] Hingmire S, Oulkar D P, Utture S C, et al. Food Chem, 2015(176): 145
[28] Yuan Y S. Chinese Pharmaceutical Journal, 1984, 19(6): 28
袁倚盛. 中国药学杂志, 1984, 19(6): 28
