高效离子交换色谱法分析青枯雷尔氏菌无致病力epsD突变菌株的异质性
2018-01-11郑雪芳陈德局陈小强朱育菁
郑雪芳, 陈德局, 陈小强, 刘 波, 朱育菁
(福建省农业科学院农业生物资源研究所, 福建 福州 350003)
青枯雷尔氏菌(Ralstoniasolanacearum)易引起作物青枯病,该病是一种毁灭性土传病害[1]。青枯病是世界上危害最大、分布最广、造成损失最严重的植物病害之一,堪称“植物癌症”,一旦发病就难以控制[2]。利用无致病力的青枯雷尔氏菌防治作物青枯病具有很好的应用潜力[3-9]。Frey等[4]、杨宇红等[5]和Hanemian等[6]用无致病力的青枯雷尔氏菌hrp- 突变体防治茄科蔬菜青枯病,并取得了良好的防治效果;Trigalet和Trigalet- Demery[7]、程本亮等[8]利用转座子Tn5插入诱变获得的青枯雷尔氏菌无致病力菌株,发现其对番茄青枯病具有良好的防病、控病效果;肖田等[9]从田间分离到116株青枯雷尔氏菌的无致病力菌株,其中有2株具有较好的温室控病效果,20 d后的相对防效分别为58.4%和97%。 然而,作者通过分离筛选自然弱毒株、60Co辐射诱变和EZ- Tn5插入诱变等途径获得的55株青枯雷尔氏菌无致病力突变菌株对番茄青枯病的防效差异较大(8.3% ~100% ),可能与青枯雷尔氏菌在自然状态下致病力分化严重、存在不同致病力菌株混杂的现象有关[3]。
青枯雷尔氏菌在致病力分化过程中会引起细胞表面特性的相应改变[10]。细菌细胞表面覆盖有多糖类、脂类、蛋白质、肽聚糖等物质,在不同条件下,这些物质的电离状态不同,从而使细菌表面带上不同的电荷[11],因此可通过高效离子交换色谱将带不同电荷的细菌分离。Daniels[12]利用强阴离子交换树脂,通过控制缓冲液pH值和离子强度,成功地将6种不同的细菌进行分离;Marquis等[13]利用阳离子交换树脂实现对不同细菌的色谱分离;林娟等[10]、Zheng等[14]以强阴离子交换树脂为介质,利用高效离子交换色谱(high performance ion- exchange chromatography,HPIEC)成功实现了不同致病力青枯雷尔氏菌的快速分离;郑雪芳等[15]对分析青枯雷尔氏菌的高效离子交换色谱分离条件进行优化,缩短了分离时间(15 min),提高了分离效率。
研究表明,胞外多糖(exopolysaccharide, EPS)在青枯菌的致病过程中起着十分重要的作用,是主要的致病因素[16,17]。EPS通过堵塞寄主维管束,干扰营养和水分的运输,最终导致植株萎蔫死亡[18-20]。胞外多糖缺失突变体则失去对寄主的致病力[16]。胞外多糖受epsA、epsB、epsC、epsD、epsE和epsF基因簇控制[21]。作者前期利用基因敲除技术,将青枯雷尔氏菌强致病力菌株FJAT- 91的epsD基因进行敲除,获得1株无致病力突变菌株FJAT- 91⊿epsD,室内盆栽试验表明该菌株具有良好的定殖能力和防治效果。本研究在此基础上,比较分析了无致病力突变菌株FJAT- 91⊿epsD与出发菌株FJAT- 91及自然致弱的无致病力菌株FJAT- 1458在菌落和菌体形态及胞外多糖含量上的异质性,进而利用高效离子交换色谱分离这3个菌株,从峰形和保留时间上分析不同菌株的色谱行为差异,为利用菌株FJAT- 91⊿epsD研发生防制剂提供理论依据。
1 实验部分
1.1 仪器、试剂与材料
高效液相色谱仪(HPLC1100,美国Agilent公司);紫外- 可见分光光度计(UV- 2550,日本岛津公司);透射电镜(HT7700,日本日立公司);高速冷冻离心机(Eppendorf 5418R,德国Eppendorf公司);荧光体视显微镜(M165FC,德国Leica公司);恒温培养箱(BI- 250AG,上海施都凯仪器设备有限公司)。
青枯雷尔氏菌强致病力菌株FJAT- 91分离自番茄青枯病株;青枯雷尔氏菌自然致弱的无致病力菌株FJAT- 1458(作为参比菌株)分离自番茄青枯病田块的健康植株;青枯雷尔氏菌无致病力突变菌株FJAT- 91⊿epsD是以FJAT- 91为出发菌株,利用基因敲除技术对其epsD基因进行敲除获得,以上菌株均由福建省农业科学院农业生物资源研究所菌种库收集并保存。供试的番茄品种为农科180,购自福建省农科农业良种开发有限公司。青枯雷尔氏菌的固体培养基为2,3,5- 氯化三苯基四氮唑(2,3,5- triphenyltetrazolium chloride, TTC)培养基[22],成分为蛋白胨10.0 g、水解酪蛋白1.0 g、葡萄糖5.0 g、琼脂粉18.0 g, 0.5 g 2,3,5- 氯化三苯基四氮唑,用蒸馏水溶解,调节pH值为7.2,定容至1 L;液体培养基为蔗糖蛋白胨(sucrose peptone, SP)培养基,成分为蔗糖20.0 g、蛋白胨5.0 g、KH2PO40.5 g和MgSO40.25 g,用蒸馏水溶解,调节pH值为7.2,定容至1 L。青枯雷尔氏菌高效离子交换色谱分离所需的平衡缓冲液(A液): 0.02 mol/L哌嗪- HCl;洗脱缓冲液(B液): 0.02 mol/L哌嗪- HCl+1 mol/L NaCl。
1.2 实验方法
1.2.1青枯雷尔氏菌epsD突变菌株的形态鉴别
菌落形态:出发菌株FJAT- 91、突变菌株FJAT- 91⊿epsD及自然致弱的无致病力菌株FJAT- 1458接种在TTC培养基上,于30 ℃条件下培养48 h,观察菌落形态并拍照。
菌体形态:将上述活化好的各菌株,挑取单菌落,转接于SP液体培养基,于30 ℃以180 r/min摇床培养24 h,分别吸取2 μL菌液至铜网,静置2 min,用滤纸吸干,然后用2%(质量分数)的磷钨酸染色30 s,自然晾干,于透射电镜下观察菌体形态并拍照。
1.2.2青枯雷尔氏菌epsD突变菌株的胞外多糖含量测定
采用苯酚- 硫酸法测定胞外多糖的含量,具体方法参照文献[8]。
1.2.3细菌培养及样品制备
青枯雷尔氏菌强致病力菌株FJAT- 91和突变菌株FJAT- 91⊿epsD经TTC培养基活化后,转接于SP液体培养基,于30 ℃以180 r/min摇床振荡培养24 h。取2 mL菌液于4 ℃以8 000 r/min离心5 min,去上清液,用超纯水洗涤沉淀物2次,然后用无菌水重悬,调至菌体细胞含量为1.0×109CFU/mL,于4 ℃保存备用。
1.2.4色谱条件
色谱系统的前处理:为了保证细菌的色谱分离过程处于无菌环境,在进样前,依次用0.1 mol/L的NaOH溶液、75%(v/v)的乙醇水溶液和无菌水各冲洗15 min,最后用无菌的缓冲液A平衡色谱系统。实验所用的所有器皿均需经过高压灭菌处理,缓冲液用超纯水配制,使用前用0.22 μm的醋酸纤维素膜过滤。上样的样品前处理也严格按照无菌操作进行。
色谱分离及检测:将制备的细胞样品注入色谱分离系统,进样量为20 μL,采用Toyopearl Tskgel SuperQ- 650C强阴离子交换树脂填充色谱柱(200 mm×4.6 mm),流速2 mL/min,泵压0.8 MPa,柱温25 ℃。样品上样后,用A液平衡0~3 min,使样品充分吸附到强阴离子交换树脂上;3~8 min时,进行线性梯度洗脱,梯度为100% ~25%的A液;8~12 min时,转换为100%B液,将树脂上的残余细菌全部洗出;12~15 min时,用A液平衡系统。样品经上述洗脱后,采用紫外检测器检测,检测波长为260 nm。
1.2.5回收率及致病力鉴定
将高效离子交换色谱分离的菌株FJAT- 91、FJAT- 91⊿epsD和FJAT- 1458的色谱峰回收,用无菌水按10-1、10-2、10-3等系列梯度稀释后涂布于TTC培养基,于30 ℃培养48 h。(1)随机选取TTC平板上的10个单菌落,在荧光体视显微镜下观察菌落形态,并测量和计算弱化指数(attenuation index, AI)[23]。(2)挑取单菌落转接至SP液体培养基,于30 ℃以180 r/min摇床振荡培养24 h,菌液稀释至108CFU/mL,伤根接种于5~6叶龄的番茄盆栽苗(4株/盆),无菌的SP培养基为阴性对照,接种量为80 mL/盆,每种色谱峰回收的菌株分别接种处理15盆,重复3次,每天观察植株发病情况。植株发病率计算公式如下:发病率=发病株数/调查总株数×100%。
1.2.6数据统计
采用不同方法处理的番茄植株的发病率及其方差均采用DPS7.05统计软件进行分析。
2 结果与讨论
2.1 青枯雷尔氏菌epsD突变菌株的形态特征

图 1 青枯雷尔氏菌(a)强致病力菌株FJAT- 91、(b)无 致病力突变菌株FJAT- 91⊿epsD和(c)无致病力菌株FJAT- 1458的菌落形态 Fig. 1 Colony morphologies of Ralstonia solanacearum (a) virulent strain FJAT- 91, (b) avirulent mutant FJAT- 91⊿epsD and (c) avirulent strain FJAT- 1458
Zheng等[14]、刘波等[23]根据青枯雷尔氏菌在TTC选择性培养基上的菌落形态特征,将其分为3种致病力类型:强致病力、无致病力和过渡型。强致病力菌株的菌落呈现圆形或近圆形,菌落表面湿润,流动性强,中间为粉红色,白边宽;无致病力菌株的菌落为圆形,菌落表面干燥,无流动性,中间为暗红色,白边窄;过渡型菌株菌落为圆形,菌落表面湿润,中间为暗红色,白边比较窄。本研究中菌株FJAT- 91的菌落形态符合强致病力菌株的形态特征(见图1a);突变菌株FJAT- 91⊿epsD的菌落形态(见图1b)与菌株FJAT- 1458的菌落形态(见图1c)相似,表现为无致病力菌株菌落形态的典型特征,即菌落表面干燥,无流动性,白边窄或无白边。

图 2 青枯雷尔氏菌(a)强致病力菌株FJAT- 91、(b)无 致病力突变菌株FJAT- 91⊿epsD和(c)无致病力菌株FJAT- 1458的菌体形态 Fig. 2 Cell morphologies of Ralstonia solanacearum in (a) virulent strain FJAT- 91, (b) avirulent mutant FJAT- 91⊿epsD and (c) avirulent strain FJAT- 1458
菌株FJAT- 91的菌体细胞为短杆状,大小为(0.60~0.85) μm×(0.90~1.72) μm,宽长比值为0.30~0.61,细胞颜色较深(见图2a);菌株FJAT- 91⊿epsD细胞大小为(0.56~0.84) μm×(1.40~1.87) μm,宽长比值为0.36~0.48,细胞颜色较浅,边缘呈透明状(见图2b);菌株FJAT- 1458细胞大小为(0.59~0.68) μm×(1.09~1.75) μm,宽长比值为0.32~0.67,细胞颜色浅,部分细胞边缘呈透明状(见图2c)。这可能是因为强致病力菌株含有大量的EPS,而无致病力菌株中的EPS含量较低,据报道[24]青枯雷尔氏菌分泌的EPS中有15%会黏附在细胞表面,EPS与磷钨酸染色剂的亲和力强,形成的电子密度高,因此在透射电镜下呈现的菌体细胞颜色较深。
2.2 胞外多糖含量测定结果
EPS是青枯雷尔氏菌的主要致病原因[25],青枯雷尔氏菌细胞表面黏附的EPS含量越高,其致病性越强[10]。本研究供试的3株菌株中,菌株FJAT- 91的EPS含量最高,为(30.49±2.97) μg/mL;菌株FJAT- 91⊿epsD的EPS含量显著降低,为(12.64±1.46) μg/mL,比菌株FJAT- 91降低了58.54% ,与菌株FJAT- 1458的EPS含量((11.30±1.38) μg/mL)相当。
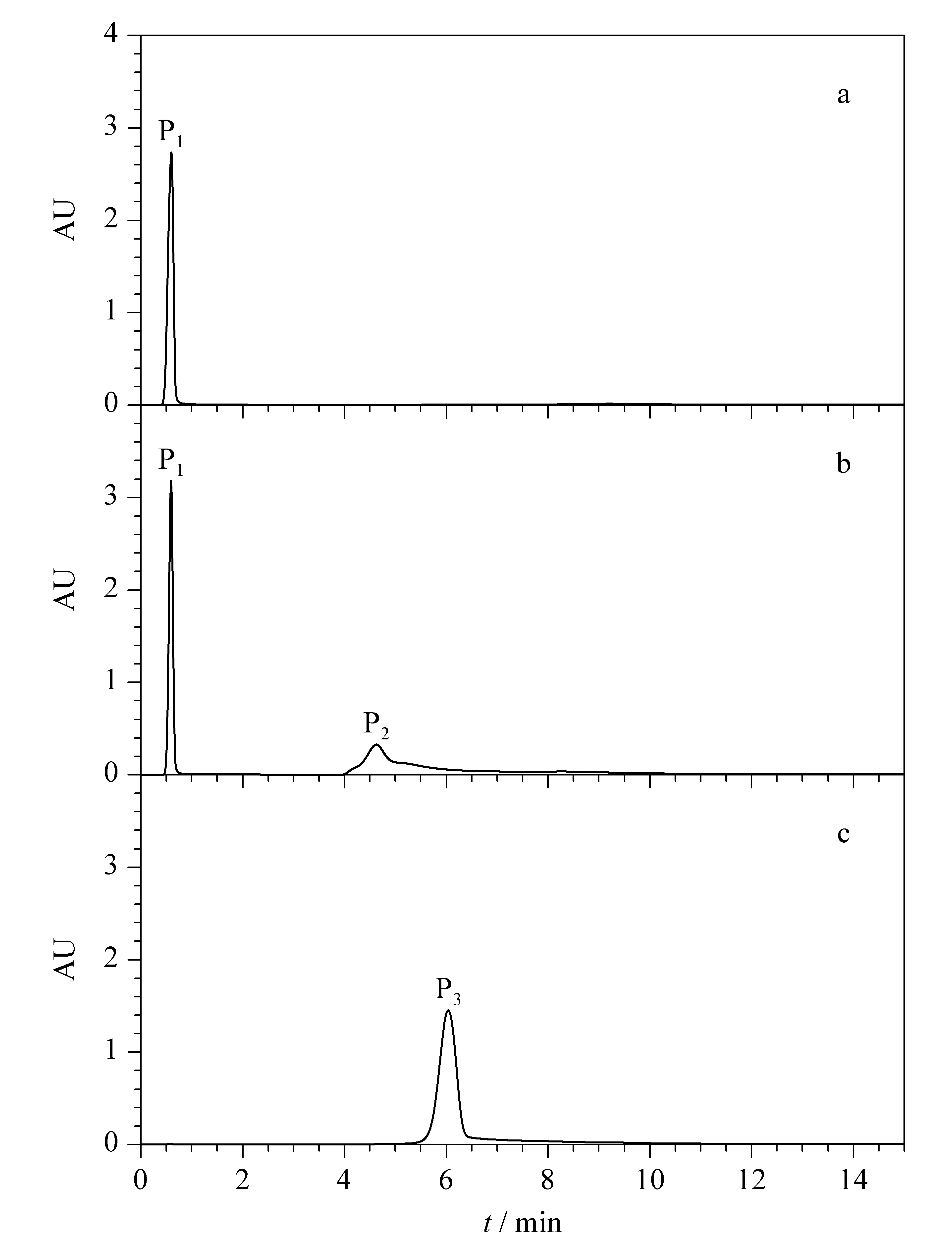
图 3 青枯雷尔氏菌(a)无致病力菌株FJAT- 1458、 (b)无致病力突变株FJAT- 91⊿epsD和(c)强致病力菌株FJAT- 91的色谱图 Fig. 3 Chromatograms of Ralstonia solanacearum in (a) avirulent strain FJAT- 1458, (b) avirulent mutant FJAT- 91⊿epsD and (c) virulent strain FJAT- 91
2.3 高效离子交换色谱分离
由图3可知,青枯雷尔氏菌菌株FJAT- 91、菌株FJAT- 91⊿epsD和菌株FJAT- 1458的色谱行为有明显的差异。菌株FJAT- 1458经高效离子交换色谱分离为单个色谱峰,命名为P1峰(见图3a),保留时间为0.59 min;菌株FJAT- 91⊿epsD经高效离子交换色谱分离,除P1峰外,在保留时间为4.62 min处形成另一个色谱峰P2(见图3b);菌株FJAT- 91则在保留时间为6.04 min处形成单一色谱峰P3(见图3c)。林娟等[10]认为青枯雷尔氏菌强致病力菌株的色谱峰保留时间长,与其EPS含量高有关,EPS的存在会增加菌体细胞表面的电负性,EPS含量越高,细胞表面携带的负电荷越多,与阴离子交换树脂的结合力就越强,色谱峰的保留时间就越长,本研究结果与此相吻合,强致病力菌株FJAT- 91的色谱峰保留时间明显长于无致病力的菌株FJAT- 1458和FJAT- 91⊿epsD的保留时间。
2.4 不同菌株致病力的鉴定
刘波等[23]用弱化指数作为青枯雷尔氏菌致病力的量化指标,弱化指数是指菌落的红斑直径与菌落直径的比值,弱化指数小于0.65为强致病力菌株,弱化指数大于0.75为无致病力菌株,弱化指数介于0.65与0.75之间为过渡型菌株。将菌株FJAT- 91的色谱峰P3、菌株FJAT- 91⊿epsD的色谱峰P1和P2及菌株FJAT- 1458的色谱峰P1进行回收,在TTC培养基上培养48 h后,呈现典型的青枯雷尔氏菌菌落形态(见图4), P1峰回收后的菌株FJAT- 1458- P1(见图4a)和FJAT- 91⊿epsD- P1(图4b)的菌落形态与菌株FJAT- 91⊿epsD(图1b)和FJAT- 1458(图1c)的菌落形态相同,P3峰回收后菌株FJAT- 91- P3的菌落形态(图4d)与菌株FJAT- 91(图1a)的菌落形态相同。
弱化指数测定结果表明,菌株FJAT- 91⊿epsD- P1的弱化指数为0.87±0.12,与菌株FJAT- 1458- P1弱化指数(0.87±0.13)相当,鉴定为无致病力;菌株FJAT- 91⊿epsD- P2的弱化指数为0.70±0.07,鉴定为过渡型;菌株FJAT- 91- P3的弱化指数为0.58±0.02,鉴定为强致病力。
经番茄盆栽苗接种试验,菌株FJAT- 91- P3致病力最强,接种后4 d植株开始发病,接种后10 d发病率达100% ;菌株FJAT- 91⊿epsD- P2在接种9 d后植株开始发病,接种10 d后发病率为11.67% ;菌株FJAT- 91⊿epsD- P1和菌株FJAT- 1458- P1接种番茄不引起番茄植株发病,接种20 d后番茄植株发病率为0,而此时接种菌株FJAT- 91⊿epsD- P2和菌株FJAT- 91- P3的番茄植株发病率为100%(见表1)。

图 4 不同色谱峰回收菌株的菌落形态Fig. 4 Colony morphologies of strains eluted from different chromatographic peaksa. FJAT- 1458- P1; b. FJAT- 91⊿epsD- P1; c. FJAT- 91⊿epsD- P2; d. FJAT- 91- P3.

StrainDiseaseincidence(mean±SD)/%4d5d6d7d8d9d10d20dFJAT-1458-P1000000 0 0FJAT-⊿epsD-P1000000 0 0FJAT-⊿epsD-P2000003.67±1.1511.67±1.53100.00±0FJAT-91-P35.33±0.5817.00±2.6533.00±3.0065.00±1.7375.00±5.0086.33±3.51100.00±0100.00±0
3 结论
本研究从形态、生理、色谱行为等方面,比较分析了青枯雷尔氏菌epsD基因敲除后获得的无致病力突变菌株FJAT- 91⊿epsD与出发菌株强致病力青枯雷尔氏菌FJAT- 91及自然致弱的无致病力菌株FJAT- 1458的差异性。研究结果可为菌株FJAT- 91⊿epsD的生防应用提供理论依据。
[1] Hayward A C. Annu Rev Phytopathol, 1991, 29: 65
[2] Jiang G F, Wei Z, Xu J, et al. Front Plant Sci, 2017, 8: 1549
[3] Zheng X F, Liu B, Lin N Q, et al. Acta Phytopathologica Sinica, 2013, 43(5): 518
郑雪芳, 刘波, 林乃铨, 等. 植物病理学报, 2013, 43(5): 518
[4] Frey P, Prior P, Marie C, et al. Appl Environ Microb, 1994, 60(9): 3175
[5] Yang Y H, Liu J P, Yang C R, et al. Journal of Plant Protection, 2008, 35(5): 433
杨宇红, 刘俊平, 杨翠荣, 等. 植物保护学报, 2008, 35(5): 433
[6] Hanemian M, Zhou B B, Deslandes L, et al. Plant Signal Behav, 2013, 8(10): e25678
[7] Trigalet A, Trigalet- Demery D. Physiol Mol Plant P, 1990, 36(1): 27
[8] Cheng B L, Che J M, Liu B. Journal of Agricultural Biotechnology, 2011, 19(1): 26
程本亮, 车建美, 刘波. 农业生物技术学报, 2011, 19(1): 26
[9] Xiao T, Xiao C G, Zou Y, et al. Plant Protection, 2008, 34(2): 79
肖田, 肖崇刚, 邹阳, 等. 植物保护, 2008, 34(2): 79
[10] Lin J, Liu S T, Gao Z N, et al. Chinese Journal of Applied and Environmental Biology, 2009, 15(5): 713
林娟, 刘树滔, 高珍娜, 等. 应用与环境生物学报, 2009, 15(5): 713
[11] Dickson J S, Koohmaraie M. Appl Environ Microb, 1989, 55(4): 832
[12] Daniels S L. Dev Ind Microbiol, 1972, 13: 211
[13] Marquis R E, Mayzel K, Carstensen E L. Can J Microbiol, 1976, 22(7): 975
[14] Zheng X F, Zhu Y J, Liu B, et al. Microb Pathogenesis, 2016, 90(4): 84
[15] Zheng X F, Liu B, Zhu Y J, et al. Chinese Journal of Chromatography, 2016, 34(11): 1091
郑雪芳, 刘波, 朱育菁, 等. 色谱, 2016, 34(11): 1091
[16] Peyraud R, Cottret L, Marmiesse L, et al. PloS Pathog, 2016, 12(10): e1005939
[17] Digonnet C, Martinez Y, Denancé N, et al. Planta, 2012, 236: 1419
[18] Genin S, Denny T P. Annu Rev Phytopathol, 2012, 50: 67
[19] Monteiro F, Genin S, van Dijk I, et al. Microbiology, 2012, 158: 2107
[20] Coplin D L, Cook D. Mol Plant- Microbe Interact, 1990, 3(5): 271
[21] Huang J Z, Schell M. Mol Microbiol, 1995, 16(5): 977
[22] Kelman A. Phytopathology, 1954, 44(12): 693
[23] Liu B, Lin Y Z, Zhu Y J, et al. Journal of Agricultural Biotechnology, 2004, 12(3): 322
刘波, 林营志, 朱育菁, 等. 农业生物技术学报, 2004, 12(3): 322
[24] Orgambide G, Montrozier H, Servin P, et al. J Biol Chem, 1991, 266(13): 8312
[25] Milling A, Babujee L, Allen C. PLoS One, 2011, 6(1): e15853
