高温固溶热处理对镁铜合金腐蚀性能的影响
2018-01-11严旭东谭丽丽赵明纯
严旭东,谭丽丽,万 鹏,赵明纯,杨 柯
(1.中南大学材料科学与工程学院,长沙410083;2.中国科学院沈阳金属研究所,沈阳110016)
高温固溶热处理对镁铜合金腐蚀性能的影响
严旭东1,2,谭丽丽2,万 鹏2,赵明纯1,杨 柯2
(1.中南大学材料科学与工程学院,长沙410083;2.中国科学院沈阳金属研究所,沈阳110016)
研究了在超共晶点温度(510℃)下高温固溶热处理对Mg-0.19Cu和Mg-0.31Cu合金组织结构以及在Hanks溶液中腐蚀速率的影响。实验发现,高温固溶同时降低了镁铜合金的自腐蚀电位和自腐蚀电流,并且自腐蚀电流是大幅度降低。镁铜合金的腐蚀降解速率主要受Mg2Cu第二相数量的影响。高温固溶处理通过减少镁铜合金中第二相含量来减缓镁铜合金腐蚀的阴极反应,进而成倍提高镁铜合金耐腐蚀性能。
镁铜合金;高温固溶;第二相;耐腐蚀性
0 前言
镁合金因为具有许多优良的性能,是继钢铁和铝合金后应用广泛的第三大金属工程材料[1]。镁合金不仅可以应用在工程材料方面,还可以应用在生物医用材料方面。镁元素是人体大量需要的元素之一,植入人体内后可降解从而避免了二次手术,同时镁及镁合金的机械性能非常接近人体骨骼,这都是镁可以作为生物医用植入材料主要原因[2]。镁合金虽然拥有诸多的优点但是在体内环境腐蚀过快阻碍了其临床应用。新的铸造技术可以通过降低镁合金中的杂质含量来提高耐腐蚀性,但是镁合金的耐腐蚀性不仅受化学成分的控制,还受到其微观组织结构的影响[3]。表面处理也可以在一定程度上提高镁合金的耐腐蚀性[4],但是当涂层脱落或者涂层被破坏时,镁合金的腐蚀速率仍然不会降低。
镁铜合金是具有抗菌和促骨骼生长的可降解镁合金,具有良好的生物相容性和优异的抗菌性能[5]。但是镁铜合金的腐蚀降解速率太快,Mg-0.03Cu的腐蚀腐蚀速率几乎是纯镁的20倍。目前,对降低镁铜合金腐蚀速率方法和工艺的研究很少,研究固溶热处理对镁铜合金腐蚀行为的影响更少。通常情况下为了保证镁合金不在热处理中被烧损,镁合金的固溶热处理温度通常在共晶点温度以下。但是根据镁铜二元合金相图,在镁铜合金中,即使在共晶点温度铜能固溶进入镁基体中质量分数只有0.034%。所以为了尽量多的将铜固溶进入镁基体,有必要研究超过共晶点温度的固溶热处理。本文研究了超共晶点温度固溶热处理对Mg-0.19Cu和Mg-0.31Cu合金组织结构和在Hanks溶液中的腐蚀行为的影响,以期为镁铜合金在未来可能的临床应用提供参考依据。
1 实验材料与方法
制备镁铜二元合金的原材料为高纯镁锭(99.99%)和高纯铜箔(99.9%)。在99%CO2+1%SF6混合气体保护下,采用井式坩埚电阻炉熔炼不同铜含量的Mg-Cu合金。熔炼坩埚为石墨坩埚,熔炼温度为750℃。成分分析使用电感耦合等离子体原子发射光谱法。用线切割机将铸锭切成尺寸规格为ϕ10mm3×3.5mm3的小试样。热处理工艺为510℃保温10h。热处理时用碳粉包覆试样,到时间后取出水冷至室温。将铸态试样和热处理试样用1500#砂纸打磨,酒精超声清洗,最后热风吹干备用。部分样品进行抛光处理,然后用硝酸酒精进行腐蚀。随后进行金相观察和扫描电镜观察并使用能谱进行第二相确认。
浸泡实验使用的Hanks溶液的配方如下:Mg-SO4·7H2O 0.2 g/L、KCl 0.4 g/L、KH2PO40.06g/L、NaCl 8.0 g/L、Na2HPO4·12H2O 0.12 g/L、D-Glucose 1.0 g/L、NaHCO30.35 g/L,以及CaCl20.14 g/L。浸泡温度为37±0.5℃。根据ISO10993,实验采用的样品表面积和溶液体积比为1.25 cm2/mL。浸泡液每天一换,并用pH计进行检测记录。浸泡3d和7d后,取出试样用200 g/L的铬酸和10 g/L的AgNO3溶液去除表面腐蚀产物进行失重计算和表面形貌观察。用失重计算腐蚀速率的公式如下:
CR=(K×W)/(A×T×D) (1)
其中:CR是腐蚀速率,mm/a;K是值为8.76×104的常数;W是浸泡前后的样品失重量,g;A是样品浸泡前的表面积,cm2;T是浸泡的时间,h;D是样品的密度,g/cm3。
动电位极化在电化学工作站上的三电极单元中进行,其中对电极为铂电极,参比电极为饱和甘汞电极。溶液也是Hanks溶液,温度为37±0.5℃。极化开始前的开位电路测量时间为30min,扫描速度0.5 mV/s。极化曲线的拟合在Gamry工作站自带软件进行。每种试样采用三个平行样进行测试,以确保实验的可重复性。
2 实验结果与分析
2.1 组织结构
图1为Mg-0.19Cu合金和Mg-0.31Cu合金高温固溶热处理前后的金相组织照片。如图1(a)、图1(b)所示,铸态Mg-0.19Cu和铸态Mg-0.31Cu的晶粒为典型柱状晶,两者的晶粒尺寸都在180μm左右。高温热处理后两者的晶粒尺寸都没有明显的变化,但是都出现了轻微的组织烧损(如图1(c)、图1(d)中箭头所示)。在金相照片中并不能清楚地看到第二相的分布,这可能是由于第二相的含量都很低并且颗粒细小。也正是因为Mg-0.19Cu和Mg-0.31Cu中第二相含量少,即使在510℃进行固溶处理,也只出现了轻微的烧损。


图1 铸态和固溶态镁铜合金的金相显微镜照片
为了进一步检测高温固溶热处理对镁铜合金组织结构的影响,对不同状态的镁铜合金进行了背散射模式下的扫描电镜观察,其结果如图2所示。由图2(a)可见,铸态Mg-0.19Cu合金晶界和晶粒内都有大量颗粒状和短杆状的第二相存在。当铜含量增加至0.31%,第二相数量增加,并且在合金晶界的分布变得更加连续,如图2(b)所示。经过高温热处理后,Mg-0.19Cu和Mg-0.31Cu合金中的第二相数量都明显减少,剩余的第二相主要沿晶界分布,如图2(c)和图2(d)所示。


图2 铸态和固溶态镁铜合金的背散射扫描照片
对镁铜合金中的第二相颗粒进行EDS能谱分析,结果如图3所示。图3(a)和图3(b)分别对应图2(a)和图2(b)中箭头所指位置的分析结果。由结果可见,镁铜合金中的第二相为富铜相。结合镁铜二元合金相图可以判断第二相应该是Mg2Cu。图3(a)和图3(b)的分析结果中,铜原子和镁原子的百分比分别约为1∶7和1∶4,比例都小于1∶2,这可能是由于存在共晶组织(Mg2Cu+α-Mg),其中的α-Mg减小了铜镁的原子比。
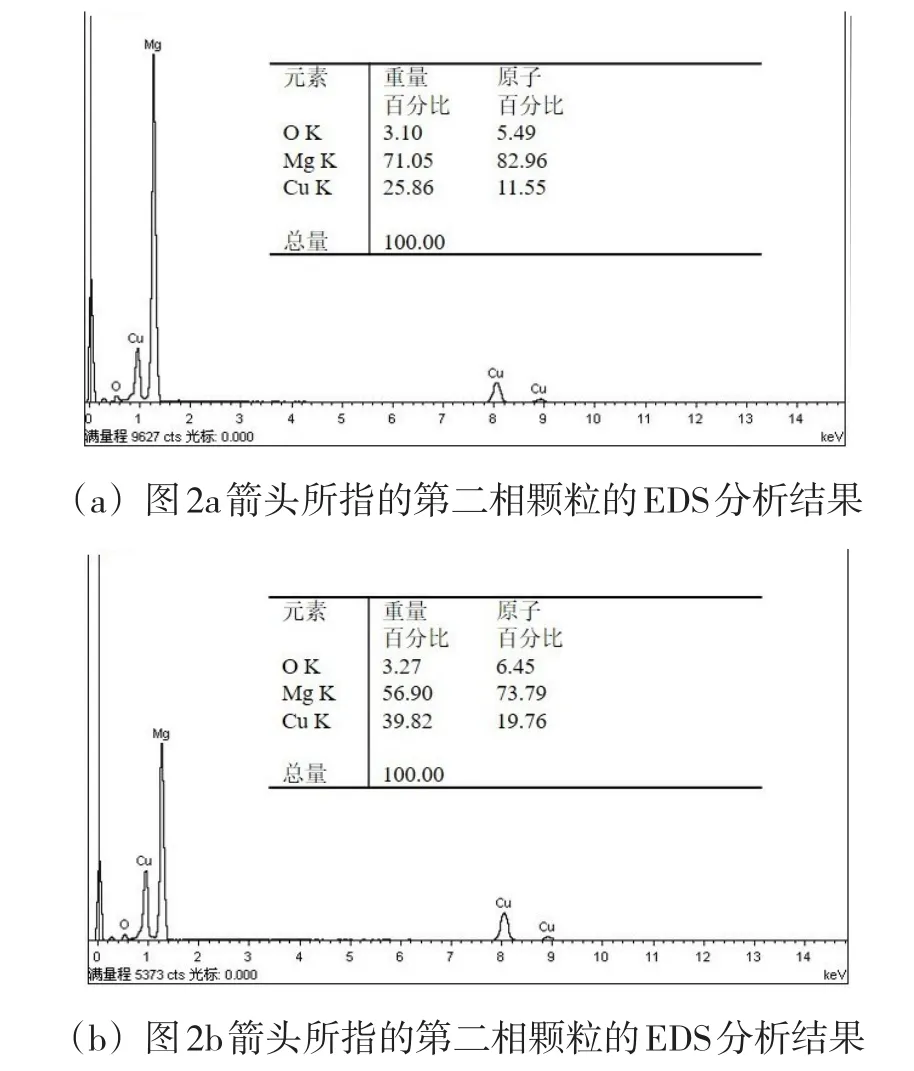
图3 镁铜合金中第二相颗粒的EDS能谱结果
2.2 浸泡实验
铸态和高温固溶态Mg-0.19Cu和Mg-0.31Cu在浸泡过程中pH随时间变化的趋势如图4(a)所示。铸态Mg-0.19Cu(Mg-0.19Cu AC)和Mg-0.31Cu(Mg-0.31Cu AC)在浸泡第一天后,pH值就迅速升到13左右,然后保持超过12的pH值,直至第三天铸态Mg-0.31Cu的几乎完全降解和第四天铸态Mg-0.19Cu的完全降解。高温固溶态的Mg-0.19Cu(Mg-0.19Cu AS) 和 Mg-0.31Cu(Mg-0.31Cu AS)在浸泡过程所产生的碱性相对于铸态来说则低了很多,从浸泡开始的第一天到浸泡的第七天,两者的pH值几乎都稳定保持在11。图4(b)为通过失重计算的Mg-Cu合金的腐蚀速率。铸态Mg-0.19Cu和Mg-0.31Cu的腐蚀速率分别为110.3mm/a和134.4mm/a。经过高温热处理后两者的腐蚀速率分别降低至1.6mm/a和3.9mm/a,降幅达到了68倍和33倍。铸态镁铜合金的腐蚀速率只有浸泡3d计算的值,是因为铸态镁铜合金在浸泡三四天后就腐蚀完全。高温固溶镁铜合金浸泡3d和7d用失重计算的腐蚀速率基本保持不变,说明整个浸泡过程固溶后镁铜合金保持了稳定的降解速率。pH的大小和变化通常可以表征腐蚀速率大小和变化,大的pH值往往对应大的腐蚀速率,铸态Mg-0.31Cu合金具有最大的pH值,其腐蚀速率也最快,高温固溶态Mg-0.19Cu则同时具有最低的pH值和腐蚀速率。

图4 镁铜合金在37℃的Hanks溶液中的浸泡实验结果
当镁铜合金表面与Hanks溶液接触时,因为溶液中Cl-的存在,会在镁铜合金表面构成一个原电池,其中镁基体和第二相分别作为电池的阳极和阴极[6]。同其他典型的多相合金一样,因为作为阴极Mg2Cu相有加速镁基体腐蚀的趋势[7]。铜往往被视为镁合金中的杂质元素因为其过低的氢超电压会导致镁合金发生严重的电化学腐蚀[8],所以铸态镁铜速率增加了22%。镁铜合金在Hanks溶液中的主要腐蚀过程可以用以下等式表示[9]:

当镁铜合金和Hanks溶液接触时,释放氢气的同时产生了OH-,并且随着氢气的不断释放,氢氧根会不断聚集,从而导致溶液pH的增加(反应2)。随后产生OH-会在镁铜合金的表面形成Mg(OH)2(反应3),表面腐蚀产物的存在会阻碍阳极反应的进行(反应1),从而抑制镁铜合金的进一步腐蚀。但是由于铜具有低的氢超电压,进而腐蚀会进一步进行。高温固溶过后因为Mg2Cu含量的降低削弱了阴极反应,进而抑制了整个反应的进行。
镁铜合金浸泡3d和7d后去除表面腐蚀产物的宏观表面形貌如图5所示。如图5(a)和图5(d)所示,铸态Mg-0.19Cu和铸态Mg-0.31Cu遭到了严重的腐蚀,浸泡3d后就完全失去了最初试样的形貌并且只剩余一部分试样,其中铸态Mg-0.31Cu几乎被完全腐蚀了。高温固溶之后,Mg-0.19Cu和Mg-0.31Cu都表现出明显轻于铸态合金的腐蚀。如图5(b)和图5(c),固溶态的Mg-0.19Cu和Mg-0.31Cu都经历了轻微的点蚀,其中固溶态Mg-0.19Cu合金的表面只出现了少量并且较浅的腐蚀坑,相对来说,固溶态Mg-0.31Cu合金表面的腐蚀坑更多并且更深。随着浸泡时间的增加,点蚀坑逐渐扩展变成了腐蚀沟壑。固溶态Mg-0.19Cu浸泡7d后,基体表面被接近1/2的腐蚀沟壑侵占,而Mg-0.31Cu的表面几乎布满了腐蚀沟壑。腐蚀形貌的不同也是腐蚀速率不同的表现,可见高温固溶后,不管是Mg-0.19Cu还是Mg-0.31Cu合金腐蚀降解都明显变慢了。


图5 镁铜合金在浸泡3d和7d后去除腐蚀产物的宏观表面形貌
浸泡实验结果表明,高温固溶热处理可以通过减少镁铜合金中第二相的含量来削弱阴极反应的进行,降低了浸泡过程中的pH值和腐蚀速率,进而能在更长时间保证镁铜合金试样的完整性。
2.3 电化学实验
为了进一步了解高温固溶热处理对镁铜合金在Hanks溶液中的腐蚀行为的影响,对四种不同状态样品进行了动电位极化曲线测试,结果如图6所示。由图可见,铸态Mg-0.19Cu(AC)的曲线位于铸态Mg-0.31Cu(AC)曲线的左下方。固溶处理后,两者的曲线都向左下方移动,并且固溶态Mg-0.19Cu(AS)也位于固溶态Mg-0.31Cu(AS)曲线的左下方。对所有曲线进行Tafel拟合,其结果列于表2中。自腐蚀电位(Ecorr)的排序如下:铸态Mg-0.31Cu>铸态Mg-0.19Cu>固溶态Mg-0.31Cu>固溶态Mg-0.19Cu。自腐蚀电流(Icorr)排序如下:铸态Mg-0.31Cu>铸态Mg-0.19Cu>固溶态Mg-0.31Cu>固溶态Mg-0.19Cu。可见,铜含量越高,自腐蚀电位越大,腐蚀电流也越大,高温固溶后,自腐蚀电位和腐蚀电流都有所下降,其中腐蚀电流下降明显。腐蚀电流通常反应的是腐蚀速率,所以腐蚀速率排序和腐蚀电流相同。βa和βc可以分别反应阳极和阴极的剧烈程度。由表可见所有试样的βa值相差不大,说明阳极反应剧烈程度也相差不大,铸态Mg-0.31Cu具有最大的βc值,固溶态Mg-0.19Cu具有最小的βc值,说明前者具有最剧烈的阴极反应,后者具有阴极反应最慢。
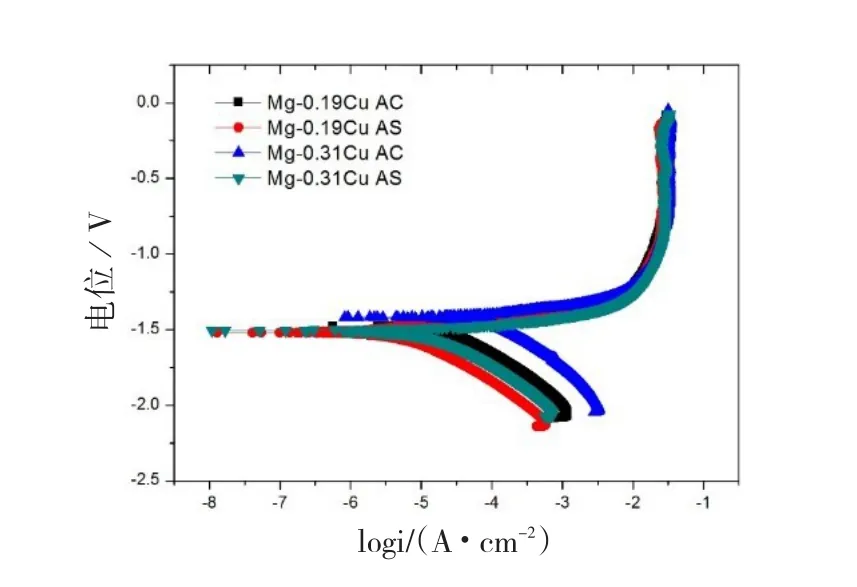
图6 镁铜合金在Hanks溶液中的极化曲线

表2 由极化曲线拟合得到的电化学数据
可见,高温固溶热处理并没有改变镁铜合金在Hanks溶液中的阳极反应,而大大减缓了阴极反应,从而降低了整体的腐蚀速率。
高温固溶热处理后,Mg2Cu含量大大减少,镁铜合金表面的阴极大大减少,所以阴极反应的剧烈程度大大减轻。浸泡实验和电化学实验得到的结果具有相同的趋势,但是用失重算出来的结果明显大于拟合出来的腐蚀速率。这可能是因为,电化学实验测的是短期瞬时的腐蚀过程,而浸泡实验检测的是长期的腐蚀降解过程[10]。不管是浸泡实验还是电化学实验都表明,高温固溶热处理可以通过减少镁铜合金中的第二相含量来减缓腐蚀过程的阴极反应,从而成倍提高镁铜合金的耐腐蚀性能。
3 结论
(1)510℃的固溶度温度虽然在镁铜合金共晶点温度以上,但是固溶后并没有在合金组织上产生明显的烧损缺陷。
(2)高温固溶后,Mg-0.19Cu和Mg-0.31Cu的Mg2Cu第二相含量都有明显的降低,其中晶粒内部的第二相含量减少明显,剩下较多的第二相主要沿晶界连续分布。
(3)高温固溶热处理后浸泡Mg-0.19Cu和Mg-0.31Cu的pH值从铸态的13左右降低到了11左右,降幅明显,浸泡腐蚀速率也分别从110.3mm/a和134.4mm/a降低到了1.6mm/a和3.9mm/a。pH和腐蚀速率的降低都是因为作为电化学腐蚀阴极的Mg2Cu相在高温固溶过程中大量固溶进入镁基体,Mg2Cu相的减少减缓了腐蚀过程的阴极反应。
(4)高温固溶热处理后,由于大量的第二相固溶到镁基体中,Mg-0.19Cu和Mg-0.31Cu的自腐蚀电位有小幅下降,但是腐蚀电流分别降低了6倍和14倍。Tafel拟合出来的腐蚀速率虽然和浸泡实验的结果差别很大,但是表现出了相同的趋势,高温固溶热处理后,腐蚀速率都成倍下降。
[1]庾莉萍.我国镁金属产业前景光明[J].铝加工,2008,(05):48-52
[2]Staiger M P,Pietak A M,Huadmai J,Dias G.Magnesium and its alloys as orthopedic biomaterials:a review.[J].Biomaterials,2006,27(9):1728-1734
[3]Song.Recent Progress in Corrosion and Protection of Magnesium Alloys[J].Advanced Engineering Materials,2005,7(7):563-586
[4]蒲以明,张志强,杜荣.镁及镁合金表面处理初探[J].铝加工,2002,25(6):32-35
[5]Liu C,Fu X,Pan H,Wan P,Wang L,Tan L,Wang K,Zhao Y,Yang K,Chu P.Biodegradable Mg-Cu alloys with enhanced osteogenesis,angiogenesis,and long-lasting antibacterial effects[J].Scientific Reports,2016,6:27374
[6]Lunder O,Nisancioglu K,Hansen R S.Corrosion of Die Cast Magnesium-Aluminum Alloys[J].Corrosion Science,1993(4):210-216
[7]Song G,Atrens A,Dargusch M.Influence of microstructure on the corrosion of diecast AZ91D[J].Corrosion Science,1999,41(2):249-273
[8]Ghali E.Corrosion and Protection of Magnesium Alloys[C].Materials Science Forum,2000:261-272
[9]Song G L,Atrens A.Corrosion Mechanisms of Magnesium Alloys[J].Advanced Engineering Materials,1999,1(1):11-33
[10]Ghali E.Corrosion and Protection of Magnesium Alloys[C].Materials Science Forum,2000:261-272
Effects of High Temperature Solution Heat Treatment on Corrosion Resistance of Mg-Cu alloy
YAN Xu-dong1,2,TAN Li-li2,WAN Peng2,ZHAO Ming-chun1,YANG Ke2
(1.School of Materials Science and Engineering,Central South University,Changsha 410083;2.Institute of Metal Research,Chinese Academy of Sciences,Shenyang 110016,China)
Effects of high temperature(510℃)solution heat treatment at Hyper eutectic temperature on microstructure and corrosion resistance of Mg-0.19Cu and Mg-0.31Cu in Hanks solution was studied.The test results showed both Ecorr and Icorr reduced by solution heat treatment,and the variation of Icorr was obvious.Corrosion rate of Mg-Cu alloys was decided by the amount of Mg2Cu phase,it could be reduced by high temperature solution heat treatment and less Mg2Cu phase lead to milder cathodic reaction.
Mg-Cu alloy;high temperature solution treatment;the second phase;corrosion resistance
TG166.4,TG146.22
A
1005-4898(2017)06-0025-03
10.3969/j.issn.1005-4898.2017.06.05
国家自然科学基金(81401773,31500777)。
严旭东(1991-),男,四川资阳人,硕士研究生,主要从事镁合金研究。
2017-04-13
