辛伐他汀对非增生期糖尿病视网膜病变患者外周血内皮祖细胞数量和视网膜病变的影响
2018-01-11
糖尿病视网膜病变(diabetic retinopathy,DR)是糖尿病患者最常见的微血管并发症之一,可导致患者视力下降,甚至致盲。25%的2型糖尿病患者在诊断时已经出现早期非增生期糖尿病视网膜病变(nonproliferative diabetic retinopathy,NPDR),故防治NPDR对于延缓DR发生、发展具有重要意义。血管内皮祖细胞(endothelial progenitor cells,EPCs)是一种血管内皮前体细胞,主要起源于骨髓,可分化为成熟的血管内皮细胞,在血管修复中发挥重要作用。糖尿病患者外周血中EPCs数量减少且其增殖、分化、迁移等功能受损。有学者提出糖尿病视网膜血管损伤不仅是血管内皮细胞结构功能障碍,还与EPCs数量及功能受损导致其血管修复机制异常有关[1]。辛伐他汀是一种3-羟基-3-甲基戊二酸单酰辅酶A还原酶(HMG-CoA)抑制剂,独立于降脂作用外,可动员骨髓中EPCs入血并修复其高糖环境引起的功能损伤。糖尿病大鼠模型中,给予辛伐他汀可以上调外周血中EPCs数量并延缓DR进展[2]。因此,本研究进一步探讨辛伐他汀对NPDR患者外周血EPCs数量的影响,并观察其治疗NPDR的疗效,为辛伐他汀防治NPDR提供临床依据。
资料与方法
一、研究对象
2016年7月至2017年7月于我院门诊就诊的NPDR患者60例(117只眼)纳入研究。其中,男性37例,女性23例;年龄38~69岁,平均(57.2±7.04)岁;2型糖尿病病程1~12年,平均(6.77±2.73)年。入选标准:(1)了解试验全过程,自愿参加,并签署知情同意书;(2)年龄为35~70岁;(3)2型糖尿病患者(世界卫生组织,1998 年诊断标准);(4)经眼底检查、荧光素眼底血管造影(FFA)确诊为NPDR(中华医学会眼科学分会,1984年诊断及分期标准)。排除标准:(1)增生期糖尿病视网膜病变患者;(2)合并不可控制的高血压、严重肝肾心脑血管疾病、肿瘤、血液系统疾病、自身免疫性疾病、急慢性感染、慢性阻塞性肺部疾病、糖尿病肾病等外周大血管并发症;(3)合并有其他眼病者(如青光眼、明显影响眼底检查的白内障、非糖尿病性引起的视网膜病变、葡萄膜炎、视网膜脱离);(4)近期严重外伤、手术及溃疡,近3个月行视网膜激光光凝或玻璃体腔注药;(5)服用影响EPCs的药物,如他汀类、雌激素、非甾体类药物等;(6)妊娠或哺乳期妇女、依从性差者。
二、研究方法
将所有患者随机分为对照组和干预组,对照组(30例58只眼)给予常规降糖、降血压治疗;干预组(30例59只眼)在对照组基础上给予辛伐他汀20 mg/d,睡前服用,连续3个月。两组患者的性别、年龄、糖尿病病程及血压比较,差异均无统计学意义(P均>0.05)。所有患者于实验开始前、后均行相关眼科检查,包括最佳矫正视力(BCVA)、眼底镜检查、FFA及眼底照相。另外,常规抽取晨起空腹静脉血行相关血液检测,包括空腹血糖、糖化血红蛋白及EPCs数量。空腹血糖、糖化血红蛋白采用全自动生化分析仪测定。EPCs数量检测参照Zhang等[2]的方法,取空腹静脉血2 ml于乙二胺四乙酸抗凝管中,采用密度梯度离心法提取外周血单个核细胞。取100 μl分离洗涤好的单个核细胞,加入CD34-FITC和CD133-PE抗体后于室温下避光孵育20 min。磷酸盐缓冲液洗涤2次后,0.5%牛血清白蛋白重悬细胞,过滤后采用流式细胞仪(美国BD公司)检测EPCs含量。依据前向角散射(FSC)、侧向角散射(SSC)设第1个细胞门,圈选出单个核细胞区域(图1A);CD34-FITC和CD133-PE设第2个细胞门,圈定CD34和CD133双阳性细胞群即为EPCs(图1B)。分析并比较两组患者2×105个细胞中EPCs的数量变化。
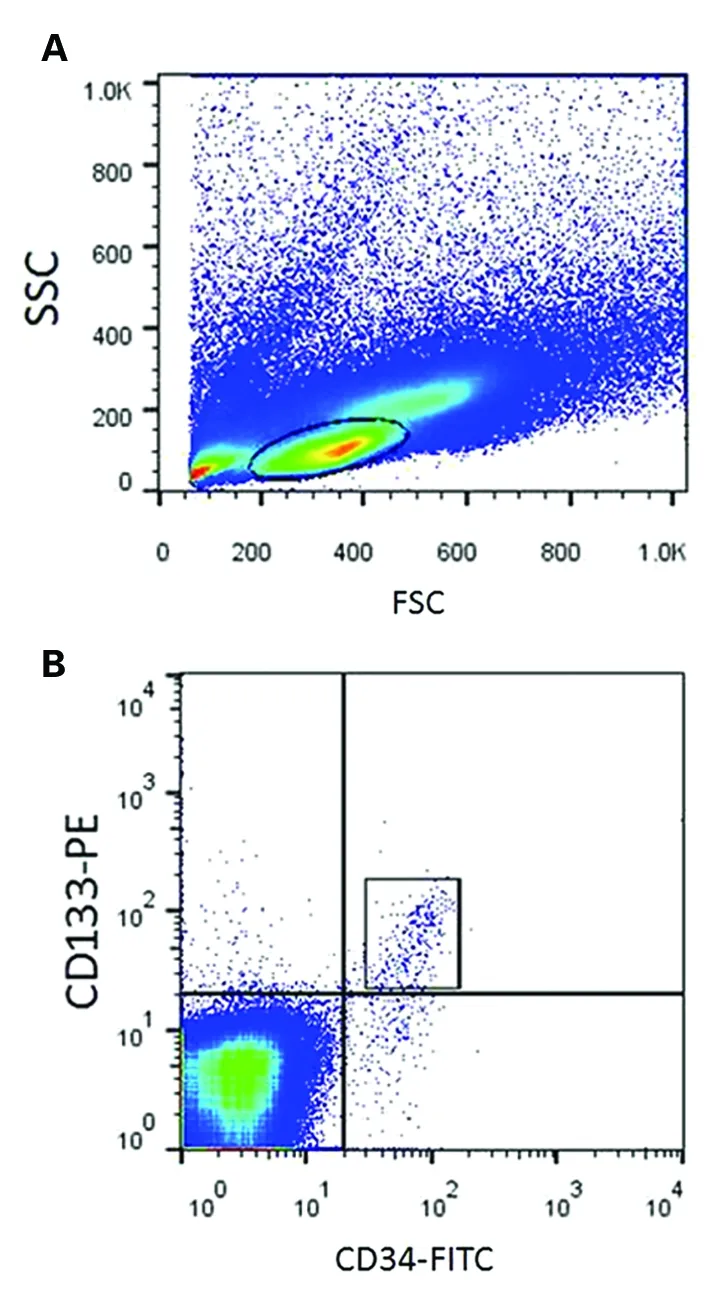
A:依据前向角散射(FSC)、侧向角散射(SSC)设第1个细胞门,圈选出单个核细胞区域;B:依据CD34-FITC和CD133-PE设第2个细胞门,圈定CD34和CD133双阳性细胞群
图1 流式细胞检测分析CD34/CD133双阳性标记的EPCs数量
三、疗效评定标准
DR分期改变:参照蒋苏平的方法[3]。缓解:DR分期减轻;进展:DR分期向前进展。缓解率=(分期缓解眼数/总患眼数)×100%,进展率=(分期进展眼数/总患眼数)×100%。
视力改变:参照段毅琴等的方法[4]。视力检测采用国际标准视力表,以提高≥4行或提高到≥1.0为视力显著提高,提高≥2行为视力提高,变化≤1行为视力不变,降低≥2行为视力下降。 治疗前视力不及0.1者,每进步0.02计为1行。
四、统计学方法
结 果
1.血糖及糖化血红蛋白:随访期间,对照组1例失访,29例(57只眼)完成研究;干预组30例(58只眼)均完成研究。对照组与干预组治疗前后空腹血糖、糖化血红蛋白见(表1)。对照组治疗前后空腹血糖、糖化血红蛋白均无统计学差异(P>0.05)。干预组治疗后的空腹血糖、糖化血红蛋白与治疗前及对照组相比,差异均无统计学差异(P>0.05)。
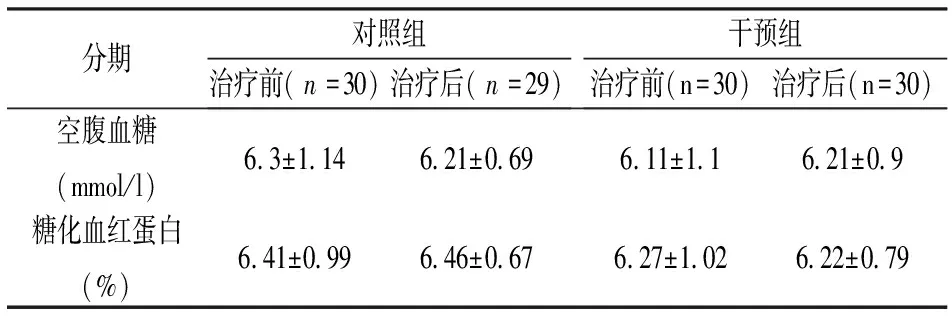
分期对照组治疗前(n=30)治疗后(n=29)干预组治疗前(n=30)治疗后(n=30)空腹血糖(mmol/l)63±114621±069611±11621±09糖化血红蛋白(%)641±099646±067627±102622±079
2.DR分期改变:干预组与对照组治疗前后DR分期见(表2)。对照组治疗后,Ⅰ期4只眼进展至Ⅱ期;Ⅱ期5只眼进展至Ⅲ期;Ⅲ期4只眼进展至Ⅳ期;进展率为21.05%,且无任何一眼病变缓解。干预组治疗后,Ⅰ期1只眼进展至Ⅱ期;Ⅱ期1只眼进展至Ⅲ期,5只眼缓解至Ⅰ期;Ⅲ期2只眼缓解至Ⅱ期;进展率为3.45%,明显低于对照组,缓解率为12.07%。两组患者治疗前后DR分期比较均无统计学差异(P>0.05)。
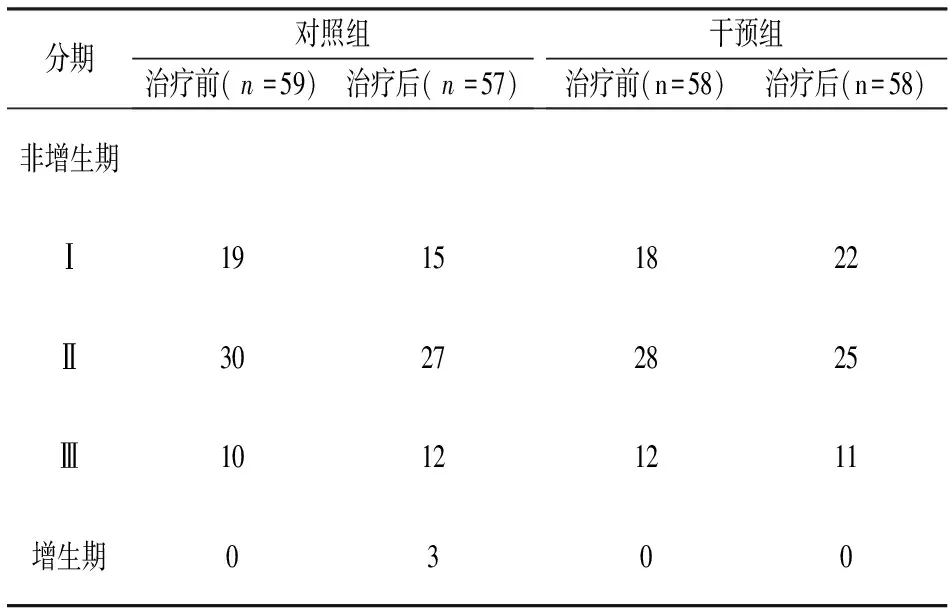
表2 两组治疗前后糖尿病视网膜病变分期
3. BCVA:改变对照组治疗后45只眼视力不变,12只眼视力下降,无患眼视力提高。干预组治疗治疗后6只眼视力显著提高,8只眼视力提高,44只眼视力不变,无患眼视力下降,视力提高率为24.14%,显著大于对照组。
4.外周血EPCs数量:流式细胞学检测显示,对照组与干预组治疗前EPCs数量分别(94.57±7.01)个、(94.73±6.54)个,差异无统计学意义(P>0.05)。治疗后,干预组EPCs数量为(128.63±14.12)个,明显高于治疗前及对照组((83.17±7.89)个),差异具有统计学意义(t=11.93,t=15.33,P均<0.05)。
讨 论
EPCs作为一种血管内皮前体细胞,可以迁移并整合至血管受损部位,分化为成熟的血管内皮细胞而起到维护血管完整性和血管修复的作用。正常情况下,内皮损失和EPCs对内皮的修复作用处于一种动态平衡状态,一旦 EPCs 受损,内皮损害和修复之间的平衡被打破,内皮层的完整性遭到破坏。血视网膜屏障破坏是NPDR发病的主要特征,主要表现为视网膜微血管壁内皮细胞损失和功能障碍,故内皮修复对于维持正常血管结构及完整性具有重要作用。糖尿病患者外周血EPCs数量明显下降,其增殖、迁移等功能受损且细胞寿命明显缩短,进而引起受损血管修复障碍,在糖尿病血管并发症的发生发展中起到重要作用。
研究表明,糖尿病患者体内ROS生成明显增多,氧化应激增强加速了EPCs端粒损伤,引起EPCs衰亡[5]。另外,VEGF/PI3K/AKt/eNOS信号通路受损以及SDF-1、CXCR4等细胞因子水平降低,导致EPCs的增殖、迁移等功能障碍。因此,寻找有效方法上调糖尿病患者EPCs数量并改善其功能,对于预防相关血管并发症的发生、发展具有重要意义。Caballero等[6]证实,缺血再灌注损伤、氧诱导的视网膜病变及糖尿病导致的视网膜血管损伤模型中,玻璃体腔或静脉注射健康的EPCs后,发现其可以迁移、整合到损伤的血管壁有效修复血管损伤,使退化的视网膜毛细血管得以重建。但是,糖尿病患者体内炎症、氧化应激微环境导致移植的EPCs衰亡且功能受损,移植效果较差。
辛伐他汀独立于降脂作用外,还具有强大的抗炎、抗氧化等多种药理作用。体外高糖培养内皮细胞,给予他汀类药物后内皮细胞表面ICAM-1表达减少,白细胞与内皮细胞粘附减少[7]。糖尿病大鼠模型中,他汀类药物可以抑制肾脏IL-1β, IL-6, PGE2等炎症因子表达,减轻肾损伤[8]。因此,辛伐他汀治疗可以改善糖尿病患者体内血管微环境,为募集EPCs至血管受损部位奠定了良好基础。另外,近年研究表明辛伐他汀可促进EPCs增殖、分化,进而上调外周血中EPCs数量,涉及多种机制如NO通路、PI3K/Akt/mTOR通路、下调miR 221和miR 222 水平、减轻氧化应激等[9]。本研究中,干预组给予辛伐他汀治疗3个月后,糖尿病患者外周血EPCs含量显著增加,与既往研究结果一致。
糖尿病大鼠模型中,辛伐他汀治疗可以延缓DR进展,与上调EPCs数量及减轻炎症反应有关。本研究进一步在临床水平证实辛伐他汀对于改善NPDR,缓解DR进展确实存在一定疗效。NPDR患者口服辛伐他汀3个月后12.07%患眼DR分期缓解,仅3.45%患眼进展,而对照组21.05%的患眼DR分期进展且无任一患眼缓解。但是,两组治疗后DR分期比较,差异无统计学意义,考虑与随访时间较短有关。另外,干预组治疗后患眼视力提高率达24.14%,而对照组无患眼视力提高。两组患者治疗前后空腹血糖与糖化血红蛋白水平比较无明显差异,表明辛伐他汀对血糖无显著影响,且其改善NPDR的作用与血糖水平无关。
综上所述,本研究证实了辛伐他汀可以动员NPDR患者体内EPCs入血,进而参与视网膜微血管损伤修复,并对延缓早期DR进展具有一定疗效。但是,本研究样本量较小、观察随访时间较短,辛伐他汀对NPDR的肯定临床疗效还需要进一步的多中心、随机双盲的大样本研究证实。
[1] Yellowlees Douglas J, Bhatwadekar AD, Li Calzi S, et al. Bone marrow-CNS connections:implications in the pathogenesis of diabetic retinopathy. Prog Retin Eye Res, 2012,31:481-494.
[2] Zhang W,Yan H. Simvastatin increases circulating endothelial progenitor cells and reduces the formation and progression of diabetic retinopathy in rats. Exp Eye Res,2012,105:1-8.
[3] 蒋苏平. 普罗布考对非增生性糖尿病视网膜病变的抗氧化应激作用. 国际眼科杂志, 2015,15:289-291.
[4] 段毅琴, 林丁, 陈忠平, 等. 普罗布考辅助治疗增殖前期及增殖早期糖尿病视网膜病变. 眼科新进展, 2015,35:945-948.
[5] Ambasta RK, Kohli H, Kumar P. Multiple therapeutic effect of endothelial progenitor cell regulated by drugs in diabetes and diabetes related disorder. J Transl Med, 2017,15:185.
[6] Caballero S,Sengupta N,Afzal A, et al. Ischemic vascular damage can berepaired by healthy, but not diabetic,endothelialprogenitor cells. Diabetes,2007,56:960-967.
[7] Park J, Hwang I, Kim SJ, et al. Atorvastatin prevents endothelial dysfunction in high glucose condition through Skp2-mediated degradation of FOXO1 and ICAM-1. Biochem Biophys Res Commun, 2017.
[8] Maraqa AD. Effect of atorvastatin on interleukins and prostaglandin E2 in the kidney of type 1 diabetic rats. Eur Cytokine Netw, 2016,27:97-101.
[9] Sandhu K, Mamas M, Butler R. Endothelial progenitor cells: Exploring the pleiotropic effects of statins. World J Cardiol, 2017,9:1-13.
