视网膜缺血再灌注后视网膜的病理变化及造模前后CREB的表达隋源
2018-01-11
cAMP 反应元件结合蛋白( cAMP response element binding protein, CREB)是一种存在于真核生物细胞核内蛋白, CREB 与真核生物 cAMP 反应元件结合,启动基因转录,又称之为转录增强因子。 CREB 功能表现在生命活动的各个方面,如调节细胞周期, 影响胎儿 T 细胞的发育,影响肝脏代谢、影响神经元细胞的存活和再生等。在培养的皮层神经元中,利用 siRNA 及基因敲除等技术证明,神经营养因子通过 MSK-1 激活 CREB 促进神经元的存活。研究表明 CREB 对心脑缺血再灌注损伤具有保护作用[1]。视网膜缺血再灌注损伤的小鼠视网膜中神经元的丢失主要集中在视网膜神经节细胞层(retinal ganglion cells,RGC)。我们观察了视网膜缺血1 h再灌注后,中长期( 7、 14、21 d)神经元细胞凋亡情况。 CREB 在脑组织缺血再灌注的研究结果显示对神经元具有保护作用,因此,我们检测了 CREB 在该模型中的表达改变,研究其与视网膜神经节细胞之间的关系。
资料与方法
一、材料
实验动物:取健康清洁的 8 周龄 C57/BL6J 小鼠 90 只,雌雄兼有(我院动物实验中心提供)。所有动物均在我院动物实验中心的 SPF 环境下饲养。所有动物的饲养与处死均按照美国国立卫生研究院( National Institutes of Health, NIH )的《实验动物管理及使用指南》进行。
主要试剂与抗体:Trizol Invitrogen, 15596-018);显影定影试剂 谷歌生物;Actin santa cruz;BCA 蛋白定量检测试剂盒 Bio-rad;cDNA 第一链合成试剂盒, Fermentas #K1622;SYBR Green/Flourescein qPCR Master Mix(2X): Fermentas , #K0242;Ex TaqTM TAKARA, DRR100A;DL2000 DNA Marker TAKARA, D502A;引物合成 金斯瑞;CREB CST, #9197。
二、方法
1.视网膜缺血再灌注模型的建立用前房加压灌注方法,将 200 ml 生理盐水输液袋悬于距大鼠眼球 1.36 m 高处。麻醉后,在显微镜下用 32G×6 mm 胰岛素针头穿刺入前房,此时眼压 相当于 100 mmHg(136 cm H20=100 mmHg, 1 kPa=7.5 mmHg , 100 mmHg=13.3 kPa),观察若出现瞳孔逐渐散大,虹膜、视网膜缺血,角膜逐渐水肿呈雾状,则视网膜缺血再灌注模型构建成功。灌注持续 1 h。造模过程中频点可乐必妥滴眼液,灌注后实验眼涂眼膏。
2.实验分组随机将实验动物随机分为正常对照组( CON)、视网膜缺血再灌注模型组(RIR)。两组均在造模后 7、 14、 21 d取材。每组每个时间点 30 只眼球。实验采用双眼造模。
3.全视网膜铺片免疫荧光每组每时间点取小鼠4只眼球,行颈椎脱臼法处死小鼠,取出眼球。去除眼前节、晶状体和玻璃体的视杯在新鲜配制的4%多聚甲醛中固定1 h,4个钟点位做松解切口,去除巩膜,玻璃体面朝上行视网膜铺片,在封闭液BSAT中进行室温孵育2 h,封闭液用PBS配制,含5%牛血清白蛋白(BSA)、6%的驴血清和0.2%的TritonX-100。用封闭液按1:200稀释山羊来源的Brn3a抗体,及小鼠来源的GFAP抗体。4 ℃孵育48 h,用PBST洗涤5次,每次5 min,用Cy3标记的驴抗山羊IgG(1:80稀释)和FITC标记的驴抗小鼠IgG(1:80稀释)室温孵育4 min,用p-phenylenediamine封片,进行拍照。
4.免疫组化剪除眼前节和玻璃体,将视杯放在用磷酸盐缓冲液(PBS)新鲜配制的4%多聚甲醛(PA)中固定30 min,梯度脱水:10%和20%的蔗糖溶液中4 ℃各放置2 h,30%溶液中4 ℃过夜,蔗糖溶液用PB缓冲液配制。标本在30%溶液沉降到底说明脱水完成。用OCT胶包埋后放置-80 ℃冰箱速冻,垂直视网膜面以12 μm厚度行冰冻视网膜切片。选取经过视神经的视网膜冰冻切片,PBST洗去OCT胶;在封闭液中孵育2 h后,用封闭液以1:200稀释山羊源的Brn3a抗体,及1:400小鼠来源的GFAP,湿盒中4 ℃冰箱过夜;用PBST洗涤3次,每次10 min。用Cy3标记的驴抗山羊IgG(1:80稀释)和FITC标记的驴抗小鼠IgG(1:80稀释)温避光孵育2 h,用PBST洗涤3次,每次10 min。用4',6-二脒基-2-苯基吲哚(DAPI)染核15 min,用PBST洗涤3次,每次10 min;用p-phenylenedia-mine封片。进行拍照。
5.Western blot 法检测视网膜组织中 CREB 的表达具体步骤严格按照试剂盒说明进行,用酶标仪测定 595nm 的光吸收 OD 值。
6.Real-Time PCR 法检测视网膜组织 CREB 的 mRNA 表达每组每时间点取小鼠眼球8只,于冰上操作并取出视网膜。存放于用DEPC水处理过的EP管中,放置-80 ℃冰箱保存。realtimePCR引物设计:MusCreb217bp;MusCrebFTCAGCCGGGTACTACCATTC;MusCrebRCTCTCTCTTCCGTGCTGCTT;PCR反应体系:b-240F(10uM)0.5 μl;b-240R(10uM)0.5 μl;dNTP(2.5mM)2 μl;ExTaq0.25 μl;10×ExTaqEbuffer2.5 μl;cDNA1补充ddH2O至25 μl;反应条件:94 ℃4 min;94 ℃30 s,54 ℃30 s,72 ℃25 s;30cycles,72 ℃4 min,4 ℃4 min。本实验采用2(-ΔΔct)相对定量法计算扩增倍数,实验重复3次。
7.视网膜神经节细胞计数:将视网膜分为4个象限,每个象限以视乳头为中心分3等份,每象限处在3等份中选取3个部位进行神经节细胞计数。计数倍率为200×倍,并用荧光显微镜进行照相,算得总数除以视网膜总面积,为单位面积内视网膜神经节细胞的数目。
8.视网膜内核层、外核层、总核层测量:用 Photoshop CS 对视网膜切片核层进行测量,每张切片选取3个位置取平均值,如 RIR 模型 7 d内核层的测量,选取 4 只眼球共 8 张切片。每张切片3个部位。共 24 个数据取平均值。
三、统计学分析
实验数据使用 SPSS16.0 统计软件进行分析,正常对照组与视网膜缺血再灌注组神经节计数比较采用独立样本t检验,以P<0.05 作为差异有无统计学意义。
结 果
一、RIR 损伤对神经节细胞层的影响
如图1所示,用 Brn3a对视网膜切片及铺片染色,观察对照组及造模后神经节细胞数量在不同时间点的改变。由铺片可见,神经节细胞在造模前后数量有明显丢失。如表1所示,计算各个象限内相同面积的神经节细胞的个数,结果示统计对照组与造模组有显著性差异(P<0.05)。

表1 造模前后视网膜铺片神经节细胞计数

图1 RIR 模型导致神经节细胞损伤(×200)
二、RIR 模型损伤致视网膜神经胶质细胞增生
在对照组中, GFAP 的荧光信号主要分布在神经节细胞层(图 2),属于正常GFAP 表达。而造模后,可见 GFAP 荧光明显增强,荧光信号分布于大部分视网膜视网膜神经胶质细胞增殖,在视网膜内侧呈栅栏状排列。于 14 d时表达最为明显。增殖肥大的 Müller 细胞形成的胶原纤维鞘包裹受损的神经元。
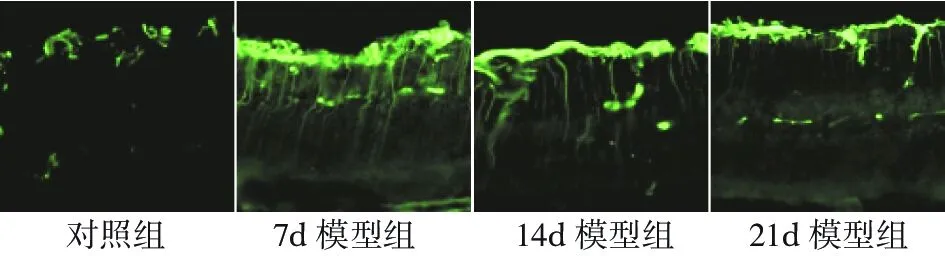
图2 RIR 模型中 Müller 细胞增殖情况(×200)
三、视网膜各核层比例改变
RIR 组 GCL层和 INL层细胞排列紊乱(图3)。统计内核层/外核层(INL/ONL)、内核层/总核层(INL/TL)的的厚度比(表2)。发现造模后 INL/ONL 呈降低趋势,但无统计学意义。造模后INL/TL呈上升趋势,组间无统计学意义。
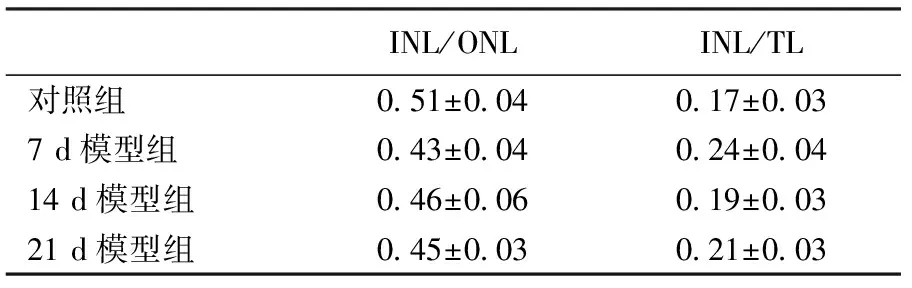
表2 RIR模型不同组别的 INL/ONL及INL/TL结果
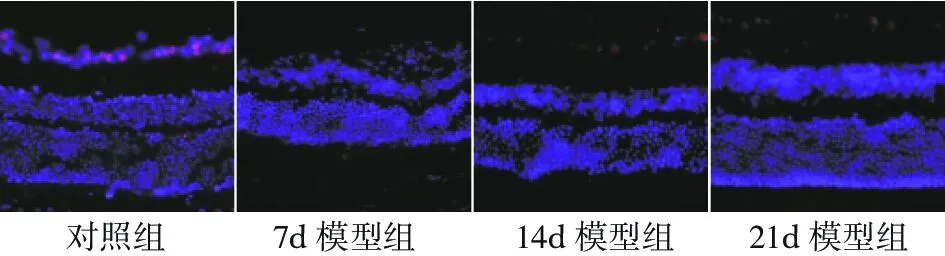
图3 RIR 模型导致视网膜各核层比例改变(×200)
四、CREB 的表达变化
本实验用 Western Blot 定量检测 CREB 在造模前后不同时间点的表达水平(图4)。发现造模后 7 d、 14 d CREB 表达下降, 21 d表达上调。 7、 14 d分别与对照组21 d组有显著性差异。 Real-time PCR 结果显示(图 3):各组 CREB 基因均较对照组下调,与对照组相比有统计学意义。在 RIR 模型 14 d时 CREB 基因相对表达量最低。其中 7 d、14 d相比有统计学意义(P<0.05)。
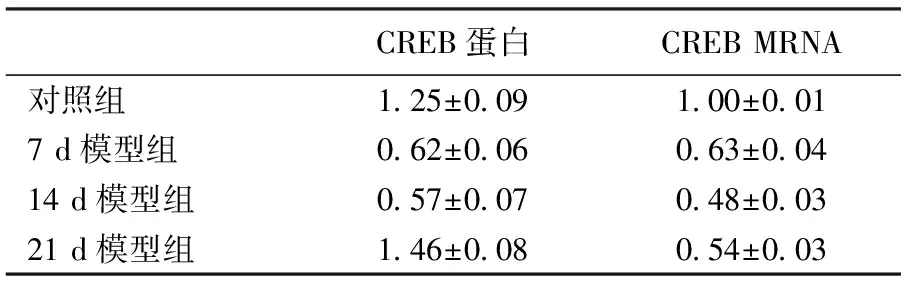
表3 CREB 的表达变化
讨 论
目前视网膜缺血再灌注损伤在心脑血管疾病中的作用中研究较多[2-4]。CREB是一种转录调节因子。I/HPC时细胞内CREB表达增加,保护神经元细胞免于凋亡。CREB激活后可通过上调BDNF、BCL-2等一些目的基因的表达,来减轻心脏缺血再灌注损伤[5]。众所周知,视网膜来源于间脑,其许多功能和结构特征与大脑相似。其发生缺血再灌注的病理生理过程与脑部相似。但是视网膜和大脑相比,最大的显着性差异是视网膜对局部缺血损伤抵抗性较强。尽管因使用不同的动物模型和种属差异使得缺血性视网膜与大脑相比抵抗倍率缺乏一致性,但视网膜缺血时细胞存活率长于大脑已是普遍共识。视网膜是非常薄的组织,当其血管发生阻塞时,可以从玻璃体获取部分能量,这也可能是视网膜具有缺血抵抗性的部分原因。
有研究发现对大鼠视网膜缺血损伤作定量分析,发现视网膜缺血30 min时基本正常;而60 min时,内层视网膜变薄,外核层基本没有变化;90 min,节细胞层和内核层的细胞几乎不存在,外核层仍然相对地完整[6,7]。对于RGC的减少,本实验出现类似变化。另外,从视网膜铺片中观察到神经节细胞的减少呈现区域化,即在锯齿缘及视乳头附近RGC的损伤程度较赤道轻微,可能是因为RGC细胞在视网膜本身分布不均匀,及视网膜所受压力不均的原因。加上本身小鼠视网膜的细胞构成和厚度就有区域性差异,同时RIR模型后视网膜细胞存在代谢差异,比如靠近血管部位的神经元更容易收到再灌注时炎性因子的损害。从而视网膜缺血再灌注后,视网膜损伤出现的差异性改变。缺乏上游神经细胞的信息传入,位于下游的外核层细胞自然的受到影响。有研究表明[6],不同时间的RIR模型所引起的视网膜病变范围是不同的。视网膜在缺血60 min时不单引起内核层的神经退行性改变,还会引起外核层光感受器的损害。而在缺血45 min时,主要对内核层细胞产生影响。还有研究发现视网膜缺血再灌注120 min时,内核层及内网层损伤较外核层明显[7]。这些结果都提示,视网膜内外核层具体的损伤程度因种属和模型而异。视网膜对缺血再灌注损伤程度有区域化改变。
就我们的模型而言,对视网膜进行DAPI染色统计发现,RIR 60 min造模后,内外核层发生相似比例变化,内总核层比例在造模前后也无明显改变。在视网膜受到损伤时,Müller细胞立即活化,即Müller细胞反应性胶质化,Müller细胞活化会高表达GFAP,视网膜的免疫保护机制被启动。增生的Müller细胞轴突包绕受损伤的神经细胞,形成长驻状结构,保护神经细胞免收免疫因子的攻击,在视网膜受损后的重塑起重要作用。本实验中对照组GFAP在GCL层有少量表达,是星形胶质细胞的显现。在RIR后,可见GFAP表达明显增强,近似贯穿整个视网膜,与对照组相比有明显差异。这是Müller受损后诱导表达GFAP。因此,RIR后可以激活Müller细胞。对与müller细胞在视网膜缺血再灌注中所以的作用,目前有两种意见,一方面其能增生包裹神经元免受免疫攻击,同时却阻碍神经再生及形成瘢痕。活化的Müller细胞还可通过释放COX-2[8]、NO[9],加重RGC的损伤。
我们用Westernblot定量方法,观察造模前后CREB的表达情况。发现造模后7 d、14 d CREB表达下降,与对照组有显著性差异。21 d CREB反而上升。有研究证实[10-12],在动物脑缺血损伤中CREB高表达,提示在脑缺血缺氧环境下对神经细胞发挥保护作用。在视网膜缺血/低氧预适应(I/HPC)中,有研究观察到诱导性上调CREB具有对RGC的神经保护作用[13]。在眼内压轻度增高时(28~35 mmHg),因为Akt激活受限,CREB表达下降[14]。有研究从观察CRER的磷酸化来检测脑缺血90 min CREB激活情况[15],发现:缺血周围区有持续增强的磷酸化的CREB,有明显的BCL-2表达,而缺盘中心区没有检测到BCL-2蛋白,这与该区神经元丢失并出现梗死有关。对于CREB蛋白在损伤后21 d表达出现上升情况,可能是因为从7 d开始视网膜处于损伤恢复期,至21 d后CREB恢复至正常水平。
综上所述,本文研究发现,视网膜缺血再灌注会引起视网膜神经节细胞大量丧失,CREB呈现下调表现。
[1] 忽海洋,白莉,马文艳,等.吡格列酮通过pCREB蛋白对大鼠缺血再灌注损伤心肌保护机制的研究.中西医结合心脑血管病杂志,2015,2:193-195.
[2] 宋庆磊,霍鸣.评价视网膜缺血再灌注损伤指标的研究进展.基础医学与临床,2014,34:1293-1296.
[3] 邵宏超,葛嫣然,刘岩,等.rh-bFGF 对兔视网膜缺血再灌注损伤的保护作用及其机制.山东医药,2016,3:038-39.
[4] 宋庆磊,张海江,霍鸣,等.TNF-α与视网膜缺血再灌注损伤的研究进展.实用医学杂志,2014,22:3685-3687.
[5] Wang P, Xu J, Zhang C. CREB, a possible upstream regulator of Bcl-2 in trichosanthin-induced HeLa cell apoptosis. Mol Biol Rep, 2010,37:1891-1896.
[6] 刘巾男,何宇,张军军,等.微小RNA-181a与视网膜节细胞在视网膜缺血-再灌注中的关系及其作用机制探讨.中华实验眼科杂志,2015,33:985-990.
[7] 王赛斌,姬斌,陈碧新,等.自发性高血压大鼠缺血再灌注后视网膜毛细血管细胞凋亡及p53基因表达.中华眼底病杂志,2009,25:198-201.
[8] Lei X,Zhang J,Shen J,et al.EP0 attenuates inflammatory cytokines by Muller cells in diabetic retinopathy.Front Biosci (Elite.Ed),2011,3:201-211.
[9] Zeng K,Xu H, Chen K, et al .Effects of taurine on glutamate uptake and degradation in Muller cells under diabetic conditions via antioxidant mechanism.Mol Cell Neurosci,2010,45:192-199.
[10] 闵晓黎,王廷勇,刘佳,等.下调IGF-1通过CREB信号通路失活间接加重大鼠脑缺血损伤.中风与神经疾病杂志,2015,32:872-876.
[11] 白万胜,陈慧,薛红丽,等.大鼠局灶性脑缺血再灌注后p-CREB、 c-fos表达与神经保护.中风与神经疾病杂志,2014,31:1084-1086.
[12] 舒洛娃,潘楚雄.丝裂原和应激激活蛋白激酶1及cAMP反应元件结合蛋白参与小剂量氯胺酮降低小鼠缺血性脑损伤.国际麻醉学与复苏杂志,2015,36:509-513.
[13] Julia Biermann, Wolf A. Lagre ze,et al.Preconditioning with inhalative carbon monoxide protects rat retinalg ganglion cells from ischemia/reperfusion injury invest.Ophthalmol Vis Sci,2010, 51:3784-3791.
[14] 杨秀梅,王雨生,张建,等.MEK/ERK和PI3K/Akt通路对大鼠脉络膜新生血管中DDR2和MMP-13表达的调控作用.中华实验眼科杂志,2015,33:678-685.
[15] 张斌.异氟烷对新生小鼠神经元细胞外信号调节激酶和cAMP反应元件结合蛋白磷酸化水平的影响.中国医药导报,2016,13:22-25.
