抗菌肽Lc-NKlysin-1a的抗菌稳定性及其抗菌机理
2018-01-11罗文杰钟亨任何露露邵佳琪宋彦廷张英霞
罗文杰,钟亨任,何露露,邵佳琪,宋彦廷,张英霞
(海南大学 海洋学院,热带生物资源教育部重点实验室, 海南 海口 570228)
抗菌肽Lc-NKlysin-1a的抗菌稳定性及其抗菌机理
罗文杰,钟亨任,何露露,邵佳琪,宋彦廷,张英霞
(海南大学 海洋学院,热带生物资源教育部重点实验室, 海南 海口 570228)
Lc-NKlysin-1是从海洋鱼类——大黄鱼(Larimichthyscrocea)中获得的抗菌肽,为进一步优化该抗菌肽和研究其结构与功能的关系,本文截取了其N末端的12个氨基酸残基,设计并合成了抗菌肽Lc-NKlysin-1a,同时,通过琼脂板打孔法,对其抗菌活性,不同温度、pH值、盐浓度等对其抗菌活性的影响,其溶血活性,最低抑菌质量浓度,其抗菌特征等进行了研究,并在扫描电镜下观察了其对细菌形态结构的影响.结果表明:抗菌肽Lc-NKlysin-1a对革兰氏阳性菌(金黄色葡萄球菌、枯草芽孢杆菌)和革兰氏阴性菌(大肠杆菌、副溶血弧菌、铜绿假单胞菌、抗链霉素大肠杆菌)均具有抗菌活性;但对金黄色葡萄球菌、大肠杆菌和抗链霉素大肠杆菌的抗菌活性最好,其最低抑菌质量浓度(MIC)在15.625~31.25 μg·mL-1之间;相对于Lc-NKlysin-1,Lc-NKlysin-1a的抗菌活性明显增强;Lc-NKlysin-1a在15.625~31.25 μg·mL-1时,其溶血率为3.80%~7.37%,溶血活性较低;Lc-NKlysin-1a对温度、pH和盐等具有良好的耐受性,且稳定性高.此外,通过扫描电镜还观察到,抗菌肽Lc-NKlysin-1a作用于细菌后细菌的形态发生了明显改变,其细胞膜出现了褶皱和塌陷的现象,最终导致了内溶物外泻而死亡.改造后的抗菌肽其相对分子质量小,活性高,稳定性强,更易于被开发成抗菌肽类药物.
抗菌肽; 大黄鱼; 抗菌活性; 稳定性; 机理
抗生素的发现和使用是人类医学史上的巨大进步,它挽救了数以亿计的生命[1],但抗生素的滥用亦导致了许多耐药菌出现,这些耐药菌给人类的健康带来了极大的威胁.抗菌肽是生物免疫系统产生的一类抵抗外界病原体感染的肽类生物活性物质,它广泛存在于昆虫、植物、动物及人体内[2].抗菌肽不仅具有抗生素的抗菌特性,而且与传统的抗生素相比,它还具有抗菌谱广、不易产生耐药性、使用后无药物残留和具有热稳定性等优点,因此,它可作为一种新型的抗生素替代品[3-4].海洋拥有丰富的生物多样性和生态环境多样性,其中,无脊椎动物和鱼类是海洋生物多样性的代表,是具有新型结构和功能的抗菌肽的重要来源.大黄鱼(Larimichthyscrocea)是一种海洋经济鱼类,为我国传统“四大海产”之一[5],Zhou等从大黄鱼中获得了多种抗菌肽,他对抗菌肽Lc-NKlysin-1(GLLKSLCKKFVKGHLGELIEELTTSDD)的抗菌活性进行了初步的研究,发现Lc-NKlysin-1对金黄色葡萄球菌、枯草芽孢杆菌和大肠杆菌具有抗菌活性,而对副溶血弧菌不具有活性[6].抗菌肽的正电荷数、疏水性、两亲性α-螺旋、肽链长度、C-末端或N-末端二级结构等都与其抗菌活性或溶血活性密切相关,因此,通过删除或替换抗菌肽中的氨基酸,可以获得活性更好的抗菌肽[7~8].为了优化抗菌肽Lc-NKlysin-1,通过对其结构的分析发现,抗菌肽Lc-NKlysin-1含有27个氨基酸残基,其合成成本相对较高,且抗菌肽Lc-NKlysin-1带有1 个负电荷,不利于与带有负电荷的细菌细胞壁相互作用.为此,本研究截取了其N-末端的12个氨基酸残基序列,并进行了固相合成,同时将其命名为Lc-NKlysin-1a(GLLKSLCKKFVK).抗菌肽Lc-NKlysin-1a(电荷数+4)富含赖氨酸,相对于原模版抗菌肽Lc-NKlysin-1(电荷数-1),其所带正电荷增加,碱性带有正电荷的区域与带负电荷的细菌细胞壁可相互作用,从而使抗菌肽更易于吸附到细胞壁上.Lc-NKlysin-1a中的亮氨酸、苯丙氨酸和缬氨酸构成了疏水性区域,这有利于抗菌肽通过细胞膜的脂质双分子层.Lc-NKlysin-1a中还含有甘氨酸、丝氨酸、半胱氨酸和赖氨酸,这些极性氨基酸形成的区域和疏水性氨基酸形成的区域形成了两亲性的分子结构,这是抗菌肽发挥抗菌作用的基础[9].Lc-NKlysin-1a与模版抗菌肽相比,其疏水性氨基酸的含量相对减少,这有利于降低其溶血活性.鉴此,笔者研究了抗菌肽Lc-NKlysin-1a的抗菌活性和其在不同条件下的抗菌稳定性,旨在获得一种抗菌活性稳定,溶血率低,合成成本低,且相较于原抗菌肽活性更好的抗菌肽;并试图在此基础上,通过杀菌曲线和扫描电镜来初步探究抗菌肽Lc-NKlysin-1a的抗菌机理.
1 材料与方法
1.1菌株受试菌株,革兰氏阴性菌:大肠杆菌(Escherichiacoli,ATCC 25922)、抗链霉素大肠杆菌、铜绿假单胞菌(Pseudomonasaeruginosa,ATCC 15442)、副溶血弧菌(Vibrioparahaemolyticus,实验室分离);革兰氏阳性菌:金黄色葡萄球菌(Staphylococcusaureus,ATCC 25923),枯草芽孢杆菌(Bacillussubtilis,ATCC 6633).
1.2抗菌肽Lc-NKlysin-1a的合成通过固相合成法来合成多肽(上海吉尔生化),并利用RP-HPLC进行纯化(纯度大于95%),然后冻干,用MALDI-TOF检测合成的多肽.
1.3抗菌肽Lc-NKlysin-1a的抗菌活性检测以琼脂板扩散法测定抗菌肽Lc-NKlysin-1a的抗菌活性[10].分别将所测试的6株细菌的单菌落接种于5 mL的 LB液体培养基中,并于37 ℃振荡培养8 h,接着调整菌液浓度至1.2×109CFU·mL-1,取200 μL菌悬液,将其加至50~55 ℃的100 mL的LB培养基中,摇匀,倒入培养皿,冷却,打孔.于孔中分别加入8 μL2 g·L-1的卡那霉素(阳性对照)、无菌水(阴性对照)和2 g·L-1的Lc-NKlysin-1a溶液,并于37 ℃恒温培养箱中倒置培养12 h(枯草芽孢杆菌培养24 h),然后观察并测量抑菌圈的直径.
1.4抗菌肽Lc-NKlysin-1a的最低抑菌质量浓度(MIC)测定用无菌水配制2 g·L-1的Lc-NKlysin-1a溶液,通过二倍稀释,分别配制成质量浓度为1 000,500,250,125,62.5,31.25,16.625 μg·mL-1和8.312 5 μg·mL-1的抗菌肽溶液(备用),调整菌液浓度至1×106CFU·mL-1,在96孔板中加入100 μL菌液,再分别加入100 μL不同质量浓度的抗菌肽溶液、无菌水或2 g·L-1的卡那霉素,混合均匀,每孔设置3个重复,然后于37 ℃培养12 h,每孔再加入20 μL刃天青溶液(1.4 g·L-1),培养2 h,观察孔中的颜色变化.
1.5Lc-NKlysin-1a抗菌稳定性的研究
1.5.1 不同温度对抗菌肽抗菌活性的影响配制2 g·L-1的Lc-NKlysin-1a溶液,分别在25,40,60,80,100 ℃处理20 min,并通过琼脂板扩散法,于每孔分别加入8 μL不同温度处理的抗菌肽溶液或无菌水(阴性对照),每孔设3个重复,然后将培养皿倒置,于37 ℃培养12 h,观察并测量抑菌圈的直径.
1.5.2 加热时间对抗菌肽抗菌活性的影响为了检测100 ℃下不同处理时间对抗菌肽抗菌活性的影响,本研究将Lc-NKlysin-1a(2 g·L-1)溶液在100 ℃下分别处理0,20,40,60,80 min,接着,通过琼脂板扩散法,于各孔中分别加入8 μL 以上处理的Lc-NKlysin-1a或无菌水(阴性对照),每孔设3个重复,实验方法见4.1.
1.5.3 不同pH对抗菌肽抗菌活性的影响参考刘晶晶等人的方法处理抗菌肽[11],即配制2 g·L-1的Lc-NKlysin-1a抗菌肽溶液,在分别用1 mol·L-1的HCl和1 mol·L-1的NaOH调节pH至2,3,4,5,6,7,8,9,10后,用0.22 μm的微孔滤膜过滤(除菌),再通过琼脂板扩散法,于各孔分别加入8 μL不同pH处理的抗菌肽溶液,每孔设3个重复,实验方法见4.1.
1.5.4 不同盐浓度对抗菌肽抗菌活性的影响分别用0.5,1,1.5,2 mol·L-1的无菌氯化钠溶液配制2 g·L-1的Lc-NKlysin-1a溶液,再通过琼脂板扩散法,分别于各孔加入8 μL不同盐浓度处理的抗菌肽溶液和无菌水(阴性对照),每孔设3个重复,实验方法见4.1.
1.6抗菌肽Lc-NKlysin-1a对金黄色葡萄球菌的杀菌曲线将金黄色葡萄球菌单菌落接种到LB液体培养基中,于37 ℃振荡培养3 h,调整细菌悬液至1×106CFU·mL-1,各取2.4 mL菌悬液,分别加入800 μL 125 μg·mL-1和62.25 μg·mL-1的Lc-NKlysin-1a溶液(终质量浓度分别为31.25,15.625 μg·mL-1)或无菌水,混匀,并于37℃振荡培养,然后分别在0,30,60,120,180 min取菌液并涂布培养,最后计数菌落数.
1.7抗菌肽Lc-NKlysin-1a对细菌形态的影响取大肠杆菌、抗链霉素大肠杆菌和金黄色葡萄球菌单菌落,并将其接种于LB液体培养基中,于37 ℃振荡培养12 h,然后取750 μL菌液,加入Lc-NKlysin-1a溶液,使其终浓度为4×MIC,接着,以无菌水为阴性对照,于37 ℃培养1 h,然后以5 000 r·min-1离心3 min,取上清,以磷酸缓冲液洗2次,再加入φ=4%的戊二醛,于4 ℃固定8 h,离心,以磷酸缓冲液洗2次;接着加入φ=2%的戊二醛,于4 ℃固定1 h,离心,以磷酸缓冲液洗2次;最后,依次用体积分数为20%,50%,80%,100%的乙醇梯度脱水,每次10 min,然后取菌悬液,将其滴到锡箔纸上,待乙醇挥发干后,用扫描电镜观察.
1.8抗菌肽Lc-NKlysin-1a的溶血活性取新鲜兔子血液,在3 500 r·min-1下离心10 min,弃上清,以生理盐水洗细胞,直至上清透亮,然后用生理盐水稀释细胞至2×107CFU·mL-1,并以二倍稀释法制备质量浓度分别为400,200,100,50,25,12.5,6.25 μg·mL-1的Lc-NKlysin-1a溶液,以w=0.1%的SDS溶液和生理盐水分别作为阳性对照和阴性对照,将不同质量浓度的抗菌肽溶液和红细胞溶液按V抗菌肽∶V细红胞=1∶1混合,于37 ℃孵育1 h,再在3 500 r·min-1下离心10 min,取上清,最后于405 nm处测吸光值,计算溶血率.
1.9统计学方法利用SPSS 19对实验数据进行分析,并通过单样品T检验来分析数据差异.
2 结 果
2.1抗菌肽Lc-NKlysin-1a的抗菌活性抗菌肽Lc-NKlysin-1a对大肠杆菌、抗链霉素大肠杆菌、金黄色葡萄球菌、副溶血弧菌、铜绿假单胞菌和枯草芽孢杆菌均具有抑菌活性(表1),其中,抗菌肽Lc-NKlysin-1a对金黄色葡萄球菌的抑菌圈直径最大,对枯草芽孢杆菌的抑菌圈直径最小(图1),这说明抗菌肽对金黄色葡萄球菌的抑菌活性较好,但对枯草芽孢杆菌的抑菌活性则相对较弱.

表1 抗菌肽Lc-NKlysin-1a对不同细菌的抑菌圈直径
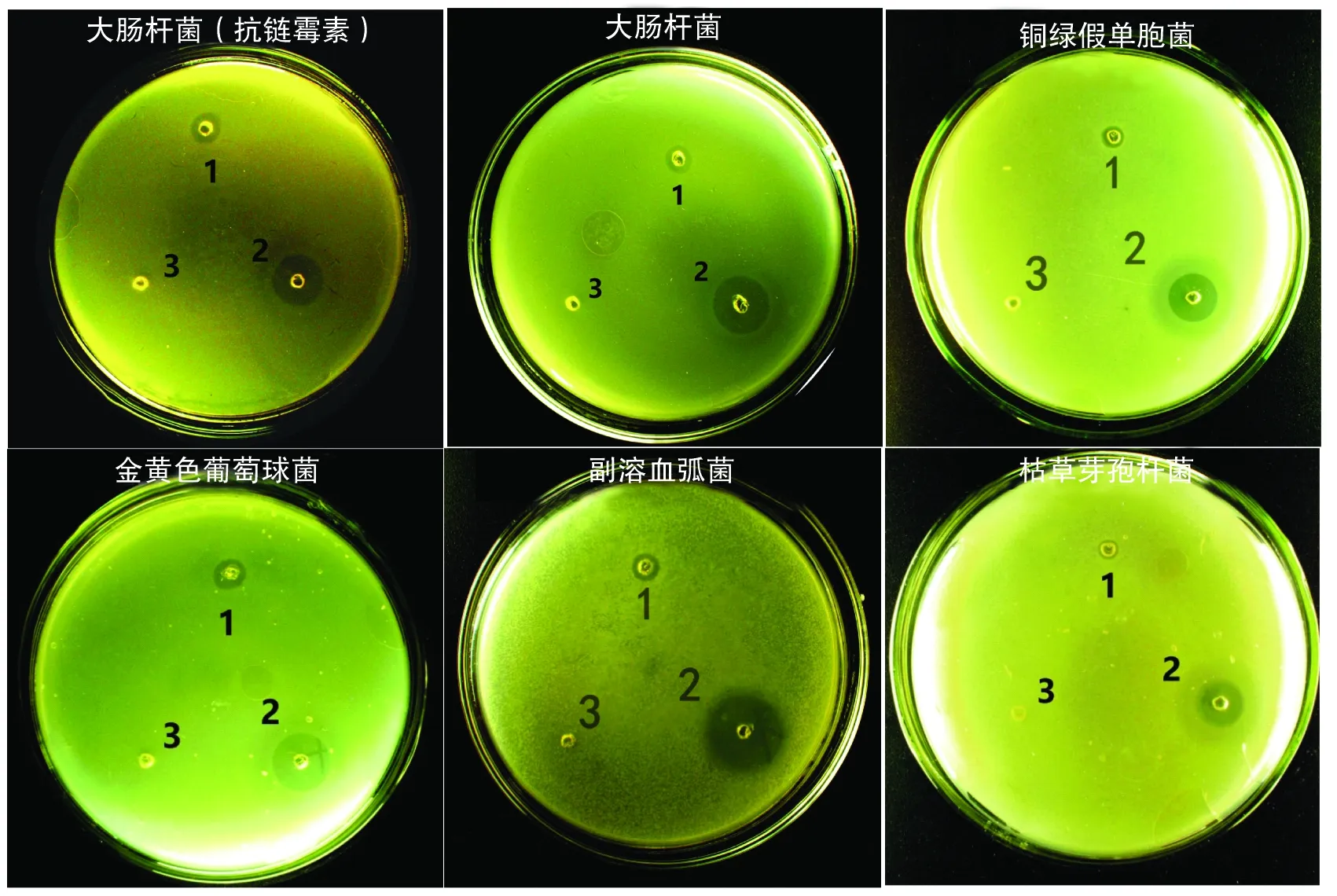
1: 2 g·L-1 的Lc-NKlysin-1a ; 2: 2 g·L-1的卡那霉素 ; 3: 无菌水
2.2抗菌肽Lc-NKlysin-1a的最低抑菌质量浓度(MIC) 抗菌肽Lc-NKlysin-1a对大肠杆菌、抗链霉素大肠杆菌和金黄色葡萄球菌的抗菌活性较好,MIC值较低(在15.625~31.25 μg·mL-1的范围),其对绿脓杆菌和枯草芽孢杆菌的抗菌活性亦相对较低,MIC在62.5~125 μg·mL-1之间(表2),此结果与抑菌圈直径的测量结果相符.

表2 抗菌肽Lc-NKlysin-1a对不同细菌的最低抑菌质量浓度
2.3抗菌肽Lc-NKlysin-1a的稳定性研究
2.3.1 不同温度对抗菌肽抗Lc-NKlysin-1a抗菌活性的影响不同温度处理后,抗菌肽Lc-NKlysin-1a对大肠杆菌、抗链霉素大肠杆菌和金黄色葡萄球菌的抑菌圈直径分别约为4.5 mm,5.5 mm,6.3 mm,与室温检测的抑菌圈直径差别不大,这说明温度对抗菌肽Lc-NKlysin-1a的抗菌活性没有显著影响(p>0.05)(图2).

2.3.2 在100 ℃下不同处理时间对抗菌肽Lc-NKlysin-1a抗菌活性的影响图3显示,在100 ℃处理0,20,40,60,80 min后,抗菌肽Lc-NKlysin-1a对大肠杆菌、抗链霉素大肠杆菌和金黄色葡萄球菌的抑菌圈直径分别约为4.5 mm,6.5 mm,6.5 mm;在100 ℃下处理20,40,60,80 min后,抗菌肽Lc-NKlysin-1a对抗链霉素大肠杆菌的抗菌活性较其在常温条件下的活性有极显著的提高;抗菌肽在100 ℃下处理20,40,60 min后,其对金黄色葡萄球菌的抗菌活性较其在常温条件下的活性没有显著的影响,但在处理80 min后,却具有显著的提高;在100 ℃下处理40,60,80 min后,抗菌肽Lc-NKlysin-1a对大肠杆菌的抗菌活性相较于其在常温条件下的活性具有极显著的提高.实验说明,在100 ℃下处理抗菌肽Lc-NKlysin-1a一定时间后,抗菌肽Lc-NKlysin-1a的抗菌活性具有一定的提高.
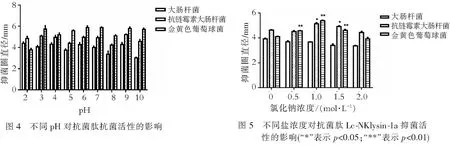
2.3.3 不同pH值对抗菌肽Lc-NKlysin-1a抗菌活性的影响pH在2.0~10.0时,抗菌肽Lc-NKlysin-1a对大肠杆菌、抗链霉素大肠杆菌和金黄色葡萄球菌均具有抗菌活性,它对金黄色葡萄球菌、大肠杆菌和抗链霉素大肠杆菌产生最大抑菌圈的pH值分别为7,2和9.抗菌肽Lc-NKlysin-1a在pH为2.0~10.0的环境下仍能维持较高的抗菌活性(图4),这说明抗菌肽Lc-NKlysin-1a在酸性、碱性和中性条件下都具有抗菌活性.
2.3.4 不同盐浓度对抗菌肽Lc-NKlysin-1a抗菌活性的影响对于大肠杆菌,随着盐浓度的增加,抑菌圈的直径逐渐减小;而对抗链霉素大肠杆菌和金黄色葡萄球菌,随着盐浓度的增加,抑菌圈的直径却先增加后减小,且当盐浓度为1 mol·L-1时,抑菌圈的直径达到最大,此时,抗菌肽Lc-NKlysin-1a的抗菌活性最强(图5).
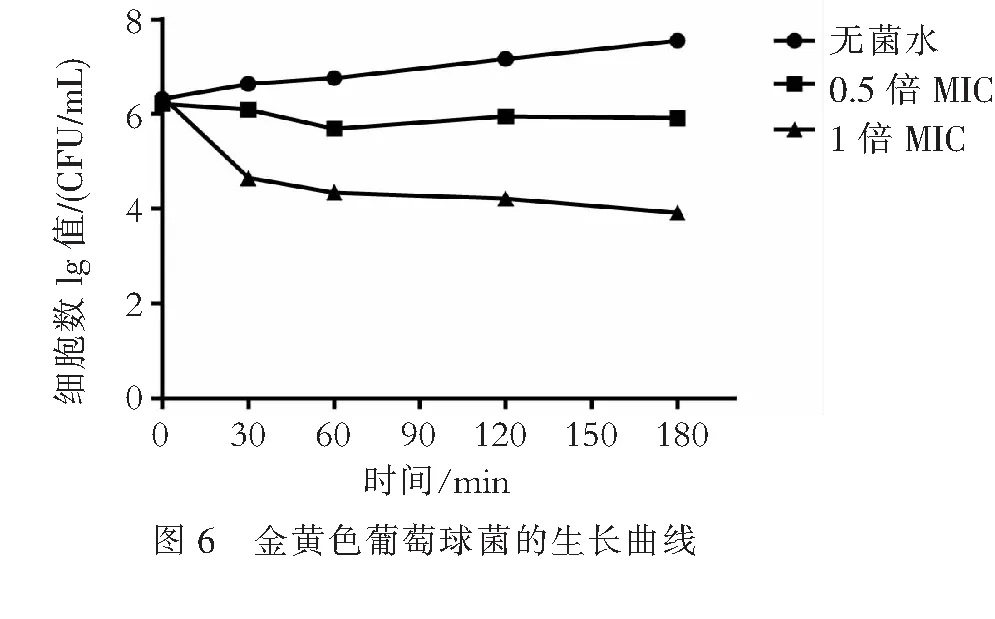
2.4抗菌肽Lc-NKlysin-1a对金黄色葡萄球菌的杀菌曲线抗菌肽Lc-NKlysin-1a的抗菌作用具有浓度依赖特点,随着抗菌肽浓度的增加,其对金黄色葡萄球菌的杀菌程度逐渐增加.用0.5×MIC和1×MIC的抗菌肽Lc-NKlysin-1a处理金黄色葡萄球菌后,在180 min内细菌数量缓慢下降;而用1×MIC的抗菌肽对其进行处理后,在30 min内细菌的数量则迅速减少,至180 min,细菌数量仍持续缓慢地下降(图6).
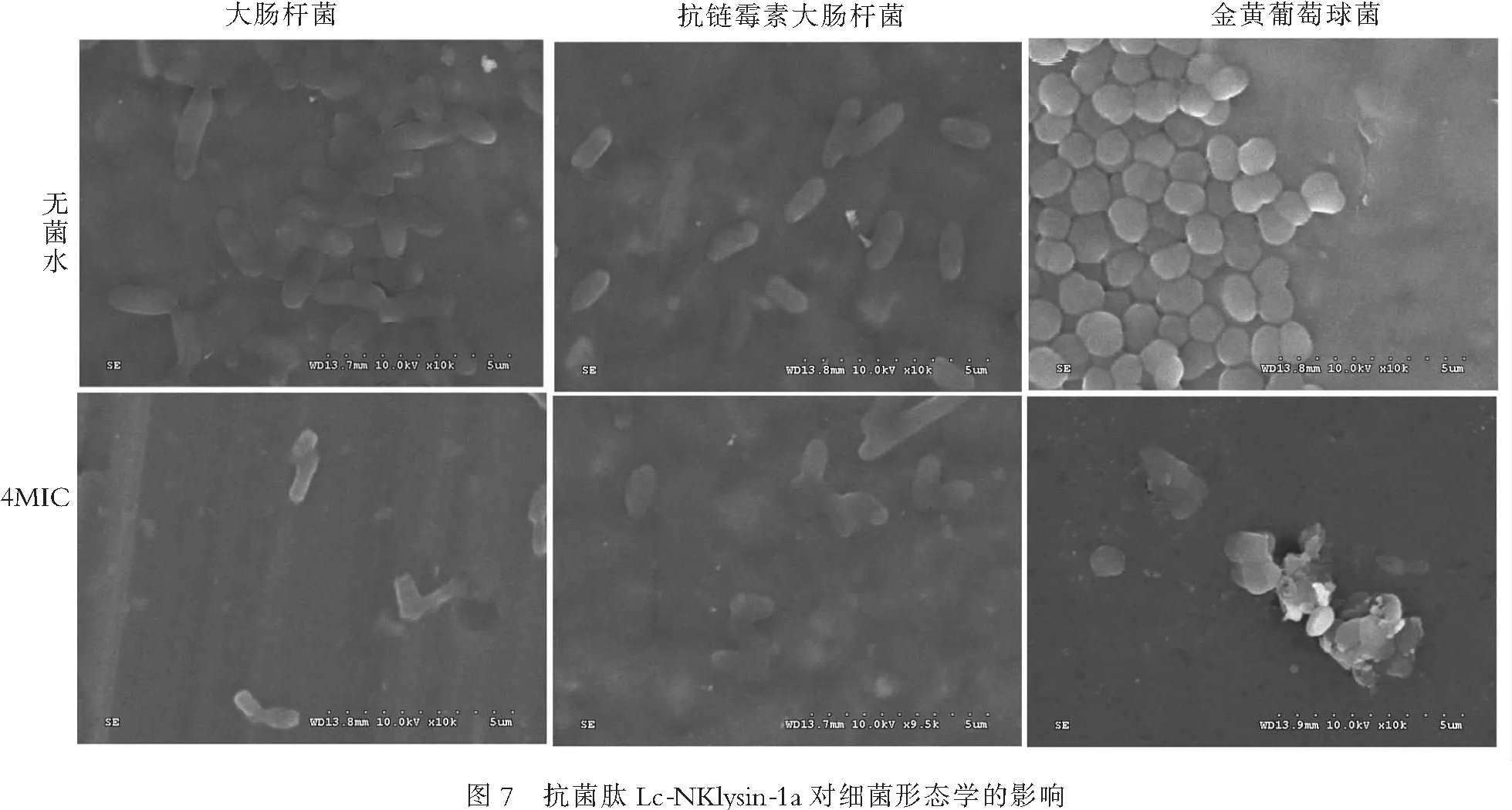
2.5抗菌肽Lc-NKlysin-1a对细菌形态的影响对于用无菌水处理的大肠杆菌、抗链霉素大肠杆菌和金黄色葡萄球菌,其细菌的形态完整,且未见细胞损伤;但用4×MIC的抗菌肽Lc-NKlysin-1a处理1 h后,却发现3种细菌的形态发生了改变(图7).
2.6抗菌肽Lc-NKlysin-1a的溶血活性测定实验结果表明,当抗菌肽Lc-NKlysin-1a的质量浓度达到200 μg·mL-1时,其对兔红细胞的溶血率达到最大,为11.83%,当其质量浓度为最低抑菌质量浓度时,其溶血率在4.09%~7.37%之间,溶血活性较低.
3 讨 论
近年来,对海洋生物的研究虽然取得了长足的进展,但与陆地生物相比,对其的研究仍显落后,尤其是有独特结构和功能的抗菌肽,对其的发掘和研究显得更为滞后.海洋来源的抗菌肽往往具有较强的红细胞溶解活性[12].因此,需重新设计和优化抗菌肽分子,这样就可以降低其细胞毒性,增强其生物活性,降低其生产成本[13].抗菌肽Lc-NKlysin-1a为海洋大黄鱼抗菌肽Lc-NKlysin-1的衍生物,为其N末端12个氨基酸残基序列.Zhou等人的研究显示,抗菌肽Lc-NKlysin-1对金黄色葡萄球菌、枯草芽孢杆菌、大肠杆菌和哈氏弧菌具有抗菌活性;对金黄色葡萄球菌、大肠杆菌和哈氏弧菌的最低抑菌质量浓度范围为35.688~71.376 μg·mL-1;对枯草芽孢杆菌的最低抑菌质量浓度范围为71.376~142.752 μg·mL-1[6].而其衍生物Lc-NKlysin-1a不仅对金黄色葡萄球菌、枯草芽孢杆菌、大肠杆菌和副溶血弧菌具有抗菌活性,而且对铜绿假单胞菌和耐药菌抗链霉素大肠杆菌也具有抗菌活性,这说明该抗菌肽具有更广的抗菌谱.Lc-NKlysin-1a对金黄色葡萄球菌、大肠杆菌和抗链霉素大肠杆菌的最低抑菌质量浓度范围为15.625~31.25 μg·mL-1,对副溶血弧菌的最低抑菌质量浓度范围为31.25~62.5 μg·mL-1,对铜绿假单胞菌和枯草芽孢杆菌的最低抑菌质量浓度范围为62.5~125 μg·mL-1.相对于其模板抗菌肽Lc-NKlysin-1,其衍生物Lc-NKlysin-1a对细菌的最低抑菌质量浓度更小,抗菌活性更好,且随着Lc-NKlysin-1a的相对分子质量降低,其合成成本也相应降低.
传统抗生素是通过作用于细菌的生理代谢过程和破坏细菌的正常代谢而起到抗菌作用的,然而,细菌可以通过改变自身的基因构成和调整药物作用的靶点等方式来避开多种抗生素的作用,从而产生耐药性[14].抗菌肽可以以两种方式作用于细菌,即胞内作用和膜作用[15-16],在通过胞内作用时,抗菌肽可透过细胞膜并进入细胞质,然后作用于细胞内靶标,破坏细胞内的正常代谢,从而使细菌死亡,这与传统抗生素的作用方式相似;在膜作用时,抗菌肽通过所带正电荷与细菌细胞壁结合,其两性结构使其可以结合到细胞膜,进而使细胞膜穿孔,破坏其完整性,最终导致细胞内溶物外溢和使细菌死亡[17].多数抗菌肽以膜作用方式作用于细菌,抗菌肽与细胞壁的这种非特异性结合,使细菌对抗菌肽不易产生耐药性[18].通过扫描电镜的观察可知,抗菌肽Lc-NKlysin-1a是通过作用于细菌细胞膜和破坏其结构来使其发生褶皱、坍塌和形成穿孔并最终使胞内物质外流而致使细菌死亡的,因此,Lc-NKlysin-1a主要是通过膜作用方式来作用于细菌的,至于其是否同时伴有其他的抗菌机制,这还有待于今后更深入的研究.
抗菌肽Lc-NKlysin-1a具有广谱抗菌活性,它对大肠杆菌、抗链霉素大肠杆菌和金黄色葡萄球菌的抗菌活性最好,其最低抑菌质量浓度在15.625~31.25 μg·mL-1的范围内.抗菌肽Lc-NKlysin-1a的抗菌活性在25 ℃~80 ℃的范围内较稳定,但在100 ℃下,不同处理时间对其抗菌活性有一定的促进作用;不同pH值对Lc-NKlysin-1a抗菌活性的影响不大;在不同盐浓度下,Lc-NKlysin-1a对大肠杆菌和金黄色葡萄球菌的抗菌活性较稳定,然而,盐浓度的增加却对抗链霉素大肠杆菌的抗菌活性具有显著的促进作用.抗菌肽Lc-NKlysin-1a的抗菌谱广,其对耐药菌具有抗菌活性,且具有稳定性好,溶血活性低,相对分子质量小等特点,这使其具有能被开发成抗菌肽药物的良好潜力.
[1] 朱永官, 欧阳纬莹, 吴楠,等. 抗生素耐药性的来源与控制对策[J]. 中国科学院院刊, 2015(4):509-516.
[2] 周义文, 尹一兵, 涂植光,等. 家蝇抗菌肽抗菌活性及抗菌机制的初步研究[J]. 中国抗生素杂志, 2004, 29(5):272-274.
[3] Koczulla A R, Bals R. Antimicrobial peptides: current status and therapeutic potential[J]. Drugs, 2003, 63(4):389-406.
[4] Zouhir A, Jridi T, Nefzi A, et al. Inhibition of methicillin-resistant (MRSA) by antimicrobial peptides (AMPs) and plant essential oils[J]. Pharmaceutical Biology, 2016, 54(12):1-15.
[5] 朱振乐. 大黄鱼人工育苗技术[J]. 上海海洋大学学报, 2000, 13(2):3-5.
[6] Zhou Q J, Wang J, Liu M, et al. Identification, expression and antibacterial activities of an antimicrobial peptide NK-lysin from a marine fishLarimichthyscrocea[J]. Fish & Shellfish Immunology, 2016, 55:195-202.
[7] Lee J K, Park S C, Hahm K S, et al. Antimicrobial HPA3NT3 peptide analogs: placement of aromatic rings and positive charges are key determinants for cell selectivity and mechanism of action[J]. BBA-Biomembranes, 2013, 1828(2):443-454.
[8] Nan Y H, Bang J K, Jacob B, et al. Prokaryotic selectivity and LPS-neutralizing activity of short antimicrobial peptides designed from the human antimicrobial peptide LL-37[J]. Peptides, 2012, 35(2):239-247.
[9] 魏照征, 田健, 伍宁丰,等. 抗菌肽构效关系及其表达策略研究进展[J]. 生物技术通报, 2011(2):7-11.
[10] Hultmark D, Steiner H, Rasmuson T, et al. Insect immunity: purification and properties of three inducible bactericidal proteins from hemolymph of immunized pupae ofHyalophoracecropia.[J]. European Journal of Biochemistry, 1980, 106(1):7-16.
[11] 刘晶晶, 王烨, 韩曜平,等. 河蚬抗氧化肽抗氧化稳定性研究[J]. 食品工业科技, 2015, 36(6):86-89.
[12] 丁云超, 张士璀. 海洋动物抗菌肽研究进展[J]. 中国海洋药物, 2013, 32(6):87-96.
[13] Tsao H S, Spinella S A, Lee A T, et al. Design of novel histone-derived antimicrobial peptides[J]. Peptides, 2009, 30(12):2168-2173.
[14] Grove T L, Benner J S, Radle M I, et al. A radically different mechanism for S-adenosylmethionine-dependent methyltransferases[J]. Science, 2011, 332(6029):604-607.
[15] Hancock R E. Cationic peptides: effectors in innate immunity and novel antimicrobials[J]. Lancet Infectious Diseases, 2001, 1(3):156.
[16] 马卫明. 猪小肠抗菌肽分离鉴定及其生物活性研究[D]. 北京:中国农业大学, 2004.
[17] Chan D I, Prenner E J, Vogel H J. Tryptophan-and arginine-rich antimicrobial peptides: structures and mechanisms of action[J]. Biochimica Et Biophysica Acta, 2006, 1758(9):1184-1202.
[18] 朱颐申, 王卫国, 邱芊,等. 抗菌肽的研究进展[J]. 生物加工过程, 2004, 2(3):5-9.
AntimicrobialStabilityandMechanismofAntimicrobialPeptideLc-NKlysin-1a
Luo Wenjie, Zhong Hengren, He Lulu, Shao Jiaqi, Song Yanting, Zhang Yingxia
(Key Laboratory of Tropical Biological Resources of Ministry of Education, College of Marine Science, Hainan University, Haikou 570228, China)
The antimicrobial peptide, Lc-NKlysin-1, was obtained from marine fish, the large yellow croaker (Larimichthys crocea). In the report, in order to study the relationship between structure and function of Lc-NKlysin-1, Lc-NKlysin-1a (12 N-terminal amino acid residues of Lc-NKlysin-1) was designed and synthesized. The effects of temperature, pH and salt concentration on antibacterial activity of Lc-NKlysin-1a were determined by agar plate drilling method. The hemolytic activity of Lc-NKlysin-1a was measured by hemoglobin releasing method. The minimum inhibitory concentration (MIC) of antimicrobial peptide was determined by two fold dilution method. The growth curve was drawn to analyze the antimicrobial characteristics of Lc-NKlysin-1a. Under scanning electron microscope, the effects of Lc-NKlysin-1a on the morphology and structure of bacteria was observed. The results indicated that Lc-NKlysin-1a has the antimicrobial activities against Gram-positive strains,Staphylococcusaureus,Bacillussubtilis, and Gram-negative strains,Escherichiacoli,Pseudomonasaeruginosa,Vibrioand streptomycin-resistentE.coli. And the MIC of Lc-NKlysin-1a againstS.aureus,E.coli, and streptomycin-resistantE.coliwere 15.625-31.25 μg.mL-1. The antimicrobial activities of Lc-NKlysin-1a were stronger than that of Lc-NKlysin-1. Lc-NKlysin-1a had high stability against temperature, pH and salt concentration. After being treated with Lc-NKlysin-1a, the cell membrane was folded and collapsed, and leading to cell death. The higher antimicrobial activity, lower molecular mass and stabilities of Lc-NKlysin-1a make it to be a promising candidate of novel antimicrobial agents or models for the development of novel antimicrobial peptides.
antimicrobial peptide;Larimichthyscrocea; antimicrobial activity; stability; mechanism
2017-07-11
国家自然科学基金(31560593);海南大学省级特色重点学科—药学(海洋药物)研究生创新课题
罗文杰(1992 - ),男,安徽太和人,海南大学海洋学院2015级硕士研究生,E-mail:1806428111@qq.com
张英霞( 1973 - ) ,女,吉林集安人,教授,硕士生导师,研究方向: 动物活性蛋白与多肽,E-mail: yingxiazhang@hotmail.com
1004-1729(2017)04-0345-07
R 931.74
ADOl10.15886/j.cnki.hdxbzkb.2017.0053
