对于αO-芋螺毒素GeXIVA[1,2]安全性的评价
2018-01-11王敏珠李晓丹胡远艳魏小斌符先先罗素兰长孙东亭
王敏珠,李晓丹,胡远艳,魏小斌,符先先,罗素兰,长孙东亭
(1.海南大学 热带生物资源教育部重点实验室,海口市海洋药物重点实验室,海南 海口 570228; 2.海口市人民医院检验科,海南 海口570228)
对于αO-芋螺毒素GeXIVA[1,2]安全性的评价
王敏珠1,李晓丹1,胡远艳1,魏小斌2,符先先2,罗素兰1,长孙东亭1
(1.海南大学 热带生物资源教育部重点实验室,海口市海洋药物重点实验室,海南 海口 570228; 2.海口市人民医院检验科,海南 海口570228)
为了初步评价αO-芋螺毒素GeXIVA[1,2]的安全性,以昆明种( KM )小鼠为受试动物,于给药组连续7天对每只小鼠肌肉注射10 nmol的αO-芋螺毒素GeXIVA[1,2], 对照组则给予等容积的生理盐水.实验期间监测小鼠的体重变化,观察小鼠的毒性反应,给药结束后,即第8天摘除其眼球并采血,检测小鼠的血常规、血液生化等指标,同时剖取其主要脏器,称重后计算脏器系数,并以此来评价GeXIVA[1,2]的毒性作用,然后对该药物剂量的安全性进行初步评价.结果显示:GeXIVA[1,2]组的小鼠与生理盐水组相比较,小鼠活动正常,且未见明显的毒性反应或死亡现象;实验期间给药组小鼠在各个观察时间的体重与对照组比较均未发现显著性差异(P>0.05);给药组与阴性组在血常规检查、血生化检测、脏器系数(%)等方面均无显著性差异(P>0.05).由此认为,在本实验剂量范围内,αO-芋螺毒素GeXIVA[1,2]的安全性好,且无明显的毒副作用.
αO-芋螺毒素GeXIVA[1,2]; 安全性评价; 小鼠
海洋药物是21世纪药学研究的热点[1],它为中国海洋药物研究与开发提供了契机[2].我国海域辽阔,海岸线漫长,具有丰富的海洋生物资源,海洋生物资源中的活性物质又是发展天然药物和治疗常见疾病与疑难杂症的理想药物.从海洋无脊椎动物中所分离的活性物质在天然化合物中占有较大的比例, 并且许多海洋化合物已被用于临床试验[3-5],它们在镇痛、戒烟和戒毒以及治疗帕金森症、精神病等重大疾病方面具有极好的应用前景[6].芋螺毒素 ( Conotoxin,Conopeptide)是由生活在热带海洋中的肉食性软体动物—芋螺(Conus)的毒腺所分泌出来的活性多肽,一般由12~46个氨基酸残基组成,它能特异性地作用于动物体内的各种离子通道和细胞膜上神经递质与激肽的受体,具有种类多、相对分子质量小、结构多样、作用靶点广泛、功能专一、作用快等特性[7-11].在海南,生活于热带海洋中的芋螺是我国宝贵的药用海洋生物资源,它对于海洋创新药物的研究与开发具有非常重要的作用.本实验室所发现的αO-芋螺毒素GeXIVA[12]是来自中国南海食虫芋螺(Conusgeneralis)的新家族—芋螺毒素.αO-芋螺毒素GeXIVA是由28个氨基酸残基组成,它含有4个半胱氨酸残基,分别有两对二硫键,有3种可能的二硫键异构体[12].其中,活性最强的异构体是GeXIVA[1,2],它的二硫键连接方式为Cys2-Cys9, Cys20-Cys27 (bead isomer)(图1),分子质量为3 452 Da.GeXIVA[1,2]是选择性作用于α9α10烟碱型乙酰胆碱受体(nAChRs)的强阻断剂,其半阻断剂量 ( IC50)仅为3.8 nmol[12].α9α10 nAChRs已被认为是治疗慢性痛(神经痛)的药物作用靶点[12-14].GeXIVA[1,2]在坐骨神经慢性挤压性损伤(CCI)神经病理性疼痛模型上的镇痛活性强,且无成瘾性,停药后其镇痛活性依然能维持较长的时间.GeXIVA[1,2]作为新型的镇痛候选新药,具有强效性、无耐受性、对运动功能无影响等优点,有望为广大神经痛患者带来福音[15].鉴此,本研究对小鼠连续7天通过肌肉注射了GeXIVA[1,2],并对其安全性进行了评价,以期为其在临床上的应用提供理论基础和实验依据.
1 材料与方法
1.1实验动物昆明种(KM)小鼠,雌雄各半,体重20~22 g,购于湖南斯莱克景达实验动物有限公司(许可证:SCXK(湘)2013-0004),在适应性饲养1周后用于实验.实验时,随机分组,每笼5只,小鼠常规进食且自由饮水,实验室湿度为40%~60%,温度保持在(23±1)℃,昼夜交替(12 h照明,12 h黑暗),风速为0.1~0.2 m/s,气流≥28 h-1.
1.2GeXIVA[1,2]的化学合成采用Fmoc固相合成法合成αO-芋螺毒素GeXIVA[1,2]线性树脂肽[16].即从固相载体除去线性肽(切割树脂及侧链保护基团,用-20 ℃冰乙醚),然后离心并洗涤3次,在获得线性肽沉淀后,进一步用HPLC纯化,接着对纯化后的线性肽进行两步氧化折叠,如此可获得二硫键定点连接的氧化肽[17].第一步氧化折叠是在0.1 mol·L-1的 NH4HCO3( pH=8.2)缓冲液中进行,线性肽的浓度为0.1 μmol·L-1,氧化折叠后就形成了第一对二硫键,即单环肽.此后,用碘氧化单环肽而形成第二对二硫键, 即双环肽GeXIVA[1,2] (图1),并在通过HPLC分离纯化和质谱鉴定后将其用于后续的动物实验.

图1 αO-芋螺毒素GeXIVA[1,2]的序列及其二硫键的连接方式
1.3连续7天给药的安全性评价受试动物适应性喂养1周后,挑选健康成年小鼠40只(雌雄各半),随机分为生理盐水对照组和GeXIVA[1,2]给药组(雌雄各10只).给药组的每只小鼠连续7天肌肉注射10 nmol的GeXIVA[1,2], 对照组则给予等容积的生理盐水.试验前动物禁食过夜,自由饮水,给药后给予正常饮食.每日观察动物的外观、体征和行为活动、粪便、食量、呼吸、消化、循环及神经系统等的临床症状或体征.分别于第1,3,5,7天称体重1次,观察动物的体重变化.于给药结束后(第8天),摘除其眼球并采血,分别使用含有乙二胺四乙酸二钾(K2EDTA)和肝素锂的真空采血管收集血液,然后进行血液学及血液生化学方面的检测(由海口市人民医院检验科化验),同时剖检和观察主要脏器.
检测指标包括: 白细胞计数(WBC)、红细胞计数(RBC)、血红蛋白含量(HGB)、红细胞压积(HCT)、红细胞平均体积(MCV)、平均血红蛋白量(MCH)、血小板计数(PLT)、淋巴细胞数(LYMPH)、RDW-CV、血小板分布宽度(PDW)、平均血小板体积(MPV)、尿素(Bun)、肌酐(CREA)、总胆固醇(CHOL)、甘油三酯(TG)、谷丙转氨酶(ALT)、谷草转氨酶(AST).
1.4统计学处理实验结果用平均值±标准差(Mean±SEM)表示,同时采用GraphPadPrism5.0软件对数据进行统计分析与作图,分析和比较各组动物的体重、脏器;血常规及血生化的各项指标则采用t检验,以P<0.05为有显著性差异.
2 结果与分析
2.1一般毒性表现雌性、雄性KM小鼠经大腿肌肉注射GeXIVA[1,2]后,实验期间小鼠状况良好,运动及行为正常,无死亡,未观察到明显的中毒症状.
2.2芋螺多肽GeXIVA[1,2]对KM小鼠体重的影响连续7天肌肉注射GeXIVA[1,2]和生理盐水,分别于第1,3,5,7天记录小鼠的体重,结果如图2所示.给药期间,随着时间的增加,给药组小鼠和生理盐水对照组小鼠的体重均逐渐增加.给药组小鼠的平均体重从(26.57±2.07)g增加到(33.10±3.45)g;生理盐水组小鼠的平均体重从(26.10±1.98)g增加到(33.86±3.67)g;虽然生理盐水组小鼠的体重增长速度比药物组的稍快,但它们之间各个观察时间点的体重差异均无显著性差异(P>0.05)(图2),可见,连续7天肌肉注射10 nmol的GeXIVA[1,2]对小鼠的体重增长未见明显的影响.
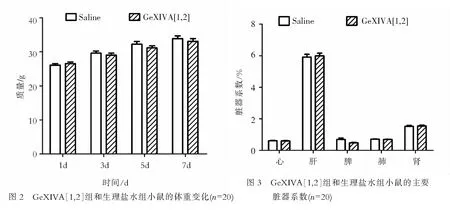
2.3GeXIVA[1,2]对KM小鼠脏器系数(%)的影响连续给药7天后,第8天进行剖检,摘取心、肝、脾、肺、肾等主要脏器,然后进行肉眼观察,接着剔除脂肪和筋膜,用滤纸吸干其表面的液体,称重并计算脏器系数:脏器系数=脏器重量(g)/体重(g)×100%,其结果如图3所示.连续7天肌肉注射10 nmol的GeXIVA[1,2]后,给药组小鼠的主要脏器系数分别为:(0.60±0.11)%(心)、(5.99±0.75)%(肝)、(0.49±0.13)%(脾)、(0.69±0.08%)(肺)、(1.55±0.28)%(肾);对照组小鼠的主要脏器系数分别为:(0.61±0.12)%(心)、(5.91±0.80%)(肝)、(0.69±0.41%)(脾)、(0.71±0.08%)(肺)、(1.53±0.25)%(肾),由上述可见,给药组与对照组小鼠的主要脏器系数相比较,二者均无显著性差异(P>0.05).剖检过程中,经肉眼观察,各脏器没有出现浴血和充血的现象,亦无明显的病变.
2.4GeXIVA[1,2]对KM小鼠血常规的影响使用含有乙二胺四乙酸二钾(K2EDTA)的真空采血管收集血液样品(每只0.5~1.0 mL/管),冰浴保存,并于当天进行血常规检测,检测结果如表1所示.GeXIVA[1,2]给药组的白细胞数[(5.36±0.52)×109·L-1]与对照组的白细胞数[(5.45±0.69)×109·L-1]比较,其间的差异只有0.09×109·L-1,差异不显著;给药组的红细胞数[(8.03±0.95)×1012·L-1]与对照组的红细胞数[(8.02±1.13)×1012·L-1]比较,其间的差异只有0.01×1012·L-1,差异不显著;血红蛋白值相差也只有0.72 g·L-1,差异不显著,其他各项检测项目的差异也比较小,都在误差范围内[18].连续7天肌肉注射10 nmol的芋螺毒素GeXIVA[1,2]组与阴性对照组相比较,血液学各项检测指标均未出现显著性的变化(P>0.05).

表1 GeXIVA[1,2]组和生理盐水组小鼠的血常规检查指标值(Mean±SEM,n=20)
2.5GeXIVA[1,2]对KM小鼠血液生化指标的影响使用含有肝素锂的真空采血管收集血液样品,每只(1.5~2.0) mL/管,冰浴保存,当天进行血液生化检测,检测结果如表2所示.GeXIVA[1,2]给药组尿素的含量为(7.06±1.24)mmol/L,与对照组尿素的含量[(5.39±0.99)mmol/L]进行比较,其间的差异为1.67 mmol/L,二者之间的差异不显著.给药组谷草转氨酶的含量为(109.20±27.45)U/L,与对照组谷草转氨酶的含量[(104.30±18.26)U/L]相比较,其间的差异只有4.90 U/L,二者之间的差异无显著性.其他各项检测项目的指标值均在波动范围内[18],均无显著性差异.芋螺毒素GeXIVA[1,2]组的各项血清生化指标,包括尿素、肌酐、胆固醇、甘油三酯、谷丙转氨酶、谷草转氨酶等,与生理盐水对照组的各项血清生化指标相比较,均无显著性差异(P>0.05).

表2 GeXIVA[1,2]组和生理盐水组小鼠的血生化检查指标值(Mean±SEM,n=20)
3 讨 论
海洋中蕴藏着丰富的天然生物活性物质,从资源研究上看,目前用于研究的海洋生物仅有几千种,这表明海洋生物还具有巨大的研究与开发潜力[5],其中,有些生物活性物质具有重要的药用价值,它们已成为人类治愈疾病的重要药物资源,如多肽海葵毒素,它已被作为自身免疫性疾病和强心药物的重要先导化合物[19-23].目前已经上市的芋螺毒素药物—齐考诺肽(ω-MVIIA),其主要被用于癌症和艾滋病晚期的顽固性疼痛治疗,疗效确切,不成瘾,比成瘾性极强的鸦片类镇痛剂具有明显的优势[10, 24-26],但是,由于齐考诺肽是通过阻断中枢神经系统中的N-型钙离子通道来发挥其镇痛效果的,它要求鞘内中枢给药,给药途径很麻烦,因而开发给药途径更方便(如肌肉注射)的新型无成瘾性镇痛药将具有更加广阔的市场前景.现已证明,α9α10 nAChRs主要分布于外周神经系统中,与痛觉信号的传递有关[27],作用于该受体的α-芋螺毒素Vc1.1、RgIA等在慢性疼痛神经病理性疼痛模型上显示了良好的镇痛效果[7, 28-30].先前研究的结果显示,αO-芋螺毒素GeXIVA[1,2]是选择性地作用于α9α10 nAChRs,它在大鼠慢性压迫性神经损伤模型上呈现出很好的镇痛活性,且不成瘾[12, 15].研究表明,α-芋螺毒素Vc1.1与RgIA对大鼠α9α10 nAChR的阻断活性强,但对人类α9α10 nAChR的阻断活性却很弱[31],这不利于用于人类神经痛的治疗.然而,αO-芋螺毒素GeXIVA[1,2]对大鼠和人类的α9α10 nAChRs的阻断活性都很强[32],因此,αO-芋螺毒素GeXIVA[1,2]可作为一个新型的海洋多肽类药物,它在治疗神经病理性疼痛方面具有广阔的开发前景.
在药物的开发过程中,通过重复给药的动物试验来表征其对受试物的毒性作用,这是药物非临床安全性评价的核心内容,它与急性毒性、生殖毒性以及致癌性等毒理学研究有着密切的联系,是药物从药学研究进入临床试验的重要环节.重复给药毒性试验所获得的信息对长期毒性试验剂量的设计和某些药物Ⅰ期临床试验起始剂量的选择具有重要的参考价值,它对于预测其可能对人体产生的不良反应,降低临床试验受试者和药品上市后使用人群的用药风险具有重要的指导意义.为此,本研究选用昆明种小鼠作为受试对象,连续7天于其体上肌肉注射GeXIVA[1,2],并以生理盐水作为对照,仔细观察了小鼠的毒性反应,然而却未见小鼠有蜷卧、耸毛、耳蜗苍白或充血、呼吸困难、肌肉瘫痪、昏迷等明显的毒性反应或死亡现象.试验期间,给药组小鼠在各个观察时间的体重与对照组比较均未发现显著性差异.给药停止后,于第8天摘除其眼球并采血,然后检测血常规和生化值,剖检和观察其主要脏器,并对脏器称重和计算脏器系数,因脏器重量及脏器系数是衡量动物功能状态的重要指标,同时也是在对药物进行毒性实验时的指定检测项目.尽管小鼠血液学及血生化指标的使用频率没有大鼠的高,但在涉及相关实验时,这些指标同样具有相当大的参考价值[33].血液生理和其生化指标是毒理学实验中经常用于评价药物安全性的测评指标,通过衡量机体血液成分在受试药物作用下有无改变和血液生化指标的变化情况,可推断出受试药物对机体脏器功能有无影响,从而可确定受试药物的毒性大小[33-34].本实验中,GeXIVA[1,2]给药组小鼠与生理盐水对照组的血常规指标均无显著性差异,表明连续7天给药对小鼠血液生理指标无明显影响.同时给药组的肝肾功能测试指标[尿素(Bun)、肌酐(CREA)、总胆固醇(CHOL)、甘油三酯(TG)、谷丙转氨酶(ALT)、谷草转氨酶(AST)]与对照组的相应指标比较,二者差异也不显著,说明连续7天给予的GeXIVA[1,2]对小鼠的肝肾功能无不良影响.
实验动物的临床血液学及生化指标对生物医学、病理学、毒理学的研究具有非常重要的参考价值,它不仅对动物正常生理状态的判定有指导意义,而且也是对食品、药品、化学物质等进行毒理学方面的安全性评价以及在人类疾病研究中探讨发病机理的重要指标和依据.本实验研究的结果显示,连续7天肌肉注射αO-芋螺毒素GeXIVA[1,2]后,未见小鼠有明显的毒性反应,这说明αO-芋螺毒素GeXIVA[1,2]在所测试的剂量范围内,不会在小鼠体内引起明显的毒性反应,因此该给药剂量较为安全.
4 结 论
在本实验剂量范围内,αO-芋螺毒素GeXIVA[1,2]对小鼠的主要脏器及血液指标无明显的毒副作用,因此它可作为后期毒理学研究和进一步的安全性评价的理论基础和实验依据.
[1] 关美君,林文翰,丁源.海洋药物——二十一世纪中国药学研究的新热点[J].中国海洋药物,2001, 20(1):1-5.
[2] 罗素兰,张本,长孙东亭,等.海洋药物研究新进展及其开发战略[J].海南大学学报:自然科学版,2003, 21(4):365-370.
[3] Newman D J, Cragg G M. Marine-sourced anti-cancer and cancer pain control agents in clinical and late preclinical development[J].Marine Drugs,2014, 12(1):255-278.
[4] Petit K, Biard J F. Marine natural products and related compounds as anti-cancer agents: an overview of their clinical status[J].Anti-cancer agents in medicinal chemistry,2013, 13(4):603-631.
[5] 姜山,李化苓,邵磊.近几年海洋药物的临床应用与研究[J].中国海洋药物,2001, 20(1):42-45.
[6] 罗素兰,长孙东亭,吴勇,等.海南产芋螺毒素在疼痛与成瘾治疗中的应用前景[J].中国药理学与毒理学杂志,2012, 26(3):439-440.
[7] Mannelli LDC, Cinci L, Micheli L, et al. α-Conotoxin RgIA protects against the development of nerve injury-induced chronic pain and prevents both neuronal and glial derangement[J].Pain, 2014, 155(10):1986-1995.
[8] Luo Sulan, Zhangsun D T, Wu Yong,et al. Characterization of a novel alpha-conotoxin fromConustextile that selectively targets alpha 6/alpha 3 beta 2 beta 3 nicotinic acetylcholine receptors[J].Journal of Biological Chemistry,2013, 288(2):894-902.
[9] Robinson S D, Norton R S. Conotoxin Gene Superfamilies[J].Marine Drugs,2014,12(12):6058-6101.
[10] Rigo F K, Dalmolin G D, Trevisan G,et al. Effect ofω-conotoxin MVIIA and Phα1βon paclitaxel-induced acute and chronic pain[J].Pharmacology Biochemistry and Behavior,2013, 114(115):16-22.
[11] Luo Sulan, Zhangsun D T, Schroeder C I, et al. A novel α4/7-conotoxin LvIA fromConuslividus that selectively blocksα3β2 vs.α6/α3β2β3 nicotinic acetylcholine receptors[J].Faseb Journal:Official Publication of the Federation of American Societies for Experimental Biology,2014, 28(4):1842-1853.
[12] Luo Sulan, Zhangsun D T, Harvey P J, et al. Cloning, synthesis, and characterization of αO-conotoxin GeXIVA, a potent α9α10 nicotinic acetylcholine receptor antagonist[J].Proceedings of the National Academy of Sciences of the United States of America, 2015,112(30):4026-4035.
[13] Vincler M, Wittenauer S, Parker R, et al. Molecular mechanism for analgesia involving specific antagonism of α9α10 nicotinic acetylcholine receptors[J]. Proceedings of the National Academy of Sciences of the United States of America,2006, 103(47): 17880-17884.
[14] Romero H K, Christensen S B, Mannelli L D C, et al. Inhibition ofα9α10 nicotinic acetylcholine receptors prevents chemotherapy-induced neuropathic pain[J]. Proceedings of the National Academy of Sciences of the United States of America, 2017, 114(10):E1825.
[15] Li X D, Hu Y Y, Wu Y, et al. Anti-hypersensitive effect of intramuscular administration of αO-conotoxin GeXIVA[1,2] and GeXIVA[1,4] in rats of neuropathic pain[J].Progress in Neuro-psychopharmacology and Biological Psychiatry, 2016, 3(66): 112-119.
[16] Luo Sulan, Akondi K B, Zhangsun D T, et al. Atypical alpha-conotoxin LtIA from Conus litteratus targets a novel microsite of the alpha3beta2 nicotinic receptor[J].Journal of Biological Chemistry, 2010, 285(16):12355-12366.
[17] Gyanda R, Banerjee J, Chang Y P, et al. Oxidative folding and preparation ofα-conotoxins for use in high-throughput structure-activity relationship studies[J].Journal of Peptide Science, 2013, 19(1):16-24.
[18] 胡建武,卢胜明,车路平,等.10种常见SPF级实验大、小鼠血液学及生化指标正常参考值的探讨[J].实验动物科学,2007,24(2):5-10.
[19] Blanchard MG, Rash LD, Kellenberger S. Inhibition of voltage-gated Na(+) currents in sensory neurones by the sea anemone toxin APETx2[J].British Journal of Pharmacology,2012, 165(7):2167-2177.
[20] Nesher N, Zlotkin E, Hochner B. The sea anemone toxin AdE-1 modifies both sodium and potassium currents of rat cardiomyocytes[J].Biochemical Journal,2014, 461(1):51-59.
[21] Zhang Y R, Wu Zongze, Luo L W, et al. Advances in researches on the pharmacological activity of sea anemone toxin[J].Journal of Anhui Agricultural Sciences,2015, 43(28): 122-124.
[22] Beeton C, Chandy K G, Iadonato S P,et al. Development of the sea anemone toxin ShK-186 for the treatment of autoimmune diseases: PK and ADME perspectives[J].Toxicon,2012,60(2):114-114.
[23] Fu Liying, Li Yang, Cheng L, et al. Effect of sea anemone toxin anthopleurin-Q on sodium current in guinea pig ventricular myocytes[J].Acta Pharmacologica Sinica,2001,22(12):1107-1112.
[24] Rigo F K, Trevisan G, Rosa F,et al. Spider peptide Al phα1βinduces analgesic effect in a model of cancer pain[J].Cancer Science,2013, 104(9):1226-1230.
[25] Bozorgi H, Jahaniann-ajafabadi A, Rabbani M. The effect of intrathecal administration of the neuronal N-type calcium channels antagonist,ω-conotoxin MVIIA, on attenuating the spontaneous and naloxone-precipitated morphine withdrawal in rats[J].Toxin Reviews,2016(1-2):33-37.
[26] 长孙东亭,朱晓鹏,吴勇,等.ω-芋螺毒素MVIIA和MVIIC对α9α10乙酰胆碱受体的活性研究[J].海南大学学报:自然科学版,2014,32(4):352-358.
[27] Del BA, Cesario A, Salinaro G,et al. Alpha9 alpha10 nicotinic acetylcholine receptors as target for the treatment of chronic pain[J].Current Pharmaceutical Design, 2014,20(38):6042-6047.
[28] Chhabra S, Belgi A, Bartels P,et al. Dicarba analogues ofα-conotoxin RgIA. structure, stability and activity at potential pain targets[J].Journal of Medicinal Chemistry, 2014,57(23):9933-9944.
[29] Pacini A, Micheli L, Maresca M,et al. The α9α10 nicotinic receptor antagonist α-conotoxin RgIA prevents neuropathic pain induced by oxaliplatin treatment[J].Experimental Neurology, 2016, 282:37-48.
[30] Yu R, Kompella S N, Adams D J,et al. Determination of the α-conotoxin Vc1.1 binding site on theα9α10 nicotinic acetylcholine receptor[J].Journal of Medicinal Chemistry, 2013,56(9):3557-3567.
[31] Azam L, Mclntosh J M. Molecular basis for the differential sensitivity of rat and humanα9α10 nAChRs toα-conotoxin RgIA[J]. Journal of Neurochemistry, 2012, 122(6):1137-1144.
[32] Zhangsun D T, Zhu X P, Kaas Q T, et al. αO-conotoxin GeXIVA disulfide bond isomers exhibit differential sensitivity for various nicotinic acetylcholine receptors but retain potency and selectivity for the humanα9α10 subtype[J]. Neuropharmacology,2017.
[33] 夏介英,雷培琪,曾晓兰,等.SPF级KM小鼠主要脏器重量和血液生化值的测定[J].四川生理科学杂志,2009, 31(3): 104-107.
[34] 于业军,仲伟珍,房丽华,等.海洋低温碱性蛋白酶亚慢性毒理学研究[J].渔业科学进展,2000, 21(4):75-86.
SafetyEvaluationofαO-ConotoxinGeXIVA[1,2]
Wang Minzhu1, Li Xiaodan1, Hu Yuanyan1, Wei Xiaobin2, Fu Xianxian2, Luo Sulan1, Zhangsun Dongting1
(1. Key Laboratory of Tropical Biological Resources, Ministry of Education, Key Lab for Marine Drug of Haikou, Hainan University, Haikou 570228, China;2. Haikou People’s Hospital, Haikou 570228, China)
In this report, to evaluate the safety and toxicology effects,αO-conotoxin GeXIVA[1,2] was intramuscular injected into KM mice for 7 days. The single dose was 10 nmol everyday, and equal volume of normal saline was injected as control. The changes of body weight were monitored during the administration, and the toxicity reactions of the mice were observed. After the last injection on the 8th day, the eyeball were removed and blood samples were collected, the effects of GeXIVA[1, 2] on blood routine, blood biochemical index were investigated, and the organs were collected and the coefficients were used to assess the safety. The results indicated that there were no obvious toxicity reactions observed in the GeXIVA[1,2] group; there were no significant differences between the weights of the mice of the GeXIVA[1,2] and that of the control group (P>0.05); as well as differences between the the blood regular parameters, biochemical indexes and organ coefficient (%) of the mice of the GeXIVA[1,2] and that of the control group (P>0.05). The conclusion can be drawn that during the dosage ranges in this work,αO-conotoxin GeXIVA[1,2] was safe.
αO-ConotoxinGeXIVA[1,2]; safety evaluation; mice
2017-06-01
国家自然科学基金(41366002, 81420108028);海南省重大科技计划项目(ZDKJ2016002);长江学者和创新团队发展计划(IRT_15R15)资助.
王敏珠(1989-),男,海南儋州人,海南大学海洋学院2015级硕士研究生,E-mail: 1043782828@qq.com
长孙东亭,男,陕西永寿人,研究员,研究方向:海洋药物与生物技术,E-mail: zhangsundt@163.com
1004-1729(2017)04-0352-07
R 99
ADOl10.15886/j.cnki.hdxbzkb.2017.0054
