氯过氧化物酶催化对氨基苯磺酸降解及其环境适应性研究
2018-01-11蒋育澄
卢 靖, 蒋育澄
(1.陕西师范大学 化学化工学院, 陕西 西安 710119; 2.陕西科技大学 材料科学与工程学院, 陕西 西安 710021)
0 引言
对氨基苯磺酸是一种酰胺类化工原料,在制造染料、农药、食用色素等领域具有重要的应用价值.由于对氨基苯磺酸分子中含有苯环、氨基和磺酸基,其具有良好的水溶性和分子结构稳定性,可在自然环境中长期稳定存在.然而酰胺类化合物是一种危害动植物健康的环境污染源,有研究报道对氨基苯磺酸可通过食物链进入生物体并逐渐累积,以血红蛋白结合态在神经组织和血液中富集,干扰机体正常新陈代谢[1],该类物质目前已被列为可能致癌化合物[2].
酰胺类化合物大部分在水体中很难降解,用一般的絮凝、萃取和吸附等物理法难以彻底从环境中去除,化学氧化法可高效降解这类有机物,但会形成二次污染,而且在工业污水处理中成本较高[3,4].酶催化氧化环境毒物是一种高效、绿色、环境友好的方法.氯过氧化物酶(简称CPO)作为过氧化物酶家族中的一员,可催化降解非甾体抗炎药[5]、蒽醌、三苯甲烷类有机染料[6],噻唑化合物、2-巯基苯并化合物[7]等多种环境污染物,具有用量少、高效、快速等优势[8].然而氯过氧化物酶催化对氨基苯磺酸降解的作用目前仍不明确,本研究考察了酶催化反应体系pH值、H2O2浓度、反应时间和CPO用量对催化降解的影响,在此基础上分析CPO催化对氨基苯磺酸降解历程,并对其环境毒性进行评价,旨在寻求一种高效、经济、绿色的酰胺类污染物处理方法.
1 实验部分
1.1 CPO及底物溶液的准备与配置
(1)CPO的培养和浓度测定:CPO由本实验室根据Hager等人的方法进行培养[9],用丙酮作为酶分离沉淀溶剂进行提纯.酶浓度为91 200 L·mol-1·cm-1.
(2)底物溶液的配置:准确称取0.261 80 g对氨基苯磺酸定容于500 mL的容量瓶中,配置成初始浓度为3 mmol·L-1的溶液,用移液管移取不同体积的储备液于50 mL的容量瓶中定容,配置成不同浓度的底物溶液,置于4 ℃冰箱保存.
1.2 底物标准曲线的绘制
不同浓度的底物标准溶液溶于甲醇中,经过0.22μm 的有机相过滤膜过滤后用高效液相色谱(HPLC)分析浓度.色谱柱为C18反相色谱柱,内径4.6 mm,柱长250 mm.检测条件:对氨基苯磺酸的检测波长λ为249 nm;流动相为甲醇∶水=50∶50(V/V);流速v为0.4 mL·min-1;进样量V为20μL.以吸收峰强度-浓度作图得到底物的标准曲线方程[10].
1.3 CPO催化底物降解
磷酸缓冲液中加入适量底物和0.4μmol·L-1的CPO,加入H2O2开始反应,避光、磁力搅拌下反应一定时间.反应结束后用乙酸乙酯萃取,所得萃取液进行旋转蒸发,随后加入甲醇溶解,经0.22μm的有机相过滤膜过滤后用于高效液相色谱(HPLC)分析测定.降解率用公式(1)计算:

(1)
式(1)中:C0-底物的初始浓度,μmol/L;Ct-底物在t时刻的浓度,μmol/L;η-底物的降解率.
1.4 氯过氧化物酶催化降解方法的安全性评估
CPO催化酰胺类环境污染物的降解方法的安全性评估主要通过降解前后的物质对单细胞绿藻(中国科学院淡水藻种库提供)生长的影响来衡量[11].毒性评估采用绿藻的EC50值为评价指标,EC50是指引起绿藻半数抑制率时的浓度,EC50值越大,则代表毒性越小[12].
绿藻实验室培养过程如下:
将被CPO催化降解后的液体按一定比例与培养基液混合,随后将绿藻种加入,混合溶液放置于锥形瓶中,在2 000 lux光照下,无菌培养72 h.用紫外分光光度计检测绿藻在680 nm下的吸光度,根据公式(2)计算其平均生长率μ,根据公式(3)计算抑制率i:
μ=(lnODt-lnODto)/(t-t0)
(2)
i=(μc-μt)/μc×100%
(3)
式(2)、(3)中:ODto为t0时刻的光吸收;ODt为t时刻的光吸收;μ为绿藻的平均生长率(s-1);μc为空白组的平均生长率(s-1);μt为加入降解前/后反应液的平均生长率(s-1);t-t0为培养时间(s);i为抑制率.
以加入的浓度对抑制率作图,使得各个图的线性相关系数r>0.99,根据得到的线性方程计算抑制率为50%时的浓度,即EC50值.
1.5 氯过氧化物酶促降解在模拟废水中的应用
配置人工模拟废水,组成如下:葡萄糖12 g·L-1,淀粉12 g·L-1、硫酸铵3.42 g·L-1,磷酸二氢钾1.68 g·L-1,硫酸镁0.033 g·L-1、乙酸钠0.015 g·L-1,氯化钙 0.24 g·L-1,硫酸锰0.12 g·L-1,蛋白胨0.07 g·L-1与硫酸亚铁 0.000 16 g·L-1[13-15],pH3.6.
准确称取对氨基苯磺酸0.261 80 g,用人工模拟废水作为溶剂定容于500 ml的容量瓶中,配置成对氨基苯磺酸初始浓度为3 mmol·L-1的溶液,4 ℃保存.催化降解过程及表征与步骤2.3相同.
2 结果与讨论
2.1 底物标准曲线的绘制
对氨基苯磺酸溶液的标准曲线如图1所示.在初始浓度为100~800μmol·L-1范围内,高效液相色谱所检测的吸收峰强度与底物浓度呈现良好的线性关系,标准曲线方程为:y=40 876.621 9x+507 999.142 86,线性相关系数r=0.999;因此,根据底物标准曲线进行CPO催化对氨基苯磺酸降解影响因素的考察.

图1 底物测定的标准曲线
2.2 介质pH值对降解率的影响
CPO对环境的酸碱度较为敏感,当介质pH值超出其耐受范围时,酶的活性降低,当pH>7或<2时甚至会使酶失活.本文讨论介质pH值在2~6范围内CPO催化对氨基苯磺酸降解的趋势.反应体系介质的pH值是指配置溶液所用到缓冲液的pH,即溶液在未加入底物之前的原始pH值.在底物浓度不变、H2O2用量为3 mmol·L-1、CPO浓度是0.4μmol·L-1和反应时间10 min的情况下,对氨基苯磺酸降解率变化如图2所示.

图2 介质pH值对底物降解率的影响
2.3 H2O2浓度对底物降解率的影响
大量研究已证实,H2O2在CPO酶催化反应中起着重要的作用,当反应体系中加入H2O2时,它首先氧化静态的CPO产生compoundⅠ,compoundⅠ具有很高的活性[16],可以氧化底物分子降解.另一方面,CPO具有过氧化氢酶的活性,也会促使H2O2分解.因此,溶液中H2O2浓度存在最佳值,如果浓度过低,反应体系中无法产生足够的compoundⅠ,降解效果欠佳;但当H2O2的浓度过高时,又会对CPO的卟啉环结构造成氧化性破坏[17],导致CPO的活性降低甚至失活,降解率随之下降.
本实验中H2O2浓度范围设定在0~4 mmol·L-1,CPO浓度0.4μmol·L-1,介质pH4.0,反应时间10 min.从图3的结果可以看出:当不加H2O2的时候,对氨基苯磺酸降解率为零.随着H2O2浓度的增大其降解率逐渐增大.H2O2加入量小于2 mmol·L-1时,底物的降解率基本呈线性增长,当H2O2的浓度为3 mmol·L-1时,降解率达到了97.28 %,随后继续增加H2O2浓度到4 mmol·L-1,其降解率不再增加.说明在实验设定的范围内,H2O2最佳用量为3 mmol·L-1.

图3 H2O2的浓度对底物降解率的影响
2.4 CPO浓度对底物降解率的影响
在H2O2浓度3 mmol·L-1,介质pH4.0,反应10 min的条件下,考察CPO用量对底物降解率的影响.从图4可以看出,随着CPO浓度的增大,对氨基苯磺酸的降解率不断增大.CPO浓度在0.05~0.3μmol·L-1范围内,降解率线性增加.CPO浓度为0.4μmol·L-1时,降解率达到96.36 %, 随后降解率值维持基本不变.从数据可以看出,降解率达到90%以上时CPO的浓度仅是底物浓度的万分之一.因此,CPO催化氧化降解酰胺类环境污染物的一大优势是用量极少.
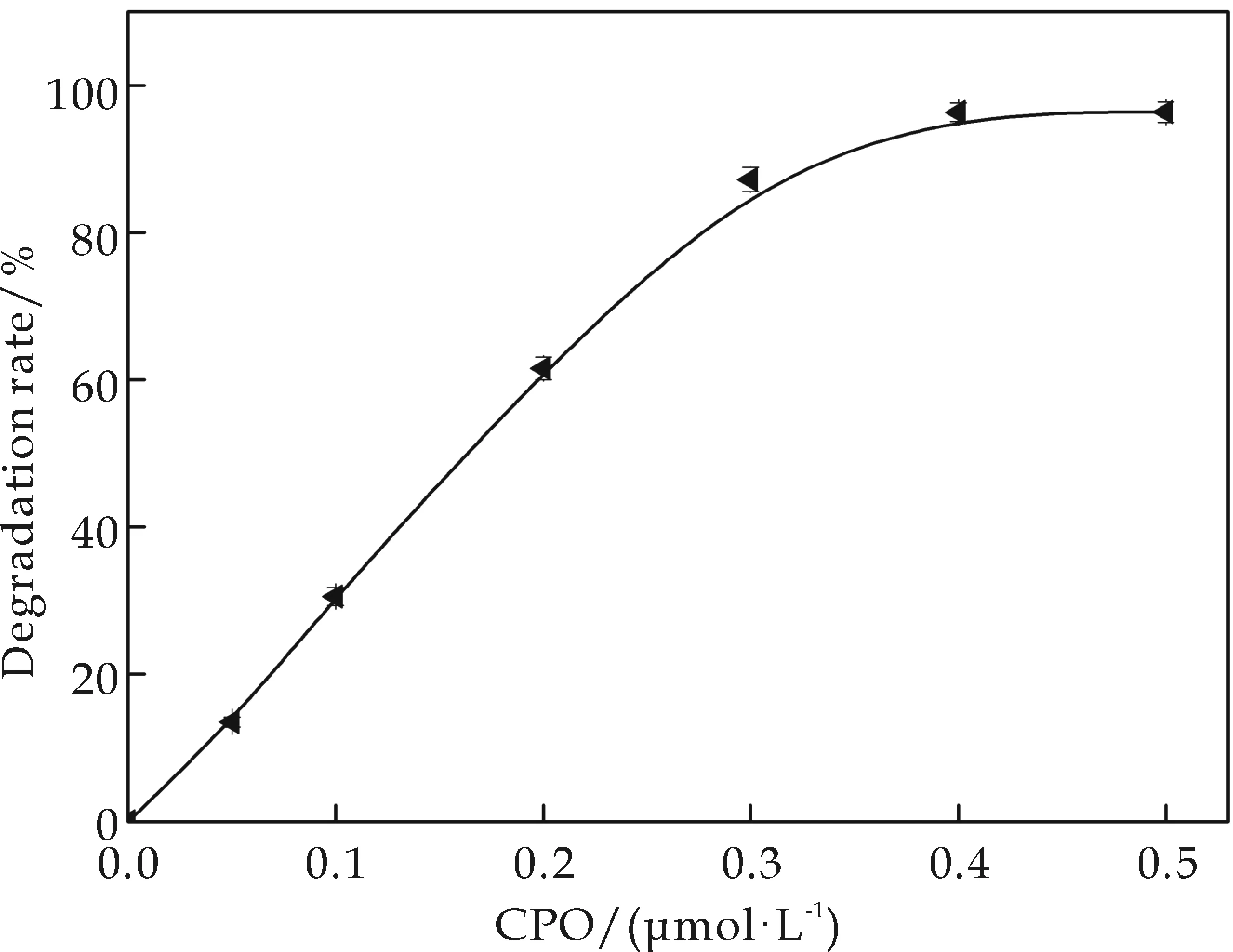
图4 CPO浓度对底物降解率的影响
2.5 反应时间对底物降解率的影响
选取CPO浓度为0.4μmol·L-1,H2O2浓度为3 mmol·L-1,介质pH为4.0的条件,考察反应时间对底物降解率的影响.从图5可以看出,随着反应时间的增大降解率逐渐增大,降解率的变化与时间基本呈线性增长关系.当反应时间达到10 min时降解反应基本达到平衡状态,此时降解率达到了96.21%,继续增加反应时间,降解率变化很小趋于恒定值.说明CPO催化降解环境有机毒物的又一优势即降解所需的时间短.
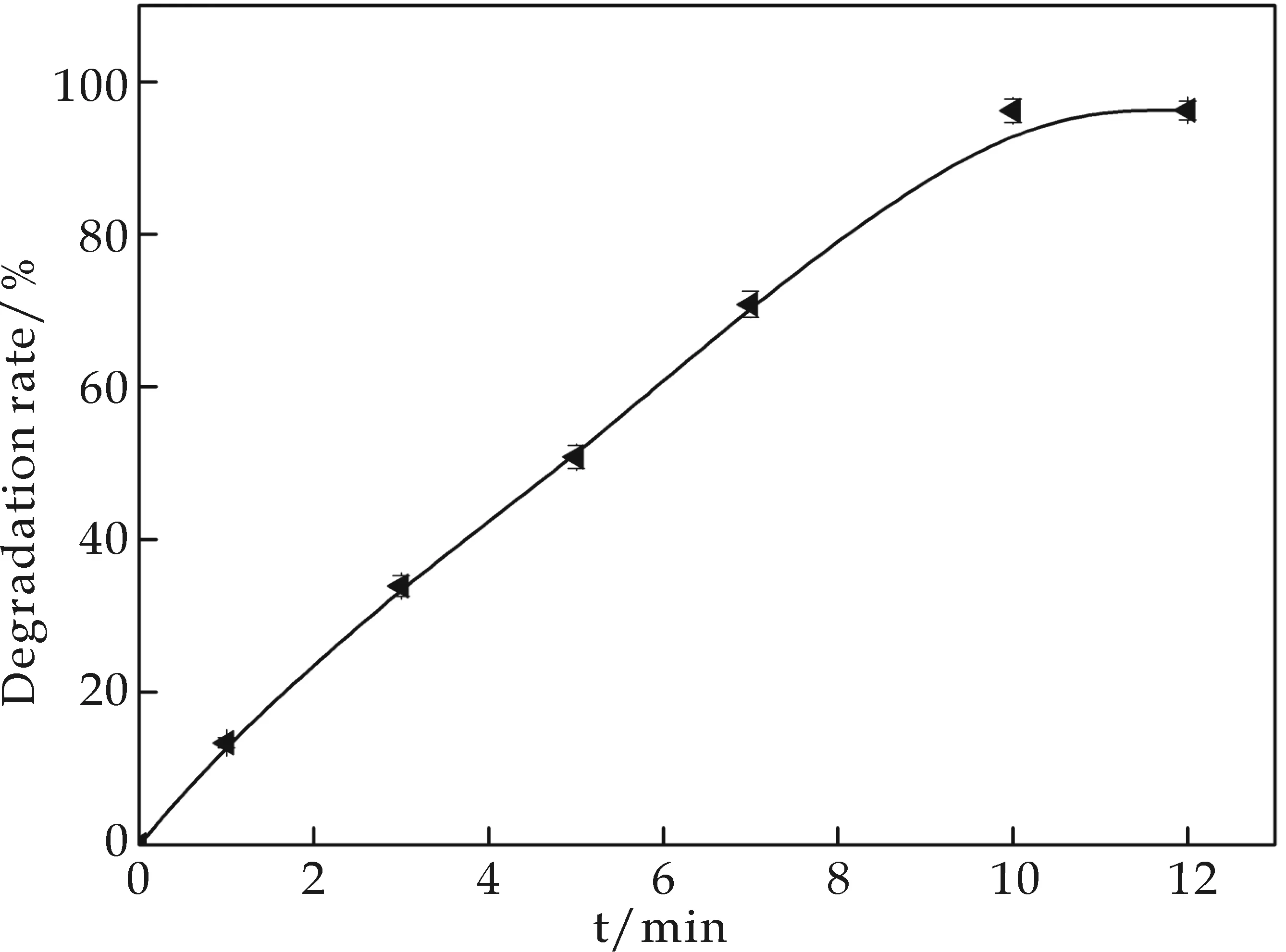
图5 反应时间对底物降解率的影响
2.6 降解产物分析及降解途径推测
在最佳反应条件下,即CPO的浓度为0.4μmol·L-1,H2O2的浓度为3 mmol·L-1,缓冲溶液pH为4,反应时间为10 min,催化对氨基苯磺酸降解.采用质谱分析降解产物组成并推测降解途径.
图6和表1列出了对氨基苯磺酸降解后的中间产物和最终产物的主要分子片段,从中可以看出对氨基苯磺酸可能通过两种方式来降解.一种是:对氨基苯磺酸去除掉硫酸根生成中间产物[a],进一步降解生成产物II(4-nitrosophenol),其分子量为123,[2II+H]+对应的m/z为285.73的峰.另一种是:对氨基苯磺酸脱磺酸基和氨基,生成中间产物[b],进一步羟基氧化生成产物I (benzoquinone),其分子量为108,[2I+H]+对应的m/z为217.82的峰.CPO-H2O2体系催化对氨基苯磺酸降解的产物如表1所示.
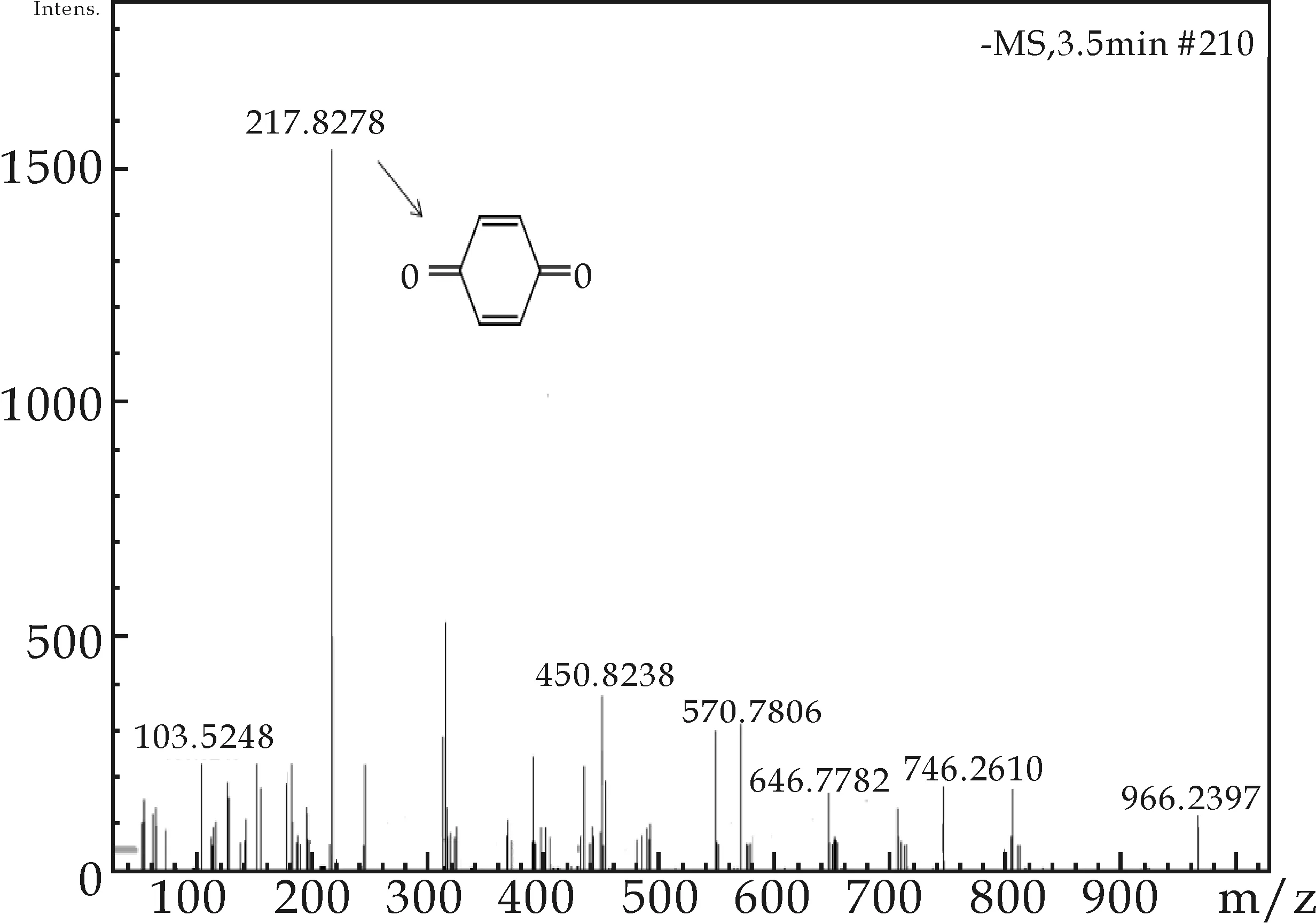


图6 CPO催化氧化降解对氨基苯磺酸的降解产物质谱分析及降解途径推测

产物代码推测方法分子量m/z结构式化学名称Ⅰ[2I+H]+108217OObenzoquinoneⅡ[2II+Na]+123285OHOH4⁃nitrosophenol
2.7 氯过氧化物酶催化降解方法的安全性评估
毒性评估采用绿藻的EC50值为评价指标,EC50是指引起绿藻半数抑制率时的浓度,EC50值越大,则代表毒性越小.图7为对氨基苯磺酸降解前后EC50值随降解率变化的趋势图.从图7可以看出,随着底物降解率的增大EC50值也在增大.由此可以说明对氨基苯磺酸通过酶促降解后的产物比原底物对绿藻的生长的抑制降低,即产物的毒性明显小于降解前.这证明了CPO在催化酰胺类环境污染物方面具有应用前景,这种方法不但能够高效消除酰胺类环境污染物,而且产物安全无毒.

图7 对氨基苯磺酸降解前后EC50值随降解率变化趋势图
2.8 氯过氧化物酶促降解在模拟废水中的应用
为探究CPO酶促降解体系在工业废水中应用的可行性,本文进一步将酶促降解体系应用于实验室配置的人工模拟废水中.在对氨基苯磺酸最佳降解率的条件下(CPO的浓度为0.4μmol·L-1,H2O2的浓度为3 mmol·L-1,反应时间为10 min降解),计算其降解率.
通过三组平行实验,取平均值计算,结果表明:对氨基苯磺酸的降解率是57.23%.分析原因,可能是模拟废水中存在的金属离子抑制CPO的活性.在此基础上提高CPO和H2O2的浓度,延长反应时间,测定其降解率.实验结果为,当CPO的浓度为0.7μmol·L-1,H2O2的浓度为5 mmol·L-1,反应时间为12 min时,模拟废水中对氨基苯磺酸的降解率达到最大为64.23 %.
3 结论
氯过氧化物酶催化对氨基苯磺酸降解,其最佳工作条件是:CPO的浓度为0.4μmol·L-1,H2O2的浓度为3 mmol·L-1,反应时间为10 min.在此条件下,对氨基苯甲酸可按照两种路径降解:一种是去除硫酸根,进一步降解生成产物4-亚硝基苯酚;另一种是脱磺酸基和氨基,进一步羟基氧化生成苯醌.毒性评估实验显示降解后产物对绿藻的生长抑制明显降低,产物安全,毒性很低.
[1] A Besaratinia,G P Pfeifer.Genotoxicity of acrylamide and glycidamide[J].J.Nati.Cancer.Inst.,2004,96(13):1 023-1 029.
[2] J Hopkins.Iarc monographs on the evaluation of carcinogenic risks to humans[M].Lyon:W.H.Organization,1991.
[3] 孙鼎承,李志励.Fenton 法氧化降解油田污水中聚丙烯酰胺的研究[J].化学工程师,2014,28(6):66-69.
[4] A El-Ghenymy,S Garcia Segura,R M Rodríguez,et al.Optimization of the electro-fenton and solar photoelectro-fenton treatments of sulfanilic acid solutions using a pre-pilot flow plant by response surface methodology[J].J.Hazard.Mater.,2012,221:288-297.
[5] X H Li,Q H He,H Y Li,et al.Bioconversion of non-steroidal anti-inflammatory drugs diclofenac and naproxen by chloroperoxidase[J].Biochem.Eng.J.,2017,120:7-16.
[6] L X Liu,J Zhang,Y Tan,et al.Rapid decolorization of anthraquinone and triphenylmethane dye using chloroperoxidase:Catalytic mechanism,analysis of products and degradation route[J].Chem.Eng.J.,2014,244:9-18.
[7] A H Alneyadi,S S Ashraf.Differential enzymatic degradation of thiazole pollutants by two different peroxidases-A comparative study[J].Chem.Eng.J.,2016,303:529-538.
[8] M Ayala,N R Robledo,A Lopez-Munguia,et al.Substrate specificity and ionization potential in chloroperoxidase-catalyzed oxidation of diesel fuel[J].Environ.Sci.Technol.,2000,34(13):2 804-2 809.
[9] L P Hager,D R Morris,F S Brown,et al.Chloroperoxidase Ii.utilization of halogen anions[J].J.Biolog.Chem.,1966,241(8):1 769-1 777.
[10] M Lakshmikandan,K Sivaraman,S E Raja,et al.Biodegradation of acrylamide by acrylamidase from stenotrophomonas acidaminiphila msu12 and analysis of degradation products by maldi-tof and hplc[J].Int.Biodeter.Biodegr.,2014,94:214-221.
[11] J Ma,R Zheng,L Xu,et al.Differential sensitivity of two green algae,scenedesmus obliqnus and chlorella pyrenoidosa to 12 pesticides[J].Ecotox.Environ.Safe.,2002,52(1):57-61.
[12] J Ma,N Lu,W Qin,et al.Differential responses of eight cyanobacterial and green algal species to carbamate insecticides[J].Ecotox.Environ.safe.,2006,63(2):268-274.
[13] E Ferrer Polonio,J Mendoza Roca,A Iborra Clar,et al.Comparison of two strategies for the start-up of a biological reactor for the treatment of hypersaline effluents from a table olive packaging industry[J].Chem.Eng.J.,2015,273:595-602.
[14] J Ma,S Wang,P Wang,et al.Toxicity assessment of 40 herbicides to the green alga raphidocelis subcapitata[J].Ecotox.Environ.Safe.,2006,63(3):456-462.
[15] C Prochaska,A Zouboulis,K Eskridge.Performance of pilot-scale vertical-flow constructed wetlands,as affected by season,substrate,hydraulic load and frequency of application of simulated urban sewage[J].Ecol.Eng.,2007,31(1):57-66.
[16] R D Libby,J Thomas,L Kaiser,et al.Chloroperoxidase halogenation reactions chemical versus enzymic halogenating intermediates[J].J.Biol.Chem.,1982,257(9):5 030-5 037.
[17] J Lu,L Cheng,Y Wang,et al.Enzymatic-photocatalytic synergetic effect on the decolorization of dyes by single chloroperoxidase molecule immobilization on TiO2mesoporous thin film[J].Materials & Design,2017,129(5):219-226.
