光合细菌利用秸秆解聚液制氢的优化研究
2018-01-11张安龙王雪青黄昱杰刘佳伟
张安龙, 王 晔, 王雪青, 黄昱杰, 刘佳伟
(1.陕西科技大学 环境科学与工程学院, 陕西 西安 710021; 2.陕西科技大学 轻工科学与工程学院, 陕西 西安 710021)
0 引言
能源危机和环境污染迫使人们去寻找环保、可再生的替代能源[1].氢能是一种高效、清洁、可持续的“无碳”能源,在地球上有巨大的蕴藏量[2,3].目前,制备氢气的方法主要有化石燃料制氢、电解水制氢、甲醇转化制氢和生物制氢[4],而生物制氢由于其成本低廉、原料丰富、适应性好、底物转化率高以及产物纯度高的特点具有广阔的发展前景[5-7].农业废弃物含有丰富的纤维素类生物质,如秸秆等.我国是农业大国,每年产生的农业废弃物超过10亿吨,其综合利用率不到50%[8],利用农业废弃物发酵生物制氢具有显著的优势,可以在提供清洁能源的同时,帮助满足二氧化碳减排的需要,并实现废物处理的目的[9].此方法操作简便,成本低,实现了农业废弃物的资源化利用,被认为是最有发展前途的制氢方法之一.光合细菌作为光发酵的一种产氢菌种,可以在光照厌氧条件下利用光能进行光合作用,具有较高的产氢得率和产氢速率.目前已知的产氢光合细菌主要有深红红螺菌、荚膜红假单胞菌、沼泽红假单胞菌、类球红细菌和荚膜红细菌.随着对光合细菌产氢机理的深入研究,光合细菌光发酵制氢已逐渐由理论研究转向工程化应用技术研究.同时,利用秸秆类生物质制氢是可再生能源领域中的一个热点研究课题[10,11].传统的光合细菌处理生物质的方法多采用暗发酵-光发酵两步法制氢,其工艺流程复杂,工程化难度大[12].用光发酵一步法代替暗-光两步法耦合制氢,可省去对暗发酵废液的中间处理环节,去除了暗发酵废液对光发酵的铵抑制效应,在降低成本的同时,使工艺流程大大简化.
造纸废水中有大量纤维素和半纤维素等物质的降解产物,所以本文以造纸污泥为研究对象,从中分离筛选高效产氢光合细菌并进行以葡萄糖为底物碳源的产氢优化实验,对比其利用秸秆解聚液的产氢能力,旨在为光合细菌直接利用有机农业废弃物的一步法产氢研究提供菌种来源和科学数据.
1 实验部分
1.1 菌种来源
用于分离筛选产氢光合细菌的活性污泥来自于陕西省某造纸厂的废水处理段,污泥呈絮状、结构比较松散,黑色,有不良气味,并长期受日光照射,是分离光合细菌的良好来源.
1.2 培养基
(1)富集培养液[13]:蛋白胨3 g/L,酵母粉3 g/L,MgCl2·7H2O 0.15 g/L,CaCl20.1 g/ L.
(2)产氢培养液:葡萄糖5 g/L,L-谷氨酸0.88 g/L,10% NaCl 10 mL,营养液(次氮基三乙酸10.0 g,MgSO4·7H2O 29.5 g,CaCl2·2H2O 3.335 g,FeSO4·7H2O 0.099 g,(NH4)6Mo7O24·4H2O 0.009 3 g,微量元素液50 mL,蒸馏水950 mL)20 mL/L,灭菌后加入磷酸盐缓冲溶液(KH2PO468.05 g,K2HPO487.09 g,蒸馏水1 000 mL)20 mL/L,维生素溶液(烟酸0.1 mg/mL,烟酸硫胺0.05 mg/mL,生物素1 ug/mL)10 mL/L.
(3)固体培养基:在液体培养基中加入2%的琼脂粉.
1.3 实验方法
1.3.1 光合细菌的富集分离及筛选
(1)富集:取活性污泥2 g置于无菌注射器中,添加灭菌后的富集培养液20 mL,与泥样震荡混匀,用胶管和止水夹封口以隔绝空气.将注射器置于光照培养箱中,在光照度4 000 lx左右,温度30 ℃条件下进行培养,当培养液变为红色时,从中取出1 mL菌液,转接入20 mL新鲜无菌富集培养液中,在相同培养条件下厌氧培养至培养液变为红色为止,此时得到富集后的菌体培养液.
(2)纯化:取1 mL的菌体培养液用无菌水按10-1~10-10梯度稀释,分别取0.1 mL悬浮液于固体培养基平板进行涂布分离操作,将培养皿倒置于密封培养罐后放入光照培养箱中,在光照度4 000 lx左右,温度30 ℃条件下厌氧培养.当平板上长出单菌落,挑取不同特征的单个红色菌落重复划线分离多次,在光学显微镜下观察细胞形态一致时可认为获得纯菌.
(3)筛选:对分离得到的光合细菌进行产氢实验,分别接种到含有10 mL产氢培养液的注射器中,在光照度4 000 lx左右,温度30 ℃,厌氧条件下进行培养,每隔12 h测定产氢量,选择产氢性能好的菌种作为研究对象并对其进行鉴定.
1.3.2 菌株的产氢性能优化
将分离筛选得到的高效产氢光合细菌菌落接种到培养液中进行扩大培养,当其生长至对数期时,按5%的接种量接种至产氢反应液中.将反应器置于光照培养箱中,在光照度4 000 lx左右,温度30 ℃,厌氧条件下进行培养,定时测定产氢量,每组设置三个平行实验.考察不同浓度碳源、氮源以及磷酸盐缓冲液添加量对细菌产氢性能的影响,得到最佳产氢组合.
1.3.3 光合细菌利用秸秆解聚液制氢
通过酸水解的方法获得秸秆解聚液并测定其还原糖浓度,按照优化后的氮源浓度和磷酸盐缓冲液添加量配制产氢反应液,并加入相应体积的秸秆解聚液作为碳源,比较菌株利用相同浓度的葡萄糖作为碳源时,其产氢性能的差异.
1.4 分析方法
1.4.1 菌液浓度测定
采用比浊法测定菌体浓度,用紫外分光光度计测定菌液在波长为600 nm时的吸光度,记为OD600.
1.4.2 气体成分的测定
利用岛津GC-2014气相色谱仪进行气相成分分析,载气为氮气,流速70 mL/min,柱室温度70 ℃,气化室温度80 ℃,检测器100 ℃,进样量100μL.
1.4.3 还原糖的测定
采用DNS法(即3-5二硝基水杨酸法)测定秸秆解聚液中的总还原糖浓度.
1.4.4 产氢参数拟合
参考Gompertz方程得到修正后的产氢拟合曲线:
(1)
式(1)中:H—细菌发酵所产生的氢气体积(mL/L);Hmax—细菌可能产生的最大氢气体积(mL/L);Rm—细菌的最大产氢速率( L/(L·h) );λ—细菌产氢的延滞时间(h);t—反应时间(h);e—为自然对数,数值为2.718 28.
2 结果与讨论
2.1 高效产氢光合细菌的鉴定
通过分离、纯化和产氢测试,筛选得到一株高效产氢光合细菌,命名为QW02,并对其进行16S rDNA基因序列测定分析[14],将所得序列通过NCBI基因库中的序列进行同源性分析并构建系统发育树,图1为菌株QW02的系统发育树,表明其属于荚膜红细菌属(Rhodobactercapsulatus).
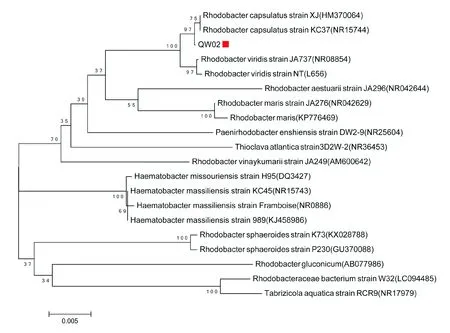
图1 菌株QW02的系统发育树
2.2 碳源浓度对光合细菌产氢的影响
碳源是光合细菌产氢的供氢体,对光合细菌的生长和产氢性能起着至关重要的作用,葡萄糖作为细菌生长的一种理想碳源,可以作为产氢基质被利用,也是秸秆解聚液的一种重要单糖成分.本实验以葡萄糖为唯一碳源,在温度为30 ℃、初始pH为7.1的条件下[15],研究不同葡萄糖浓度对光合细菌产氢的影响.
由图2可以看出,在一定的光照条件下,碳源浓度对菌株产氢性能的影响比较大.表1为光合细菌利用不同浓度葡萄糖的产氢动力学参数,随着葡萄糖浓度的不断增加,最大产氢得率呈现一个先增后减的趋势,当葡萄糖浓度增加到6 g/L时,最大产氢得率为2 273.4 mL/L,最大产氢速率为94.5 mL/(L·h).随后再增加葡萄糖浓度,最大产氢得率与速率均呈现下降的趋势.说明光合细菌产氢时,对碳源的利用能力有限,碳源浓度过低,不能保证细菌的生长和产氢;浓度过高,葡萄糖分解产生的有机酸会对光合细菌内的产氢代谢途径产生抑制[16].所以,需要在适当的范围内选择葡萄糖浓度,提高产氢得率.
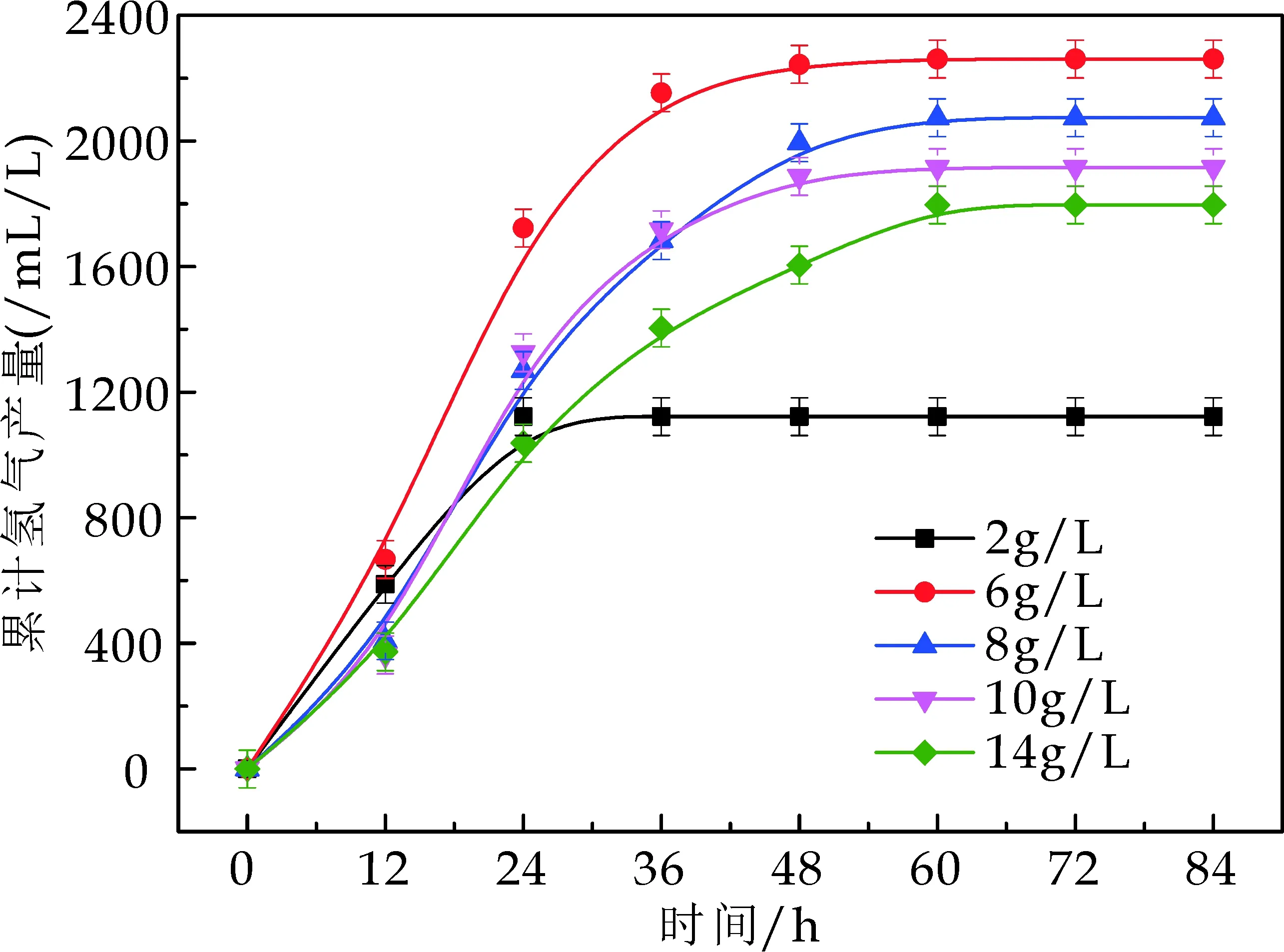
图2 不同葡萄糖浓度下光合细菌累积产氢量随时间的变化
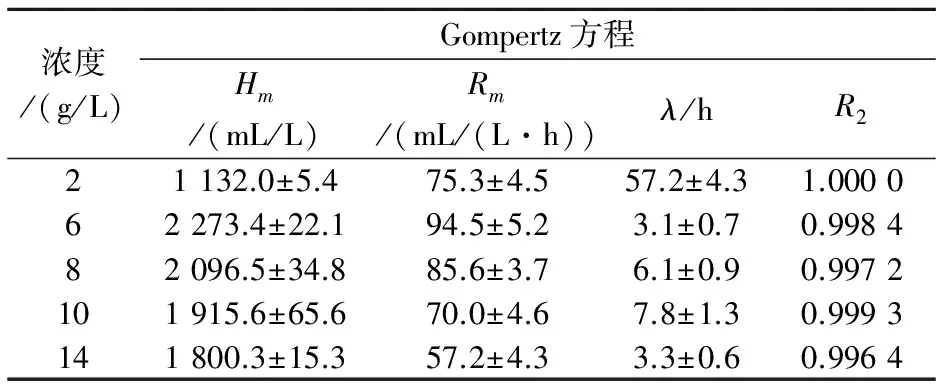
浓度/(g/L)Gompertz方程Hm/(mL/L)Rm/(mL/(L·h))λ/hR221132.0±5.475.3±4.557.2±4.31.000062273.4±22.194.5±5.23.1±0.70.998482096.5±34.885.6±3.76.1±0.90.9972101915.6±65.670.0±4.67.8±1.30.9993141800.3±15.357.2±4.33.3±0.60.9964
2.3 氮源浓度对光合细菌产氢的影响
氮源是微生物生长代谢所必需的物质,氮源的主要作用是合成细胞中的含氮物质,一般不用做能源物质.光合细菌产氢主要是由固氮酶催化,不同的氮源种类及不同的C/N对光合细菌的产氢均有显著影响.氮源对光合细菌产氢活性的影响主要表现为对固氮酶活性的影响,当培养环境中NH4+浓度过高时不仅会抑制固氮酶的产氢活性,使菌体产氢能力下降[17],还会影响光合细菌通过光合磷酸化产生ATP,导致光合细菌细胞内ATP水平偏低,不能为产氢提供足够的能量,造成产氢量的下降.本试验以L-谷氨酸为唯一氮源,在温度为30 ℃、初始pH为7.1、葡萄糖浓度为6 g/L的条件下,研究不同氮源浓度对光合细菌产氢的影响.
结合图3与表2的产氢动力参数可以看出,随着L-谷氨酸浓度在2~18 mmol/L范围内的不断增加,累积产氢量与最大产氢得率与速率也不断增加.在浓度为18 mmol/L时,获得最大产氢得率与速率,分别为2 828.2 mL/L和111.7 mL/(L·h),随着氮源浓度的继续增加,最大产氢得率与速率相继减少.说明18 mmol/L的谷氨酸浓度为产氢适宜浓度,此时,产氢延滞期相对较短,菌体具有较强的产氢活性.虽然在浓度为2 mmol/L时产氢延滞期最短,但是最大产氢得率最低,说明当氮源不足时,细菌没有足够充足的能量合成蛋白质,而导致没有足够的生物量,无法保证产氢代谢进行;而当氮源浓度超过18 mmol/L时,最大产氢得率下降可能是因为谷氨酸浓度过高时游离出NH4+,抑制了固氮酶的活性,从而使细菌的光合产氢作用受到抑制,表现为产氢量和产氢活性的下降.
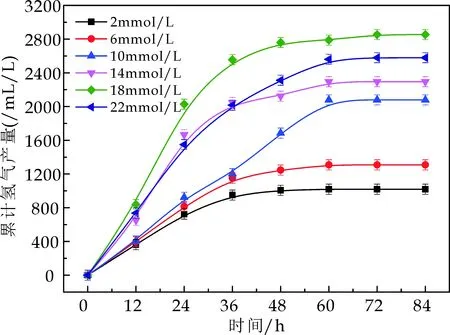
图3 不同氮源浓度下光合细菌累积产氢量随时间的变化
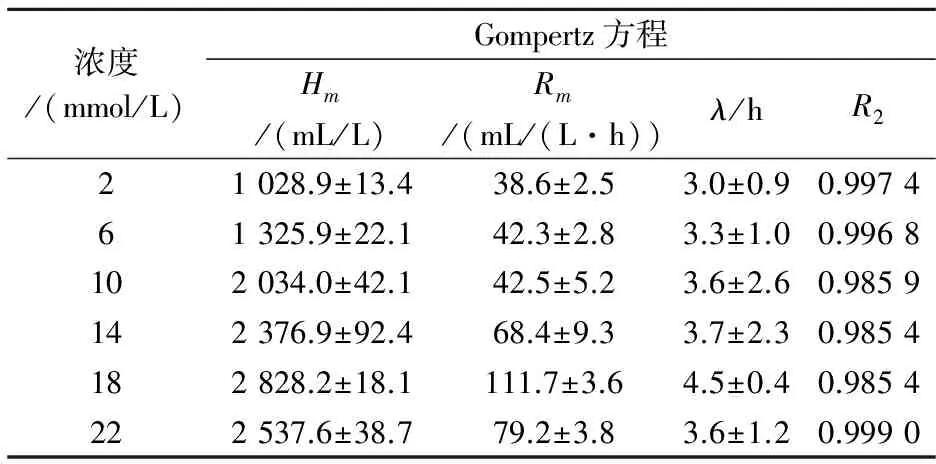
浓度/(mmol/L)Gompertz方程Hm/(mL/L)Rm/(mL/(L·h))λ/hR221028.9±13.438.6±2.53.0±0.90.997461325.9±22.142.3±2.83.3±1.00.9968102034.0±42.142.5±5.23.6±2.60.9859142376.9±92.468.4±9.33.7±2.30.9854182828.2±18.1111.7±3.64.5±0.40.9854222537.6±38.779.2±3.83.6±1.20.9990
2.4 磷酸盐浓度对光合细菌产氢的影响
培养液中的磷酸盐不仅给微生物提供细胞生长所需要的磷源,而且提供了一种缓冲体系,维持培养基中酸碱度的稳定及其它矿质元素的平衡,有利于微生物对营养物质的有效利用.有研究表明,荚膜红细菌中固氮酶和氢酶所需的最适pH范围7.1~7.3,过酸过碱都会影响光合细菌的产氢相关酶活性,从而影响产氢量[18],因此磷酸盐的存在就可以为光合细菌维持一个相对稳定的酸碱环境.本试验在温度为30 ℃、初始pH为7.1、葡萄糖浓度为6 g/L、L-谷氨酸浓度为18 mmol/L的条件下,研究不同磷酸盐缓冲液添加量对光合细菌产氢的影响.
结合图4和表3可以看出,随着磷酸盐缓冲液添加量的增大,其最大产氢速率和得率均呈现先上升后下降的趋势.当磷酸盐缓冲液添加量为20 mL/L时,其最大产氢得率与速率最大,分别为3 397.0 mL/L和125.3 mL/(L·h).而后随着磷酸盐缓冲液浓度的不断增大,其最大产氢速率和得率均所下降.可见,并非磷酸盐缓冲液的浓度越高,缓冲能力越强,过多的磷酸盐缓冲溶液会改变细菌胞内的渗透压,从而改变细菌的生长代谢,因此会对产氢带来抑制作用.
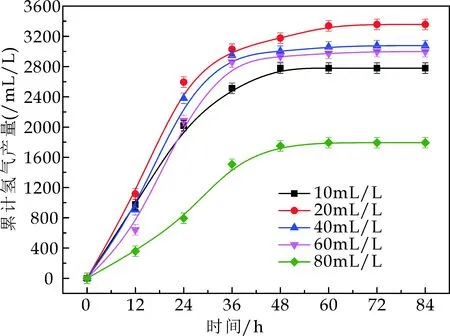
图4 不同磷酸盐缓冲液添加量下光合细菌累积产氢量随时间的变化
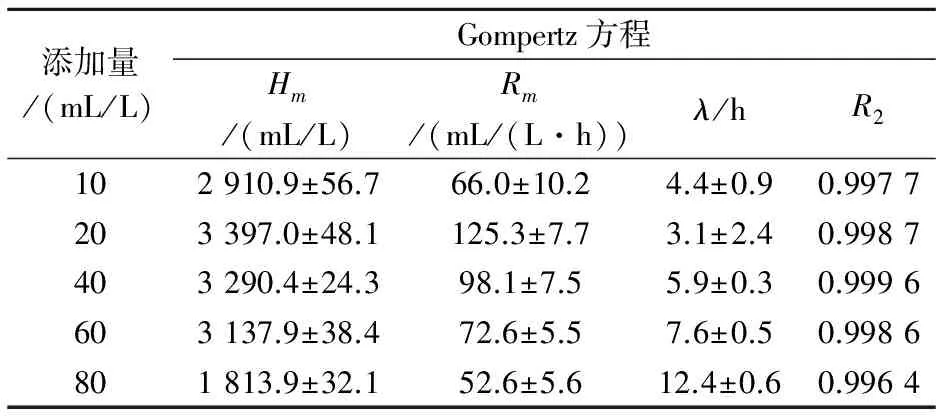
添加量/(mL/L)Gompertz方程Hm/(mL/L)Rm/(mL/(L·h))λ/hR2102910.9±56.766.0±10.24.4±0.90.9977203397.0±48.1125.3±7.73.1±2.40.9987403290.4±24.398.1±7.55.9±0.30.9996603137.9±38.472.6±5.57.6±0.50.9986801813.9±32.152.6±5.612.4±0.60.9964
2.5 光合细菌利用秸秆解聚液的产氢研究
将已知还原糖浓度的秸秆解聚液pH调节至7.1,以作为产氢反应液的底物碳源.按照优化后的氮源浓度和磷酸盐缓冲液添加量配制产氢反应液,并加入相应体积的秸秆解聚液(还原糖浓度6 g/L)作为碳源,研究光合细菌利用秸秆解聚液的产氢能力.以生物质秸秆的解聚液做为底物进行光合细菌的产氢反应时,其中主要是以葡萄糖,木糖等小分子单糖混合物提供碳源[11].所以用相同浓度的葡萄糖作为碳源,比较其与秸秆解聚液作为碳源时,其产氢性能的差异.
如图5和表4所示,光合细菌利用秸秆解聚液的产氢性能优于葡萄糖,最大产氢量为3 944.2 mL/L,最大产氢速率为153.5 mL/(L·h),这两项指标均优于光合细菌利用葡萄糖为底物碳源时的.其次,光合细利用秸秆解聚液的产氢迟滞时间也比较短,可能是因为秸秆解聚液中还有其他小分子酸被作为碳源利用.
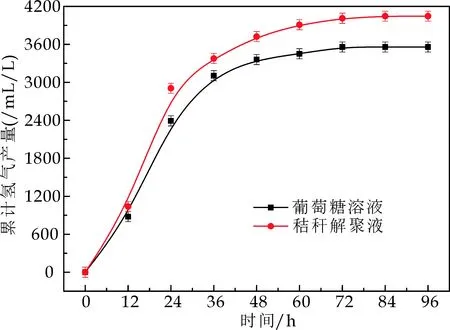
图5 光合细菌在两种碳源条件下的累积产氢曲线

碳源Gompertz方程Hm/(mL/L)Rm/(mL/(L·h))λ/hR2葡萄糖3552.7±26.4131.8±5.25.3±0.50.9988秸秆解聚液3944.2±45.8153.5±16.84.9±1.40.9923
由图6可以看出,在两种碳源条件下,产氢液pH均呈现先上升后下降的趋势.当以葡萄糖作为碳源时,pH在36 h左右上升到最大值为7.31.之后,pH值随着产氢反应的持续进行,一直呈现下降趋势,96 h左右时,pH下降至5.84.依据上述实验结果,说明光合细菌利用葡萄糖产氢的过程存在着代谢产酸的过程,且产酸的速度快于有机酸分解的的过程,菌液的酸化使菌体的生长活性下降,生长受到抑制并发生衰亡自溶,因此菌体的产氢活性也受到一定抑制,产氢稳定性较差.而以秸秆解聚液作为碳源时,pH在36 h上升到最大值7.46.之后,pH值随着产氢反应的持续进行呈现略微下降,72 h后,pH最终稳定在7左右.这说明在秸秆解聚液中,除了糖类占大多数外,还存在一部分小分子挥发性有机酸或有机酸盐[19],这部分小分子酸可以以碳源的形式被光合细菌利用,而光合细菌利用小分子酸产氢的过程是一个pH升高的过程,因此在整个产氢过程中,pH都呈现出较强生物自稳性.
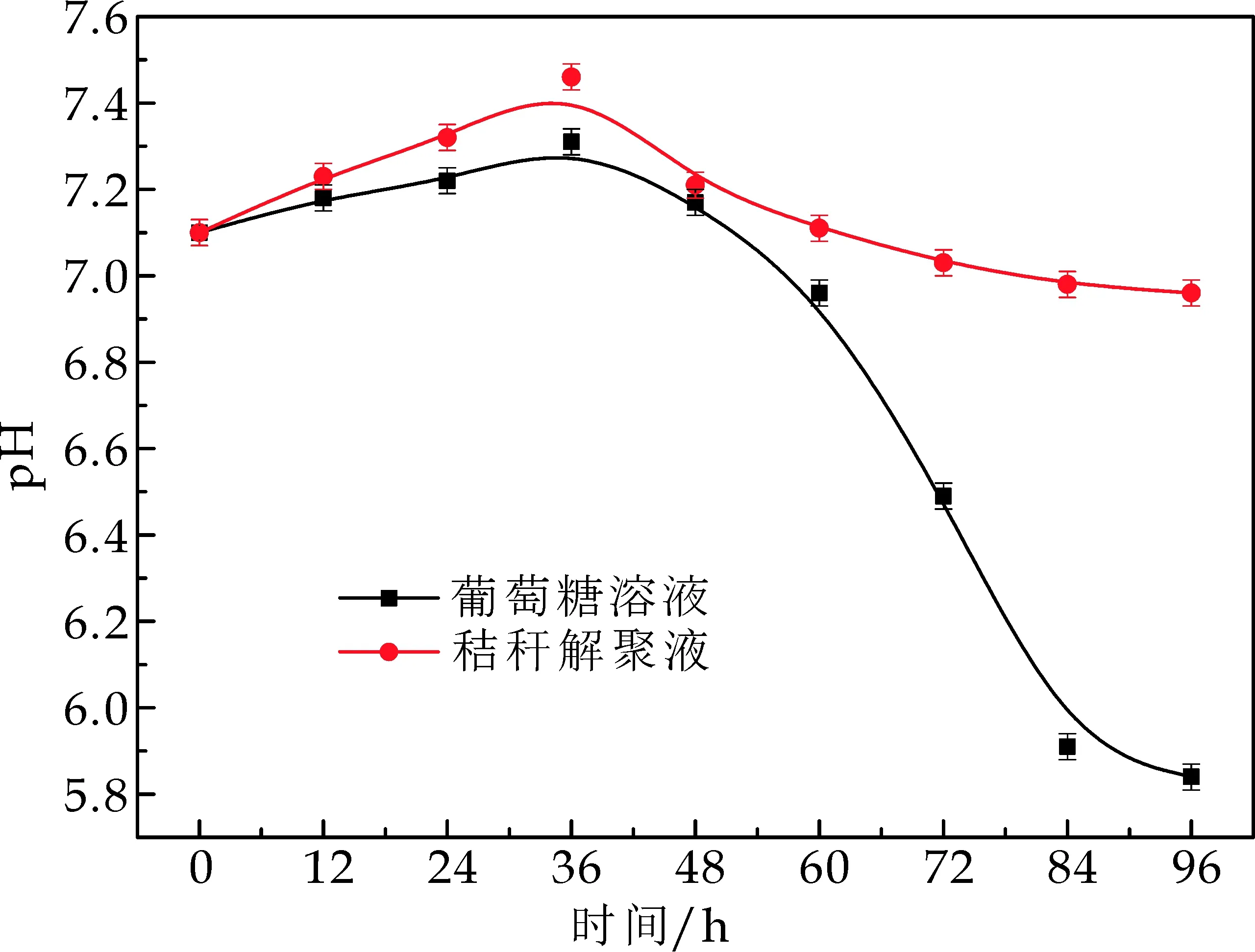
图6 两种碳源条件下光合细菌产氢液pH变化曲线
为了进一步探究光合细菌在以秸秆解聚液和葡萄糖作为底物时,其产氢性能提高的机理,本文测试了以两种不同底物作为碳源时的产氢反应液在产氢过程中的OD600,得出生物量的变化规律.由图7可以看出,两种碳源条件下生物量都呈现持续增加的趋势,而以秸秆解聚液为碳源时,其生物量在整个产氢周期中,要明显高于以葡萄糖作为碳源时的生物量.结合前面的实验,说明秸秆解聚产氢液pH的自稳效应可以使细菌保持较高的生长活性,提供足够的生物量,这是秸秆解聚液作为碳源时高产氢得率与速率的关键.
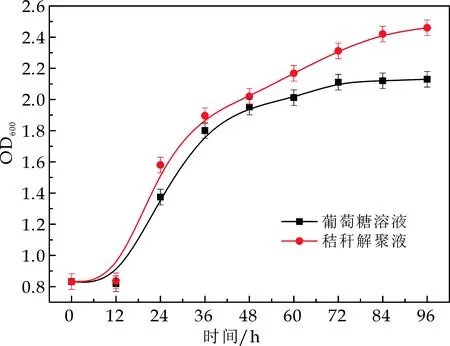
图7 两种碳源条件下光合细菌产氢液生物量变化曲线
3 结论
(1)为筛选出高效产氢光合细菌,对从造纸厂采集的活性污泥进行驯化后分离筛选得到一株高效产氢光合细菌QW02,对其进行16S rDNA序列对比分析并构建系统发育树,表明QW02属于荚膜红细菌.
(2)通过单因素实验确定菌株获得最大产氢量和产氢速率的条件为葡萄糖为6 g/L,谷氨酸为18 mmol/L,磷酸盐缓冲液浓度为20 mL/L.
(3)在单因素优化的条件下分别以葡萄糖和秸秆解聚液为碳源对菌株进行产氢实验.结果表明,菌株利用秸秆解聚液的产氢得率优于以葡萄糖为碳源时的得率,其最大产氢量为3 944.2 mL/L,最大产氢速率高达153.5 mL/(L·h),反应迟滞时间短,pH变化幅度较小,具有一定的自稳效应,因而使其产氢周期较长,并且生物量在整个产氢过程中始终高于以葡萄糖作为碳源时的生物量.证实了利用光合细菌转化秸秆解聚液的一步法光合产氢的可行性.
[1] Luo J,Tian Y S,Song C J,et al.Parameter optimization of hydrogen production by anaerobic fermentation with corn straw[J].Preparative Biochemistry&Biotechnology,2015,31(2):305.
[2] Sandy F,Hubertus B,Christa S K,et al.Temporal and spatial trends of perfluoroalkyl substances in liver of roe deer(Capreolus capreolus)[J].Environmental Pollution,2012,171(171):1-8.
[3] 张 聪.世界氢能技术研究和应用新进展[J].石油石化节能,2014,42(8):56-59.
[4] 张 乐.一株光合细菌的筛选及其产氢试验研究[D].太原:太原理工大学,2015.
[5] Elif Kirtay.Recent advances in production of hydrogen from biomass[J].Energy Conversion and Management,2011,52(4):1 778-1 789.
[6] 孙立红,陶虎春.生物制氢方法综述[J].中国农学通报,2014,30(36):161-167.
[7] Yang H,Wang X,Zhang L,et al.Enhanced hydrogen production performance of Rubrivivax gelatinosus M002 using mixed carbon sources[J].International Journal of Hydrogen Energy,2012,37(18):13 296-13 303.
[8] 陶德刚.生物质颗粒燃料烘烤烟叶的优点[J].云南农业,2017(3):94.
[9] Yue X F,Sun H Y,Zhao X X,et al.Research progress of food waste fermentation for bio-hydrogen production[J].Bulletin of Science & Technology,2009,550-553:569-573.
[10] 李小虎.秸秆类生物质结合暗发酵-MEC两阶段过程高效产氢的研究[D].郑州:郑州大学,2014.
[11] 李燕红,林 钰,杏 艳,等.农作物秸秆废弃物厌氧发酵生物制氢的研究[J].环境科学与技术,2006,29(11):8-9.
[12] Hay J X W,Wu T Y,Juan J C,et al.Biohydrogen production through photo fermentation or dark fermentation using waste as a substrate: Overview,economics,and future prospects of hydrogen usage[J].Bioproducts and Biorefining,2013,7(3):334-352.
[13] Daldal F,Cheng S,Applebaum J,et al.Cytochrome c(2) is not essential for photosynthetic growth of Rhodopseudomonas capsulata[J].Proceedings of the National Academy of Sciences of the United States of America,1986,83(7):2 012-2 016.
[14] 陈 慧,张德民,王龙刚,等.一株反硝化光合细菌的生物学特性及系统发育分析[J].微生物学报,2011,51(2):249-255.
[15] Wang X,Yang H,Zhang Y,et al.Remarkable enhancement on hydrogen production performance of Rhodobacter sphaeroides,by disrupting spbA,and hupSL,genes[J].International Journal of Hydrogen Energy,2014,39(27):14 633-14 641.
[16] 崔宝臣,张国欣,侯 博,等.碳氮源对光合细菌混合菌群产氢性能的影响[J].环境科学与技术,2010,33(12):5-7,13.
[17] 王 毅,周雪花,张志萍,等.光合细菌产氢过程中氮源利用实验[J].农业机械学报,2014,45(10):194-199.
[18] Koku H,Erog L I,Gündüz U,et al.Aspects of the metabolism of hydrogen production by Rhodobacter sphaeroides[J].International Journal of Hydrogen Energy,2002,27(11-12):1 315-1 329.
[19] Pan C M,Ma H C,Fan Y T,et al.Bioaugmented cellulosic hydrogen production from cornstalk by integrating dilute acid-enzyme hydrolysis and dark fermentation[J].International Journal of Hydrogen Energy,2011,36(8):4 852-4 862.
