TLR4在绵羊肺炎支原体介导肺泡上皮细胞凋亡中的作用机理
2018-01-11张俊波印双红
张俊波 , 印双红 , 张 红
(1.铜仁学院农林工程与规划学院 铜仁市文化科技产业创新研究中心 , 贵州 铜仁 554300 ; 2.浙江大学动物科技学院 ,浙江 杭州 310204 ; 3.铜仁学院大健康学院 , 贵州 铜仁 554300)
山羊传染性胸膜肺炎(CCPP) 在我国流行已久,1947年在甘肃即有本病报道,随后,内蒙古、四川、山东、云南、江苏等地都有临床病例报道[1]。在贵州,2001年万一元等[2]于罗甸等地分离到丝状支原体山羊亚种,2011年张双翔等[3]首次分离到绵羊肺炎支原体。铜仁沿河县为贵州白山羊的原产地和主产区,而山羊传染性胸膜肺炎发生频繁,2岁内山羊最易感染,发病率为37.7%,病死率为36.4%[4]。山羊传染性胸膜肺炎已成为严重危害贵州省养羊业健康发展的主要传染病。
TLRs是近年来发现的一类细胞表面的天然免疫受体,是一类高度保守的I型跨膜蛋白,属模式识别受体,是重要的天然免疫分子[5],主要表达于免疫细胞和上皮细胞。它通过识别病原微生物的保守分子发挥着重要的防御作用,激活天然免疫细胞,从而引起一系列的炎症反应,在机体抵抗病原微生物入侵上发挥重要作用。TLR样受体信号通路介导多种生物学效应,如诱导炎症因子释放,诱导杀菌活性,促凋亡与抗凋亡作用等。
目前,由于MO对山羊肺泡上皮细胞的作用机理尚不是很清楚,本实验的目的探讨TLR4在绵羊肺炎支原体感染山羊肺泡上皮细胞中作用机制,本研究发现,TLR4在MO介导山羊肺泡上皮细胞凋亡过程中发挥重要作用,该研究为绵羊支原体肺炎的致病机理研究提供理论基础和参考意见。
1 材料与方法
1.1 菌株与细胞 绵羊肺炎支原体与山羊肺泡上皮细胞为实验室保存。
1.2 仪器 恒温培养箱(北京市光明医疗仪器厂);吸水纸、海尔冰箱、清洁无油脂的一次性实验纸板、记号笔、振动器、自动酶标仪(美国BioTek仪器有限公司);烧杯、电子天平、称量纸、高压灭菌锅、烧杯、单道微量移液枪、8道微量移液枪。
1.3 试剂 胎牛血清和DMEM细胞培养液,购自GIBCO公司;酵母提取物、蛋白胨,购自上海生工生物工程技术服务有限公司;Triton X-100细胞裂解液、MTT试剂盒和DMSO,购自北京索莱宝科技有限公司;Caspase-3/8活性检测试剂盒和TAK-242抑制剂,购自碧云天生物技术有限公司;SYBR染料,购自罗氏公司。
1.4 方法
1.4.1 MTT实验 (1)收集对数期的小鼠脑微血管内皮细胞,用0.25%胰蛋白酶消化细胞,用含10%胎牛血清的DMEM培养液配成单个细胞悬液,以每孔103-104个细胞接种于96孔培养板中,每孔总体积为200 μL,边缘孔用无菌的PBS填充;(2)置37 ℃、5%CO2培养箱培养6~24 h使细胞贴壁;(3)将不同浓度的抑制剂Rapamycin(5 nmol/L、10 nmol/L、20 nmol/L、50 nmol/L)与细胞共同孵育,0.1%DMSO处理的细胞作对照,每组设置5个复孔;(4) 置37 ℃、5%CO2培养箱培养16~48 h,倒置显微镜下观察;(5)小心吸取上清,加入180 μL新鲜培养液,再加入20 μL MTT(5 mg/mL,即0.5% MTT)溶液,继续培养4 h;(6)弃去上清,每孔加入150 μL DMSO溶液,置摇床上低速振荡10 min,使结晶充分溶解,在酶联免疫检测仪490 nm处测量各孔的吸光值;(7)同时设置调零孔(培养基、MTT、DMSO溶解液),对照孔(细胞、相同浓度的药物溶解介质、培养液、MTT、DMSO溶解液),每组设定3复孔,细胞存活率=(实验组OD值-空白组OD值)/(对照组OD值-空白组OD值)× 100%。
1.4.2 实时定量PCR 从NCBI(http://www.ncbi.nlm.nih.gov/)网站GenBank上查找公布相关基因设计引物。引物序列见表1。实时定量PCR采用20 μL体系,实时定量PCR采用20 μL体系,PCR反应条件:95 ℃ 5 min变性,95 ℃ 15 s,59 ℃ 30 s,72 ℃ 30 s 40个循环。每组细胞每个时间点的细胞做3个重复,实验完成后用2-ΔΔCt法对实验数据进行分析。

表1 引物设计
1.4.3 Caspase3/8活性检测 (1) 测定pNA标准曲线: ① 标准品稀释液的配制:按照每0.9 mL检测缓冲液加入0.1 mL裂解液的比例配制适量的标准品稀释液;② 把试剂盒提供的pNA (10 mmol/L)用标准品稀释液稀释为0、10、20、50、100 μm和200 μm,作为标准品;③ 每个浓度的标准品稀释液取100 μL用酶标仪进行检测,或取用容量不超过100 μL的分光光度检测杯进行检测,测定A405;④ 每一个标准品的A405减去空白对照的A405计算出实际的因pNA而导致的吸光度,并制作出A405的标准曲线。
(2) 样品的收集: ① 抑制剂TAK-242与细胞作用1 h,支原体感染细胞,细菌:细胞按10∶1的个数比进行感染细胞,并将感染的细胞继续置于5% CO2、37 ℃的培养箱中培养24 h,PBS洗涤3次。用胰蛋白酶消化贴壁细胞,并收集至细胞培养液以待备用中。600 r/min(4℃)离心5 min收集细胞,小心吸除上清,同时确保尽量没有细胞被吸除,PBS洗涤一次。同前吸尽上清后,按照每200万细胞加入100 μL裂解液的比例加入裂解液,重悬沉淀,冰浴裂解15 min;② 16 000~20 000 r/min (4℃)离心10~15 min;③ 把离心得到的上清移到冰浴预冷的离心管中;④ 立即测定Caspase3/8的酶活性或-70 ℃保存样品。
(3) Caspase3/8酶活性的检测: ①取出pNA和适量的Ac-DEVD-pNA(2 mmol/L),置于冰浴上备用;②如下(表3)设置反应体系;③加入Ac-DEVD-pNA(2 mmol/L)后混匀,但要避免在混匀时气泡的产生。37℃孵育时间不定。若发现颜色变化比较明显时即可测定A405。如果颜色变化不明显,可以适当延长孵育时间,直到颜色变化明显为止;④样品的A405减去空白对照的A405,就是样品中Caspase3/8催化产生的pNA产生的吸光度。通过步骤(1)中获得的标准曲线的对比就可以计算出样品中催化产生了多少量的pNA; ⑤ 参考Chemicon公司的Caspase3/8酶活力单位的定义:一个酶活力单位定义为当底物饱和时,在37 ℃1 h内可以剪切1 nmol/L Ac-DEVD-pNA产1 nmol/L pNA的Caspase3/8的酶量。这样就可以计算出样品中含有多少个酶活力单位的Caspase3/8;⑥ 用Bradford法检测待测样品中的蛋白浓度(由于裂解液中含有较高浓度的DTT,不适合采用BCA法进行蛋白浓度测定)。这样就可以计算出一个样品单位重量蛋白中所含的Caspase3/8的酶活力单位。

表2 反应体系
1.4.4 凋亡率检测 (1) 抑制剂TAK-242与细胞作用1 h。支原体感染细胞,细菌:细胞按10∶1的个数比进行侵染细胞,并将侵染的细胞继续置于5% CO2、37 ℃的CO2培养箱中培养24 h,PBS洗3次;(2) 收集六孔板中的细胞(2 000 r/min离心5 min);(3) 用PBS洗涤细胞两次(2 000 r/min离心5 min)收集1~5×105个细胞;(4) 每个样加入500 μL的Binding Buffer悬浮细胞;(5) 加入5 μL Annexin V-FITC混匀后,加入5 μL Propidium Iodide,混匀;(6) 室温、避光、反应5~15 min;(7) 利用流式细胞仪测定细胞凋亡率。
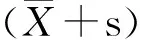
3 结果
3.1 TLR4抑制剂TAK-242对绵羊肺泡巨噬细胞活性的影响 不同浓度抑制剂TAK-242(1 nmol/L、5 nmol/L、10 nmol/L、20 nmol/L和30 nmol/L)与细胞作用24 h后,收集细胞,利用MTT方法检测细胞活性,结果表明,当抑制剂TAK-242浓度为1 nmol/L、5 nmol/L、10 nmol/L不影响细胞活性(图1),而在20 nmol/L和30 nmol/L时细胞活性显著降低(P<0.05)。结果表明,本试验发现TAK-242对细胞活性影响具浓度依赖性。

图1 TAK-242对细胞活性影响
注: 细胞活性在TAK-242组与对照组中的比较; * :P<0.05
3.2 对不同时间下MO感染肺泡上皮细胞的分析
绵羊肺炎支原体感染肺泡上皮细胞后,提取细胞的总RNA或总蛋白,用实时定量PCR检测TLR4的mRNA水平。在支原体MOI为10情况下,感染时间为4 h、8 h、12 h和24 h,结果发现,在12 h和24 h时可以显著提高TLR4 mRNA表达水平(P<0.01)(图2)。

图2 TLR4 mRNA表达水平
3.3 TAK-242对MO介导的Caspase-3和Caspase-8活性的影响 本研究检测了抑制剂TAK-242对16 mol/L介导的Caspase-3和Caspase-8活性的影响,本研究将TAK-242(10 nmol/L)的抑制剂与细胞提前孵育1 h,再用16 mol/L感染细胞24 h,检测Caspase-3和Caspase-8的活性,结果显示,MO可显著提高Caspase-3和Caspase-8的活性,而TAK-242能够显著降低Caspase-3和Caspase-8的活性(P<0.05)(见图3),削弱MO对Caspase-3和Caspas-8活性的促进作用。
3.4 TAK-242对MO介导的TNF-α mRNA表达的影响 在感染时间24 h发现,支原体提高促凋亡基因TNF-α mRNA表达水平,TLR4抑制剂TAK-242在10 nmol/L浓度下可显著降低支原体介导的TNF-α mRNA表达水平(P<0.01)(图4)。
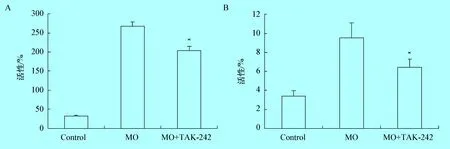
图3Caspase-3和Caspase-8活性变化
注: MO+TAK-242组细胞与MO组细胞的比较;* :P<0.05
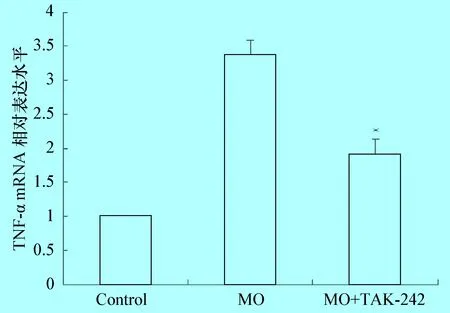
图4 TNF-α mRNA表达水平
注: MO+TAK-242组细胞与MO组细胞的比较;* :P<0.01
3.5 TAK-242对MO介导的细胞凋亡率的影响 通过流式细胞仪检测细胞凋亡率,结果显示,在24 h,支原体引起的细胞凋亡率为16.7%±1.81%,抑制剂TAK-242处理组,支原体引起的细胞凋亡率为11.7%±1.32%,经统计学分析,支原体引起的凋亡水平显著高于正常细胞组(P<0.01),而抑制剂TAK-242处理显著降低支原体引起的细胞凋亡水平(P<0.01)。
4 讨论
TLRs属于一种受体,属于模式识别受体,能够识别病原的相关分子模式,而且识别的范围较广,有脂质类、碳水化合物、脂蛋白和核酸等结构,是连接非特异性免疫和特异性免疫应答的一个桥梁[6]。TLRs是表示一个家族,而TLR4是TLRS其中的成员之一,它是通过活化前炎症事件的级联信号起始对病原生物所进行的应答,而脂多糖是TLR4 配体有效的激动剂[7]。在本试验中,用不同浓度的抑制剂TAK-242与细胞作用24 h后,收集细胞,利用MTT法检测细胞活性,结果发现,当抑制剂TAK-242浓度为1 nmol/L、5 nmol/L、10 nmol/L时并不影响细胞活性,但是在20 nmol/L和30 nmol/L浓度时细胞活性显著降低。这些结果表明,TAK-242对细胞活性影响具有浓度依赖性。


图5 TAK-242对MO介导的细胞凋亡率影响
当被感染绵羊肺炎支原体后,就会激起机体内的免疫应答反应[8],而天然免疫系统又是机体抵御病原微生物入侵体内的第一道防线,其中Toll样受体(TLR)在其中发挥着主要作用。当山羊肺泡上皮细胞感染MO的时候,支原体就会激活宿主细胞Toll样受体(TLR)信号通路,致使细胞释放大量的肿瘤坏死因子(TNF-α)白细胞介素-1(IL-1)等因子的释放[9]。在本实验中,当支原体感染山羊肺泡上皮细胞MOI为10时,在不同时段提取细胞总RNA,实时定量PCR检测TLR4 mRNA水平,结果发现,在感染12 h和24 h后可以提高TLR4 mRNA表达水平。且在抑制剂TAK-242的作用下,可以抑制支原体介导的TNF-α mRNA表达水平。
绝大多数哺乳类动物细胞中都有Caspases家族,在Caspase 级联反应中居于重要位置的主导者是Caspase-3与 Caspase-8,是致使细胞发生凋亡的关键步骤和所有凋亡信号传导的共同通路[10-11]。Caspase-8 是凋亡途径中的起始因子,可以直接激活下游效应Caspase,比如 Caspase-3。而Caspase-3是处于凋亡级联反应的下游,也是细胞程序性死亡的主要效应因子[12]。本试验结果显示,MO可显著提高Caspase-3和Caspase-8的活性,而TAK-242能够显著降低Caspase-3和Caspase-8的活性,削弱MO对Caspase-3和Caspase-8活性的促进作用。
正常的细胞都会死亡,其中,根据细胞死亡过程中的不同表现形式,把细胞死亡分成细胞凋亡和细胞坏死[13]。通过流式细胞仪检测细胞的凋亡率,结果显示,在24 h,支原体引起的细胞凋亡率为16.7%±1.81%,抑制剂TAK-242处理组,支原体引起的细胞凋亡率为11.7%±1.32%,经统计学分析,支原体引起的凋亡水平显著高于正常细胞组,而抑制剂TAK-242处理组显著降低支原体引起的细胞凋亡水平。
[1] 汪代华, 徐刚毅.山羊传染性胸膜肺炎的流行现状和防制技术[J].四川畜牧兽医, 2005,32(10):48-49.
[2] 万一元, 龙鳖, 万晴姣,等. 贵州山羊传染性胸膜肺炎病原的分离鉴定[J].中国草食动物,2001,3(4):44-46.
[3] 张双翔, 周碧君, 姜汉雯,等. 山羊传染性胸膜肺炎继发大肠埃希氏菌感染的诊断[J]. 贵州农业科学,2011,39(6):144-146.
[4] 杨光, 李忠全, 崔玉林,等. 贵州白山羊传染性胸膜肺炎流行病学调查报告[J].中国畜牧兽医文摘,2012(7):46-49.
[5] O'Neill L A, Golenbock D, Bowie A G. The history of Toll-like receptors-redefining innate immunity[J]. Nat Rev Immunol, 2013, 13(6):453-60.
[6] 徐恩君, 刘亚婷, 李涛.Toll样受体信号转导与原发性肝癌发生发展关系的研究进展[J]. 免疫学杂志, 2015,31(8):727-732.
[7] 王振辉, 马科, 朱晓波, 等.TLR4抑制剂TAK-242对高脂饮食诱导的小鼠胰岛素抵抗的干预作用[J].免疫学杂志,2016,32(11):928-934.
[8] Hilliard B,Samoilova E B,Liu T S,etal. Experimental autoimmune encephalomyelitis in NF-kappa B-deficient mice:roles of NF-kappa B in the activation and differentiation of autoreactive T cells[J]. Journal of Immunology,1999, 163(5):2 937-2 943.
[9] 黄亦彤,钟志勇,吕永慧,等.肠炎清对免疫复合溃疡型结肠炎模型大鼠结肠组织NF-κB蛋白表达和TLR4、MyD88基因表达的影响[J].中国中西医结合消化杂志,2016(12):906-910.
[10] Marani M,Tenev T,Hancock D,etal.Identification of novelisoforms of the BH3 domain protein Bim which directly activate Bax to trigger apoptosis [J]. Mol Ceil Biol,2002,22 (11):3 577-3 589.
[11] 毛德文,陈月桥,王丽,等. Caspase-8及Caspase-3于细胞凋亡[J].辽宁中医药大学学报,2008,10(10):148-150.
[12] 曾明,丁媛媛,王金萍,等.可舒胶囊对酒精性肝损伤小鼠肝组织Caspase-3与Caspase-8活性的影响[J].中国医药导报, 2013, 10(27):22-24.
[13] Bin L, Luping D, Bing S,etal.Transcription analysis of the porcine alveolar macrophage response to Mycoplasma hyoneumoniae[J]. Plos one, 2014,9(8):e101968.
