稀释凝血酶时间试验检测血浆达比加群水平的性能评价
2018-01-10吴雪莲屈晨雪戴菊华李丽萍龚岩陆遥袁家颖倪莲芳
吴雪莲,屈晨雪,戴菊华,李丽萍,龚岩,陆遥,袁家颖,倪莲芳
(北京大学第一医院a.检验科,b.老年科,北京 100034)
·临床检验技术研究·
稀释凝血酶时间试验检测血浆达比加群水平的性能评价
吴雪莲a,屈晨雪a,戴菊华a,李丽萍a,龚岩a,陆遥a,袁家颖a,倪莲芳b
(北京大学第一医院a.检验科,b.老年科,北京 100034)
目的评价稀释凝血酶时间(dTT)试验用于检测血浆达比加群水平的性能,观察其是否能满足临床实验室检测需求。方法参考美国临床和实验室标准化协会(CLSI)EP15-A2、EP6-A、EP7-A及C-24文件对dTT试验检测血浆达比加群水平的精密度、正确度、分析测量范围、携带污染率、抗生物干扰进行评价,并观察血浆样品的稳定性。结果dTT试验检测血浆达比加群水平的日内、日间变异系数(CV)均符合厂家声明的CV;3个水平美国病理学家协会(CAP)能力验证计划物质达比加群浓度与靶值的相对偏差均<10%;在30.92~249.13 ng/mL范围内dTT试验检测达比加群水平结果呈线性分布;携带污染率为-0.84%;Hb≤3 g/L、三酰甘油≤873 mg/dL、肝素≤2.2 IU/mL、FDP≤29 mg/L对dTT试验检测达比加群水平无影响;血浆样品在常温保存不宜超过4 h,4 ℃不宜超过4 d,-20 ℃不宜超过1个月,-80 ℃条件下可以存放半年。结论dTT试验检测达比加群浓度的精密度、正确度、分析测量范围、携带污染率、抗生物干扰能力基本符合实验室要求。血浆样品稳定性满足临床要求。
达比加群;抗凝监测;稀释凝血酶时间;性能验证
达比加群是一种直接口服抗凝药(direct oral anticoagulants,DOACs),属于凝血酶抑制剂。服用达比加群的患者无需常规监测凝血功能。近年来的临床实践发现,用药期间出现血栓形成、大出血、急诊手术、肝/肾功能不全等情况时需要监测达比加群抗凝效果。因此,上述患者常规检测血液达比加群浓度尤为重要。稀释凝血酶时间(diluted thrombin time,dTT)是可用常规凝血仪检测达比加群浓度的试验。为保证该项目结果的准确性[1],本研究拟评价dTT试验检测血浆达比加群浓度的精密度、正确度、分析测量范围、携带污染率、抗生物干扰情况等主要性能指标,并观察稳定性,为临床实际应用提供依据。
1 材料与方法
1.1研究对象 收集2016年1至9月北京大学第一医院门诊或住院服用达比加群治疗>4 d、年龄≥18 岁的患者。排除标准:同时应用其他静脉或直接口服抗凝药;影响凝血功能的疾病史;妊娠。本研究经北京大学第一医院医学伦理学委员会审核批准。
1.2标本采集与处理 分别采集患者服药前(谷浓度)和服药后2~4 h(峰浓度)[2]静脉血2.7 mL,用109 mmol/L枸橼酸钠抗凝,2 000×g离心10 min,1 h内分离血浆。
1.3主要仪器与试剂 ACL-TOP 700全自动血凝仪(美国IL公司);XS-800i血液分析仪(日本Sysmex公司); 7600-110 全自动生化分析仪(日本Hitachi公司);B320A离心机(北京白洋医疗器械公司);SSW-420-2S型电热恒温水槽(上海博远实业公司医疗设备厂);Forma905超低温冰箱(美国Thermo Fisher公司)。
dTT试验试剂盒、定标品和质控品(美国IL公司);干扰试剂盒(日本Sysmex公司);力文(无锡华瑞制药公司);肝素钠注射液(常州千红生化制药公司);枸橼酸钠抗凝管(美国BD公司);2015年能力验证计划样品由美国病理学家协会(College of American Pathologists,CAP)提供。
1.4方法
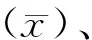
1.4.2正确度 用dTT试验测定2015年3个不同水平的能力验证计划样品的达比加群浓度各1次,与靶值比较并计算相对偏差(%)。相对偏差(%)=[(测定值-靶值)/靶值]×100%,判定标准为相对偏差<10%。
1.4.3分析测量范围 根据CLSI EP6-A文件[4]对线性范围评价的要求,选取高浓度(以H表示)和低浓度(以L表示)达比加群血浆样品各一份,高浓度及低浓度均接近该系统分析测量范围的高限与低限。低浓度样品为1号,高浓度样品为5号,二者3∶1混合为2号,等份混合为3号,1∶3混合为4号,制成5个浓度梯度的样品,每个浓度样品随机排列并重复测定2次,以各浓度实测均值和理论值进行直线回归分析,得出线性方程Y=bX+a,以相关系数(r)≥0.95为判断标准。
1.4.4携带污染率 根据CLSI C-24文件的要求[5],选取高浓度和低浓度达比加群血浆样品各1份,先连续测定高浓度样品3次(H1、H2、H3),后立即检测低浓度样品3次(L1、L2、L3),计算携带污染率(%)。携带污染率(%)=(L1-L3)/(H3-L3)×100%。
1.4.5抗生物干扰 (1)溶血干扰物(Hb=30 g/L):红细胞于-40 ℃冰冻8 h后再复融为血红蛋白液,检测该血红蛋白液浓度(如果血红蛋白液浓度超出检测上限,则稀释后再测)。(2)黄疸干扰物(总胆红素浓度为5 640 μmol/L,即330 mg/dL):取胆红素干扰物,按说明书1/2溶解液的量配制,测定总胆红素浓度为5 640 μmol/L,结果以总胆红素浓度表示。(3)乳糜干扰物(三酰甘油浓度为98 mmol/L,即8 730 mg/dL):因乳糜液干扰物浓度高,超出生化分析仪可报告范围,故将乳糜液干扰物的配制调整为乳糜样品配制,终浓度为9.8 mmol/L。制备方法如下:在494 μL待测血浆中加入力文6 μL,测定三酰甘油浓度为9.8 mmol/L,结果以三酰甘油浓度表示。(4)肝素干扰物(肝素浓度22 IU/mL):用移液器取肝素钠注射液1 μL加入284 μL待测血浆中,结果以肝素浓度表示。(5)FDP干扰物:选取高浓度FDP临床标本,用ACL-TOP 700全自动凝血仪检测FDP浓度。
根据CLSI EP7-A文件对干扰实验的相关要求[6],向血浆中加入干扰物来评价该项目的抗生物干扰能力。干扰物体积与原样品体积比例为1∶9。除乳糜样品外,其他干扰样品(溶血、黄疸、肝素、FDP)加样量均为50 μL干扰物+450 μL待测血浆,形成溶血、黄疸、乳糜、肝素、FDP干扰样品,测定达比加群浓度。根据加入干扰物质前后的测定值计算相对偏差,相对偏差=[(加入干扰物后血浆测定值-未加干扰物血浆测定值)/未加干扰物血浆测定值]×100%,要求相对偏差<10%。
1.4.6样品稳定性 选择6份患者血浆,将每份血浆样品分装成8管,每管100 μL,以即刻检测的血浆达比加群水平作为对照值(0 h)。前3份患者的7管血浆分别室温保存 4、8、24 h,冷藏(2~8 ℃)保存24 h、48 h、4 d、7 d,低温冷冻(-20 ℃)保存7 d、1个月,后3份患者的7管血浆样品分别低温冷冻(-20 ℃) 3、6个月,超低温冷冻(-80 ℃) 3个月、6个月、9个月、1年。测定达比加群浓度,与0 h对照值比较并计算偏差,以相对偏差<10%作为结果判定标准。
2 结果
2.1精密度 用dTT试验检测2个不同浓度达比加群血浆样品日内CV分别为3.59%、2.51%;日间CV分别为2.29%及3.97%,见表1。厂家声明的日内CV为2.8%。水平2日内CV为2.51%,小于厂家声明,验证合格;水平1为3.59%,大于厂家声明,验证值计算结果为3.66%,验证合格。
低、高浓度质控品厂家声明的日间CV分别为3.6%及4.1%,2个水平的日间CV均小于厂家声明,验证合格。
2.2正确度 3个不同水平能力验证计划样品达比加群的实测值与理论值相对偏差均<10%,见表2。
2.3分析测量范围 试剂说明书提供的分析测量范围为20~2 000 ng/mL。高浓度(249.13 ng/mL)及低浓度(30.92 ng/mL)血浆各1份按不同比例混合后,检测达比加群浓度,见表3,最佳拟合方程为二元一次方程式,Y=0.98X+5.15,r=0.98,P<0.05,在30.92~249.13 ng/mL范围内呈线性分布。

表1 dTT试验检测达比加群的日内及日间精密度

表2 dTT试验检测达比加群的正确度
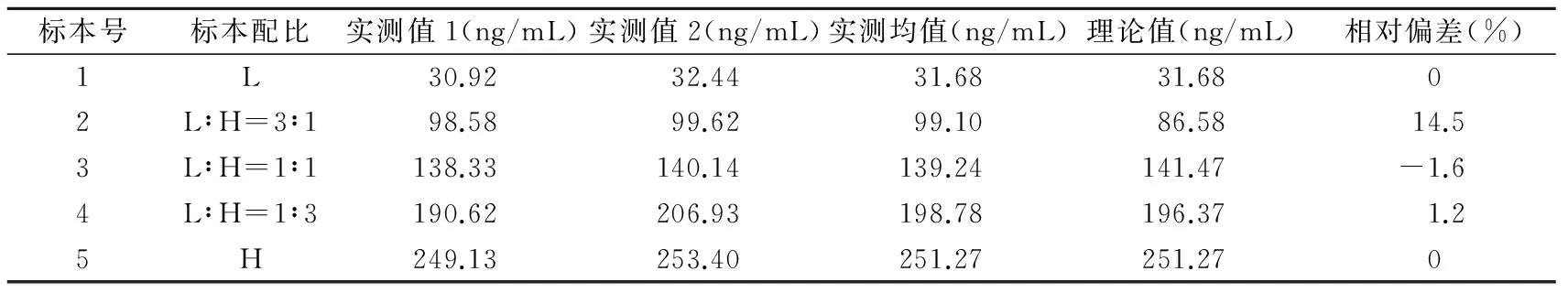
表3 dTT试验检测达比加群的的分析测量范围
2.4携带污染率 高浓度样品H1、H2、H3连续3次检测结果分别为249.13、253.4、277.75 ng/mL,低浓度样品L1、L2、L3连续3次检测结果分别为30.92、32.44、32.97 ng/ mL。携带污染率(%)计算结果为-0.84%,仪器清洁能力较好。
2.5抗生物干扰 当溶血(血红蛋白浓度=3 g/L)干扰存在时,相对偏差均<5%;当黄疸(总胆红素浓度=33 mg/dL)干扰存在时, 样品易受影响,低浓度达比加群样品受影响较小;当乳糜(三酰甘油浓度=873 mg/dL)干扰存在时,偏差均<5%;当肝素(肝素浓度=2.2 IU/L)干扰存在时,偏差均<5%;当FDP(FDP浓度=29 mg/L)干扰存在时,偏差均<10%。dTT试验可抗溶血(3 g/L)、乳糜(三酰甘油690 mg/dL)、肝素(2.2 IU/L)、FDP(29 mg/L)干扰,而对于黄疸(33 mg/dL)干扰,则与样品达比加群浓度高低有关,高浓度达比加群样品易受影响。见表4。
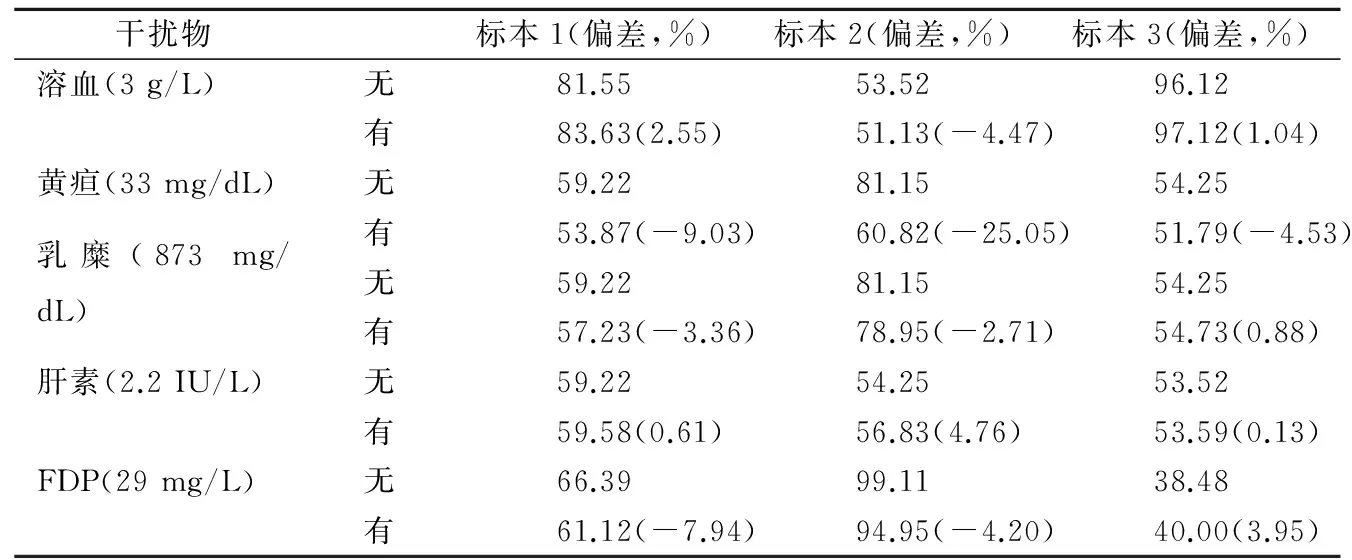
表4 dTT试验检测达比加群(ng/mL)的抗生物干扰试验结果
2.6标本稳定性 见图1。检测达比加群的血浆样品,常温放置不宜超过4 h,4 ℃不宜超过4 d,-20 ℃不宜超过1个月;-80 ℃条件下目前仅有6个月的数据,稳定性良好。
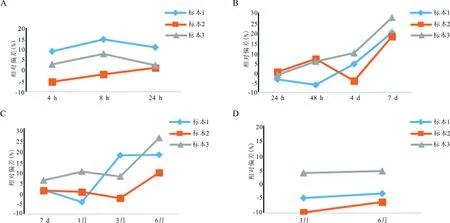
注,A,室温保存; B,-4 ℃保存;C,-20 ℃保存; D,-80 ℃保存。
图1 不同保存条件下达比加群待测血浆样品的稳定性
3 讨论
临床研究证实,达比加群比华法林明显降低心房颤动(房颤)患者脑卒中风险,同时降低患者大出血风险[7],因此其运用越来越广泛。达比加群的抗凝监测包括筛查和定量检测。筛查试验主要有活化部分凝血活酶时间(APTT)和凝血酶时间(TT)试验,定量试验主要有dTT试验、Hemoclot 凝血酶抑制试验(Hemoclot thrombin inhibitor,HTI)、Ecarin凝固时间(Ecarin clot time,ECT)、Ecarin发色试验(Ecarin chromogenic assay,ECA),其中,dTT试验可以在很多实验室用常规血凝仪检测,方便、快捷。故本研究评价dTT试验的性能指标,为其临床应用提供依据。
dTT检测原理为:待测血浆用健康人混合血浆(试剂盒提供)稀释,将固定浓度的牛凝血酶加入已被稀释的患者血浆样品,激活凝血瀑布,血浆凝固,凝血仪测定并记录凝固时间。如血浆样品含有达比加群,因其抑制外源加入的凝血酶活性,会导致凝固时间延长,将测定的凝固时间与事先绘制好的达比加群浓度与凝固时间的标准曲线比较,即得出达比加群浓度(单位为ng/mL)。据文献报道,该方法与达比加群检测的参考方法——高效液相色谱串联质谱法(high performance liquid chromatography tandem mass spectrometry,HPLC-MS/MS)相关性好(r=0.979 9)[8]。本试剂盒中采用的校准品溯源至参考方法HPLC-MS/MS。
本研究结果显示,该方法日内、日间CV均符合厂家声明的CV,表明该项目具有较好的重复性。2015年共有21个实验室参加了CAP达比加群浓度检测能力验证计划,其中,15个实验室采用dTT试验检测达比加群浓度,不同实验室dTT试验的室间CV为7.7%~10.3%,故本研究将相对偏差<10%作为判定标准。本研究检测3个不同浓度水平能力验证计划物质的相对偏差均<10%,表明该方法具有较好的正确度。进一步进行分析测量范围验证即线性范围验证,结果显示实测值与理论值的相关系数为0.98,表明在30.92~249.13 ng/mL范围内存在线性关系。携带污染率为-0.84%,表明该仪器检测此项目时高值标本对低值标本影响小,仪器清洗功能较好。
依据说明书抗生物干扰能力(血红蛋白≤300 mg/dL、三酰甘油≤873 mg/dL、胆红素≤33 mg/dL、肝素≤2.2 IU/mL)配制浓度接近的相应干扰样品,在Hb≤300 mg/dL、三酰甘油≤873 mg/dL时,偏差均<5%,表明一般溶血、乳糜血对达比加群检测干扰较小,可以满足临床需要。对于黄疸干扰,达比加群浓度较低的样品(54.25~59.22 ng/mL)受黄疸影响较小(均<10%),而浓度较高的样品(81.15 ng/mL)受黄疸影响较大(偏差=-25.05%)。但由于样品数量不足,本研究并没有重复检测高浓度样品对抗黄疸干扰的能力。
普通肝素(unfractionated heparin,UFH)主要通过增加抗凝血酶的能力来灭活凝血因子Ⅱa、Ⅹa、Ⅸa、ⅩⅠa、ⅩⅡa[9]。服用达比加群患者血浆中若存在肝素,肝素与血浆样品中的抗凝血酶结合,灭活外源性的凝血酶试剂,使凝固时间延长。延长的凝固时间对应校准曲线上更高的“达比加群浓度”,即肝素会使达比加群检测结果“假性升高”。为此,本研究评价dTT试验的抗UFH干扰能力。低分子肝素(low molecular weight heparin,LMWH)由于分子量较小,灭活Ⅱa因子的能力明显降低,抑制Ⅹa因子和Ⅱa因子的比值约为(2~4)∶1[7],理论上,LMWH对dTT检测的干扰应小于UFH,故本研究没有设计LMWH对dTT的干扰试验。结果表明肝素浓度<2.2 IU/mL对dTT试验无显著影响。此外,本研究还评价了FDP对dTT试验的影响。由于FDP中碎片X(X′)、E(E′)、 D(D′)的结构与纤维蛋白原或纤维蛋白单体的结构相似,故可与纤维蛋白原竞争凝血酶而使血液凝固时间延长,或与纤维蛋白单体形成复合物,阻止纤维蛋白单体的交联,使凝固时间延长[10-11]。当FDP≥50 mg/L时会干扰TT检测[12]。dTT试验的检测原理如上所述是基于TT的检测,故本研究增加了FDP对dTT试验的影响,采用临床高浓度FDP样品(290 mg/L)评价FDP对dTT的影响,结果显示,相对偏差分别为-7.94%、-4.20%、3.95%,FDP<29 mg/L时对dTT试验无显著影响。后续可继续寻找临床高FDP样品,评价dTT抗FDP干扰能力。
稳定性试验结果提示,待测达比加群的血浆样品在常温放置不宜超过4 h,4 ℃不宜超过4 d,-20 ℃不宜超过1个月,-80 ℃可以存放半年。
综上,dTT试验检测达比加群的各项性能指标基本满足实验室要求,血浆样品稳定性结果为临床送检标本要求提供了实验室依据。
[1]康凤凤,王治国. ISO 15189:2012与临床检验定量检测方法确认和性能验证[J]. 临床检验杂志,2013,31(12):881-884.
[2]Stangier J, Rathgen K, Stahle H,etal. The pharmacokinetics, pharmacodynamics and tolerability of dabigatran etexilate, a new oral direct thrombin inhibitor, in healthy male subjects[J]. Br J Clin pharmacol, 2007, 64(3):292-303.
[3]CLSI EP15-A2. User verification of performance for precision and trueness;approved guideline-Second Edition[S]. CLSI, 2005.
[4]CLSI EP6-A. Evaluation of the Linearity of Quantitative Measurement Procedures; A Statistical Approach; Approved Guideline[S]. CLSI, 2003.
[5]NCCLS C24-A. Interference quality control testing principles and definition:approved guideline[S]. NCCLS, 1991.
[6]CLSI EP7-A2. Interference Testing in Clinical Chemistry;approved guideline-Second Edition[S]. CLSI, 2005.
[7]Connolly SJ EM, Yusuf S, Eikelboom J,etal. Dabigatran versus warfarin in patients with atrial fibrillation[J]. N Engl J Med, 2009, 361(12):1139-1151.
[8]Bozic-Mijovski M, Malmstrom RE, Malovrh P,etal. Diluted thrombin time reliably measures low to intermediate plasma dabigatran concentrations[J]. Ann Clin Biochem, 2016, 53:446-451.
[9]史旭波, 胡大一. 肝素的抗凝机制及临床相关问题[J]. 临床荟萃, 2007, 22(18):1293-1295.
[10]Williams JE, Hantgan RR, Hermans J,etal. Characterization of the inhibition of fibrin assembly by fibrinogen fragment D[J]. The Biochem J, 1981, 197(3):661-668.
[11]王鸿利. 血液学和血液学检验[M].第2版. 北京:人民教育出版社, 1997:248.
[12]王建中. 实验诊断学[M].第2版. 北京:北京大学医学出版社, 2010:88-89.
PerformanceverificationofdilutedthrombintimeassayfordetectingDabigatranlevelinplasma
WUXue-liana,QUChen-xuea,DAIJu-huaa,LILi-pinga,GONGYana,LUYaoa,YUANJia-yinga,NILian-fangb
(a.DepartmentofClinicalLaboratory,b.DepartmentofGeriatrics,PekingUniversityFirstHospital,Beijing100034,China)
ObjectiveTo evaluate the performance of diluted thrombin time (dTT) assay for detecting Dabigatran levels and observe whether this assay may meet the requirements of clinical laboratory.MethodsAccording to EP15-A2, EP6-A, EP7-A and C-24 documents of the Clinical and Laboratory Standards Institute (CLSI), the precision, trueness, analytical measurement range, carryover rate and anti-biological interference of dTT assay were evaluated and the stability of specimen for dTT assay was observed.ResultsBoth the within-day and between-day coefficient of variation (CV) of dTT assay for detecting Dabigatran levels were consistent with manufacturer′s statedCV. Compared with target values of Dabigatran, the relative bias of 3 levels of proficiency test materials from College of American Pathologists (CAP) were less than 10%. The results meet linear verification when Dabigatran concentration was between 30.92 and 249.13 ng/mL. The carryover rate was -0.84%. There was no interference for Dabigatran levels by dTT assay for detecting Dabigatran when Hb≤3 g/L, triglyceride≤873 mg/dL, heparin≤2.2 IU/mL and FDP≤29 mg/L. The results of stability showed that plasma specimens for dTT could not be stored at room temperature more than 4 hours, at 4 ℃ more than 4 days, at -20 ℃ exceed 1 month, while at -80℃ the plasma specimens could be stored at least 6 months for dTT assay.ConclusionThe precision, trueness, analytical measurement range, carryover rate, anti-biological interference of dTT assay may meet the requirement of clinical laboratory. The stability of the specimen can fulfill the clinical requirements.
Dabigatran;anticoagulation monitoring;diluted thrombin time; performance verification
10.13602/j.cnki.jcls.2017.12.07
吴雪莲,1989年生,女,技师,硕士,研究方向为血液病的筛查与诊断。
屈晨雪,副主任医师,博士,E-mail:qucx2012@163.com。
R446.11
A
2017-10-24)
王海燕)
