达比加群服药患者出血风险的实验室检测
2018-01-10王婵娟杨硕张捷乔蕊
王婵娟,杨硕,张捷,乔蕊
(北京大学第三医院检验科,北京 100191)
·临床实验研究·
达比加群服药患者出血风险的实验室检测
王婵娟,杨硕,张捷,乔蕊
(北京大学第三医院检验科,北京 100191)
目的观察常规凝血试验结果与血浆达比加群浓度的相关性,寻找合适的试验用于监测达比加群服药患者的出血风险。方法分析北京大学第三医院2015年至2017年使用达比加群抗凝的49名非瓣膜性心房颤动(NVAF)患者的临床资料,并计算其出血发生率。收集20名健康志愿者的血浆,制成正常混合血浆(NPP),分别向1 mL NPP中加入0~1 000 ng/mL浓度梯度的达比加群,检测凝血酶原时间(PT)、活化部分凝血活酶时间(APTT)、凝血酶时间(TT)、纤维蛋白原(Fib)和稀释蝰蛇毒时间(dRVVT)。另外收集3名健康志愿者的新鲜全血,做相同的加药处理后进行血栓弹力图试验(TEG)。结果服用达比加群的NVAF患者的出血发生率高达28.6%,以消化道出血居多。APTT、dRVVT、TEG的 R时间(R)和凝血指数(CI)结果与血浆达比加群浓度相关性良好,其中,dRVVT的敏感性最强,APTT次之,R和CI敏感性较差。结论APTT和dRVVT在监测达比加群出血事件方面具有重要意义,将有助于临床寻找合适的停药时机,减少出血事件的发生。
达比加群;活化部分凝血活酶时间;稀释蝰蛇毒时间;血栓弹力图;出血事件
达比加群是一种新型的口服抗凝药,通过结合凝血酶的活性位点抑制其活性,从而阻断凝血瀑布反应的最后阶段,防止血栓形成;另外,它还能抑制血小板的聚集[1]。目前,达比加群被批准用于非瓣膜性心房颤动(nonvalvular atrial fibrillation,NVAF)患者卒中和全身性血栓的预防,临床应用日益广泛[2]。与华法林相比,达比加群具有作用快、半衰期短、药物食物相互作用少以及药物代谢动力学稳定等特点,因此临床上以固定剂量给药且不需要常规监测[3]。长期抗凝治疗的随机性评价(randomised evaluation of long-term anticoagulation therapy, RE-LY)研究通过比较不同口服抗凝药的安全性和有效性指出,达比加群导致的出血事件发生率低于华法林,特别是大出血和颅内出血事件[4]。但近年来关于达比加群服药患者出血事件的报道越来越多,特别是消化道出血事件的发生率较高,给临床用药带来一定的困惑。目前,许多研究正致力于寻找合适的凝血试验以监测达比加群的抗凝活性,降低出血事件的发生率。其中,Ecarin凝血时间(Ecarin clotting time,ECT)和稀释凝血酶时间(diluted thrombin time,dTT)测定法在治疗范围内与血浆达比加群浓度的相关性好,是推荐的达比加群监测试验[5-6],但由于二者尚未标准化,且国内尚无相应的试剂,无法在常规实验室中开展。Korostelev等[7]研究认为,高效液相色谱串联质谱法是检测血浆达比加群浓度快而有效的方法,但其方法较复杂、费时,不适用于常规检测。因此,评价现有的常规凝血功能试验对达比加群出血事件的监测能力有更多实践意义。Reilly等[8]研究表明,血浆达比加群水平与出血风险密切相关。本研究通过外源性加药的方式模拟血浆达比加群浓度,并使其覆盖治疗浓度和过量浓度,通过分析其对常规凝血试验结果的影响,筛选恰当的实验室指标用于监测达比加群的出血风险。
1 材料和方法
1.1研究对象 连续选择2015年至2017年在北京大学第三医院住院的服用达比加群抗凝的NVAF患者49例,排除瓣膜性心房颤动、使用华法林等其他抗凝药物、服用达比加群前即有出血事件发生的患者,分析其临床资料,包括年龄、性别、体重、肾功能、基础疾病、用药等,并通过病例查询或电话回访确定患者是否发生出血事件及其出血部位。患者在服药期间发生出血事件为随访终点。本研究通过本院医学伦理学委员会批准,研究对象均知情同意。
1.2主要仪器与试剂 ACL-TOP 700全自动血凝分析仪(西班牙Werfen公司),Haemoscope 5000分析仪及其配套试剂(美国Haemonetics公司);达比加群BIBR953(批号S2196,美国Selleckchem公司),凝血四项试剂、狼疮抗凝物测定试剂盒(美国Instrumentation Laboratory公司)。
1.3标本采集与处理 采集20名健康志愿者(男5例,女15例,平均年龄38岁)清晨空腹静脉血,枸橼酸钠抗凝,混匀后3 000 r/min离心10 min,收集新鲜抗凝血浆各2 mL,混匀形成正常混合血浆(normal pooled plasma,NPP)40 mL。同时收集3名健康志愿者的新鲜全血各10 mL,枸橼酸钠抗凝。入选标准:近2周内未服用抗凝药物,无血栓和出血相关基础疾病,凝血检查无异常。
将NPP和新鲜全血各990 μL分装于EP管中,分别加入不同剂量的溶解于二甲基亚砜(dimethyl sulfoxide,DMSO)的达比加群活性药物,达比加群的终浓度分别为0、25、50、100、200、400、600、800和1 000 ng/mL。每个EP管的终体积为1 mL,最终每管溶液中DMSO所占的体积比均为1∶100。
1.4常规凝血试验 用ACL-TOP 700血凝分析仪检测加入达比加群活性药物的NPP,分析凝血酶时间(thrombin time,TT)、凝血酶原时间(prothrombin time,PT)、活化部分凝血活酶时间(activated partial thromboplastin time,APTT)、纤维蛋白原(fibrinogen,Fib)、稀释蝰蛇毒时间(diluted Russell viper venom time,dRVVT)。在Haemoscope 5000分析仪上用加入达比加群活性药物的新鲜全血进行血栓弹力图(thromboelastogram,TEG)试验,分析TEG凝血因子激活时间(R)、血块形成时间(K)、最大切角(α angle,α)、最大振幅(maximum amplitude,MA)和凝血指数(clot index,CI)。
1.5统计学分析 用SPSS 17.0统计软件进行。计算出血发生率,分析TT、PT、APTT、Fib、dRVVT、TEG结果与血浆达比加群浓度的相关性。以P<0.05为有统计学意义。
2 结果
2.1出血发生率 49例患者与RE-LY研究[8]的人群特征见表1。随访49例服用达比加群抗凝的NVAF患者发现,14例在服药期间发生了不同程度的出血,总出血发生率约28.6%,出血部位包括消化道(7例)、尿道(2例)、呼吸道(2例)、颅内(1例)和皮肤黏膜(2例)。其中,以消化道出血居多,约占50%。
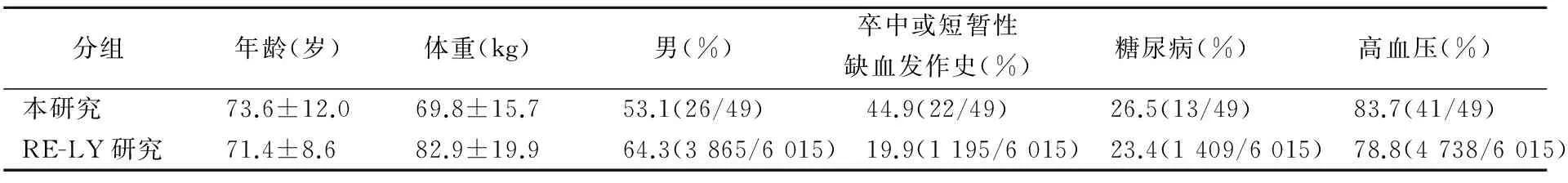
表1 本研究与RE-LY研究[8]的人群特征
2.2达比加群对凝血四项的影响 TT和Fib对达比加群过于敏感,在血浆达比加群浓度达到50 ng/mL时,TT超过检测上限,当浓度达到100 ng/mL时,凝血酶法(Clauss法)测定的Fib低于检测下限。PT对血浆达比加群浓度变化不够敏感,在低浓度时曲线变化缓慢,见图1,其回归方程为Y=0.015X+
9.5(r=0.967,P<0.01)(Y为PT值,X为血浆达比加群浓度)。APTT随血浆达比加群浓度增加而延长,二者呈现良好的线性相关性,特别是在治疗浓度范围内,而当高于治疗浓度时曲线变缓,见图1,其回归方程为Y=0.063X+38.388(r=0.982,P<0.01)(Y为APTT值,X为血浆达比加群浓度)。
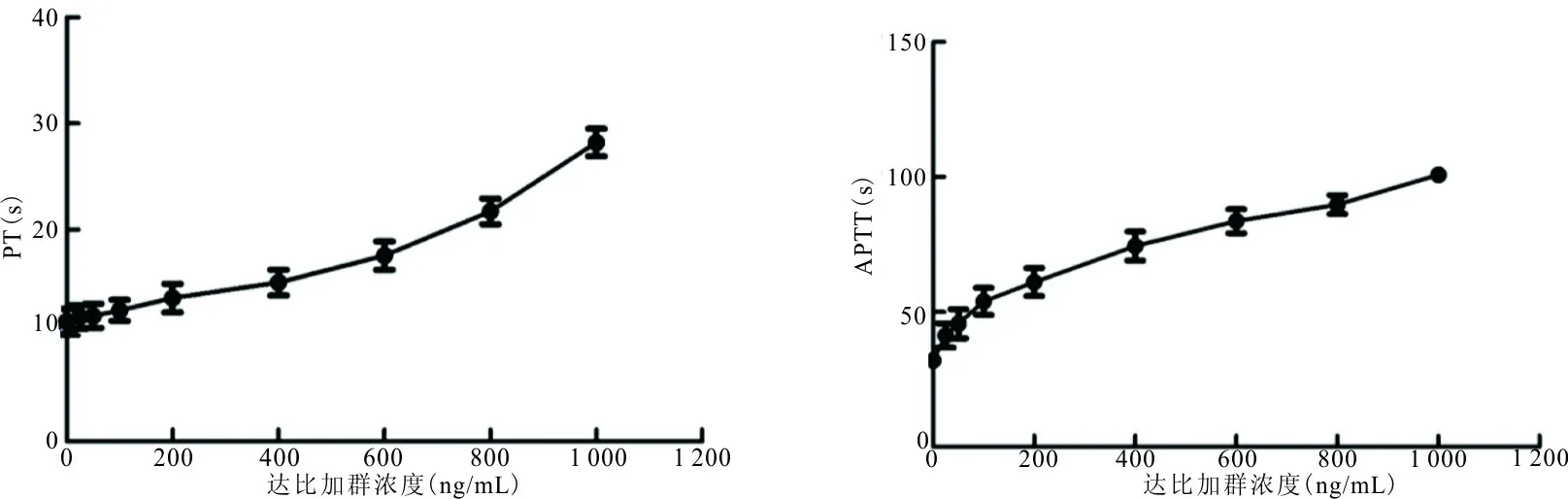
图1 血浆达比加群浓度对PT、APTT的影响
2.3达比加群对dRVVT的影响 见图2。dRVVT筛查试验(dRVVT-S)和dRVVT确证试验(dRVVT-C)均随血浆达比加群浓度升高而延长,在治疗浓度范围内呈现良好的线性相关性,而超过治疗浓度后变化不显著,其回归方程分别为Y=0.094X+49.957(r=0.913,P<0.01)和Y=0.11X+44.205(r=0.935,P<0.01),Y分别为dRVVT-S和dRVVT-C结果,X为血浆达比加群浓度。
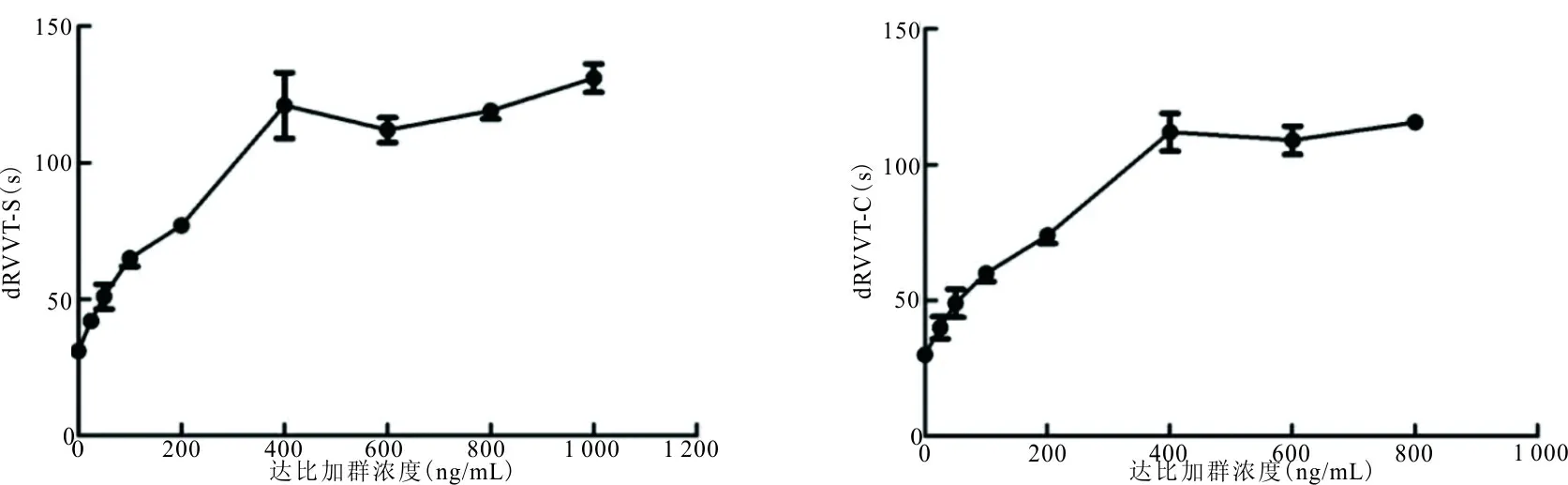
图2 血浆达比加群浓度对dRVVT的影响
2.4达比加群对TEG结果的影响 见图3。R值随血浆达比加群浓度升高而延长,CI值随血浆达比加群浓度升高而降低,二者均呈现良好的线性相关性,其回归方程分别为Y=0.009X+5.968(r=0.957,P<0.01)和Y=-0.008X-0.483(r=0.974,P<0.01),Y分别为R和CI值,X为血浆达比加群浓度。α和K虽然在血浆达比加群浓度200 ng/mL之后随浓度呈线性变化,但二者始终在参考区间内,其回归方程分别为Y=-0.015X+65.677(r=0.952,P<0.01)和Y=0.001X+1.894(r=0.936,P<0.01),Y分别为α和K值,X为血浆达比加群浓度。MA与血浆达比加群浓度没有相关性。
2.5常规凝血试验对血浆达比加群浓度变化的敏感性 见表2。将血浆达比加群浓度与凝血试验结果同时进行对数转换,然后进行相关回归分析(X为以10为底数的血浆达比加群浓度的对数,Y分别为以10为底数的APTT、R、dRVVT-S、dRVVT-C的对数),回归方程的系数越大说明敏感性越高,dRVVT的敏感性最高,尤其是dRVVT-C,其次是APTT,而R值的敏感性最小。
表2 经对数转换后血浆达比加群浓度与常规凝血试验的相关性
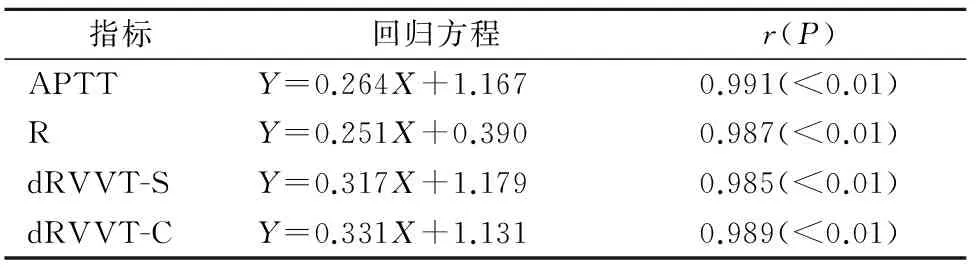
指标回归方程r(P)APTTY=0.264X+1.1670.991(<0.01)RY=0.251X+0.3900.987(<0.01)dRVVT-SY=0.317X+1.1790.985(<0.01)dRVVT-CY=0.331X+1.1310.989(<0.01)
3 讨论
尽管RE-LY研究[8]认为,达比加群的药物代谢动力学稳定,其出血发生率明显低于华法林,但其临床出血事件仍时有发生。本研究通过临床随访得出,达比加群服药患者中出血发生率约为28.6%,高于RE-LY研究[8]。通过与RE-LY研究[8]的人群特征比较发现,本研究人群体重偏低,高血压和糖尿病等基础疾病较多且44.9%有卒中史,提示基线水平差异会导致出血风险不同。考虑到国内服用达比加群进行抗凝的多为有基础疾病的老年人,而RE-LY研究[8]指出,高龄(≥75岁)、低体重、糖尿病等是出血发生的高危因素。因此,对于出血高风险的服药患者有必要适时地监测血浆达比加群浓度以判断正确的停药时机,对于判断服药中出血是否由达比加群引起也有提示作用。
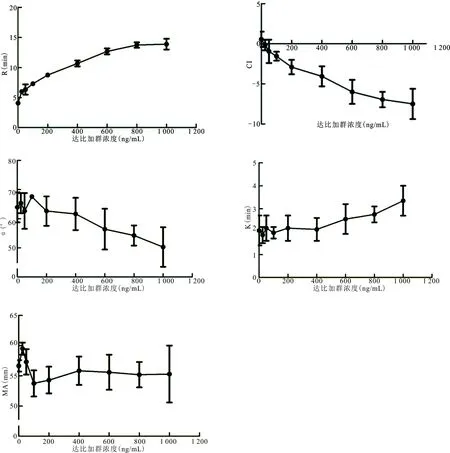
图3 血浆达比加群浓度对TEG结果的影响
通过观察凝血四项监测血浆达比加群浓度发现,TT和Fib对血浆达比加群浓度变化太过于敏感,这是由于达比加群直接抑制试剂中凝血酶活性。PT随血浆达比加群浓度升高呈指数而变化,初始时对浓度变化的敏感性较差,而随着血浆达比加群浓度的升高,单凭PT值将会高估出血风险,给临床造成误解。因此,三者均不适用于达比加群的监测。APTT对血浆达比加群浓度变化比较敏感,在治疗浓度范围内呈现良好的线性相关关系,与Douxfils等[9]研究结果一致。另外,Lindahl等[10]研究认为,不同APTT试剂对血浆达比加群浓度变化的反应相似。
目前,在临床上dRVVT主要用于狼疮抗凝物的检测。本研究发现,与APTT结果类似,dRVVT与血浆达比加群浓度在治疗范围内呈现良好的线性相关关系,其敏感性高于APTT,尤其是dRVVT-C。Colombini等[11]研究发现,dRVVT与利伐沙班血浆浓度也有良好的相关性,其敏感性高达100%,提示dRVVT在口服抗凝药出血监测方面具有潜在价值。
对于TEG,Solbeck等[12]发现,R值与ECT试验有很强的相关性(R2=0.914,P<0.01)。本研究发现,R和CI与血浆达比加群浓度呈现良好的线性相关关系,但是其敏感性较dRVVT和APTT低;K和α虽然随血浆达比加群浓度有变化趋势,但二者始终在参考区间内,因此其提示作用较弱,不易引起临床医生的注意;MA与血浆达比加群浓度没有相关性。这可以用TEG反应的原理来解释上述结果:R和CI反映的是凝血因子的活性,而K、α和MA主要反映纤维蛋白原和血小板的功能[13]。虽然TEG可以反映机体整个凝血系统和纤溶系统的功能,在血栓和出血疾病的监测中发挥重要作用,但其检验费用较高,而且不可能单独检测R和CI两个指标,考虑到经济效益比,不推荐其作为达比加群监测的首选。
综上所述,某些特定人群服用达比加群时出血发生率较高,因此监测达比加群具有重要的临床价值。本研究通过比较常规凝血试验与血浆达比加群浓度的相关性,并结合经济效益等因素综合考虑,推荐APTT和dRVVT作为达比加群的监测试验,超过第90百分位数的达比加群谷浓度(约200 ng/mL)时测得的APTT和dRVVT考虑与出血风险增高相关,可以指导临床适时地停药。
[1]Aalbers J, Bryer A, Klug E. FDA committee unanimously recommends approval of dabigatran etexilate for stroke prevention in atrial fibrillation [J]. Cardiovasc J Afr, 2010, 21(6): 341.
[2]Wolowacz SE, Roskell NS, Plumb JM,etal. Efficacy and safety of dabigatran etexilate for the prevention of venous thromboembolism following total hip or knee arthroplasty—A Meta-analysis[J]. Thromb Haemost, 2009, 101(1): 77-85.
[3]Bounameaux H, Reber G. New oral antithrombotics: a need for laboratory monitoring. Against[J]. J Thromb Haemost, 2010, 8(4): 627-630.
[4]Wallentin L, Yusuf S, Ezekowitz MD,etal. Efficacy and safety of dabigatran compared with warfarin at different levels of international normalised ratio control for stroke prevention in atrial fibrillation: an analysis of the RE-LY trial[J]. Lancet, 2010, 376(9745): 975-983.
[5]Du S, Weiss C, Christina G,etal. Determination of dabigatran in plasma, serum, and urine samples: comparison of six methods[J]. Clin Chem Lab Med, 2015, 53(8):1237-1247.
[6]Cuker A, Siegal DM, Crowther MA,etal. Laboratory measurement of the anticoagulant activity of the non-vitamin K oral anticoagulants[J]. J Am Coll Cardiol, 2014, 64(11):1128-1139.
[7]Korostelev M, Bihan K, Ferreol L,etal. Simultaneous determination of rivaroxaban and dabigatran levels in human plasma by high-performance liquid chromatography-tandem mass spectrometry[J]. J Pharm Biomed Anal, 2014, 100(Supplement C): 230-235.
[8]Reilly PA, Lehr T, Haertter S,etal. The effect of dabigatran plasma concentrations and patient characteristics on the frequency of ischemic stroke and major bleeding in atrial fibrillation patients: the RE-LY Trial (Randomized Evaluation of Long-Term Anticoagulation Therapy)[J]. J Am Coll Cardiol, 2014, 63(4): 321-328.
[9]Douxfils J, Mullier F, Robert S,etal. Impact of dabigatran on a large panel of routine or specific coagulation assays[J]. Thromb Haemost, 2012, 107(5): 985-997.
[10]Lindahl TL, Baghaei F, Blixter IF,etal. Effects of the oral, direct thrombin inhibitor dabigatran on five common coagulation assays[J]. Thromb Haemost, 2011, 105(2): 371-378.
[11]Colombini MP, Derogis PBMC, de Aranda VF,etal. Comparison of different laboratory tests in the evaluation of hemorrhagic risk of patients using rivaroxaban in the critical care setting: diagnostic accuracy study[J]. Thromb J, 2017, 15:21.
[12]Solbeck S, Ostrowski SR, Stensballe J,etal. Thrombelastography detects dabigatran at therapeutic concentrations in vitro to the same extent as gold-standard tests[J]. Int J Cardiol, 2016, 208(Supplement C):14-18.
[13]Solbeck S, Meyer MA, Johansson PI,etal. Monitoring of dabigatran anticoagulation and its reversal in vitro by thrombelastography[J]. Int J Cardiol, 2014, 176(3): 794-799.
LaboratorymeasurementofbleedingriskforpatientsreceivingDabigatran
WANGChan-juan,YANGShuo,ZHANGJie,QIAORui
(DepartmentofLaboratoryMedicine,PekingUniversityThirdHospital,Beijing100191,China)
ObjectiveTo observe the correlation between conventional coagulation tests and Dabigatran concentration in order to find proper test method to predict the bleeding risk of patients receiving Dabigatran.MethodsThe clinical data of forty-nine non-valvular atrial fibrillation (NVAF) patients who took Dabigatran in Peking University Third Hospital from 2015 to 2017 were analyzed and the bleeding rates were calculated. The plasma samples from twenty healthy volunteers were collected and mixed up into normal pooled plasma (NPP). Different doses of active Dabigatran were mixed with NPP, making Dabigatran concentrations from 0 to 1 000 ng/mL. Prothrombin time (PT), activated partial thromboplastin time (APTT), thrombin time (TT), fibrinogen (Fib) and diluted Russell viper venom time (dRVVT) were determined. Fresh whole blood samples from three normal volunteers were collected and mixed with Dabigatran in the same way to perform thromboelastogram (TEG).ResultsThe total bleeding rate of NVAF patients receiving Dabigatran was 28.6%, among which gastrointestinal bleeding accounts for the most. APTT, dRVVT, R time (R) and clot index (CI) showed a good linear correlation with Dabigatran concentration. The sensitivity of dRVVT was the best, followed by APTT. R and CI showed low sensitivity compared with APTT and dRVVT.ConclusionAPTT and dRVVT should be good parameters for monitoring the bleeding risk of Dabigatran and helpful for physicians to choose proper point-in-time for withdrawal of Dabigatran and reduce bleeding events.
Dabigatran; activated partial thromboplastin time; diluted Russell viper venom time; thromboelastogram; bleeding event
10.13602/j.cnki.jcls.2017.12.08
国家自然科学基金(81601824)。
王婵娟,1992年生,女,硕士研究生,主要从事血栓与止血研究。
乔蕊,副教授,E-mail:qrqiaorui@163.com。
R446.11;R619
A
2017-10-09)
王海燕)
