血小板平均体积在监测大动脉炎疾病活动及疗效评估中的作用
2018-01-10李治琴庞琳烜吴振彪
李治琴,庞琳烜,吴振彪
(第四军医大学附属西京医院临床免疫科,西安 710002)
·临床实验研究·
血小板平均体积在监测大动脉炎疾病活动及疗效评估中的作用
李治琴,庞琳烜,吴振彪
(第四军医大学附属西京医院临床免疫科,西安 710002)
目的评估平均血小板体积(MPV)在大动脉炎(TA)疾病活动及疗效评估中的作用。方法对2010年1月至2016年10月在西京医院临床免疫科住院及随访的152例TA患者(活动组86例,非活动组66例)MPV等指标进行回顾性分析,并选取年龄及性别匹配的180例健康人作为对照组。结果TA患者组MPV(fL)低于健康人对照组(10.1±1.78 vs 11.6±1.35,P<0.01)。TA疾病活动组MPV(fL)低于TA非活动组(9.5±1.45 vs 10.88±1.28,P<0.01)。TA患者MPV(fL)经强的松等治疗后升高(9.5±1.45 vs 10.5±1.81,P<0.01)。在TA患者中,MPV与C反应蛋白(CRP)、红细胞沉降率(ESR)、中性粒细胞计数(Neu)和血小板计数(PLT)均呈负相关(r分别为-0.239、-0.266、-0.282、-0.506,P均<0.01),与血小板分布宽度(PDW)呈正相关(r=0.300,P<0.05)。TA活动组MPV与ESR、Neu均呈负相关(r=-0.366,-0.390,P<0.05)。经多元线性回归分析,TA患者MPV与ESR独立相关(标准化的β系数为-0.028,P<0.05)。结论MPV可能在监测TA疾病活动及评估疗效中有一定作用。
血小板平均体积;血沉;大动脉炎
大动脉炎(takayasu arteritis,TA)主要影响大动脉,如主动脉、肺动脉及其主要的分支血管[1]。血管壁的慢性炎症使管腔狭窄,导致脑、器官、肢体的局部缺血症状[2]。但患者的局部缺血症状与血管壁损伤、狭窄的程度有关,而与管壁是否存在炎症、疾病是否活动并不一定相符[3]。血细胞沉降率(erythrocyte sedimentation rate,ESR)、C反应蛋白(C reactive protein,CRP)等炎症指标对判断TA疾病活动情况有帮助,但仅72% TA活动期患者ESR升高,而仍有44%非活动期患者ESR升高[4]。因此,临床判断TA疾病活动情况比较困难。
血小板平均体积(mean platelet volume,MPV)反映血小板的大小及功能[5]。血小板体积增加是冠心病的独立危险因素[6],也与阵发性室上性心动过速、视网膜动脉阻塞及卵巢附件的扭转相关[7-9]。类风湿关节炎患者给予抗炎治疗后MPV升高[10],而其他风湿病如系统性红斑狼疮、炎性肠病、强直性脊柱炎和多肌炎患者MPV也升高[11-14],但TA患者MPV水平目前尚未见报道。本研究主要分析MPV在TA疾病活动及疗效中的作用。
1 对象与方法
1.1研究对象 2010年1月至2016年10月在西京医院住院及随访的TA患者152例(男6例,女146例,年龄16~37岁,中位年龄24岁),均符合美国风湿病学会分类标准[15]。根据美国TA临床活动性评分标准判断TA患者的疾病活动度[16]。TA疾病活动的标准被定义为至少符合以下两个特征:(1)典型的疾病症状;(2)除外感染的ESR升高;(3)血管缺血症状;(4)典型的血管造影特征。TA患者分为活动(86例)和非活动(66例)两组。合并有心血管疾病、感染、肝功能及肾功能异常、血脂异常、恶性肿瘤及其他风湿病的患者均除外。采集患者治疗前及治疗3个月后的相关临床指标。180例年龄及性别匹配的健康人作为对照组(男10例,女170例,年龄18~40岁,中位年龄26岁)。
1.2标本采集与处理 健康人对照组空腹12 h后采集肘静脉血;TA患者于诊断时且空腹12 h后采集肘静脉血3管,1管EDTA-K2抗凝,用于检测WBC及其分类;1管肝素抗凝,用于检测CRP;1管枸橼酸钠抗凝,用于检测ESR。大动脉炎患者治疗3个月后再次空腹12 h后采集肘静脉血2 mL,EDTA-K2抗凝,用于检测WBC及其分类。
1.3实验室指标检测 查询患者病历资料,记录TA患者治疗前后实验室指标,如中性粒细胞(Neu)、血红蛋白(Hb)、血小板计数(PLT)、血小板分布宽度(platelet distribution width,PDW),MPV、ESR、CRP等。上述实验室指标均来自于西京医院检验科同1个实验室。其中,WBC及其分类由Bayer 120血液分析仪及其配套试剂检测;ESR由ESR-30测定仪以魏氏法检测;CRP由Immage 800生化分析仪及其配套公司试剂以乳胶增强比浊法检测;MPV参考区间是7.4~13.0 fL。
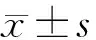
2 结果
2.1TA患者和健康对照者的基本资料 TA患者组高血压75例(49.3%),糖尿病2例(1.3%),服用强的松者126例(82.9%),病程(5.0±4.74)年,CRP(1.8±5.98)mg/dL,ESR(40.8±60.80)mm/h。
TA患者组和健康人对照组Neu、Hb、PDW和PLT差异均有统计学意义(t分别为3.475、3.628、4.025、3.702,P均<0.01),TA患者MPV低于健康人对照组(t=3.894,P<0.01),见表1。
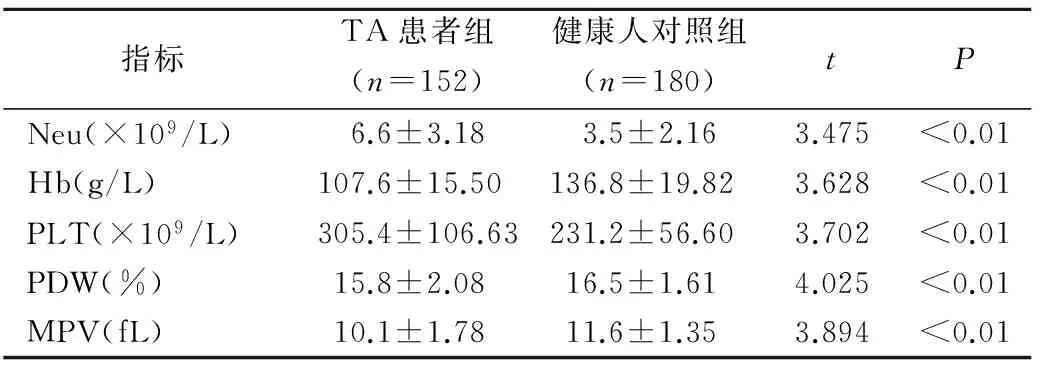
表1 TA患者与健康对照者Neu、Hb、PLT、PDW和MPV结果
2.2TA活动组与非活动组的实验室指标结果 TA活动组MPV水平低于TA非活动组(t=3.802,P<0.01)。TA活动组患者CRP、ESR、PLT均高于TA非活动组,差异均有统计学意义(t分别为4.127、4.722、6.669,P均<0.01),而Hb则低于TA非活动组,差异有统计学意义(t=-6.860,P<0.01),见表2。
区分TA患者活动与非活动的ROC曲线下面积为0.735,MPV的临界值是9.72 fL。
2.3TA活动组患者治疗前后实验室指标结果 TA活动组患者中使用强的松治疗者76例,环磷酰胺40例,甲氨蝶呤28例,霉酚酸酯12例,来氟米特8例。基于以下临床缓解标准为观察终点:典型的临床症状缓解或减轻;ESR降至正常;血管影像提示无明显疾病进展。TA活动组72例患者在治疗后达到临床缓解,MPV较前增加(t=5.033,P<0.01),而ESR、CRP、PLT下降(t分别为-4.526、-4.623、-3.822,P分别为<0.01、<0.01、<0.05,见表3。
治疗后没有达到临床缓解的14例TA活动组患者其MPV值与治疗前差异无统计学意义(t=0.584,P>0.05)。
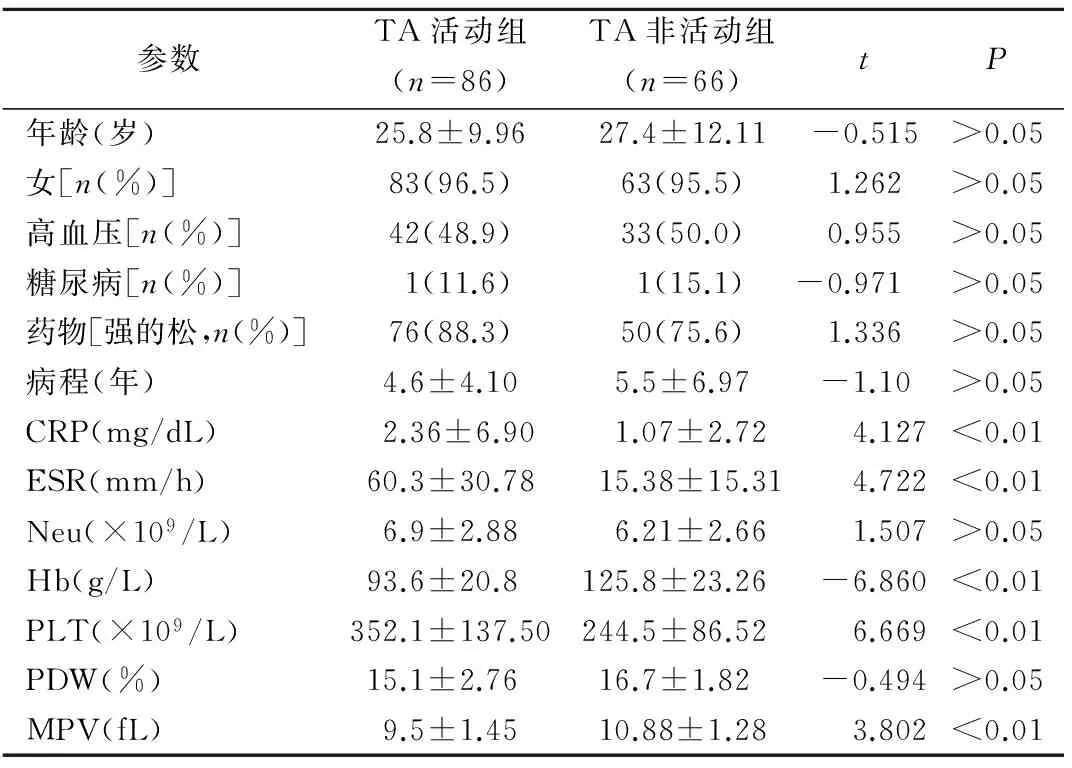
表2 TA活动组与非活动组的基本资料和实验室指标结果
表3 治疗后达到临床缓解的TA活动组患者治疗前后实验室指标结果(n=72)
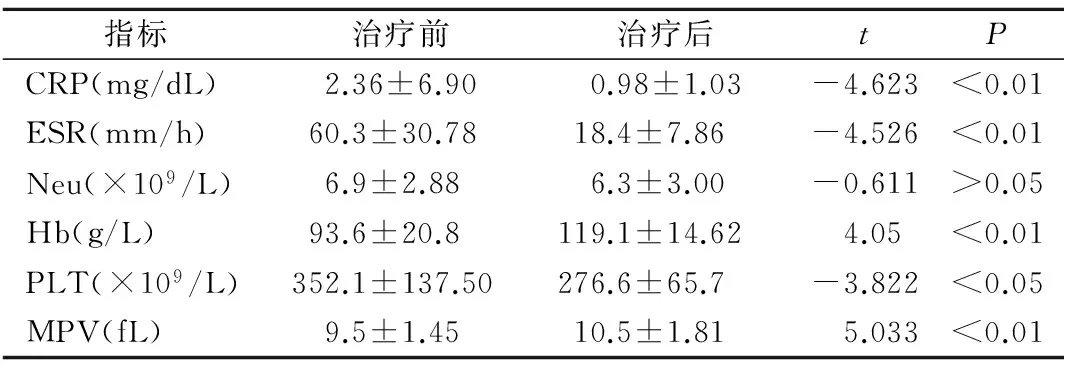
指标治疗前治疗后tPCRP(mg/dL)2.36±6.900.98±1.03-4.623<0.01ESR(mm/h)60.3±30.7818.4±7.86-4.526<0.01Neu(×109/L)6.9±2.886.3±3.00-0.611>0.05Hb(g/L)93.6±20.8119.1±14.624.05<0.01PLT(×109/L)352.1±137.50276.6±65.7-3.822<0.05MPV(fL)9.5±1.4510.5±1.815.033<0.01
2.4相关性分析 在TA患者中,MPV与CRP、ESR、Neu、PLT均呈负相关(r分别为-0.239、-0.266、-0.282、-0.506,P均<0.05),与PDW呈正相关(r=0.300,P<0.01)。在TA活动组中,MPV与ESR、Neu均呈负相关(r分别为-0.336、-0.390,P均<0.05),与PDW呈正相关(r=0.471,P<0.01);而在TA非活动组中,MPV与CRP或ESR无明显相关性(P均>0.05)。在多元线性回归分析中,校正年龄、性别、高血压、糖尿病、药物、病程、CRP、Neu、PDW和PLT后,MPV与ESR独立相关(标准化的β系数=-0.028,P<0.05)。
3 讨论
在多种风湿病的诊断及随访中,MPV与疾病活动相关[17]。本研究发现,与TA非活动组相比,TA活动组患者MPV较低,达到临床缓解后MPV升高。研究结果提示MPV有可能在判断TA疾病活动及疗效评估中发挥作用。血小板在各种病理生理情况下,如炎症和血栓形成中均发挥重要作用[18]。MPV被认为是评估血小板功能和活性的重要指标[19]。许多细胞炎性因子,包括白介素-3、白介素-6和肿瘤坏死因子,被认为在造血功能及继发性血小板增多症中发挥作用[20-21],可以促进巨核细胞生成和释放血小板至外周血中。这个调节过程在生理及病理状态下激活了血小板[22]。肿瘤坏死因子等多种炎性细胞因子在TA患者血清中升高[23];其中,炎性细胞因子的过度升高刺激骨髓中的巨核细胞释放更多的小体积血小板[22]。有证据显示,外周血中大体积血小板被极大地消耗在炎症部位[22]。在一些风湿病中,严重的炎症会消耗更多大体积血小板[24],故在TA疾病活动时,动脉管壁的炎症可极大地消耗外周血中正常体积血小板,促使释放功能尚未成熟的小体积血小板。
本研究也有一些局限性。首先,样本量还不是足够大,尤其是处于活动期、给予强的松等治疗的TA患者。其次,需要进一步研究证实MPV改善是否可作为TA疾病缓解、治疗有效的依据。再次,活动期TA患者经强的松治疗后可能会影响血小板的计数及功能。最后,研究未评估不同类型TA与MPV下降之间的关系。本研究结果提示,TA疾病活动时MPV下降,经过治疗后MPV升高;MPV有可能成为评估TA疾病活动的标志物,MPV升高可能有助于判断疗效及病情。
[1]Mason JC. Takayasu arteritis—advances in diagnosis and management[J]. Nat Rev Rheumatol, 2010, 6(7): 406-415.
[2]Park SJ, Kim HJ, Park H,etal. Incidence, prevalence, mortality and causes of death in Takayasu Arteritis in Korea—A nationwide, population-based study[J]. Int J Cardiol, 2017, 235(5): 100-104.
[3]Mirault T, Messas E. Takayasu arteritis[J]. Rev Med Interne, 2016, 37(4): 223-229.
[4]Maksimowicz-Mckinnon K, Clark TM, Hoffman GS. Limitations of therapy and a guarded prognosis in an American cohort of Takayasu arteritis patients[J]. Arthritis Rheum, 2007, 56(3): 1000-1009.
[5]Gawaz M, Langer H, May AE. Platelets in inflammation and atherogenesis[J]. J Clin Invest, 2005, 115(12): 3378-3384.
[6]Martin JF, Bath PM, Burr ML. Influence of platelet size on outcome after myocardial infarction[J]. Lancet, 1991, 338(8780): 1409-1411.
[7]Ocak T, Erdem A, Duran A,etal. The importance of the mean platelet volume in the diagnosis of supraventricular tachycardia[J]. Afr Health Sci, 2013, 13(3): 590-594.
[8]Sahin M, Sahin A, Yuksel H,etal. Mean platelet volume in patients with retinal artery occlusion[J]. Arq Bras Oftalmol, 2016, 79(1): 12-14.
[9]Koleli I. Mean Platelet volume in early diagnosis of adnexal torsion[J]. Balkan Med J, 2015, 32(4): 410-413.
[10]Gasparyan AY, Sandoo A, Stavropoulos-Kalinoglou A,etal. Mean platelet volume in patients with rheumatoid arthritis: the effect of anti-TNF-α therapy[J]. Rheumatol Int, 2010, 30(8): 1125-1129.
[11]Safak S, Uslu AU, Serdal K,etal. Association between mean platelet volume levels and inflammation in SLE patients presented with arthritis[J]. Afr Health Sci, 2014, 14(4): 919-924.
[12]Kapsoritakis AN, Koukourakis MI, Sfiridaki A,etal. Mean platelet volume: a useful marker of inflammatory bowel disease activity[J]. Am J Gastroenterol, 2001, 96(3): 776-781.
[13]Kisacik B, Tufan A, Kalyoncu U,etal. Mean platelet volume (MPV) as an inflammatory marker in ankylosing spondylitis and rheumatoid arthritis[J]. Joint Bone Spine, 2008, 75(3): 291-294.
[14]Peng YF, Huang YX, Wei YS. Altered mean platelet volume in patients with polymyositis and its association with disease severity[J]. Braz J Med Biol Res, 2016, 49(6): e5168.
[15]Arend WP, Michel BA, Bloch DA,etal. The American College of Rheumatology 1990 criteria for the classification of Takayasu arteritis[J]. Arthritis Rheum, 1990, 33(8): 1129-1134.
[16]Misra R, Danda D, Rajappa SM,etal. Development and initial validation of the Indian Takayasu Clinical Activity Score (ITAS2010)[J]. Rheumatology (Oxford), 2013, 52(10): 1795-1801.
[17]Sert A, Kilicaslan C, Solak ES,etal. Mean platelet volume in children with Reye-like syndrome[J]. Platelets, 2015, 26(3): 212-215.
[18]Wagner DD, Burger PC. Platelets in inflammation and thrombosis[J]. Arterioscler Thromb Vasc Biol, 2003, 23(12): 2131-2137.
[19]Soydinc S, Turkbeyler IH, Pehlivan Y,etal. Mean platelet volume seems to be a valuable marker in patients with systemic sclerosis[J]. Inflammation, 2014, 37(1): 100-106.
[20]Ertenli I, Kiraz S, Ozturk MA,etal. Pathologic thrombopoiesis of rheumatoid arthritis[J]. Rheumatol Int, 2003, 23(2): 49-60.
[21]叶军,张立新,李加新,等. 肝病患者血清血小板生成素水平的观察[J]. 临床检验杂志,2005,23(6):459.
[22]Gasparyan AY, Ayvazyan L, Mikhailidis DP,etal. Mean platelet volume: a link between thrombosis and inflammation?[J]. Curr Pharm Des, 2011, 17(1): 47-58.
[23]Saruhan-Direskeneli G, Bicakcigil M, Yilmaz V,etal. Interleukin (IL)-12, IL-2, and IL-6 gene polymorphisms in Takayasu′s arteritis from Turkey[J]. Hum Immunol, 2006, 67(9): 735-740.
[24]林宝顺,郑德柱,刘文星,等.大血小板检测及临床意义探讨[J].临床检验杂志,2003,21(1):17-18.
10.13602/j.cnki.jcls.2017.12.16
李治琴,1981年生,女,主治医师,硕士,主要从事风湿病临床诊断与治疗相关研究。
吴振彪,主任医师,E-mail:wuzhenbiao@fmmu.edu.cn。
R446.11
A
2017-04-20)
王海燕)
