科尔沁沙地草地植物群落功能性状对封育和放牧的响应
2018-01-09左小安岳喜元刘良旭何钊全
张 晶,左小安,杨 阳,岳喜元,张 婧,吕 朋,周 欣,连 杰,刘良旭,何钊全
科尔沁沙地草地植物群落功能性状对封育和放牧的响应
张 晶1,2,3,左小安1,2※,杨 阳1,岳喜元1,张 婧1,吕 朋1,周 欣2,连 杰2,刘良旭1,何钊全2
(1. 中国科学院西北生态环境资源研究院乌拉特荒漠草原站,兰州 730000; 2. 中国科学院西北生态环境资源研究院奈曼沙漠化研究站,兰州 730000;3. 中国科学院大学,北京 100049)
该研究以科尔沁沙地中草甸(meadow)、针茅草原(steppe)、疏林草地(scattered tree grassland)和沙质草地(sandy grassland)4种草地的18种优势植物为研究对象,分别测定了不同草地植物群落在封育和放牧下的高度(height)、比叶面积(specific leaf area,SLA)、叶片干物质含量(leaf dry matter content,LDMC)、叶片面积(leaf area,LA)、叶片氮含量(leaf nitrogen content,LNC)和叶片碳同位素(leaf carbon isotopes)6个相关于植物生理生态过程的功能性状指标。结果表明:1)长期放牧增加了草地中一年生植物和C4植物的丰富度和重要值,降低了沙质草地中多年生植物的相对生物量;2)沙质草地植物群落的SLA和δ13C高于其他3种草地,LDMC小于其他3种草地;3)长期放牧降低了草地植物群落的高度和LA,增加了草地植物群落的δ13C,SLA、LDMC和LNC则不受放牧的影响;4)植物功能性状中,SLA与LDMC极显著负相关且不受放牧的干扰;而长期放牧导致了高度与SLA和δ13C显著负相关以及SLA和δ13C显著正相关。科尔沁沙地长期放牧的草地中一年生植物和C4植物比例相对增加,且优势植物具有较低的高度和LA以及较高的δ13C,表明了草地植物群落通过物种竞争结构和功能性状权衡策略的改变来适应长期放牧。因此,减轻放牧压力,改善植物群落的功能性状,对于该区域退化草地的恢复及持续管理具有一定的重要意义。
植物;生长;生理学;草地;放牧;草地植物群落;封育;不同草地类型
0 引 言
草地是陆地上分布最广的生态系统之一,中国天然草地总面积约为4.0×108hm2,约占国土总面积的41.7%[1]。草地生态系统的植物群落结构及生态功能不仅取决于气候和土壤变化等因素,并且受到土地利用变化以及人类活动的影响[2]。放牧是草地利用的主要方式之一,主要是通过家畜的采食与践踏影响土壤的物理结构[3],同时家畜对营养物质的摄取转化及排泄物归还等影响草地营养物质的循环,导致草地土壤化学成分的变化,从而进一步影响植物的生长[4-5]。放牧不仅影响着草地植物的叶片、根系和种子库等植被特征,而且也对土壤容重、土壤孔隙结构及土壤肥力(碳、氮含量、氮的矿化、微生物活性)等也具有重要的的影响[6-8]。长期超载放牧,使草地植被覆盖率和生产力急剧降低、土壤贫瘠化,最终草畜平衡被打破,草地逐渐开始退化。植物功能性状被看成是植物适应环境变化与干扰的不同反映,是植物与环境相互作用的结果[9]。已有研究表明,植物和土壤对放牧敏感性的顺序为:地上植株>根系>土壤[10]。叶片性状作为植物与外界环境直接接触的器官,可以最大限度地提供有关植物生长和适应环境的重要信息,反映植物适应环境的生存对策[11-13]。在群落水平上,由于食草动物采食可选择范围变宽,而且不同植物种对放牧干扰的响应也不一致,因而放牧对植物群落组成的影响远比对单一植物种群内植株个体的影响复杂[14]。因此,基于生态系统中物种相对生物量结合相关功能性状的研究,可以很好的将个体水平放大到群落水平,凸显放牧对于草地植物群落的影响,为中国北方草地的管理提供一定的科学依据。
植物功能性状是植物长期适应外部环境过程中经遗传变异和自然选择而形成的稳定指标,可以较好地反映植物生长状况、资源利用策略和植物对环境变化的响应及适应[15-16]。植物高度(height)会影响光来源、热量负荷、湿度和种子扩散[17];较高的植物个体,表明植物生长速率较快、生物量较大[18-20]。叶面积(LA)能很好地反映植物对周围环境的适应特征,是植物比较生态学研究中的重要指标[21-24]。比叶面积(SLA)、叶片干物质含量(LDMC)以及叶片氮含量(LNC),均与植物的结构和组织特性密切相关,极大地影响着植物的生长[25-27]。高SLA的植物,往往光合速率高,有着较强的碳贮存能力和氮素利用效率[28];高的LDMC植物,具有较强的忍耐性和抗压能力[29],在养分限制区,植物往往采用高LDMC、低SLA的资源保守策略,并通过存储充足的氮来完成生活史[25,30-31]。植物叶片碳同位素(δ13C)反映了与植物光合、蒸腾强度相关联的水分利用率,指示着植物的长期水分利用效率[32];叶片的δ13C与氮含量的变化对于植物适应干旱环境具有非常重要的作用[33]。因此,研究不同草地植物功能性状对封育和放牧的响应,有助于揭示不同草地植物群落的构建及其对环境变化的适应机理,对于退化草地植被恢复和管理具有重要的理论及实践意义。
科尔沁沙地地处中国温带半干旱草原区,由于过度的开垦、放牧和持续的干旱,导致了该区域生物资源锐减和土地生产力下降[34]。近些年,随着退耕还草和封育禁牧等政策的实施,沙漠化蔓延速度减缓,退化植被得以恢复,沙化土地质量有所改善[35]。有关封育和放牧对该区域沙丘生境影响的研究报道较多,主要集中在对沙丘土壤呼吸、植被特征以及物种丰富度等方面[36-37]。然而,由于人类活动和气候变化的影响,该区域不仅存在各类型沙丘,也发育了以多年生禾本科植物为主的湿草甸、针茅草原、疏林草地以及一年生植物为主的沙质草地[38]。本文以上述4种草地的植物为研究对象,探讨长期封育和放牧对草地植物重要值、生物量以及植物群落6项功能性状(植物高度、比叶面积、叶片干物质含量、叶面积、叶片氮含量、叶片碳同位素)指标的影响,以期揭示:1)封育和放牧对不同草地植物重要值和相对生物量的影响;2)不同植物群落功能性状对草地类型的差异化响应;3)不同草地植物群落功能性状对封育和放牧差异化的响应;4)草地植物群落功能性状差异的驱动机制,为进一步加强对草地的管理、遏制草地的退化和促进草地生态系统可持续发展提供一定的理论支撑。
1 材料与方法
1.1 研究区概况
研究区位于科尔沁沙地42°55′-44°41′ N,120°42′-121°33′E之间,海拔200~360 m。属温带半干旱大陆性气候,夏季炎热,冬季寒冷;年均温3~7 ℃,≥10 ℃年积温2 200~3 200 ℃;年均降水量350.0 mm,80%的降水集中在6-9月。草地类型主要有草甸(M)、针茅草原(SS)、疏林草地(SG)和沙质草地(G)。主要植物种有针茅()羊草()糙隐子草()赖草()、芦苇()、兴安胡枝子()虎尾草()狗尾草()、毛马唐()等。其中草甸主要以灰色草甸土为主,针茅草原和疏林草地主要以典型栗钙土为主,沙质草地主要以沙质栗钙土为主。
1.2 研究方法
1.2.1 取样方法
2014年8月,在该研究区域内选取长期保护封育和放牧下的草甸(M)、针茅草原(SS)、疏林草地(SG)和沙质草地(G)4种草地为研究对象。4种封育草地围栏保护大约20~30 a,冬季偶有放牧或割草,干扰程度较轻;放牧草地均为封育草地附近无围栏保护的长期公共自由放牧区,放牧强度大约每公顷2头牛、6只羊,属于重度放牧[2,39]。在每个封育草地中设置6个面积为20 m× 20 m的典型样地,样地间距最小为500 m。每个样地随机设置3个1 m×1 m样方,调查样方中优势植物种的生物量。
1.2.2 试验方法
参照植物功能性状取样和测定标准方法[40-42]对样方内所有的物种进行叶功能性状的取样和测定,植物功能性状包括:height(植物高度),cm;SLA(比叶面积),m2/kg;LDMC(叶片干物质含量),g/kg;LA(叶面积),cm2;LNC(叶片N含量)、碳同位素(δ13C)等。
每个样方内植物取5~10株,选择10片无病虫害的完全伸展叶,用剪刀剪下,置于湿润的滤纸之间,迅速放入密封袋贮藏于便携式车载冰箱内(内部温度<5 ℃)。回到实验室将叶片去叶柄后浸入水中,置于黑暗环境中(5 ℃)冷藏12 h。取出后迅速吸干叶表水分,在百万分之一的电子天平上称得叶鲜质量。然后将叶片平铺在扫描仪上扫描,再用ImageJ1.48v软件进行处理,得到叶面积(LA)。最后,将扫描后的叶片放入60 ℃烘箱内烘48 h,取出称得叶干质量。LDMC=叶干质量/叶鲜质量,SLA=叶面积/叶干质量。
为保证每种植物有足够的叶片用以测定样品N和δ13C,在每个样方附近获取部分植物的叶,带回实验室烘干称质量后,与原来每个样方烘干称质量后的样品混合,制成分析植物叶片N和δ13C的样品。再将每个植物叶的样品混合粉碎,过0.25 mm筛,存储备用。分析前在65 ℃的干燥箱中烘干1 h,放入干燥器中保存待测。采用元素分析仪(Costech ECS 4010,意大利)测定样方中每种植物叶的N和δ13C含量。
1.3 数据分析
1.3.1 物种相对生物量(P)

式中N是物种在群落内的生物量,是群落中全部物种的生物量。
1.3.2 植物群落功能性状(CWM)
植物群落功能性状(CWM),即就某一性状而言,群落内每一物种该性状的值与该物种相对生物量积的总和[43],表示群落内某功能性状的均值,常用来评估群落动态和生态系统特征[43]。CWM由下列公式计算[44]

式中是物种在群落内的相对生物量,trait是物种的性状值。
1.3.3 物种重要值
根据植物群落的数量特征,计算每种类型草地每个物种的重要值,公式如下[45]
物种重要值=(相对高度+相对盖度+相对生物量)/3
1.4 统计分析
采用SPSS 17.0进行数据分析,单因素方差分析比较封育和放牧下不同草地CWM的差异;双因素方差分析比较放牧和草地类型对CWM的影响,多重比较采用最小显著性差异法(LSD)。
2 结果与分析
2.1 放牧对不同草地优势物种重要值和相对生物量的影响
表1表明,4种草地在封育和放牧下,其优势植物多样性和丰富度都有显著的差异。在封育下,草甸中优势植物为多年生的赖草、芦苇等,重要值为22.71、12.35;针茅草原优势植物为多年生的针茅和羊草等,重要值为44.22、14.86;疏林草地优势植物为多年生的糙隐子草、一二年生的狗尾草、黄蒿以及半灌木兴安胡枝子等,重要值依次为31.50、13.03、10.31、12.42;沙质草地优势植物为一二年生的狗尾草、黄蒿和多年生的糙隐子草、芦苇等,重要值依次为22.30、9.79、12.39、9.72。而在长期放牧干扰下,草甸中优势植物为一年生的虎尾草和多年生的赖草、芦苇及皱果苔草等,重要值依次为16.58、14.17、13.18、9.72;针茅草原优势植物为半灌木兴安胡枝子、多年生的糙隐子草和针茅等,重要值为28.68、25.84、12.01;疏林草地优势植物为一二年生的虎尾草和毛马唐等,重要值为29.04、11.90;沙质草地优势植物为一年生的马唐、虎尾草、黄蒿和画眉草等,重要值为16.63、13.59、11.34、10.23。由此表明,4种草地在长期封育下,草地植物群落的优势植物主要为多年生禾本科植物,但在长期放牧影响下,草地植物群落中一二年生植物和灌木的优势度有所增加。此外,C4植物的多样性和重要值有所增加,尤其在疏林草地和沙质草地中有较大幅度的增加。这表明,放牧明显导致植物种群内个体组成变化,改变了群落的竞争结构。

表1 不同草地优势物种重要值
注:M:草甸;SS:针茅草原;SG,疏林草地;G:沙质草地;AS:一二年生植物;PS:多年生植物;C3:C3植物;C4:C4植物。
Note: M: Meadow; SS:steppe; SG:Scattered tree grassland; G: Sandy grassland; AS: Annual or two species; PS: Perennial species; C3: C3species; C4:C4species.
封育和放牧下草甸、疏林草地和沙质草地一年生植物的相对生物量无显著差异(图1a),放牧干扰下,4种草地多年生植物相对生物量发生了显著的变化,沙质草地中多年生植物的相对生物量在放牧干扰下显著降低(<0.05)(图1b)。

注:不同字母表示同一管理下不同草地植物相对生物量在P<0.05水平上的差异;*表示不同管理下同一草地植物相对生物量在P<0.05水平上的差异。
2.2 放牧对不同草地CWM的影响
由方差分析表2看出,不同草地植物群落的height、SLA、LDMC、LA和δ13C差异极显著(<0.01),长期放牧极显著影响height、LA和δ13C(<0.01),二者交互作用下height、SLA、LDMC和LA差异显著(<0.05)。

表2 植物群落功能性状CWM方差分析表
从表3可以看出,针茅草原植物群落的height大于其他3种草地(<0.05),而长期放牧降低了草地植物群落高度(<0.05);沙质草地植物群落的SLA大于其他3种草地(<0.05),而LDMC小于其他3种草地(<0.05),放牧对于草地植物群落SLA和LDMC无显著影响;草甸植物群落的LA大于其他3种草地,放牧减小了草地植物群落的LA;针茅草原植物群落的LNC大于草甸,而放牧对于草地植物群落的LNC无显著影响;沙质草地植物群落δ13C高于其他3种草地(<0.05),且放牧提高了草地植物群落的δ13C(<0.01)。
从表4看出,封育和放牧下植物群落height最大的分别为针茅草原和草甸(<0.05),放牧极显著降低了4种草地植物群落的height(<0.01)。封育下,针茅草原植物群落的SLA小于其他3种草地(<0.05),而在放牧干扰下,沙质草地植物群落的SLA大于其他3种草地(<0.05),其中,草甸植物群落的SLA显著降低(<0.05)。封育下,针茅草原和疏林草地植物群落的LDMC大于草甸和沙质草地(<0.05),而在放牧干扰下,针茅草原植物群落的LDMC高于其他3种草地(<0.05),其中,草甸植物群落的LDMC显著升高(<0.05)。封育下,草甸和沙质草地植物群落的LA大于针茅草原和疏林草地(<0.05),而在放牧干扰下,只有草甸植物群落的LA大于其他3种草地(<0.05),放牧显著降低了草甸(<0.01)、针茅草原(<0.01)和沙质草地植物群落的LA(<0.05)。封育和放牧下沙质草地植物群落的δ13C大于其他3种草地(<0.05),其中,放牧极显著提高了疏林草地植物群落的δ13C(<0.01)。

表3 草地类型和管理方式对CWM的影响
注:不同小写字母表示不同草地CWM在<0.05水平上的差异;不同大写字母表示不同管理方式下CWM在<0.05水平上的差异,下同。
Note: Different small letters indicate multiple comparison of plant functional traits in community level in different grasslands at 0.05 level, different capital letters indicate multiple comparison of plant functional traits in community level in different management modes at 0.05 level, the same as below.

表4 放牧对不同草地CWM的影响
注:*, **分别表示不同管理下同一草地CWM在<0.05和<0.01水平上的差异。
Note: *, ** express multiple comparison of CWM of different treatment in same grassland at 0.05 and 0.01 level.
由表5可以看出,草地CWM之间有显著的相关关系。在封育和放牧下,植物群落SLA与LDMC极显著负相关(<0.01)。封育下,LA与LDMC极显著负相关(<0.01),LNC与LDMC显著正相关(<0.05),而放牧消除了以上的相关关系。在放牧干扰下,SLA与height、δ13C与height极显著负相关(<0.01),δ13C与SLA极显著正相关(<0.01)。
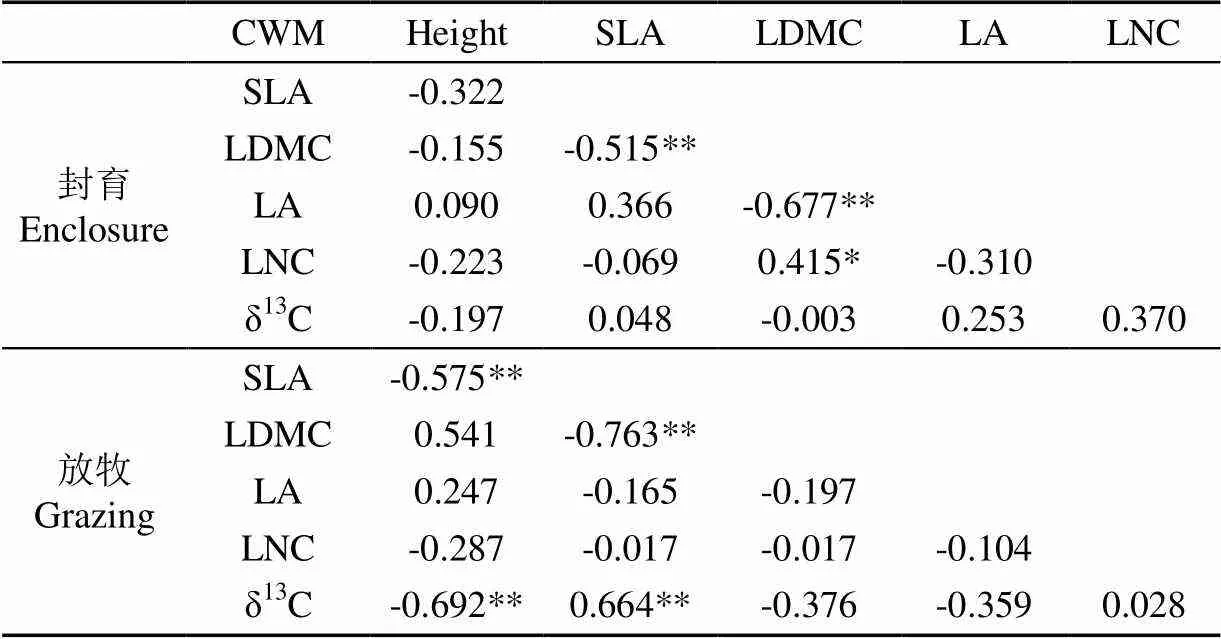
表5 草地CWM相关关系
3 讨 论
科尔沁沙地生态环境演化过程中,优势植物通过不断地权衡资源的分配和调节生理生态过程,从而在植物个体大小和叶片形态上形成了能够适应不同环境的植物功能性状[38,46]。我们的研究结果表明,不同草地植物群落功能性状之间有着明显的差异,说明了草地植物功能性状对生境变化发生了协同性响应,这与Zheng等的研究结果相一致[47]。科尔沁沙地中不同草地及其生境间的土壤特性存在较大的差异[48],导致了植物群落功能性状有所不同。针茅草原中优势物种为“针形”叶的多年生禾本科的大针茅,因而其植物群落高度较高、叶面积较小。沙质草地生产力低、土壤贫瘠,其优势植物大多为一二年生C4植物,较多年生C3植物而言,一二年生C4植物具有较强的光合生产能力和资源利用效率[49],其高SLA低LDMC的特点有助于利用有限的资源迅速完成生活史[50]。草甸中水肥条件相对良好,植物生长过程中受到的水分和养分限制较小,因而植物群落叶面积相对较大。在水分有限的条件下,植物为了生长和生存,从而提高了植物的水分利用效率[51-52]。沙质草地土壤含水量相对较低[48],植物群落中占优势的一二年生植物为了快速生长和繁殖,从而提高了叶片的δ13C值来适应相对干旱的土壤环境。
已有研究表明,长期放牧极大地改变着草地植物的物种组成和生活型变化[48]。本研究中,草甸、疏林草地和沙质草地在放牧干扰下出现了虎尾草、马唐和狗尾草等一二年生C4植物,说明了科尔沁沙地中长期的放牧明显地增加了草地生态系统中一二年生植物的优势,这与前人的研究结果相一致[7,53]。长期的放牧也极大地影响草地植物的功能性状[14],而且不同草地植物群落功能性状对放牧的响应有所不同[47]。草原植物矮化是长期过度放牧下植株变矮、叶片变短变窄、节间缩短等性状的集合[54]。在本研究中,不同草地植物群落在长期放牧下植物高度和叶面积显著降低,支持了草地植物应对践踏和啃食而产生的防御性响应[14]。长期放牧也导致了土壤保水和持水能力降低,从而提高草地植物群落的δ13C值。
此外,Cruz等的研究发现,15 a放牧处理后草地中以C4植物为优势,这些植物群落通过低的叶组织密度、高的比叶面积、高的光和效率,快速增长来恢复损失的组织,增强地上部的生长能力,从而使得植物具有更强的耐牧性[55],表现出植物对放牧干扰的“快速资源获得型策略”;也有研究表明,放牧导致了植物叶片具有低的SLA、叶片氮含量和高的LDMC,从而使得植物具有低的光合能力和养分周转速率,表现出植物对资源利用的“保守性策略”[14]。本研究的草甸植物群落在放牧干扰下,SLA显著降低,LDMC显著升高,属于“资源保持型”策略,主要原因可能是草甸中优势物种为多年生的禾本科植物,其植物群落对于放牧的抵抗性较强,主要通过降低光合速率来应对干扰。同时,LDMC较高的叶片,木质素和纤维素成分相应较高,叶片相对较硬,适口性较差且不利于反刍动物的消化代谢[14]。本研究中草甸植物群落在放牧干扰下LDMC升高,也是草地植物“避牧”的一种生存策略。植物群落化学计量特征对于放牧的响应存在明显的滞后性,植物群落作为一个整体需要在很长的时间尺度上做出反应[56-57],这也是本研究中叶片氮含量在草地类型和放牧下无显著差异的主要原因。
在以往的研究中SLA与LDMC之间表现出显著的负相关关系[23],其原因是LDMC越大,叶组织密度越高,限制了光和CO2在叶组织中的传导[58],导致光合速率降低、SLA变小。本研究中封育和放牧下草地植物群落SLA与LDMC的极显著负相关关系,与李玉霖等的研究结果相一致[24],说明SLA与LDMC的负相关关系没有受到放牧的干扰。长期放牧导致了土壤风蚀和土壤的贫瘠化,草地中植物为了适应土壤环境变化而具有较低height和较高水分的生长策略[32],因而形成了草地中SLA与height、δ13C与height的负相关关系以及δ13C与SLA的正相关关系。这些结果表明了科尔沁沙地中草地植物为了适应放牧干扰过程,采取了资源利用率和水分利用率之间的权衡策略。本研究仅以一年的试验数据揭示了不同草地植物群落功能性状对生境变化和放牧响应的差异性,但是一年的试验周期相对较短,其研究结果可能存在偶然性。因此,有必要进行更长时间的观测和调查,进一步探究长期放牧和环境变化对不同草地植物功能性状及其功能型组成的影响。
4 结 论
放牧降低了草地植物群落的高度和叶面积,降低了沙质草地中多年生植物的相对生物量,提高了草地植物群落的水分利用率。在土壤资源相对贫瘠和生产力较低的沙质草地中,植物通过高的比叶面积、低叶干物质含量的策略来充分利用有限的资源而迅速完成生活史。放牧干扰下草甸植物群落“耐牧”和“避牧”的策略为低的比叶面积和高的叶干物质含量。植物群落高度、比叶面积、叶干物质含量、叶面积、水分利用率为放牧干扰的敏感性状,而植物群落叶片氮含量在不同草地类型和管理水平上均无显著差异。放牧导致草地植物群落高度降低、水分利用效率增加,进而形成了比叶面积与高度、水分利用率与高度的负相关关系以及水分利用率与比叶面积的正相关关系,但比叶面积与叶干物质含量间的负相关关系不受放牧的干扰,这些结果表明了草地植物群落功能性状在应对放牧干扰时权衡并形成了特定的生长对策。然而,研究放牧对草地植物群落功能性状的影响,也需要充分考虑草地生态系统的初始状况。
[1] 方精云,杨元合,马文红,等. 中国草地生态系统碳库及其变化[J]. 中国科学:生命科学,2010,40(7):566-576.
Fang Jingyun, Yang Yuanhe, Ma Wenhong, et al. Ecosystem carbon stocks and their changes in China’s grasslands[J]. Sci China Life Sci, 2010, 40(7): 566-576. (in Chinese with English abstract)
[2] 赵哈林,大黑俊哉,李玉霖,等. 科尔沁沙质草地植物群落的放牧退化及其自然恢复过程[J]. 中国沙漠,2009,29(2):229-235.
Zhao Halin, Okuro Toshiya, Li Yulin, et al. Changes of plant community in grazing and restoration processes in Horqin Sand Land, Inner Mongolia[J]. Journal of Desert Research, 2009, 29(2): 229-235. (in Chinese with English abstract)
[3] Manouchehr D, Gifford G F. Influence of vegetation, rock cover, and trampling on infiltration rates and sediment production[J]. Jawra Journal of the American Water Resources Association, 1980, 16(6): 979-986.
[4] Haynes R J, Williams P H. Nutrient cycling and soil fertility in the grazed pasture ecosystem[J]. Advances in Agronomy, 1993, 49(8): 119-199.
[5] Krzic M, Broersma K, Thompson D J, et al. Soil properties and species diversity of grazed crested wheatgrass and native rangelands[J]. Journal of Range Management, 2000, 53(3): 353-358.
[6] 侯扶江,杨中艺. 放牧对草地的作用[J]. 生态学报,2006,26(1):244-264.
Hou Fujiang, Yang Zhongyi. Effets of grazing of livestock on grassland[J]. Acta Ecologica Sinica, 2006, 26(1): 244-264. (in Chinese with English abstract)
[7] 孙大帅. 不同放牧强度对青藏高原东部高寒草甸植被和土壤影响的研究[D]. 兰州:兰州大学,2012.
Sun Dashuai. Studies on the Effects of Grazing Intensity on Vegetation and Soil in Alpine Meadow on the Eastern Qinghai-Tibetan Plateau[D]. Lanzhou: Lanzhou University, 2012. (in Chinese with English abstract)
[8] 高英志,韩兴国,汪诗平. 放牧对草原土壤的影响[J]. 生态学报,2004,24(4):790-797.
Gao Yingzhi, Han Xingguo, Wang Shiping. The effects of grazing on grassland soils[J]. Acta Ecologica Sinica, 2004, 24(4): 790-797. (in Chinese with English abstract)
[9] Zheng S X, Ren H Y, Lan Z C, et al. Effects of grazing on leaf traits and ecosystem functioning in Inner Mongolia grasslands: Scaling from species to community[J]. Biogeosciences Discussions, 2009, 6(5): 1117-1132.
[10] 李西良,侯向阳,吴新宏,等. 草甸草原羊草茎叶功能性状对长期过度放牧的可塑性响应[J]. 植物生态学报,
2014,38(5):440-451.
Li Xiliang, Hou Xiangyang, Wu Xinhong, et al. Plastic responses of stem and leaf functional traits into long-term grazing ina meadow steppe[J]. Chinese Journal of Plant Ecology, 2014, 38(5): 440-451. (in Chinese with English abstract)
[11] Bussotti F. Functional leaf traits, plant communities and acclimation processes in relation to oxidative stress in trees: A critical overview[J]. Global Change Biology, 2008, 14(11): 2727-2739.
[12] Cornelissen J H C. Foliar nutrients in relation to growth, allocation and leaf traits in seedlings of a wide range of woody plant species and types[J]. Oecologia, 1997, 111(4): 460-469.
[13] Garnier E, Laurent G, Bellmann A, et al. Consistency of species ranking based on functional leaf traits[J]. New Phytologist, 2001, 152(1): 69-83.
[14] 赵娜,赵新全,赵亮,等. 植物功能性状对放牧干扰的响应[J]. 生态学杂志,2016,35(7):1916-1926.
Zhao Na, Zhao Xinquan, Zhao Liang, et al. Progress in researches of response of plant functional traits to grazing disturbance[J].Chinese Journal of Ecology, 2016, 35(7): 1916-1926. (in Chinese with English abstract)
[15] Reich P B, Walters M B, Ellsworth D S. Leaf life-span in relation to leaf, plant, and stand characteristics among diverse ecosystems[J]. Ecological Monographs, 1992, 62(3): 365-392.
[16] 刘金环,曾德慧,Don Koo LEE. 科尔沁沙地东南部地区主要植物叶片性状及其相互关系[J]. 生态学杂志,2006,25(8):921-925.
Liu Jinhuan, Zeng Dehui, Don Koo LEE. Leaf traits and their interrelationships of main plant species in southeast Horqin sandy land[J]. Chinese Journal of Ecology, 2006, 25(8): 921-925. (in Chinese with English abstract)
[17] Givnish T J. 1-plant stems: Biomechanical adaptation for energycapture and influence on species distributions[J]. Plant Stems, 1995: 3-49.
[18] Lavorel S, Grigulis K. How fundamental plant functional trait relationships scale-up to trade-offs and synergies in ecosystem services[J]. Journal of Ecology, 2012, 100(1): 128-140.
[19] Lienin P, Kleyer M. Plant trait responses to the environment and effects on ecosystem properties[J]. Basic & Applied Ecology, 2012, 13(4): 301-311.
[20] Conti G, Díaz S. Plant functional diversity and carbon storage-an empirical test in semi-arid forest ecosystems[J]. Journal of Ecology, 2013, 101(1): 18-28.
[21] Meziane D, Shipley B. Interacting determinants of specific leaf area in 22 herbaceous species: Effects of irradiance and nutrient availability[J]. Plant Cell & Environment, 1999, 22(5): 447-459.
[22] Poorter H, Jong R D. A comparison of specific leaf area, chemical composition and leaf construction cost of field plants from 15 habitats differing in productivity[J]. New Phytologist, 1999, 143(1): 163-176.
[23] Garnier E, Shipley B, Roumet C, et al. A standardized protocol for the determination of specific leaf area and leaf dry matter content[J]. Functional Ecology, 2001, 15(5): 688-695.
[24] 李玉霖,崔建垣,苏永中. 不同沙丘生境主要植物比叶面积和叶干物质含量的比较[J]. 生态学报,2005,25(2):304-311.
Li Yulin, Cui Jianyuan, Su Yongzhong. Specific leaf area and leaf dry matter content of some plants in different dune habitats[J]. Acta Ecologica Sinica, 2005, 25(2): 304-311. (in Chinese with English abstract)
[25] Kazakou E, Vile D, Shipley B, et al. Co‐variations in litter decomposition, leaf traits and plant growth in species from a Mediterranean old-field succession[J]. Functional Ecology, 2006, 20(1): 21-30.
[26] Cortez J, Garnier E, Pérez-Harguindeguy N, et al. Plant traits, litter quality and decomposition in a Mediterranean old-field succession[J]. Plant & Soil, 2007, 296(1/2): 19-34.
[27] Dechaine J M, Brock M T, Iniguezluy F L, et al. Quantitative trait loci × environment interactions for plant morphology vary over ontogeny in Brassica rapa[J]. New Phytologist, 2014, 201(2): 657-669.
[28] Feng Y L, Fu G L, Zheng Y L. Specific leaf area relates to the differences in leaf construction cost, photosynthesis, nitrogen allocation, and use efficiencies between invasive and noninvasive alien congeners[J]. Planta, 2008, 228(3): 383.
[29] Wilson P J, Thompson K, Hodgson J G. Specific leaf area and leaf dry matter content as alternative predictors of plant strategies[J]. New Phytologist, 1999, 143(1): 155-162.
[30] Poorter H, Niinemets U, Poorter L, et al. Causes and consequences of, variation in leaf mass per area (LMA): A meta-analysis[J]. New Phytologist, 2009, 182(3): 565.
[31] Milcu A, Roscher C, Gessler A, et al. Functional diversity of leaf nitrogen concentrations drives grassland carbon fluxes[J]. Ecology Letters, 2014, 17(4): 435-444.
[32] Knight J D, Livingston N J, Kessel C V. Carbon isotope discrimination and water-use efficiency of six crops grown under wet and dryland conditions[J]. Plant Cell & Environment, 1994, 17(2): 173-179.
[33] 苗艳明,吕金枝,毕润成. 不同功能型植物叶氮含量与光合特性的关系研究[J]. 植物研究,2012(4):425-429.
Miao Yanming, Lv Jinzhi, Bi Runcheng. Relationships between leaf nitrogen content and photosynthetic characteristics in different plant functional types[J]. Bulletin of Botanical Research, 2012(4): 425-429. (in Chinese with English abstract)
[34] 赵哈林,赵学勇,张铜会,等. 科尔沁沙地沙漠化过程及其恢复机理[M]. 北京:海洋出版社,2003.
[35] 王涛,吴薇,薛娴,等. 近50年来中国北方沙漠化土地的时空变化[J]. 地理学报,2004,59(2):203-212.
Wang Tao, Wu Wei, Xue Xian, et al. Spatial-temporal changes of sandy desertified land during last 5 decades in Northern China[J]. Acta Geographica Sinica, 2004, 59(2): 203-212. (in Chinese with English abstract)
[36] 孙殿超,李玉霖,赵学勇,等. 放牧及围封对科尔沁沙质草地土壤呼吸的影响[J]. 中国沙漠,2015,35(6):1620-1627.
Sun Dianchao, Li Yulin, Zhao Xueyong, et al. Effects of grazing and enclosure on soil respiration rate in the Horqin sandy grassland[J]. Journal of Desert Research, 2015, 35(6): 1620-1627. (in Chinese with English abstract)
[37] 吕朋,左小安,张婧,等. 放牧强度对科尔沁沙地沙质草地植被的影响[J]. 中国沙漠,2016,36(1):34-39.
Lü Peng, Zuo Xiaoan, Zhang Jing, et al. Effects of grazing intensity on vegetation in sandy grassland of Horqin[J]. Journal of Desert Research, 2016, 36(1): 34-39. (in Chinese with English abstract)
[38] Zuo Xiaoan, Zhao Xueyong, Zhao Halin, et al. Scale dependent effects of environmental factors on vegetation pattern and composition in Horqin Sandy Land, Northern China[J]. Geoderma, 2012(173/174): 1-9.
[39] 张铜会,赵哈林,大黑俊哉,等. 沙质草地连续放牧后某些土壤性质的变化[J]. 中国草地学报,2003,25(1):9-12.
Zhang Tonghui, Zhao Halin, Okuro Toshiya, et al. Variations of soil characterics after successive grazing in keerqin sandy land, Inner Mongolia[J]. Grassland of China, 2003, 25(1): 9-12. (in Chinese with English abstract)
[40] Conti G, Diaz S. Plant functional diversity and carbon storage-an empirical test in semi-arid forest ecosystems[J]. Journal of Ecology, 2013, 101(1): 18-28.
[41] Jhc C, Lavorel S, Garnier E, et al. A handbook of protocols for standardised and easy measurement of plant functional traits worldwide[J]. Australian Journal of Botany, 2003, 51(4): 335-380.
[42] Spasojevic M J, Grace J B, Harrison S, et al. Functional diversity supports the physiological tolerance hypothesis for plant species richness along climatic gradients[J]. Journal of Ecology, 2014, 102(2): 447-455.
[43] Garnier E, Cortez J, Billès G, et al. Plant Functional markers capture ecosystem properties during secondary succession[J]. Ecology, 2008, 85(9): 2630-2637.
[44] Naeem S, Li S. Biodiversity enhances ecosystem reliability[J]. Nature International Weekly Journal of Science, 1997, 390(6659): 507-509.
[45] Curtis J T, Mcintosh R P. An upland forest continuum in the Prairie-Forest Border Region of Wisconsin[J]. Ecology, 1951, 32(3): 476-496.
[46] Zuo X, Zhou X, Lv P, et al. Testing associations of plant functional diversity with carbon and nitrogen storage along a restoration gradient of sandy grassland[J]. Frontiers in Plant Science, 2016, 7(e17476): 189.
[47] Zheng Shuxia, Ren Haiyan, Lan Zhichun, et al. Effects of grazing on leaf traits and ecosystem functioning in Inner Mongolia grasslands: scaling from species to community[J]. Biogeosciences, 2010, 7(3): 1117-1132.
[48] Zhang Jing, Zuo Xiaoan, Zhou Xin, et al. Long-term grazing effects on vegetation characteristics and soil properties in a semiarid grassland, northern China[J]. Environmental Monitoring & Assessment, 2017, 189(5): 216.
[49] Ripley B, Martin T. Experimental investigation of fire ecology in the C3and C4subspecies of Alloteropsissemialata[J]. Journal of Ecology, 2010, 98(5): 1196-1203.
[50] 周欣,左小安,赵学勇,等. 科尔沁沙地中南部34种植物叶功能性状及其相互关系[J]. 中国沙漠,2015,35(6):1489-1495.
Zhou Xin, Zuo Xiaoan, Zhao Xueyong, et al. Plant functional traits and interrelationships of 34 plant species in south central Horqin Sandy Land, China[J]. Journal of Desert Research, 2015, 35(6): 1489-1495. (in Chinese with English abstract)
[51] 阮成江,李代琼. 黄土丘陵区沙棘气孔导度及其影响因子[J]. 西北植物学报,2001,21(6):1078-1084.
Ruan Chengjiang, Li Daiqiong. Stomatal conductance and influence factors of seabuckthorn in Loess Hilly Region[J]. Acta Botanica Boreali-Occidentalia Sinica, 2001, 21(6): 1078-1084. (in Chinese with English abstract)
[52] 孙惠玲,马剑英,王绍明,等. 准噶尔盆地荒漠植物碳同位素组成研究[J]. 中国沙漠,2007,27(6):972-976.
Sun Huiling, Ma Jianying, Wang Shaoming, et al. The study of stable carbon isotope composition in desert plants of Junggar Basin[J]. Journal of Desert Research, 2007, 27(6): 972-976. (in Chinese with English abstract)
[53] Díaz S, Lavorel S, Mcintyre S, et al. Plant trait responses to grazing- a global synthesis[J]. Global Change Biology, 2007, 13(2): 313-341.
[54] 王炜,梁存柱,刘钟龄,等. 草原群落退化与恢复演替中的植物个体行为分析[J]. 植物生态学报,2000,24(3):268-274.
Wang Wei, Liang Cunzhu, Liu Zhongling, et al. Analysis of the plant individual behavior during the degradation and restoring succession in steppe community[J]. Acta Phytoecologica Sinica, 2000, 24(3): 268-274. (in Chinese with English abstract)
[55] Cruz P, Quadros F L F D, Theau J P, et al. Leaf traits as functional descriptors of the intensity of continuous grazing in native grasslands in the South of Brazil[J]. Rangeland Ecology & Management, 2010, 63(3): 350-358.
[56] Coffin D P, Laycock W A, Lauenroth W K. Disturbance intensity and above-and belowground herbivory effects on long-term (14y) recovery of a semiarid grassland[J]. Plant Ecology, 1998, 139(2): 221-233.
[57] Milchunas D G. Livestock Grazing: Animal and plant biodiversity of shortgrass steppe and the relationship to ecosystem function[J]. Oikos, 1998, 83(83): 65-74.
[58] Parkhurst DF. Diffusion of CO2and other gases inside leaves[J]. New Phytologist, 1994, 126(3): 449-479.
Response of plant community functional traits in different grasslands to enclosure and grazing in Horqin Sandy Land
Zhang Jing1,2,3, Zuo Xiaoan1,2※, Yang Yang1, Yue Xiyuan1, Zhang Jing1, Lü Peng1, Zhou Xin2, Lian Jie2, Liu Liangxu1, He Zhaoquan2
(1.,,730000,; 2.,,,730000,; 3.,100049)
Functional traits as a link between plants and environment, express plants’ physiological, phenological and morphological adaptive strategy when plants face environment changes. In recent years, some trait-based means show that plant functional traits are some of the most reliable predictors of ecosystem, increasingly used to assess and predict the ecosystem feature and succession. Grazing is one of the most common utilization methods for pasture, affecting the semiarid and arid grassland ecosystems in various ways.It not only alters individual plant growth and population dynamics, but also changes soil properties, ultimately changing the vegetation composition and structure. The influence of grazing on plant communities is much greater than that of individual plant.At the community level, herbivores have extensive range of food intake, and different plant species have different response to nibbling, and therefore, it is more reasonable to explore the influence of grazing at the community level.Based on the changes of 18 dominant species in 4 different types of grassland under grazing and enclosure in Horqin sandy land,in this study, we compared the plant community functional traits in the meadow,steppe, scattered tree grassland and sandy grassland. We measured the 6 functional traits related to the process of plant growth and photosynthesis in different types of grassland under the condition of enclosure and grazing, and these traits included the plant height, specific leaf area(SLA), leaf dry matter content(LDMC), leaf area(LA), leaf nitrogen content(LNN) and leaf carbon isotopes(δ13C). The results showed that:1) Long term grazing increased the species richness and dominance of annuals and C4species, as well as decreased the relative biomass of perennials; 2) The SLA and δ13C in sandy grassland were higher than the other 3 types of grassland, while LDMC showed a reversed trend; 3) Grazing decreased the plant height and LA and increased the δ13C, while the other functional traits in different grasslands did not differ due to grazing; 4) Correlation relationship analysis showed that SLA was significantly and negatively correlated with LDMC in different types of grassland under both grazing and enclosure, suggesting that long term grazing did not change the negative associations of SLA and LDMC; however, long term grazing resulted in the significant and negative correlations between plant height, SLA and δ13C, as well as a significant and positive correlation between SLA and δ13C. In Horqin sandy land, long term grazing increased the proportion of annuals and C4species, and these species had the lower plant height and LA and the higher water use efficiency, which illustrates that the grassland community adapts to the long term grazing through the change in species competition structure and function strategy trade off. Therefore, to improve the functional traits of plant community by reducing grazing pressure is helpful and meaningful to the vegetation restoration and sustainable management in the degraded grasslands.
plants; growth; physiology; grass land; grazing;plant community traits; enclosure
10.11975/j.issn.1002-6819.2017.24.034
X17
A
1002-6819(2017)-24-0261-08
2017-07-04
2017-12-14
国家自然科学基金项目(41622103,41571106);国家重点研发计划重点专项课题(2016YFC0500506)
张 晶,女,甘肃榆中人,博士生,主要从事植物生态方面的研究。Email:zhangjing_881014@163.com
左小安,男,博士,研究员,主要研究方向为干旱区生态格局与过程。Email:zuoxa@lzb.ac.cn
张 晶,左小安,杨 阳,岳喜元,张 婧,吕 朋,周 欣,连 杰,刘良旭,何钊全. 科尔沁沙地草地植物群落功能性状对封育和放牧的响应[J]. 农业工程学报,2017,33(24):261-268. doi:10.11975/j.issn.1002-6819.2017.24.034 http://www.tcsae.org
Zhang Jing, Zuo Xiaoan, Yang Yang, Yue Xiyuan, Zhang Jing, Lü Peng, Zhou Xin, Lian Jie, Liu Liangxu, He Zhaoquan. Response of plant community functional traits in different grasslands to enclosure and grazing in Horqin Sandy Land[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2017, 33(24): 261-268. (in Chinese with English abstract) doi:10.11975/j.issn.1002-6819.2017.24.034 http://www.tcsae.org
