乙肝肝硬化背景下T2WI结合DWI对LI-RADS分类诊断效能的研究
2018-01-09王志鹏高凤国刘秀颀王晓博杨正汉
王志鹏 高凤国 刘秀颀 王晓博 冯 宝 杨正汉
乙肝肝硬化背景下T2WI结合DWI对LI-RADS分类诊断效能的研究
王志鹏1高凤国2刘秀颀3王晓博4冯 宝2杨正汉5
目的乙肝肝硬化背景下,探讨肝脏影像报告与数据系统(LI-RADS,2014版)定义的2个辅助征象(T2WI轻-中度高信号与扩散受限)对肝细胞癌(HCC)的诊断价值。资料与方法回顾性分析北京友谊医院2012年1月—2016年11月69例HCC患者共77个分类到LI-RADS 3~5的病灶,大小1.1cm×0.7cm~12.7cm×9.1cm。图像包括MRI平扫加多期动态增强扫描。由2名影像科医师分析图像,如有分歧结合肝脏容积加速采集加多期动态增强扫描达成共识。比较T2WI和扩散加权成像(DWI)序列的噪声比(CNR)及表观扩散系数(ADC)图的差异,以及两种征象的识别是否一致。结果乙肝肝硬化背景下,T2WI轻-中度高信号与扩散受限对识别分类到LI-RADS 3~5的病灶差异无统计学意义(P>0.05),但是b=600s/mm2较b=0的DWI识别率更高(70.1%比61.0%,P<0.05)。CNR在DWI(b=0、600s/mm2)序列上均较T2WI序列上高(P<0.01)。病灶最大径≥2cm较最大径<2cm病灶的ADC值更低[(1.37±0.51)×10-3mm2/s比(1.57±0.37)×10-3mm2/s,P<0.05]。结论T2WI轻 -中度高信号和扩散受限检出病灶的敏感性方面无显著差异。但是由于CNR不同,b=600s/mm2的DWI对病灶显示更加明显,在实际工作中可以优先观察。
癌,肝细胞;肝炎,乙型;肝硬化;磁共振成像;扩散加权成像;肝脏影像报告与数据系统
肝细胞癌(hepatocellular carcinoma,HCC)是肝脏最常见的原发恶性肿瘤,全球约75%的新发病例发生在贫困和发展中国家,50%以上的新发和死亡病例发生在中国[1-2]。影像学特征对HCC的早期诊断至关重要[3]。Meta分析表明,MRI较CT增强扫描对HCC的诊断敏感性高[4]。扩散加权成像(DWI)在HCC的诊断与治疗中的应用受到广泛关注[5-6]。美国放射学会(ACR)于2011年制订了肝脏影像报告与数据系统(liver imaging reporting and data system,LI-RADS),其目的是使HCC的影像诊断规范化、标准化[7-8]。LI-RADS分类系统定义了5个主要征象,包括大小、动脉期高强化、“廓清”表现、“包膜”表现和超阈值生长。还有13个倾向恶性及7个倾向良性的辅助征象。其中T2WI轻-中度高信号、扩散受限为2个识别率较高的倾向恶性的辅助征象。乙肝肝硬化背景下,对2种征象的认识尚未达成一致,本研究拟探讨乙肝肝硬化背景下2种征象的诊断意义。
1 资料与方法
1.1 研究对象 收集2012年1月-2016年11月北京友谊医院经穿刺活检(6例)或外科手术(63例)病理证实的HCC患者69例共77个病灶,其中61例单发,8例有2个病灶,男59例,女10例;年龄37~80岁,平均(56.5±8.6)岁。病灶最大截面范围1.1cm×0.7cm~12.7cm×9.1cm,平均最大径(3.4±2.0)cm。所有患者均行MRI平扫及动态增强扫描,包括T1WI、T2WI、DWI(b=0、600s/mm2)、肝脏容积加速采集加多期动态增强扫描,以HCC病灶之外相对正常的肝组织(肝硬化的肝脏)作为肝硬化背景。所有患者的目标图像均为治疗前最近一次检查的图像,即在检查前未行任何针对HCC的治疗。
1.2 仪器与方法 采用GE Medical System,LLC设备,规格型号为1.5T Signa HDxt。RTr-FSET2WI+FS采集参数:TR 7500ms,翻转角90°,TE 86.0ms,回波次数 EC1/1,带宽 41.7kHz,矩阵大小 288×224,视野(FOV)38.0cm×30.4cm,层厚5.6mm,层间距1.0mm。RTr-SE/EPI DWI采集参数:TR 6667ms,TE 68.7ms,回波次数EC1/1,带宽250kHz,矩阵128×128,FOV 38cm×38cm,层厚6mm,层间距1.0mm。肝脏容积加速采集+C采集参数:TR 3.3ms,TE 1.6ms,TI 7.0ms,回波次数EC1/1,带宽83.3kHz,矩阵288×170,FOV 40cm×36cm,层厚3.8mm,层间距-1.9mm。增强扫描采用钆喷酸葡胺(马根维显)注射液,按0.2ml/kg经肘静脉以2~3ml/s注射,注射对比剂后分别从15~20s、50~60s、180s、300s开始行动脉早、晚期、门静脉期、平衡期及延迟期扫描。
1.3 图像分析 本研究以LI-RADS(2014版)为依据,HCC最终诊断以穿刺活检或外科手术病理结果为“金标准”。记录分类到LI-RADS 3~5病灶的大小、部位、分类等特征,不能把T2WI的信号强度和是否扩散受限作为辅助征象调整分类。由于病灶最大径<1cm的测量误差较大,为了最大限度地减小误差,最大径<1cm的病灶不予入组,为了避免定位混淆,每一例患者肝内HCC数目不多于2个。
所有图像均以DICOM格式在科室工作站的PACS系统上分析。由2位有5年以上工作经验的主治医师采用双盲法分析,如有分歧,则结合动态增强图像达成一致。分析T2WI图像时用类似于分析DWI图像的方法用高、等、低信号3种描述记录信号强度,若有异议,两者讨论达成一致。2位医师独立评价图像受呼吸伪影、动脉搏动伪影及磁敏感伪影的影响程度,可分为4个等级,1:无或很小;2:轻微;3:中度;4:严重。1级指图像质量非常好;2级指图像质量合格,尽管有瑕疵但不影响图像分析;3级指图像质量影响征象的判读或不能有效地识别;4级指图像质量很差,表现征象完全无法识别。
在 T2WI、DWI(b=0、b=600s/mm2)图像上对病灶和同层面周围肝组织区域划定感兴趣区(ROI)[9]。根据病灶大小ROI取值范围为0.1~1.6cm2,测量区域不能包括病灶以外成分。每个病灶ROI的大小在T2WI和DWI上完全相等。为了保持ROI的大小不变,每个病灶测量时ROI仅画1次,拖动到需要测量的区域,取值,测量时ROI尽量选择信号强度比较均匀的区域,避开大血管、信号强度不稳定区和伪影。相邻肝组织的信号强度取2次ROI测值的平均值。根据公式(1)计算病变和周围肝组织的对比噪声比(CNR)。
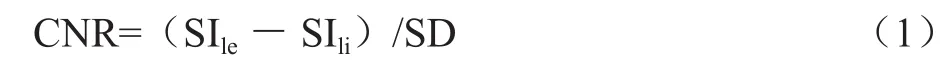
其中,SIle为病变信号强度,SIli为周围肝组织信号强度,SD为周围肝组织信号强度的标准差[10-11]。病灶在T2WI和高b值DWI上为高信号时方可使用此公式定量分析。
1.4 统计学方法 采用SPSS 19.0软件,不同序列对病灶的检出率比较采用χ2检验,T2WI、DWI(b=0、600s/mm2)的CNR比较采用配对资料t检验,病灶最大径≥2cm、病灶最大径<2cm和肝组织的ADC值比较采用配对资料t检验,P<0.05表示差异有统计学意义。
2 结果
2.1 病变检出率、一致性和图像质量 69例患者共77个病灶,其中38个病灶分类到LI-RADS 5,25个病灶分类到LI-RADS 4,4个病灶分类到LI-RADS 3。2位医师在不同序列上对病灶的检出率比较见表1。b=600s/mm2较b=0的DWI对病灶检出率高,差异有统计学意义(P<0.05)。b=600s/mm2较b=0的DWI分类到LI-RADS 3~5的病灶检出率更高,差异有统计学意义(P<0.01),见图1、2。

表1 T2WI和DWI(b=0、600s/mm2)对77个HCC病灶的检出率比较[n(%)]
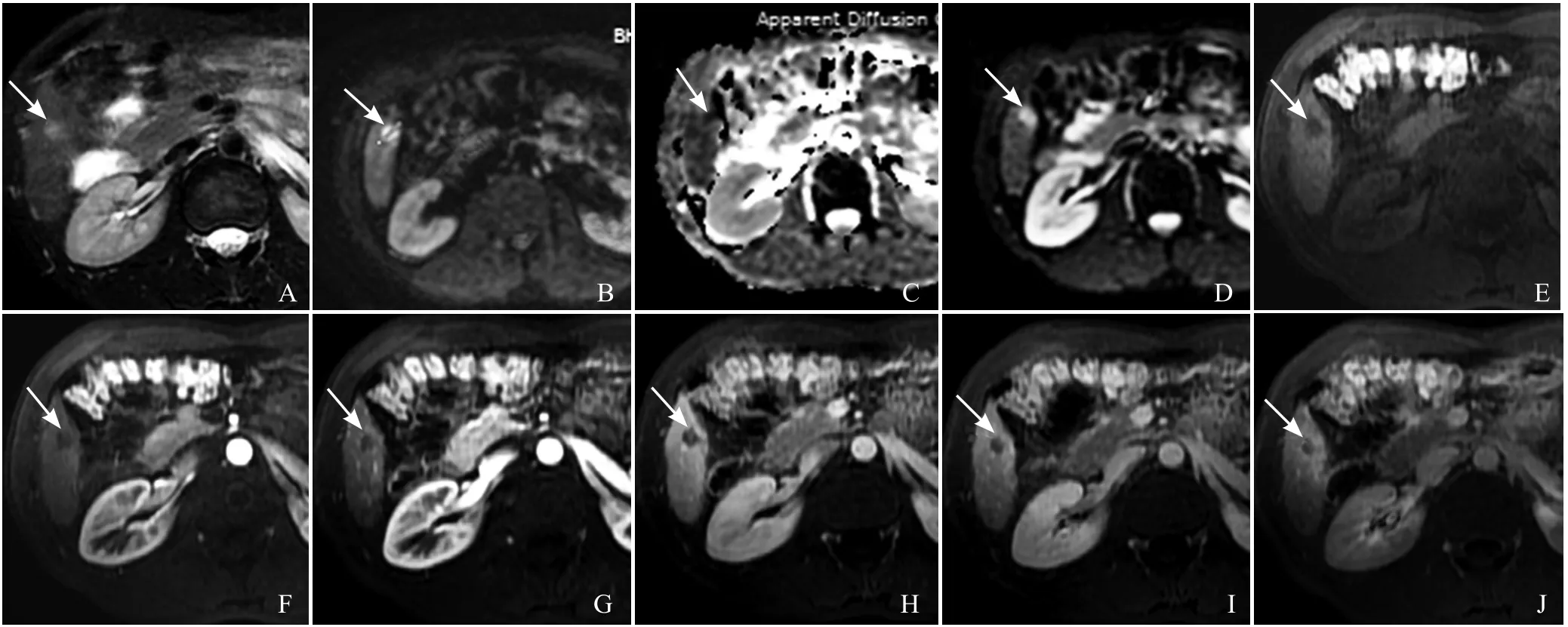
图1 男,37岁,低分化HCC。肝S5直径约1.5cm类圆形结节(箭)。T2WI呈轻-中度高信号,DWI(b=0)呈高信号,ADC值较低,T1WI呈低信号,医师1分类到LI-RADS 4,医师2分类到LI-RADS 3,经协商分类到LI-RADS 4。A为T2WI图像,B为b=600s/mm2图像,C为b=0图像,D为ADC图,E为T1WI图像,F为动脉早期图像,G为动脉晚期图像,H为门静脉期图像,I为平衡期图像,J为5min延迟期图像
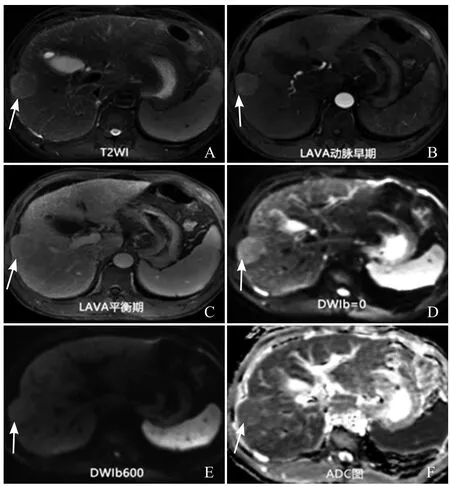
图2 男,49岁,中分化HCC。T2WI示肝S5、8交界区一最大界面约3.2cm×3.9cm呈轻-中度高信号病灶(箭,A);动脉期高强化病灶(箭,B);可见“包膜”表现(箭,C);DWI(D、E)、ADC图(F)示扩散受限(箭)。影像诊断为LIRADS 5,病理结果为中分化HCC
T2WI与DWI b=0序列对病灶检出率比较,差异无统计学意义(P>0.05);T2WI、DWI(b=0、b=600s/mm2)对病灶检出率比较,差异亦无统计学意义(P>0.05),即具有高度一致性。
2.2 CNR和ADC图T2WI或 DWI(b=0、b=600s/mm2)发现的67个病灶定量分析表明,DWI(b=0、b=600s/mm2)的CNR较T2WI高,差异有统计学意义(P<0.01),见图3、4及表2。两b值间CNR无明显差异。同一序列不同LI-RADS分类间的CNR无明显差异。
病灶的ADC值和肝背景的ADC值比较,差异无统计学意义(P>0.05),见表3。按病灶最大径分为最大径<2cm和最大径≥2cm两组,结果显示,病灶最大径≥2cm病灶的ADC值较病灶最大径<2cm低,差异有统计学意义(P<0.05);最大径<2cm病灶的ADC值较肝背景的ADC值高,差异有统计学意义(P<0.05)。
共10个病灶在DWI(b=0、b=600s/mm2)及T2WI上均未被明确发现,其中3个分类到LI-RADS 3,4个分类到LI-RADS 4,3个分类到LI-RADS 5。
3 讨论
目前LI-RADS运用越来越广泛,尤其是在欧美国家。LI-RADS诊断流程除根据主要征象外,结合次要征象对病灶评价也十分重要。Piana等[12]以动脉期高强化、廓清表现及扩散受限等为诊断标准进行比较,结果表明乙肝肝硬化背景下,通用的影像诊断标准发现HCC的敏感性降低,在体现HCC的特征方面也不是很典型,增加DWI序列提高了诊断的敏感性。本研究在乙肝肝硬化背景下,比较HCC在DWI(b=0、600s/mm2)和T2WI序列上的检出率,结果表明DWI序列发现HCC病灶比T2WI序列敏感、信号强度更显著。67个病灶中,3个序列的CNR呈递增趋势,T2WI的CNR最低,DWI(b=600s/mm2)的 CNR最高,与 Piana等[12]的研究结果一致,均表明在肝硬化背景下DWI诊断HCC的重要性,研究过程中均以病灶最大径≥1cm者为研究对象,均以组织病理学为确诊HCC的依据。b=0的DWI无梯度场的情况下,主要体现T2成分,仅比单次激发快速自旋回波序列的T2WI的回波时间稍短,随着b值增高,如b=600s/mm2的DWI,可以使肝内局灶病变相邻的小血管和毛细血管的信号减低,病变的信号增加,从而提高病灶检出的敏感性[13]。肝内非HCC病灶,如转移瘤、肝内胆管细胞癌等扩散也受限,高b值DWI发现病灶的敏感性显著高于低b值DWI[13-15]。本研究中,DWI(b=0)对病灶的检出率为58.4%、57.1%,DWI(b=600s/mm2)对病灶的检出率为68.8%、74.0%。Zech等[13]从成像原理角度说明DWI的成像原理及与T2WI的关系。Taouli等[16]研究表明,扩散受限在区分肝脏局灶病变良恶性方面有应用价值,采用2个(0、500s/mm2)和4个(0、134、267、400s/mm2)b值的DWI,且以病灶最大径≥1cm为纳入标准。本研究与Taouli等[16]的研究结果一致,再次证明扩散受限对肝脏局灶病变的诊断价值,高b值的DWI敏感性较高。病灶的发现依赖于图像清晰度,图像清晰度越高,越有利于发现病变,病变和周围肝组织CNR高的图像能够体现病变的特点。在肝脏扫描方案中2个b值的DWI很有必要。
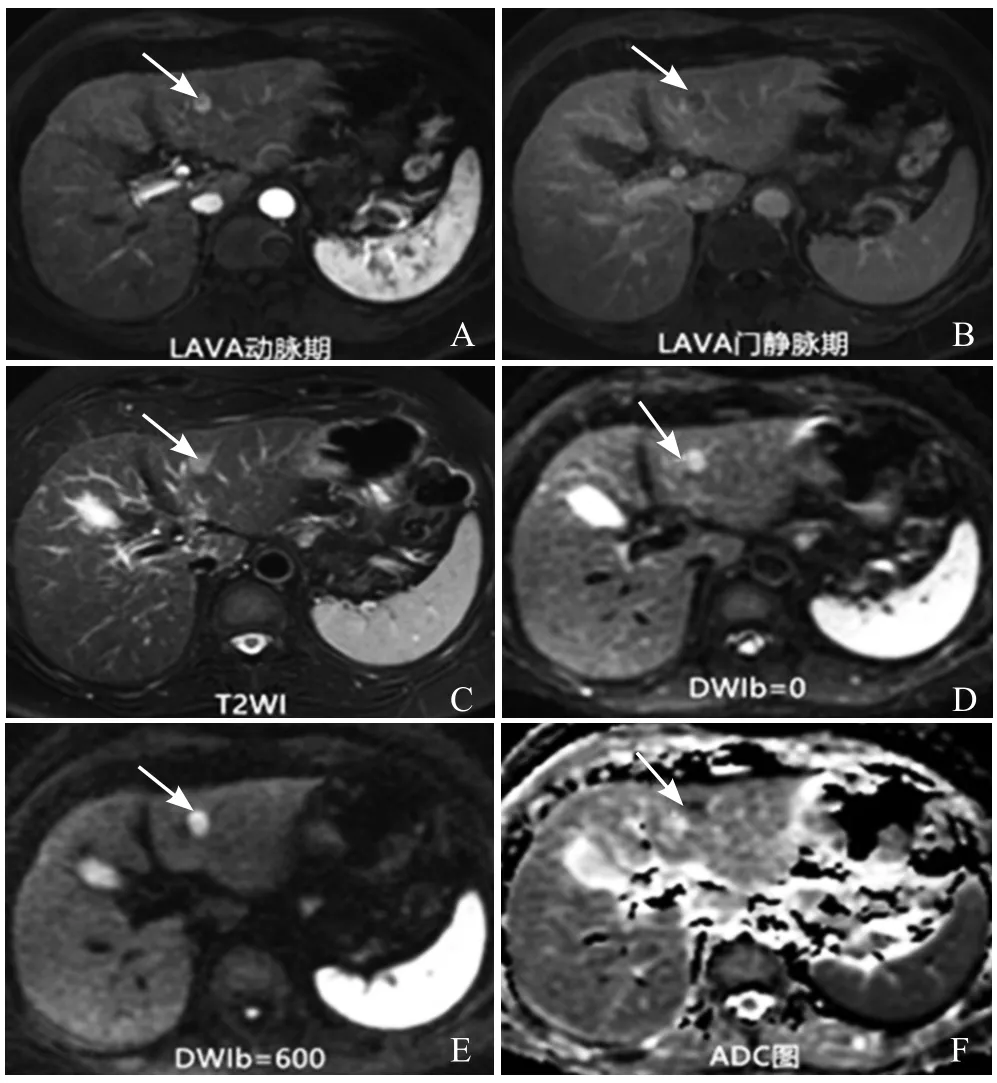
图3 女,60岁,中分化HCC。肝S3一大小约1.1cm×1.2cm动脉期高强化结节(箭,A);门静脉期可见“廓清”和“包膜”表现(箭,B);T2WI(C)、DWI(b=0、b=600s/mm2,D、E)和ADC图(F)示扩散受限(箭)。影像诊断LI-RADS 5,病理结果为中分化HCC
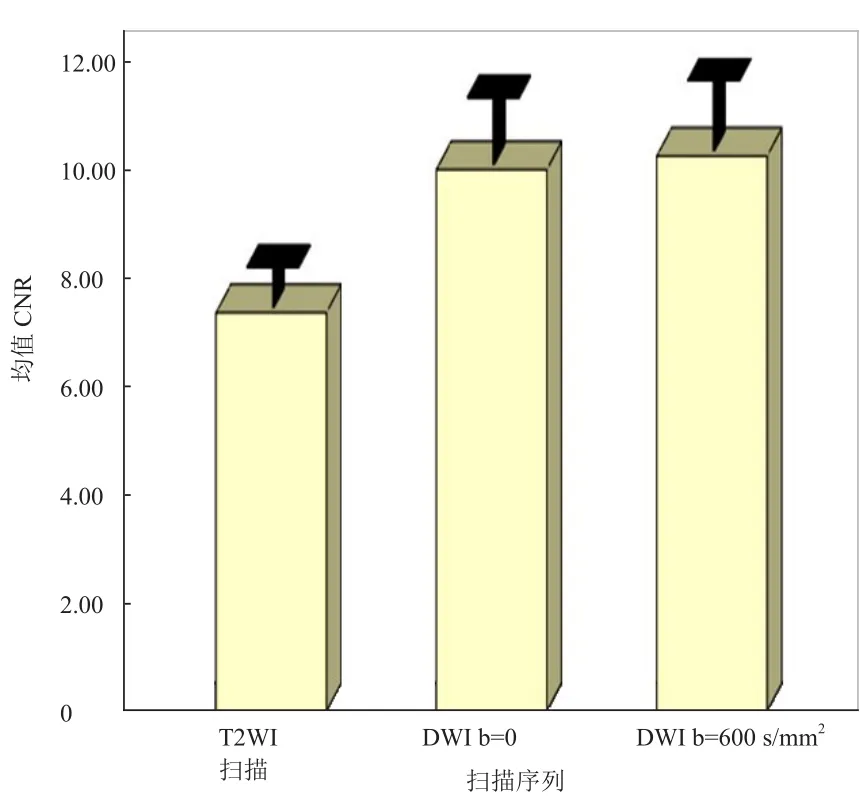
图4 T2WI和DWI(b=0、b=600s/mm2)图像病灶和周围肝组织CNR比较。分类到LI-RADS 3~5的77个病灶,DWI(b=0、b=600s/mm2)的CNR较T2WI高(P<0.01)
表2 T2WI或(和)DWI(b=0、600s/mm2)发现的67个HCC病灶的CNR比较(±s)
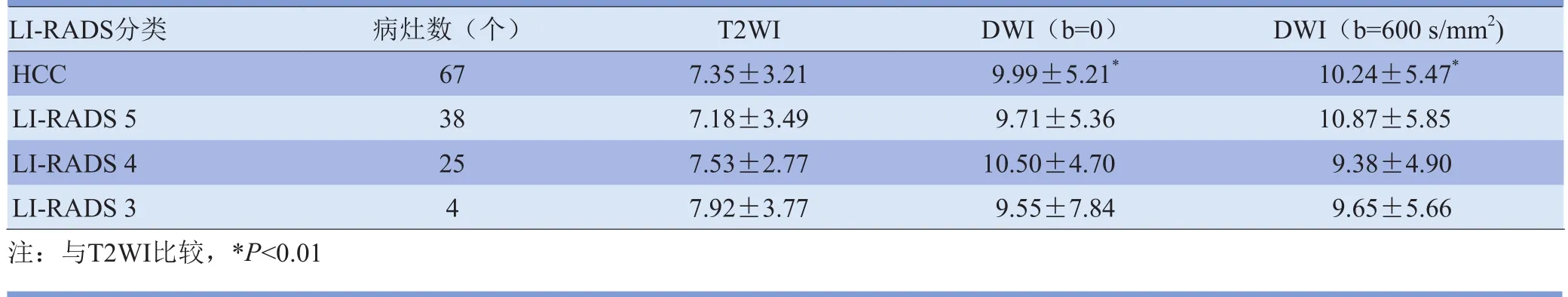
表2 T2WI或(和)DWI(b=0、600s/mm2)发现的67个HCC病灶的CNR比较(±s)
LI-RADS分类 病灶数(个) T2WI DWI(b=0) DWI(b=600s/mm2)HCC 67 7.35±3.21 9.99±5.21* 10.24±5.47*LI-RADS 5 38 7.18±3.49 9.71±5.36 10.87±5.85 LI-RADS 4 25 7.53±2.77 10.50±4.70 9.38±4.90 LI-RADS 3 4 7.92±3.77 9.55±7.84 9.65±5.66注:与T2WI比较,*P<0.01
表3 T2WI和(或)DWI发现的67个HCC病灶与同层面肝背景ADC值比较(±s,×10-3mm2/s)
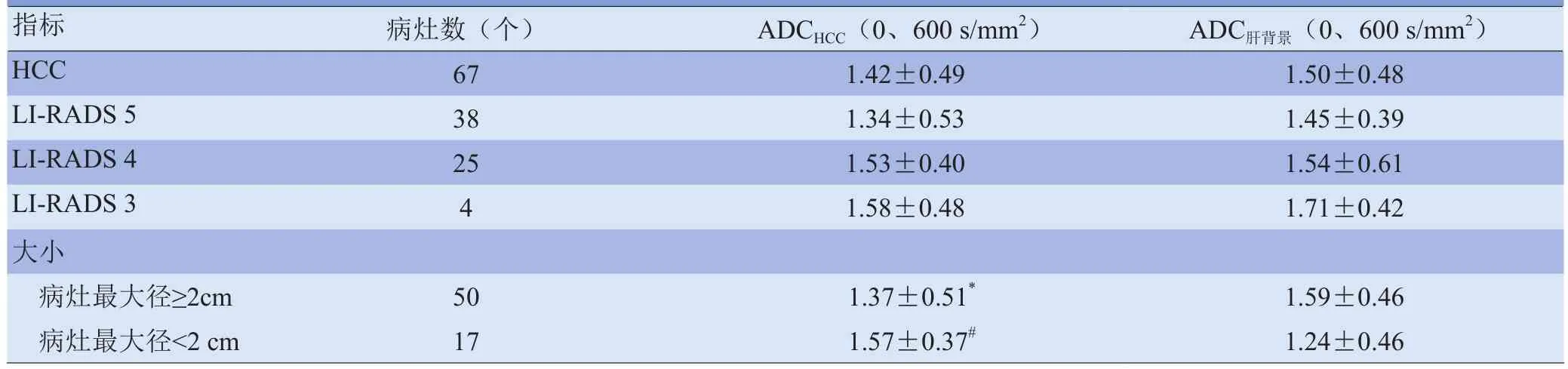
表3 T2WI和(或)DWI发现的67个HCC病灶与同层面肝背景ADC值比较(±s,×10-3mm2/s)
注:与病灶最大径<2cm组比较,*P<0.05;与ADC肝背景比较,#P<0.05
指标 病灶数(个) ADCHCC(0、600s/mm2) ADC肝背景(0、600s/mm2)HCC 67 1.42±0.49 1.50±0.48 LI-RADS 5 38 1.34±0.53 1.45±0.39 LI-RADS 4 25 1.53±0.40 1.54±0.61 LI-RADS 3 4 1.58±0.48 1.71±0.42大小病灶最大径≥2cm 50 1.37±0.51*1.59±0.46病灶最大径<2cm 17 1.57±0.37# 1.24±0.46
肝良性肿瘤(如囊肿和血管瘤)与恶性肿瘤(如HCC和转移瘤)通过动态增强扫描易于鉴别。扩散受限是鉴别肝良性肿瘤和恶性肿瘤的一种更有效的方法,如一个病灶的扩散受限程度类似于周围肝实质时,可排除肝囊肿[16]。HCC扩散受限程度较周围肝背景加重,ADC值多较相邻的肝组织ADC值低。比较T2WI和DWI的敏感性,选择合适的观察序列对提高HCC的诊断准确率非常重要。在DWI上,HCC的检出率和b值的关系尚不清楚[17-20]。DWI除因组织的ADC值不同而形成的图像对比外,还含有组织T2时间不同所形成的T2WI对比,称为T2穿透效应或T2效应。b值与T2效应关系密切,DWI时需设置合适的b值。长T2信号的病灶,如果明显扩散受限,因T2效应使病变区信号更高,利于显示病灶。若轻微扩散受限,很难判断DWI上高信号是由于扩散受限还是T2效应所致。故扩散受限是在去除T2穿透效应后,DWI(b值≥400s/mm2)上病灶的信号高于周围肝背景,同时ADC图上表现为等或低信号。
本研究结果可能会对HCC的鉴别诊断和治疗等流程有一定的提示意义,若DWI和T2WI在反映病灶特征方面具有一致性,则HCC患者进行检查时,仅扫描其中1个序列即可。DWI信号变化无法反映病变的全部生理病理信息,但比T2WI包含的信息多。HCC的放射学分期是根据病灶的大小和数目划分,故对辅助征象的分析有利于提高检出率和准确率,对于指导临床治疗方面非常重要。
总之,T2WI轻-中度高信号与扩散受限对识别分类到LI-RADS 3~5的病灶敏感性类似,但是b=600s/mm2较b=0的DWI识别率更高。CNR在DWI(b=0、600s/mm2)序列上均较T2WI序列上高。鉴于DWI需除外T2穿透效应,故LI-RADS分类系统将扩散受限和T2WI轻-中度高信号等作为倾向恶性肿瘤的辅助征象。然而,在肝硬化背景下,DWI序列中b值的选择对发现HCC的敏感性最佳这一问题尚未达成共识。本研究仅比较了2个b值的DWI,后续研究需增加病例数,并对多个b值的DWI进行对比。
[1]Chen WQ,Zheng RS,Zhang SW,et al.The incidences and mortalities of major cancers in China 2010.Chin J Cancer,2014,33(8):402-405.
[2]Stewart BW,Wild CP.World cancer report 2014.http://www.doc88.com/p-9347659230543.html.
[3]Sofue K,Burke LM,Nilmini V,et al.Liver imaging reporting and data system category 4 observations in MRI:risk factors predicting upgrade to category 5.J Magn Reson Imaging,2017,46(3):783-792.
[4]Lee YJ,Lee JM,Lee JS,et al.Hepatocellular carcinoma:diagnostic performance of multidetector CT and MR imaging-a systematic review and Meta-analysis.Radiology,2015,275(1):97-109.
[5]杜鲲,杨奎,尹君,等.表观扩散系数评价肝细胞癌肝动脉化疗栓塞近期疗效的价值.中国医学影像学杂志,2014,22(5):365-368.
[6]唐艳华,叶慧义.扩散加权成像在肝细胞癌中的应用.中国医学影像学杂志,2016,24(3):234-237.
[7]American College of Radiology.Liver imaging reporting and date system version 2014.http://www.acr.org/Quality-Safety/Resources/LIRADS.
[8]Cruite I,Tang An,Sirlin CB.Imaging-based diagnostic systems for hepatocellular carcinoma.Am J Roentgenol,2013,201(1):41-55.
[9]Rosset A,Spadola L,Osirix RO.An open-source software for navigating in multidimensional DICOM images.J Digit Imaging,2004,17(3):205-216.
[10]Matsuo M,Kanematsu M,Murakami T,et al.T2-weighted MR imaging for focal hepatic lesion detection:supplementary value of breath-hold imaging with half-Fourier single-shot fast spinecho and multishot spin-echo echoplanar sequences.J Magn Reson Imaging,2000,12(3):444-452.
[11]Coenegrachts K,Delanote J,Ter BL,et al.Improved focal liver lesion detection:comparison of single-shot diffusion weighted echoplanar and single-shot T2 weighted turbo spin echo techniques.Br J Radiol,2007,80(955):524-531.
[12]Piana G,Trinquart L,Meskine N,et al.New MR imaging criteria with a diffusion-weighted sequence for the diagnosis of hepatocellular carcinoma in chronic liver diseases.J Hepatol,2011,55(1):126-132.
[13]Zech CJ,Herrmann KA,Dietrich O,et al.Black blood diffusion-weighted EPI acquisition of the liver with parallel imaging:comparison with a standard T2-weighted sequence for detection of focal liver lesions.Investig Radiol,2008,43(4):261-266.
[14]Gourtsoyianni S,Papanikolaou N,Yarmenitis S,et al.Respiratory gated diffusion-weighted imaging of the liver:value of apparent diffusion coefficient measurements in the differentiation between most commonly encountered benign and malignant focal liver lesions.Eur Radiol,2008,18(3):486-492.
[15]Onur MR,Cicekci M,Kayali A,et al.The role of ADC measurement in differential diagnosis of focal hepatic lesions.Eur J Radiol,2012,81(3):E171-E176.
[16]Taouli B,Vilgrain V,Dumont E,et al.Evaluation of liver diffusion isotropy and characterization of focal hepatic lesions with two single-shot echo-planar MR imaging sequences:prospective study in 66 patients.Radiology,2003,226(1):71-78.
[17]Tamai Ken,Koyama T,Saga T,et al.Diffusion-weighted MR imaging of uterine endometrial cancer.J Magn Reson Imaging,2007,26(3):682-687.
[18]Bruegel M,Holzapfel K,Gaa J,et al.Characterization of focal liver lesions by ADC measurements using a respiratory triggered diffusion-weighted single-shot echo-planar MR imaging technique.Eur Radiol,2008,18(3):477-485.
[19]Miller FH,Hammond N,Siddiqi AJ,et al.Utility of diffusionweighted MRI in distinguishing benign and malignant hepatic lesions.J Magn Reson Imaging,2010,32(1):138-147.
[20]Sutherland T,Watts J,Ryan M,et al.Diffusion-weighted MRI for hepatocellular carcinoma screening in chronic liver disease:direct comparison with ultrasound screening.J Med Imaging Radiat Oncol,2017,61(1):34-39.
Diagnostic Ef fi ciency of T2WI and DWI in LI-RADS Classi fi cation with Cirrhosis Caused by Hepatitis B
WANG Zhipeng
GAO Fengguo
LIU Xiuqi
WANG Xiaobo
FENG Bao
YANG Zhenghan
PurposeTo investigate the value of T2WI mild-moderate signal and restricted diffusion in the context of liver imaging reporting and data system (LI-RADS)(2014 edition) in the diagnosis of hepatocellular carcinoma (HCC) with cirrhosis caused by hepatitis B virus.Materials and MethodsA total of 77 lesions (LI-RADS 3-5,size of 1.1cm×0.7cm-12.7cm×9.1cm) of 69 HCC patients in Beijing Friendship Hospital from January 2012 to November 2016 were retrospectively analyzed.All these patients underwent MRI scan and multiphase dynamic enhanced scan.The images were analyzed by two radiologists.If a disagreement occurred,liver accelerated volume acquisition and multiphase dynamic enhanced scan were combined to reach a consensus.The contrast noise ratio (CNR) and apparent diffusion coefficient (ADC) of T2WI and diffusion weighted imaging (DWI) sequences were compared,as well as the identi fi cation of the two signs.ResultsThere was no statistically signi fi cant difference between T2WI mild-moderate signal and restricted diffusion in the identification of lesions (LI-RADS 3-5) (P>0.05),while the sensitivity with DWI b=0 (61.0%) was signi fi cantly lower than DWI b=600s/mm2(70.1%) (P<0.05).The CNR of all DWI sequences (b=0,600s/mm2) were larger than those of T2WI (P<0.01).The ADC of small lesions (diameter <2cm) were larger than those of larger lesions (diameter ≥2cm) [(1.57±0.37)×10-3mm2/s vs.(1.37±0.51)×10-3mm2/s,P<0.05].ConclusionThere is no signi fi cant difference in sensitivity of lesions between T2WI mild-moderate signal and restricted diffusion.However,due to different CNRs,DWI with b=600s/mm2is more obvious for the lesions,and can be fi rst investigated in practice.
Carcinoma,hepatocellular; Hepatitis B; Liver cirrhosis; Magnetic resonance imaging; Diffusion weight imaging; Liver imaging reporting and data system (LI-RADS)
1.承德医学院附属保定市第一医院核磁室河北保定 071000 2.保定市第一医院核磁室 河北保定071000 3.河北省涞水县医院MRI室 河北保定074100 4.保定市第一中心医院临床心理科 河北保定 071000 5.北京友谊医院影像中心 北京 100069
10.3969/j.issn.1005-5185.2017.11.003
高凤国
Department of MRI,the First Hospital of Baoding,Baoding 071000,China
Address Correspondence to:GAO Fengguo
E-mail:gfg1666@163.com
R657.3+1;R445.2
2017-07-12
2017-08-29
中国医学影像学杂志2017年 第25卷 第11期:811-816
Chinese Journal of Medical Imaging 2017 Volume 25 (11):811-816
(本文编辑 张春辉)
