18F-FDG PET/CT术前诊断结直肠癌区域淋巴结转移的价值
2018-01-09田蓉蓉薄云峰张毅勋张红雨
田蓉蓉 薄云峰 张毅勋 原 凌 赵 铭 张红雨
18F-FDG PET/CT术前诊断结直肠癌区域淋巴结转移的价值
田蓉蓉1薄云峰2张毅勋3原 凌1赵 铭1张红雨1
目的探讨18F-FDG PET/CT术前诊断结直肠癌区域淋巴结转移的价值及其最佳诊断阈值。资料与方法结直肠癌初诊患者76例,均在PET/CT检查后1周内行结直肠癌根治术,将所有与PET/CT相匹配的淋巴结依据其与原发肿瘤的位置关系分为近端和远端淋巴结,同时以病理结果为“金标准”,生成淋巴结短径与最大标准化摄取值(SUVmax)的受试者工作特性(ROC)曲线,分析其诊断效能。结果近端与远端淋巴结ROC曲线示淋巴结短径、SUVmax的最佳阈值为6.5mm、1.9和5.5mm、1.81,淋巴结短径最佳阈值时诊断近端淋巴结转移的敏感度、特异度、准确度分别为84.85%、73.02%、77.52%,诊断远端淋巴结转移的敏感度、特异度、准确度分别为97.62%、65.45%、79.38%;SUVmax最佳阈值时诊断近端淋巴结转移的敏感度、特异度、准确度分别为84.85%、95.81%、91.64%,诊断远端淋巴结转移的敏感度、特异度、准确度分别为92.86%、94.55%、93.81%。SUVmax最佳阈值时诊断特异度、准确度均高于淋巴结短径最佳阈值(P<0.01),且SUVmax最佳阈值时与病理结果一致性较高(Kappa=0.813、0.874,P<0.01)。结论最佳阈值法能提高18F-FDG PET/CT对结直肠癌区域淋巴结转移的诊断效能,且SUVmax标准优于淋巴结短径标准。
结直肠肿瘤;淋巴转移;正电子发射断层显像术;体层摄影术,X线计算机;氟脱氧葡萄糖F18
淋巴结转移是结直肠癌最重要的转移途径,准确判断区域淋巴结转移是肿瘤分期和制订个体化方案的重要依据,传统影像学以淋巴结大小评估淋巴结状态,但正常大小的转移淋巴结常被漏诊[1],PET/CT将代谢信息与形态信息相结合,能提高结直肠癌N分期的准确性[2-3],但由于样本选择差异及缺乏统一的评估标准,导致诊断效能各异[4-5]。本研究将术前18F-FDG PET/CT显像与病理结果进行对比,探讨18F-FDG PET/CT显像对结直肠癌区域淋巴结转移的诊断价值及其最佳诊断阈值。
1 资料与方法
1.1 研究对象 选取2014年1月—2016年3月于山西省肿瘤医院住院治疗并接受PET/CT检查的结直肠癌初诊患者76例,其中男50例,女26例;年龄29~90岁,平均(59.78±14.13)岁;部位:直肠癌36例,乙状结肠癌15例,升结肠癌21例,结肠肝曲癌2例,降结肠癌1例,横结肠癌1例;病理类型:腺癌为主型71例,黏液腺癌为主型5例;T分期:T2期10例,T3期21例,T4期45例。纳入标准:①所有患者均接受结直肠癌根治术;②PET/CT检查时间与手术间隔时间不超过1周;③排除远处转移、伴急性感染的病例。
1.2 仪器与方法 采用GE Discovery STE PET/CT扫描仪,18F-FDG由医用回旋加速器(Minitrace,GE)和TracelabFx-FN(GE)生产,18F-FDG放化纯度>95%。患者禁食6h以上,测量空腹血糖在正常范围,注射18F-FDG 5.55 MBq/kg,平静休息45~60min后依次采集CT、PET图像,显像范围均为股骨上段至颅底,采集3min/床位。CT扫描条件:管电压120kV,管电流200mA,层厚3.75mm,螺距1.375∶1,采集完成后利用CT数据对PET图像进行衰减校正。数据经迭代重建后获得水平位、冠状位、矢状位的PET、CT、PET/CT融合图像。
1.3 外科手术及病理诊断 所有纳入患者均接受结直肠癌根治术,手术医师详细探查、清除系膜根部淋巴结并标记,原发肿瘤旁、肠管旁及系膜内淋巴结由病理取材医师进行分离,详细记录每一枚淋巴结的位置、大小、数量及毗邻关系,并逐一行病理检查,对难以分离的融合淋巴结按1枚淋巴结计算。每例患者切除淋巴结≥12枚,所有淋巴结根据其位置分为两组,肠管旁和肿物旁淋巴结为近端淋巴结,沿系膜血管走行的淋巴结及系膜根部淋巴结为远端淋巴结(包括肠系膜上动脉、肠系膜下动脉、回结肠动脉、升结肠动脉、中结肠动脉、乙状结肠动脉、直肠上动脉、髂内动脉、髂外动脉、骶前、闭孔淋巴结等)[6]。
1.4 图像分析及数据处理 由2位PET/CT主治医师共同阅片,分别从水平位、矢状位、冠状位测量淋巴结的长径和短径,与手术、病理医师提供的淋巴结信息进行对照,位置及3个方位的大小信息均相近的淋巴结认为是同一枚淋巴结(手术取出但不能明确配对者不纳入研究范围),3个方位测量的最小值为淋巴结的短径,并多次重复测量取其平均值。在病灶显像剂浓聚的位置勾画感兴趣区(ROI),由软件自动计算获得最大标准化摄取值(maximum standardized uptake value,SUVmax)。
1.5 统计学方法 采用SPSS 17.0软件,计量资料以±s表示,以病理结果为“金标准”,采用非参数法,分别生成近端及远端淋巴结的短径、SUVmax的受试者工作特性(ROC)曲线,以曲线最接近左上角位置为最佳临界点确定最佳阈值[7],率的比较采用χ2检验或Fisher确切概率法,计量资料比较采用独立样本t检验和单因素方差分析,一致性分析采用Kappa检验[8]。P<0.05表示差异有统计学意义。
2 结果
2.1 PET/CT与手术切除匹配结果 76例患者中,29例仅近端淋巴结转移,2例仅远端转移,14例近端合并远端转移,31例无淋巴结转移,近端淋巴结转移率为56.58%(43/76),远端淋巴结转移率为21.05%(16/76);手术切除并与PET/CT影像相匹配的淋巴结444枚。
2.2 淋巴结转移与临床病理的关系 淋巴结转移与年龄、T分期、肿瘤分化程度有关(P<0.05),而与性别、位置、病理类型无关(P>0.05),见表1。淋巴结转移阳性患者原发灶SUVmax为14.54±7.06(5.31~41.13),高于淋巴结转移阴性患者的11.64±4.35(4.43~25.90),差异有统计学意义(t=2.210,P<0.05)。
2.3 近端淋巴结PET/CT结果 近端淋巴结短径及SUVmax见表2。以病理结果为“金标准”,生成的近端淋巴结短径及SUVmax的ROC曲线(见图1)示淋巴结短径、SUVmax的最佳阈值分别为6.5mm、1.9,近端淋巴结短径、SUVmax的曲线下面积分别为0.786±0.026(95% CI 0.735~0.836)、0.900±0.020(95% CI 0.860~0.939)。最佳阈值法与常规标准(SUVmax≥2.5或淋巴结短径≥10.0mm)比较近端淋巴结转移的诊断效能见表3。
最佳阈值SUVmax≥1.9与SUVmax≥2.5诊断效能比较,评估近端淋巴结转移的敏感度、准确度、阴性预测值明显提高(χ2=11.88、7.25、4.79,P<0.05),与病理结果一致性较高,Kappa值由0.694上升为0.813;淋巴结短径≥6.5mm与淋巴结短径≥10.0mm诊断效能比较,敏感度、阴性预测值升高(χ2=33.803、10.430,P<0.01),而特异度、阳性预测值降低(χ2=49.639、18.025,P<0.01),准确度差异无统计学意义(χ2=0.550,P>0.05),一致性检验均为中等。
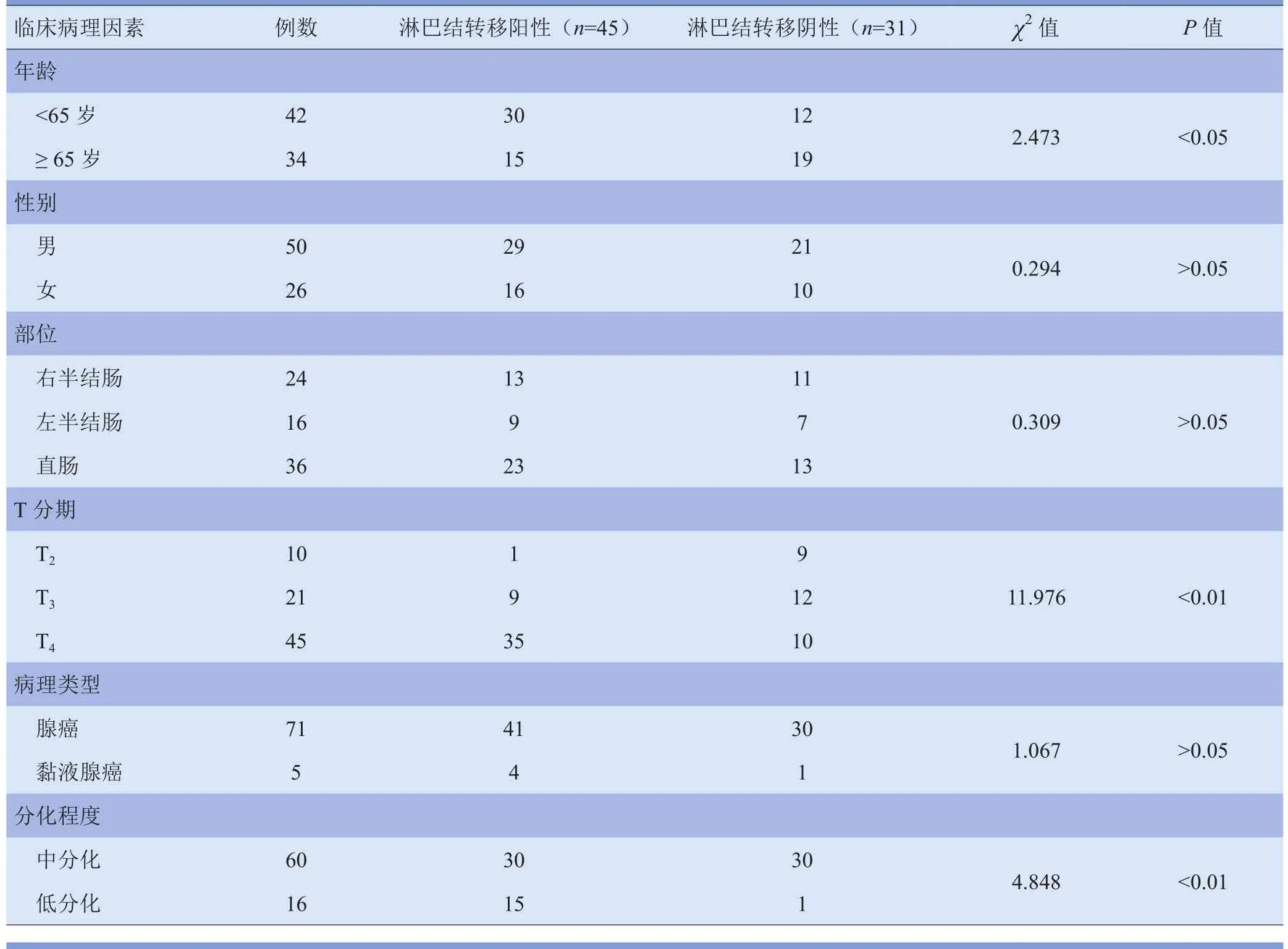
表1 76例结直肠癌患者淋巴结转移与临床病理、原发灶的关系(例)
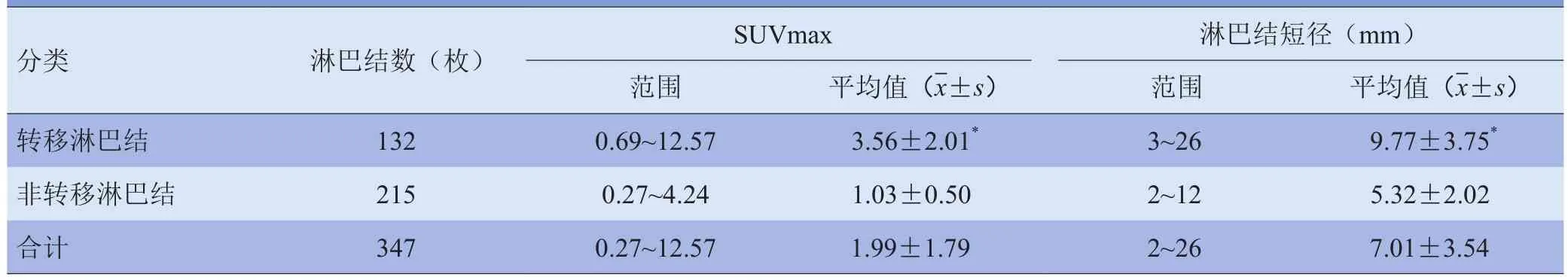
表2 76例结直肠癌患者近端转移与非转移组淋巴结短径与SUVmax比较
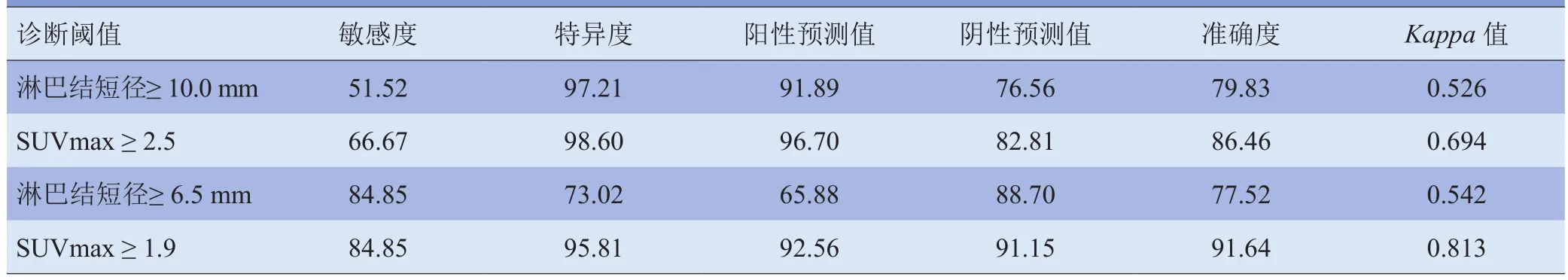
表3 不同方法评估结直肠癌近端淋巴结转移的诊断效能(%)
分别以最佳阈值SUVmax≥1.9和淋巴结短径≥6.5mm为恶性标准时,两者敏感度一致,SUVmax≥1.9的特异度、阳性预测值、准确度均高于淋巴结短径≥6.5mm,差异有统计学意义(χ2=42.450、28.390、26.530,P<0.01),见图2。SUVmax≥2.5为恶性标准时,检测淋巴结转移的敏感度、准确度高于淋巴结短径≥10.0mm(χ2=6.268、5.438,P<0.05)。
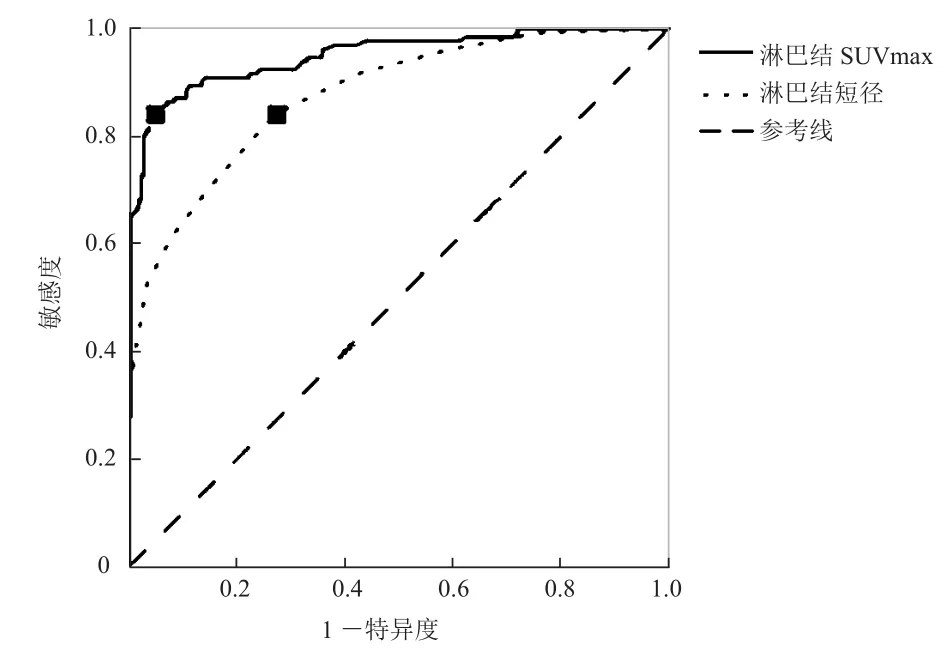
图1 近端淋巴结短径及SUVmax预测淋巴结转移的ROC曲线。淋巴结短径及SUVmax的最佳阈值分别为6.5mm、1.9
2.4 远端淋巴结PET/CT结果 远端淋巴结短径及SUVmax见表4。ROC曲线示远端淋巴结短径、SUVmax最佳阈值为5.5mm、1.81(图3),远端淋巴结短径及SUVmax的曲线下面积分别为0.881±0.033(95%CI0.816~0.945)、0.979±0.012(95%CI0.954~1.000)。不同方法对远端淋巴结转移的诊断效能比较见表5。
最佳阈值SUVmax≥1.81与SUVmax≥2.5比较,评估远端淋巴结转移的敏感度、准确度、阴性预测值升高,但差异无统计学意义(P>0.05),与病理结果的一致性检验由良好上升为极好,Kappa值由0.801上升为0.874;最佳阈值淋巴结短径≥5.5mm与短径≥10.0mm诊断效能比较,敏感度、阴性预测值升高(P<0.01),而特异度降低(P<0.01),准确度、阳性预测值差异无统计学意义(P>0.05),一致性检验由尚可上升为中等,Kappa值由0.343上升为0.600。分别以最佳阈值SUVmax≥1.81和淋巴结短径≥5.5mm为恶性标准时,SUVmax≥1.81标准的特异度、阳性预测值、准确度均高于淋巴结短径≥5.5mm标准,差异有统计学意义(P<0.01),见图4、5。SUVmax≥2.5为恶性标准时,检测远端淋巴结转移的敏感度、准确度、阴性预测值均高于淋巴结短径≥10.0mm标准,差异有统计学意义(χ2=21.600、14.153、9.956,P<0.01)。
2.5 PET/CT对远端淋巴结与近端淋巴结诊断效能的比较 采用SUVmax≥2.5为恶性标准时,PET/CT检测远端淋巴结的敏感度高于近端,分别为83.33%和66.67%(χ2=4.272,P<0.05),其余指标差异无统计学意义(P>0.05);均采用最佳阈值(SUVmax=1.9、1.81)时检测远端淋巴结转移的敏感度高于近端,分别为92.86%和84.85%,但诊断效能组间差异无统计学意义(χ2=1.782,P>0.05)。
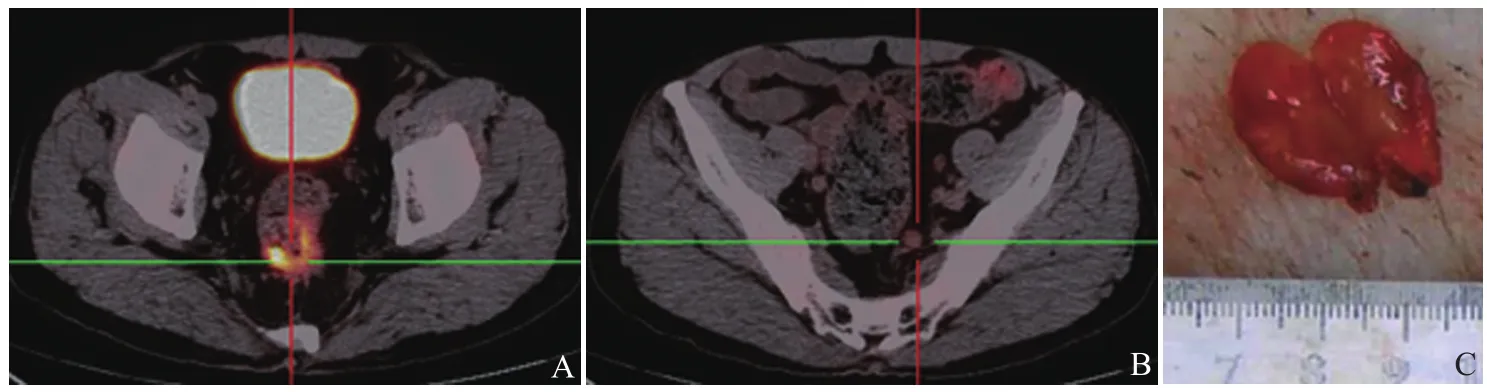
图2 男,70岁,直肠中分化腺癌T3期。原发灶SUVmax=7.1(A);肠管旁短径约10mm淋巴结SUVmax=1.52(B);病理示反应性增生(淋巴结已从中间切开,C)
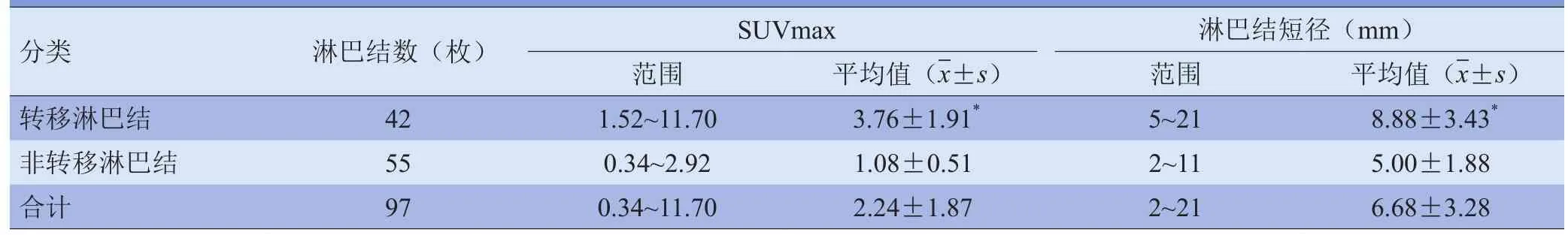
表4 远端转移与非转移组淋巴结短径与SUVmax情况
3 讨论
淋巴结转移是结直肠癌预后的重要因素[9],准确判断区域淋巴结状态对于结直肠癌的分期、治疗方案的选择及预后评估均有重要影响。大部分结直肠癌细胞沿区域淋巴结系统由近及远转移,少部分可以发生跳跃性转移[10],远端发生淋巴结转移与患者局部复发和预后的关系较近端淋巴结转移更重要,故本研究将淋巴结分为近端和远端两组。赵文军等[11]报道直肠癌经淋巴结向远端系膜播散率为13%(8/60);Kanemitsu等[12]报道直肠癌系膜根部淋巴结转移率为0.7%~14.4%,本研究中结直肠癌淋巴结远端转移率为21.05%,近端转移率为56.58%,远端转移率偏高的原因为本研究将沿系膜血管走行的淋巴结均归入远端淋巴结。
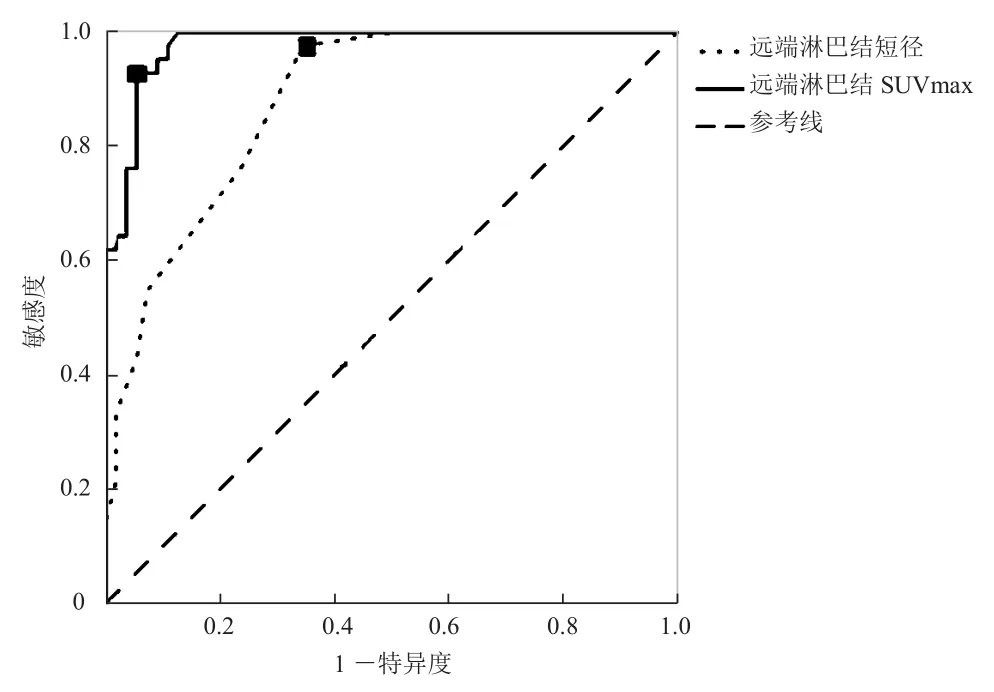
图3 远端淋巴结短径及SUVmax预测淋巴结转移的ROC曲线。淋巴结短径及SUVmax的最佳阈值分别为5.5mm、1.81
既往报道18F-FDG PET/CT显像对于结直肠癌N分期的检测敏感度相对较低,Lu等[13]对409例结直肠癌患者淋巴结分期进行了Meta分析,结果发现PET/CT显像对于结直肠癌N分期的敏感度、特异度分别为42.9%(95%CI0.360~0.500)、87.9%(95%CI0.826~0.920);Kwak等[5]研究显示,PET/CT检测近端淋巴结转移的敏感度、特异度、准确度分别为66%、60%、63%,诊断远端淋巴结的准确度为87%,分析诊断效能较低可能与评估标准有关,既往PET阳性标准多为淋巴结SUV高于周围本底或SUVmax≥2.5,CT阳性标准为淋巴结短径≥10.0mm或伴有坏死。
本研究采用最佳阈值法评估区域淋巴结状态,诊断效能明显提高,SUVmax最佳阈值时诊断近端淋巴结转移的敏感度、准确度、阴性预测值高于SUVmax≥2.5(P<0.05)。而淋巴结短径最佳阈值时,诊断近端和远端淋巴结转移的敏感度较淋巴结短径≥10.0mm 均增高(P<0.01),特异度均减低(P<0.01),准确度差异无统计学意义(P>0.05);本研究中SUVmax最佳阈值法检测远端淋巴结的效能与SUVmax≥2.5的诊断效能差异无统计学意义(P>0.05),可能与远端淋巴结数量相对较少及样本选择有关,伴有远处转移的患者均未纳入。Yu等[14]采用最佳阈值法评估结直肠癌肠管旁(近端)淋巴结转移,所做SUVmax及淋巴结短径的ROC曲线显示最佳阈值为2.0、4.85mm,最佳阈值下诊断淋巴结转移的敏感度、特异度分别为 91.43%、85.71%和87.83%、60.87%,SUVmax标准优于淋巴结短径标准,与本研究结果基本一致。Tsunoda等[6]采用SUVmax最佳阈值(1.5)诊断近端淋巴结转移的敏感度、特异度、准确度分别为51.2%、85.1%、69.3%,诊断远端淋巴结转移的敏感度、特异度、准确度分别为62.5%、92.5%、89.7%,PET/CT显像在探测远端转移淋巴结方面优于近端淋巴结,与本研究结果一致,PET空间分辨率较低是导致近端淋巴结假阴性较高的原因[5];与Yu等[14]、Tsunoda等[6]的研究比较,本研究中ROC曲线下所做最佳阈值及诊断效能略有差异,可能与患者选择及淋巴结分组标准差异有关。葛继元等[15]采用SUVmax≥1.5/淋巴结短径≥5mm为标准时检测淋巴结转移的敏感度、特异度、准确度分别为67.9%/82.1%、70.8%/58.3%、68.8%/75%,淋巴结短径标准结果与本研究相近,而SUVmax标准结果差异较大,考虑与SUV阈值有关,由于该研究为回顾性分析,未做ROC曲线,所取SUVmax≥1.5并非检测淋巴结转移的最佳阈值。
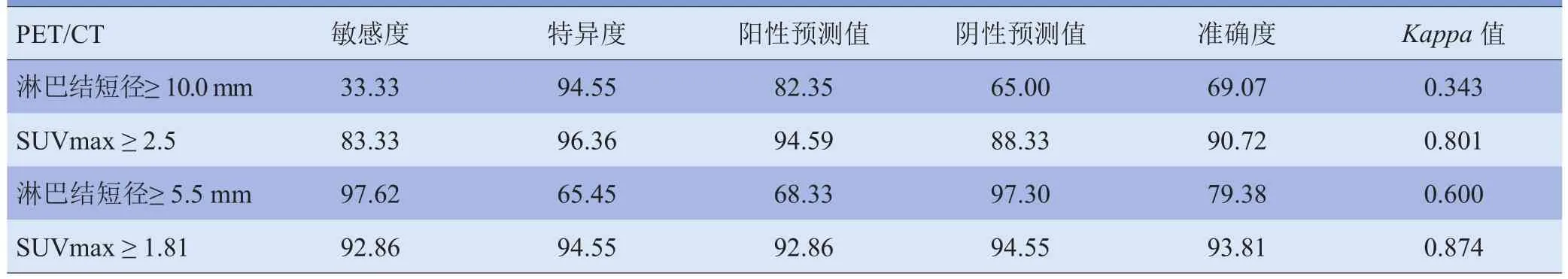
表5 不同方法评估结直肠癌远端淋巴结转移的诊断效能(%)
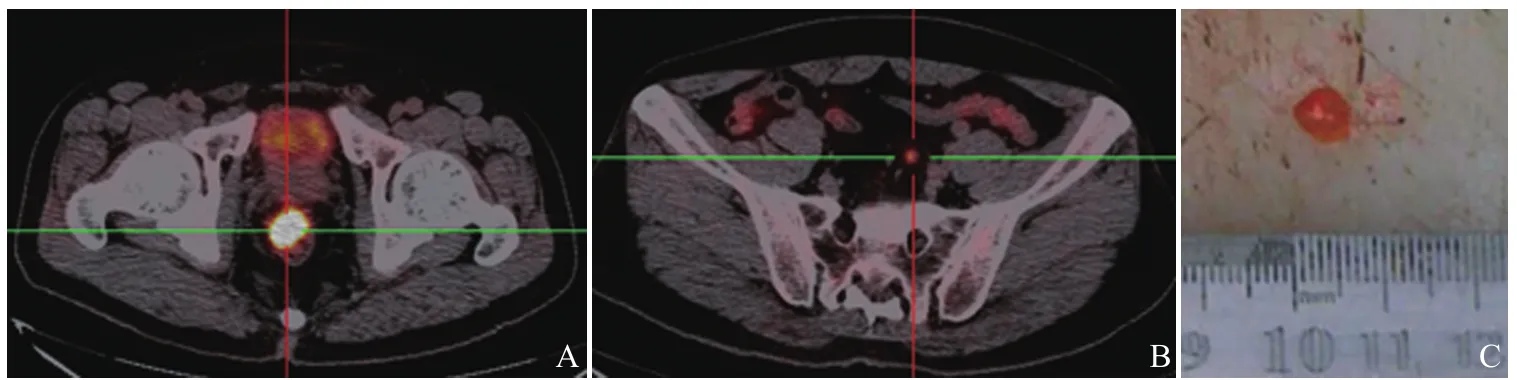
图4 男,51岁,直肠低分化腺癌T4期。原发灶SUVmax=8.84(A);肠系膜下动脉旁代谢增高小淋巴结,短径约6mm,SUVmax=4.84(B);病理示转移淋巴结(C)
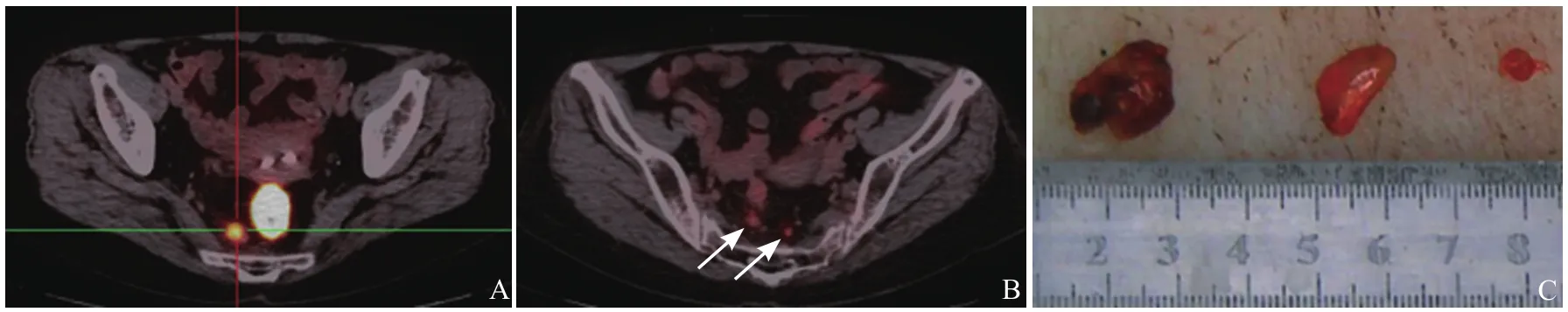
图5 女,66岁,直肠中分化腺癌T4期。原发灶SUVmax=31.22,肠管旁代谢增高淋巴结,短径约15mm,SUVmax=6.22(A);肠系膜2枚代谢增高小淋巴结,短径分别为7mm、4mm,SUVmax=2.65、2.61(箭,B);3枚淋巴结病理均为转移性淋巴结(C)
SUVmax最佳诊断阈值下仍然存在一定的假阳性及假阴性,SUVmax≥1.9时检测近端淋巴结假阳性率为4.19%(9/215),假阴性率为15.15%(20/132);远端淋巴结SUVmax≥1.81时检测淋巴结转移的假阳性率为5.45%(3/55),假阴性率为7.14%(3/42),近端淋巴结假阴性率明显高于远端。既往研究报道,原发肿瘤附近的淋巴结假阴性率较高是导致PET/CT显像在淋巴结转移方面敏感度、准确度较低的原因,假阴性的主要原因是距离原发肿瘤较近、黏液腺癌和淋巴结直径较小或仅有微小恶变的淋巴结[16-17];近端假阳性淋巴结共9枚,其中5枚位于原发肿瘤旁,1枚为癌结节,3枚位于肠管旁,远端3枚假阳性淋巴结SUVmax/短径分别为2.86/9mm、2.38/7mm、2.92/9mm[16]。原发肿瘤的容积效应、合并肠管炎症和周围本底较高、癌结节是造成假阳性的主要原因[6]。
总之,最佳阈值法能显著提高18F-FDG PET/CT检测结直肠癌区域淋巴结转移的敏感度和准确度,特别是对于近端淋巴结,SUVmax标准优于淋巴结短径,且SUVmax最佳阈值时与病理结果一致性极好,但本研究未使用静脉对比剂,无法观察淋巴结内详细信息,关于结直肠癌区域淋巴结转移的诊断标准还需进一步大样本分层研究,同时可结合增强CT或MRI提高局部分辨率,进一步减少假阳性及假阴性的发生。
[1]Tan YN,Li XF,Li JJ,et al.The accuracy of computed tomography in the pretreatment staging of colorectal cancer.Hepatogastroenterology,2014,61(133):1207-1212.
[2]Jasna M,Olivera I,Emil M,et al.18F-FDG PET/CT imaging in primary staging of colorectal cancer.J Nucl Med,2015,56(Supplement 3):1337.
[3]Lee JY,Yoon SM,Kim JT,et al.Diagnostic and prognostic value of preoperative (18)F-fluorodeoxyglucose positron emission tomography/computed tomography for colorectal cancer:comparison with conventional computed tomography.Intest Res,2017,15(2):208-214.
[4]Kamel IR,Cohade C,Neyman E,et al.Incremental value of CT in PET/CT of patients with colorectal carcinoma.Abdom Imaging,2004,29(6):663-668.
[5]Kwak JY,Kim JS,Kim HJ,et al.Diagnostic value of FDGPET/CT for lymph node metastasis of colorectal cancer.World J Surg,2012,36(8):1898-1905.
[6]Tsunoda Y,Ito M,Fujii H,et al.Preoperative diagnosis of lymph node metastases of colorectal cancer by FDG-PET/CT.Jpn J Clin Oncol,2008,38(5):347-353.
[7]陈卫中,潘晓平,宋兴勃,等.ROC曲线中最佳工作点的选择.中国卫生统计,2006,23(2):157-158.
[8]Lim JS,Kim MJ,Yun MJ,et al.Comparison of CT and18F-FDG pet for detecting peritoneal metastasis on the preoperative evaluation for gastric carcinoma.Korean J Radiol,2006,7(4):249-256.
[9]Kim JS,Sohn DK,Park JW,et al.Prognostic signi fi cance of distribution of lymph node metastasis in advanced mid or low rectal cancer.J Surg Oncol,2011,104(5):486-492.
[10]黄永鸿,梁君林.结直肠癌单个转移淋巴结分布情况及其影响因素.结直肠肛门外科,2012,18(2):79-82.
[11]赵文军,王青,张才全,等.溶脂法研究直肠癌在直肠远端系膜内的播散.中华普通外科杂志,2006,21(6):427-430.
[12]Kanemitsu Y,Hirai T,Komori K,et al.Surivival benefit of high ligation of the inferior mesenteric artery in sigmoid colon or rectal cancer surgery.Br J Surg,2006,93(5):609-615.
[13]Lu YY,Chen JH,Ding HJ,et al.A systematic review and metaanalysis of pretherapeutic lymph node staging of colorectal cancer by18F-FDG PET or PET/CT.Nucl Med Commun,2012,33(11):1127-1133.
[14]Yu L,Tian M,Gao X,et al.The method and efficacy of18F-fluorodeoxyglucose positron emission tomography/computed tomography for diagnosing the lymphatic metastasis of colorectal carcinoma.Acad Radiol,2012,19(4):427-433.
[15]葛继元,张建,吴仪仪,等.18F-FDG PET/CT在结直肠癌术前N分期中的价值及诊断标准探讨.医学研究杂志,2014,43(7):65-69.
[16]Seong YK,Jung JM,Young SS,et al.Characteristics manifested by FDG PET/CT in lymph node staging of colorectal cancer.J Nucl Med,2006,47(Suppl 1):463.
[17]陈虞梅,刘建军,陈涛,等.PET诊断结直肠癌复发价值及误诊原因的Meta分析.中华核医学杂志,2007,27(3):131-134.
Preoperative Diagnosis of18F-FDG PET/CT on Regional Lymph Node Metastasis in Colorectal Cancer
TIAN Rongrong
BO Yunfeng
ZHANG Yixun
YUAN Ling
ZHAO Ming
ZHANG Hongyu
PurposeTo discuss the diagnostic value and the optimal diagnostic threshold of preoperative18F-FDG PET/CT imaging on regional lymph node metastasis in colorectal cancer.Materials and MethodsSeventy-six patients with newly diagnosed colorectal cancer underwent radical resection of colorectal cancer within one week after PET/CT examination.All lymph nodes matching PET/CT were divided into proximal and distal lymph nodes on the basis of their location relative to the primary tumor.Meanwhile,the receiver operating characteristic (ROC) curves of the lymph node short diameter and maximum standardized uptake value (SUVmax) were created according to the pathological fi ndings which were considered as the gold standard,and the diagnostic ef fi cacies were analyzed.ResultsThe proximal and distal lymph node ROC curves showed that the optimum thresholds of lymph node short diameter,SUVmax were 6.5mm,1.9 and 5.5mm,1.81.The sensitivity,specificity and accuracy of the diagnosis of proximal lymph node metastasis under the optimum threshold of lymph node short diameter were 84.85%,73.02% and 77.52%,respectively; and those of distal lymph node metastasis were 97.62%,65.45% and 79.38%,respectively.The sensitivity,speci fi city and accuracy of the diagnosis of proximal lymph node metastasis under the optimum threshold of SUVmax were 84.85%,95.81% and 91.64%,respectively; those of distal lymph node metastasis were 92.86%,94.55% and 93.81%,respectively.The speci fi city and accuracy of the optimum threshold of SUVmax were higher than those of the optimum threshold of lymph node short diameter(P<0.01).The homogeneity of optimum threshold of SUVmax was excellent in comparison with the pathological results (Kappa=0.813 and 0.874,P<0.01).ConclusionOptimum threshold method improves the diagnostic ef fi cacy of18F-FDG PET/CT in regional lymph node metastasis of colorectal cancer.Moreover,the SUVmax standard is superior to lymph node short diameter standard.
Colorectal neoplasms; Lymphatic metastasis; Positron-emission tomography;Tomography,X-ray computed; Fluorodeoxyglucose F18
1.山西省肿瘤医院PET/CT中心 山西太原030013
2.山西省肿瘤医院病理科 山西太原030013
3.山西省肿瘤医院结直肠肛门外科 山西太原 030013
10.3969/j.issn.1005-5185.2017.11.001
赵 铭
Department of PET/CT Center,Shanxi Tumor Hospital,Taiyuan 030013,China
Address Correspondence to:ZHAO Ming
E-mail:zm19701125@163.com
R730.44;R735.3
2017-07-16
2017-11-06
中国医学影像学杂志2017年 第25卷 第11期:801-806
Chinese Journal of Medical Imaging 2017 Volume 25 (11):801-806
(本文编辑 周立波)
